Introducción
La neuroplasticidad es la capacidad del sistema nervioso de cambiar sus relaciones funcionales y estructurales en respuesta a estímulos externos o internos. En este sentido, el sistema nervioso posee una plasticidad altamente desarrollada y evidente en las primeras etapas del desarrollo, sobre todo en los mamíferos.1
Los mecanismos de neuroplasticidad son universales ya que están conservados tanto en la filogenia como en la ontogenia. Operan en especies tan distantes como en los moluscos y participan en los procesos de desarrollo, memoria y recuperación de funciones perdidas tras una lesión. De modo que cualquier agente o maniobra que pueda potenciar o reforzar cualquiera de los mecanismos de neuroplasticidad en una especie, tiene un alto grado de probabilidad de ser útil para estimular otros mecanismos neuroplásticos en otras especies. La estimulación y modulación de procesos de neuroplasticidad son herramientas de gran valor para lograr una más rápida y eficaz recuperación de funciones neurales dañadas por lesiones del sistema nervioso.1
La amígdala basolateral (BLA, del inglés basolateral amygdala), ha emergido como la región principal que orquesta el almacenamiento de memorias en muchas otras regiones.2 Se conoce sobre los neurotransmisores y las influencias hormonales en la BLA que contribuyen a su influencia moduladora sobre otras regiones del cerebro.2),(3 Sin embargo, se ha valorado que la fuerza de la memoria depende de los procesos celulares que producen cambios en las sinapsis y que representan la experiencia de aprendizaje. Por lo tanto, es posible que la amígdala module los productos de los genes dependientes de la experiencia en las sinapsis que sustentan la memoria.
La BLA a nivel funcional favorece la inducción de la potenciación de larga duración (LTP, del inglés long-term-potentiation) en el hipocampo.4 La LTP consiste en un incremento sostenido de la eficacia de la transmisión sináptica que se produce después de estimular una vía aferente con pulsos de corriente eléctrica de alta frecuencia.5),(6
De la misma forma, se ha demostrado que estímulos conductuales con fuerte contenido emocional/motivacional pueden prolongar y reforzar procesos de plasticidad sináptica en el hipocampo7 y que ese efecto es mediado por la BLA.8 Además, la estimulación de la BLA acelera la adquisición de habilidades motoras9 y contribuye a la recuperación de la memoria espacial en animales con lesión de la fimbria-fórnix (FF).10 Este efecto, puede estar sustentado, al menos en parte, en la mejoría demostrada en procesos de plasticidad sináptica.
Por las evidencias experimentales mostradas en el párrafo anterior la estimulación de la BLA puede mejorar o modular los procesos neuroplásticos implicados en la recuperación de funciones perdidas como consecuencia de lesiones del sistema nervioso central. Sin embargo, no se conoce cuales mecanismos neuroplásticos están involucrados en esta recuperación funcional. Estudiar los mecanismos neuroplásticos implicados en esos procesos sería de vital importancia para la neurología restaurativa. Consecuentemente el problema abordado en este trabajo es: ¿puede la estimulación eléctrica de la BLA reforzar los cambios neuroplásticos implicados en la recuperación de la memoria espacial en ratas con lesión de FF?
Métodos
Para responder la pregunta de este trabajo se llevaron a cabo dos tipos de estudio: agudos y crónicos. En el estudio agudo se hicieron mediciones de diferentes variables relacionadas con la plasticidad neural a distintos tiempos después de la estimulación de la BLA. Estos estudios sirvieron para conocer el efecto de la estimulación de la BLA por sí sola en animales sanos, sobre las variables relacionadas con la plasticidad; así como conocer su curso temporal. Por otra parte, el estudio crónico aborda directamente el problema de este trabajo.
Procedimientos generales
Animales. Se utilizaron ratas Wistar machos (de 280 g a 300 g) de 3 meses de edad provenientes del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). Los animales se mantuvieron en el vivario del Centro Internacional de Restauración Neurológica (CIREN) en condiciones de luz, temperatura y humedad controladas, además de comida y agua ad libitum.
Las ratas fueron tratadas y mantenidas de acuerdo con el Comité de Bioética institucional de nuestra institución (CIREN) bajo la observación de las directrices nacionales cubanas para el cuidado y uso de los animales de laboratorio, que sigue la revisión de 1996 de la guía de salud del Instituto Nacional para el Cuidado y Uso de los Animales de Laboratorio (Publicaciones NIH No. 80-23) de Estados Unidos. Se hicieron todos los esfuerzos para minimizar el número de animales usados y su sufrimiento.
Cirugía de la fimbria-fórnix. La lesión de FF bilateral se realizó por transección como ha sido previamente descrito.10
Implantación de electrodos en la amígdala basolateral
Para la estimulación de la BLA, se introdujo un electrodo de estimulación en las coordenadas AP = -3,1 mm, ML = +4,7 mm y DV = -8,5 mm y un electrodo de registro en el giro dentado en las coordenadas AP = -3,8 mm, ML = +2,0 mm y DV = -3,5 mm.
En el estudio agudo se procedió a aplicar la estimulación de alta frecuencia, la cual consistió en 3 trenes de 15 pulsos con una duración de 0,2 ms, una intensidad de 400 μA y una frecuencia de 200 Hz. De esta manera, en el estudio crónico, en el cual se implantaron los electrodos de forma permanente se siguieron los mismos pasos y se estimuló 15 min después de finalizado el entrenamiento.
Entrenamiento en el laberinto acuático de Morris
El Laberinto Acuático de Morris (LAM) es una prueba de aprendizaje y memoria espacial, la cual depende del hipocampo. Se utilizó para evaluar las capacidades de aprendizaje y memoria en las ratas con lesión de FF, las cuales están afectadas en estos animales. Una semana después de la cirugía, las ratas fueron entrenadas en el LAM por 4 días consecutivos como se describe en la literatura.10
Análisis estadístico. Todos los datos fueron analizados usando el programa estadístico STATISTICA 7.0. Se utilizó estadística paramétrica (ANOVA). Un análisis de post hoc usando la prueba de análisis de rangos múltiples de Duncan fue realizado cuando el ANOVA resultó significativo para evaluar las diferencias entre los grupos. Se consideraron diferencias estadísticamente significativas cuando el valor de p < 0,05.
Determinación de genes y proteínas relacionadas con la plasticidad a través de técnicas bioquímicas, biología molecular e inmunohistoquímica
Las concentraciones de BDNF (factor neurotrófico derivado del cerebro, del inglés, Brain Derivated Neurotrophic Factor) o NGF (Factor de Crecimiento nervioso, del inglés, nerve Growth factor) se midieron en el hipocampo por el método de inmunoensayo (ELISA) en un formato tipo sándwich de anticuerpo de acuerdo a las instrucciones del fabricante (Promega, USA).11
La determinación de los genes bdnf y arc (proteína asociada al citoesqueleto regulada por la actividad, del inglés activity-regulated cytoskeletal protein) se realizó mediante RT-PCR (del inglés, reverse transcriptase polymerase chain reaction) en el hipocampo.12 Para el análisis semicuantitativo, empleamos el programa libre ImageJ (Versión 1.44; Wayne Rasband, Instituto Nacional de Salud; http://imagej.nih.gov/ij). Para este análisis, primero se sustrajo la actividad del fondo a las bandas de interés y luego se dividió este valor por el valor de la banda de β-actina (menos su fondo) correspondiente de cada muestra y se multiplicó por 100.
Las concentraciones de las proteínas MAP-2 (proteína asociada a los microtúbulos, del inglés microtubule associated Protein) y GAP-43 (proteína asociada al crecimiento, del inglés growth Associated protein) en la corteza prefrontal y en el hipocampo se determinaron por la técnica de Western-blot.13) El análisis cuantitativo, se realizó de manera similar al estudio anterior utilizando el programa libre ImageJ.
La presencia de la proteína c-Fos en los diferentes grupos experimentales se determinó por inmunohistoquímica. Para la cuantificación, se seleccionaron 5 cortes aleatorios por animal de las regiones corteza prefrontal e hipocampo. Las imágenes fueron tomadas a 40 X mediante una cámara acoplada al microscopio óptico (Olympus BX51, Tokyo, Japón). Para el análisis cuantitativo, empleamos el programa libre ImageJ.
Resultados
Experimentos agudos
La estimulación de la BLA en ratas sanas aumentó significativamente en el hipocampo la concentración de la proteína BDNF a las 2 h y 24 h posterior a la estimulación respecto a los grupos controles, y de NGF solo a las 24 h posterior a la estimulación. Además, la estimulación eléctrica de la BLA produjo un incremento significativo en la expresión de bdnf y arc en el hipocampo desde los 30 min hasta las 2 h y retorna a los niveles basales a las 24 h posterior a la estimulación en comparación con los grupos controles.
En relación con las proteínas relacionadas con la sinaptogénesis, la estimulación de la BLA produjo un incremento de la concentración de MAP-2 y GAP-43 a las 24 h, 48 h, 72 h y 96 h después de la estimulación en comparación con los grupos controles tanto en el hipocampo como en la corteza prefrontal. Por último, la estimulación de la BLA indujo un incremento en el número de núcleos marcados con c-Fos en el giro dentado del hipocampo y en la corteza prefrontal medial 30 min después de la estimulación que fue decreciendo con el tiempo de 1 h a 2 h respecto a los grupos controles.
Experimentos crónicos
Entrenamiento en el laberinto acuático de Morris
Tratándose de un requisito necesario de nuestros experimentos, en los cuatro diseños experimentales realizados en este trabajo, se evaluó las capacidades de aprendizaje y memoria de las ratas con lesión de FF con o sin estimulación de la BLA, a través del entrenamiento conductual en el LAM. La Figura 1 muestra que el grupo de ratas con lesión de FF mantuvo valores altos de latencias de escape durante los días de entrenamiento (Fig. 1A, *F(2, 25) = 31,96, p = 0,00); nadaron distancias mayores (Fig. 1B, *F(2, 25) = 91,62, p = 0,00) y pasaron más tiempo nadando alrededor de las paredes del LAM (tigmotaxia) (Fig. 1D, *F(2, 25) = 36,01, p = 0,00).
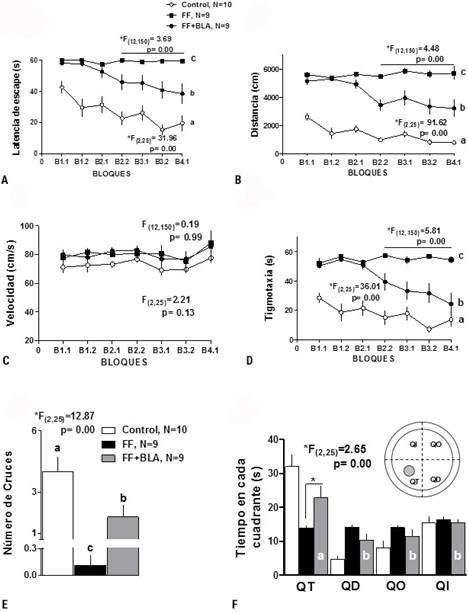
Fig. 1 La estimulación de la BLA mejoró el desempeño conductual en ratas con lesión de FF. A) Latencia de escape. B) Distancia. C) Velocidad. D) Tigmotaxia. E) Número de cruces. F) Tiempo empleado en cada cuadrante durante la prueba de los cruces. Las letras de la a-c representan las diferencias significativas entre los grupos y los bloques (prueba de rangos múltiples de Duncan). Arriba en F: Esquema del LAM con los 4 cuadrantes: QT, cuadrante target; QI, cuadrante a la izquierda de QT; QD, cuadrante a la derecha de QT y QO, cuadrante opuesto al QT. Se muestran las medias ± SEM, p < 0,05 y el estadígrafo F para el factor grupo (abajo) y el factor bloque (arriba) de los ANOVAs.
En cuanto a la velocidad de nado no se encontraron diferencias significativas entre los grupos experimentales (Fig. 1C, F(2, 25) = 2,21, p = 0,13) (ANOVA de medidas repetidas seguido por la prueba de rangos múltiples de Duncan, efectos de Grupo). Sin embargo, las ratas lesionadas que recibieron la estimulación de la BLA demoraron significativamente menos tiempo en encontrar la plataforma sumergida (latencia de escape [Fig. 1A]); disminuyeron las distancias de nado (Fig. 1B) y el tiempo de nado alrededor de los bordes del LAM (Fig. 1D) en comparación con las ratas con lesión de FF sin estimulación de la BLA. Además, la prueba de memoria realizada en el último intento, el número de cruces (Fig. 1E, ANOVA de clasificación simple seguido por la prueba de rangos múltiples de Duncan *F(2, 25) = 12,87, p = 0,00) y el tiempo de permanencia en el cuadrante target de las ratas lesionadas y estimuladas fue superior al de las ratas lesionadas no estimuladas (Fig. 1F, ANOVA bifactorial seguido de la prueba de rangos múltiples de Duncan *F(2, 25) = 2,65, p = 0,00).
Aunque las ratas con estimulación de la BLA están lejos de los resultados de las ratas controles, nosotros consideramos que el mejoramiento observado después de la estimulación de la BLA es relevante, considerando que la lesión de FF produce una profunda y probablemente irreversible discapacidad en el aprendizaje.
Determinación de las concentraciones de BDNF y NGF
Las concentraciones de BDNF difirieron entre las ratas controles basales (no entrenadas) y las ratas controles sanas entrenadas. Las concentraciones de esta neurotrofina fueron significativamente más altas en las ratas con lesión de FF entrenadas que en las ratas controles no entrenadas y las ratas sanas entrenadas. La estimulación repetida de la BLA indujo las concentraciones más altas de BDNF en las ratas con lesión de FF (Datos no mostrados). Por otra parte, las concentraciones de NGF no difirieron entre el grupo control basal y el grupo control entrenado en el LAM. En las ratas con lesión en la FF se produjo un ligero, pero significativo aumento en las concentraciones de NGF; sin embargo, esto no fue influenciado por la estimulación de la BLA (Datos no mostrados).
Expresión de los genes bdnf y arc
En este estudio se midió la expresión de estos genes en el hipocampo de ratas entrenadas al final de la prueba conductual (Fig. 2A). Como se puede observar en la Figura 2, la estimulación de la BLA 15 min después de culminado el entrenamiento en el LAM en ratas con lesión de FF aumentó significativamente la expresión de los genes relacionados con la plasticidad bdnf (Fig. 2B, ANOVA de clasificación simple, *F (3, 21) = 40,57, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) y arc (Fig. 2C, ANOVA de clasificación simple, *F(3, 21) = 19,85, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) en comparación con las ratas controles entrenadas, las ratas con lesión de FF y las ratas sanas (control basal). La expresión de los genes de activación temprana relacionados con la plasticidad bdnf y arc en los animales con lesión de FF fue similar. estadísticamente al grupo de controles entrenados. Sin embargo, en ambos grupos aumentó la expresión de los genes relacionados con la plasticidad bdnf y arc en comparación con el grupo control basal (Fig. 2B, C).
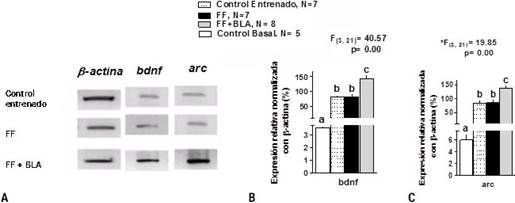
Fig. 2 La estimulación de la BLA aumentó la expresión de bdnf y arc en el hipocampo de ratas con lesión de FF. A) Electroforesis representativa de los diferentes grupos experimentales, la cual muestra la expresión de (-actina, bdnf y arc. B y C) Análisis cuantitativo de la expresión de bdnf y arc respectivamente. Se muestra la media y la desviación estándar, los valores del estadígrafo F y los grados de libertad de los ANOVA. Las letras de la a-c representan las diferencias significativas entre los grupos (prueba de rangos múltiples de Duncan, p < 0,05).
Expresión de MAP-2 y GAP-43
En este estudio se midió la concentración de las proteínas GAP-43 y MAP-2 en ratas entrenadas en el LAM. Como se puede observar en la Figura 3(A-C) , existen diferencias en la concentración de la proteína GAP-43 en el hipocampo (Fig. 3B, ANOVA de clasificación simple, *F(3, 23) = 14,46, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) y en la corteza prefrontal (Fig. 3C, ANOVA de clasificación simple, *F(3, 23) = 17,11, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) entre los diferentes grupos experimentales. El entrenamiento produjo un incremento significativo de la concentración de la proteína GAP-43 en el hipocampo y la corteza prefrontal en relación al grupo de ratas sanas (control basal). En las ratas con lesión de FF no se produjo un aumento en la concentración de la proteína GAP-43, sino que permaneció en concentraciones estadísticamente similares al grupo control basal. Por otra parte, la estimulación de la BLA en ratas con lesión de FF produjo un incremento significativo de la concentración de la proteína GAP-43 en el hipocampo y la corteza prefrontal en comparación con las ratas controles entrenadas y a las ratas con lesión de FF sin estimulación de la BLA.
Resultados similares se evidenciaron cuando se determinó la concentración de la proteína MAP-2 (Fig. 3D-F) en el hipocampo (Fig. 3E, ANOVA de clasificación simple, *F(3, 30) = 14,42, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) y en la corteza prefrontal (Fig. 3F, ANOVA de clasificación simple, *F(3, 30) = 10,65, p = 0,00 seguido por la prueba de rangos múltiples de Duncan) en ratas entrenadas en el LAM. El entrenamiento produjo un aumento significativo de la concentración de la proteína MAP-2 en el hipocampo y la corteza prefrontal en relación al grupo control basal. En contraste, en las ratas con lesión de FF la concentración de la proteína MAP-2 fue estadísticamente similar al grupo de animales sanos. En el hipocampo, los valores más altos de concentración de la proteína MAP-2 se encontraron en el grupo de estimulación de la BLA en ratas con lesión de FF en comparación con las ratas controles entrenadas y las ratas con lesión de FF sin estimulación de la BLA. Sin embargo, no se encontraron diferencias en la concentración de la proteína MAP-2 en la corteza prefrontal entre las ratas sanas entrenadas y las ratas con lesión de FF sin estimulación de la BLA.
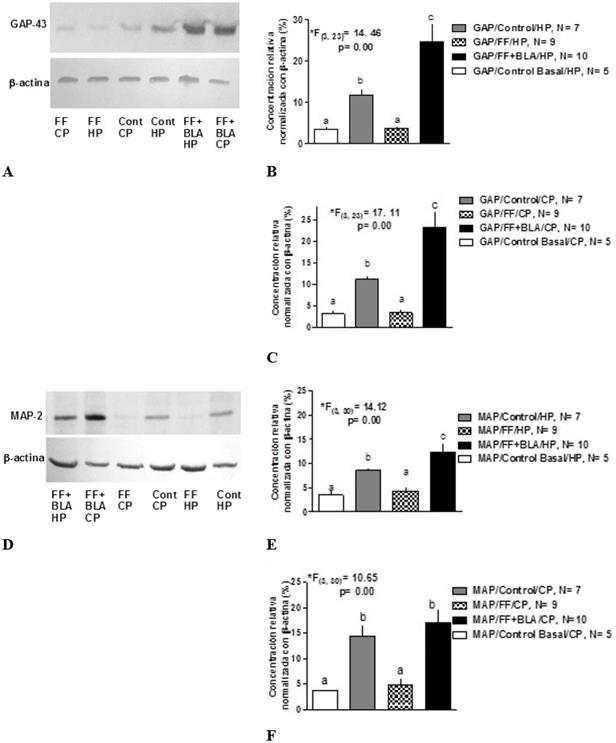
Fig. 3 La estimulación de la BLA indujo un incremento significativo de la concentración de GAP-43 y MAP-2 en el hipocampo y la corteza prefrontal en ratas con lesión de FF. A y D) Resultados representativos del Western-blot de extractos de proteínas de la corteza prefrontal y el hipocampo. B, C) Análisis cuantitativo de la concentración de la proteína GAP-43 en el hipocampo y la corteza prefrontal. E, F) Análisis cuantitativo de la concentración de la proteína MAP-2 en el hipocampo y la corteza prefrontal. Se muestra la media y la desviación estándar, los valores del estadígrafo F y los grados de libertad de los ANOVA. Las letras de la a-c representan las diferencias significativas entre los grupos (prueba de rangos múltiples de Duncan, p < 0,05).
Expresión de c-Fos
En la Figura 4(A-D) se muestran fotomicrografías de cortes representativos de todos los grupos experimentales. En ellas se puede observar que en los cortes histológicos de las ratas del grupo control basal y el grupo lesionado tienen poca positividad a c-Fos (Fig. 4A, C). Por otra parte, las fotomicrografías pertenecientes a los grupos de lesión de FF con estimulación de la BLA y el control entrenado, presentan un número mayor de núcleos positivos a c-Fos (Fig. 4B, D).
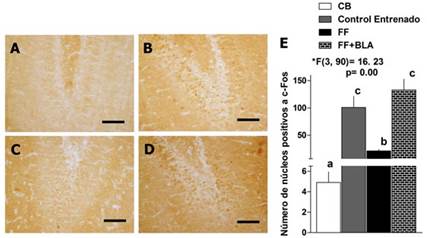
Fig. 4 La estimulación eléctrica de la BLA indujo un incremento significativo en la expresión de la proteína c-Fos en el giro dentado del hipocampo. A) Fotomicrografía (40X) del grupo control basal. B, D) Fotomicrografías (40X) de los grupos control entrenado y el grupo de ratas con lesión de FF y estimulación de la amígdala respectivamente. C) Fotomicrografía (40X) del grupo de lesión de FF. Barra = 50 µm. E) Análisis cuantitativo de los núcleos positivos a c-Fos en los diferentes grupos experimentales. Se muestra la media y la desviación estándar, el valor del estadígrafo F y los grados de libertad del ANOVA. Las letras de la a-c representan las diferencias significativas entre los grupos (prueba de rangos múltiples de Duncan, p < 0,05). N = 5 para todos los grupos experimentales.
En la Figura 4E se muestra el análisis cuantitativo de este patrón. El entrenamiento en el LAM indujo un incremento en el número de núcleos marcados con c-Fos en el giro dentado del hipocampo con respecto al control basal (ANOVA de clasificación simple, *F(3.90) = 16, 23, p = 0,00 seguido de la prueba de rangos múltiples de Duncan). En las ratas lesionadas entrenadas se produjo una disminución en el número de núcleos marcados con c-Fos en el giro dentado del hipocampo con respecto a las ratas del grupo control entrenado (ANOVA de clasificación simple, *F (3.90) = 16, 23, p = 0,00 seguido de la prueba de rangos múltiples de Duncan). Sin embargo, en el grupo de ratas lesionadas y estimuladas en la BLA se produjo un incremento significativo en el número de núcleos marcados con c-Fos en el giro dentado del hipocampo con respecto al grupo control basal y al grupo de ratas lesionadas, pero no con respecto al grupo de ratas entrenadas (ANOVA de clasificación simple, *F(3.90) = 16, 23, p = 0,00 seguido de la prueba de rangos múltiples de Duncan).
En cuanto a la corteza prefrontal, se obtuvo un patrón similar. En la Figura 5(A-D) se muestran fotomicrografías de cortes representativos de todos los grupos experimentales. En la Figura 5E se muestra el análisis cuantitativo de este patrón. Cuando observamos lo que aconteció en la corteza prefrontal por efecto de la estimulación lo primero que llama la atención es que el número de núcleos marcados es mucho más alto que los observados en el hipocampo de esos mismos animales (Fig. 5E). Esto es cierto incluso para el grupo de ratas lesionadas y entrenadas que en cuyo giro dentado del hipocampo se contaron como promedio 21,4 ± 3,072, en tanto en la corteza prefrontal fueron 106,04 ± 7,82. Este último valor es similar al observado en el giro dentado del hipocampo de las ratas controles entrenadas. Más allá de este primer análisis para mostrar las diferencias en el número de núcleos marcados con c-Fos, es importante destacar que, al igual que en el hipocampo, el entrenamiento y la estimulación de la BLA produjeron un incremento en el número de núcleos marcados con c-Fos en la corteza prefrontal estadísticamente significativo con respecto al control basal y a las ratas lesionadas respectivamente (ANOVA de clasificación simple, *F(3.91) = 14, 53, p = 0,00 seguido de la prueba de rangos múltiples de Duncan). Además, las ratas del grupo lesionadas, entrenadas y estimuladas tuvieron un mayor número de núcleos marcados con c-Fos que el grupo de ratas controles entrenadas (ANOVA de clasificación simple, *F(3.91) = 14, 53, p = 0,00 seguido de la prueba de rangos múltiples de Duncan).
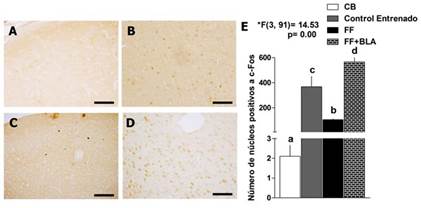
Fig. 5 La estimulación de la BLA indujo un incremento significativo en la expresión de la proteína c-Fos en la corteza prefrontal. A) Fotomicrografía (40 X) del grupo control basal. B, D) Fotomicrografías (40 X) de los grupos control entrenado y el grupo de ratas con lesión de FF y estimulación de la BLA respectivamente. C) Fotomicrografía (40 X) del grupo de lesión de FF. Barra = 50 µm. E) Análisis cuantitativo de los núcleos positivos a c-Fos en los diferentes grupos experimentales. Se muestra la media y la desviación estándar, el valor del estadígrafo F y los grados de libertad del ANOVA. Las letras de la a-d representan las diferencias significativas entre los grupos (prueba de rangos múltiples de Duncan, p < 0,05). N = 5 para todos los grupos experimentales.
Discusión
El objetivo de esta serie de experimentos era esclarecer los mecanismos a través de los cuales la activación de la amígdala promueve la recuperación de la memoria espacial en animales que tienen un déficit en estas habilidades como consecuencia de la lesión de la FF.
Hemos podido demostrar que la estimulación eléctrica de la BLA induce la expresión temprana de los genes relacionados con la plasticidad como el bdnf y el arc, así como la concentración de las proteínas BDNF y NGF. Además, la estimulación de la BLA aumenta la expresión de las proteínas asociadas al crecimiento dendrítico, MAP-2 y axonal, GAP-43. Por otro lado, la estimulación de la BLA produce una activación de diferentes regiones cerebrales como el hipocampo y la corteza prefrontal, demostrada a través del incremento en la inmunoreactividad a la proteína c-Fos.
Lesión de fimbria-fornix
En los cuatro experimentos que se diseñaron en este trabajo, el estudio histológico demostró una transección casi completa de la FF, lo cual sugiere que el procedimiento de la lesión es efectivo debido a que produce una denervación colinérgica casi completa en el hipocampo. Esto se demuestra por la pérdida de tinción de la AChE. Estos resultados son coincidentes con estudios previos de nuestro laboratorio.10),(14
La estimulación eléctrica de la BLA promueve la recuperación de la memoria espacial en ratas con lesión de fimbria-fórnix
Los resultados del presente estudio en los cuatro diseños experimentales, confirman que la estimulación diaria de la BLA 15 min después del entrenamiento mejora el aprendizaje en ratas con déficit de memoria como resultado de la transección bilateral de la FF. Los mecanismos por los cuales la estimulación de la BLA ejerce su efecto en la mejoría de la memoria pueden involucrar su efecto reforzador en procesos como la LTP en el hipocampo.15 Esto ha sido demostrado en animales sanos entre los cuales la estimulación de la BLA consolida una potenciación de corta duración (E-LTP, del inglés early-long term-potentiation) y la prolonga a una potenciación duradera (L-LTP, del inglés late-long term-potentiation).16),(17
La estimulación eléctrica de la amígdala aumenta la concentración de las neurotrofinas BDNF y NGF
Nuestros datos muestran que la estimulación eléctrica de la amígdala aumenta la concentración de la neutrofina BDNF a las 2 h y 24 h posteriores a la estimulación en el hipocampo de ratas no lesionadas, y en ratas con lesión de FF después de la combinación del entrenamiento en el LAM y la estimulación de la BLA, mientras que la concentración de NGF muestra cambios menores en ambas situaciones.
Se ha demostrado que el BDNF juega un papel en los procesos de aprendizaje y memoria y en la plasticidad sináptica.18 Coincidente con estos resultados, nuestros datos mostraron diferencias significativas en la concentración de BDNF entre el grupo control basal y el grupo control entrenado en el LAM y, además, se encontraron diferencias entre los grupos de lesión de FF con o sin estimulación de la amígdala.
Basándonos en lo anterior, podemos suponer que un incremento en la síntesis y liberación del BDNF después de la estimulación de la BLA y el entrenamiento podría actuar paracrinamente sobre las neuronas del hipocampo para activar cascadas y mecanismos capaces de promover la plasticidad neural y con ello promover la memoria para la tarea.
Por otra parte, el NGF parece ser decisivo para la supervivencia de las neuronas colinérgicas septales que se proyectan al hipocampo.19 Las aferencias colinérgicas son cruciales para la memoria y su degeneración o interrupción pueden tener efectos devastadores sobre las funciones de la memoria.19
Sin embargo, en el presente estudio se demuestra que la estimulación de la BLA aumenta significativamente la concentración de NGF en el hipocampo 24 h después de la estimulación en ratas sanas, así como en ratas lesionadas con o sin estimulación de la BLA.
La estimulación eléctrica de la amígdala incrementa los niveles de expresión de los genes de expresión temprana relacionados con la plasticidad bdnf y arc
En este trabajo se demostró que la estimulación de la BLA produce un incremento en la expresión de los genes relacionados con la plasticidad bdnf y arc después del entrenamiento. Además, evaluamos la expresión de ambos genes después de la estimulación de la BLA en ratas sanas donde observamos un aumento en la expresión de estos genes que duró al menos hasta las 2 h con un pico en la expresión máxima a los 30 min. Este hallazgo está en línea con lo reportado en trabajos anteriores.20
Los resultados de este estudio apoyan la suposición de que la estimulación de la BLA induce la transcripción del gen bdnf en su ARNm, el cual es después traducido en la proteína BDNF. Este factor neurotrófico participa en la señalización y en la plasticidad sináptica dependiente de la actividad en el sistema nervioso adulto y su liberación podría activar la expresión temprana del gen arc cuyos niveles de expresión están aumentados por la fuerte estimulación sináptica.
Los estudios con ARN antisentido,21 los estudios con ratones knockout21 y farmacológicos2 sugieren que la proteína arc tiene una alta tasa de recambio y que su síntesis continua es necesaria durante una ventana crítica para que la consolidación de la memoria22 y de la LTP tenga lugar.23 En línea con nuestros datos se ha demostrado que el arc se incrementa en el hipocampo inmediatamente después del entrenamiento en el LAM y que es crítico para la consolidación de la memoria espacial a largo plazo.21
GAP-43, MAP-2 y la recuperación de la memoria espacial
Nuestros datos muestran que la estimulación de la BLA produce un incremento mantenido en la concentración de GAP-43 en el hipocampo y la corteza prefrontal desde las 24 h hasta las 96 h. Datos previos han sugerido que GAP-43 es un correlato intrínseco de axones en crecimiento y la sinaptogénesis durante el desarrollo y la reorganización anatómica, así como también de la regeneración axonal, la sinaptogénesis reactiva y la plasticidad sináptica en el estado adulto guiado por la experiencia.24 En este estudio presentamos datos que muestran que en las ratas sanas entrenadas en el LAM se induce un incremento en la concentración de la proteína GAP-43, lo cual es coincidente con resultados previos.25 Más interesantemente, la estimulación eléctrica de la BLA posterior al entrenamiento diariamente produce un aumento de la concentración de GAP-43 en el hipocampo y la corteza prefrontal en ratas con lesión de FF, superior no solamente comparado con el grupo de animales con lesión de FF, sino además con las ratas sanas entrenadas. Reportes previos han mostrado, que la expresión de GAP-43 aumenta durante la LTP,26 y que el bloqueo del receptor NMDA con MK-801 reduce la expresión de GAP-43 en las células granulares del hipocampo.27 Es muy sugestivo, que la activación de la BLA, una estructura límbica involucrada en la emoción y la motivación, produzca un incremento de GAP-43 en el hipocampo y la corteza prefrontal, y consecuentemente podría conducir a la recuperación de la memoria espacial en animales con lesión de la FF.
Con la intensión de construir una vista más completa sobre la estimulación eléctrica de la BLA y sus efectos sobre el crecimiento y la remodelación sináptica, estudiamos la proteína postsináptica MAP-2. La proteína MAP-2 es una fosfoproteína del citoesqueleto que está principalmente asociada con los microtúbulos en las dendritas postsinápticas.28 En este trabajo, hemos mostrado que la estimulación de la BLA produce un incremento sustancial de la concentración de MAP-2 en el hipocampo y la corteza prefrontal de las 24 h a las 96 h. Existen evidencias que muestran que los cambios dependientes de la actividad en la estructura dendrítica podrían involucrar la expresión de MAP-2.28 La inhibición de MAP-2 por oligonucleótidos anti sentido MAP-2 en cultivos de macroneuronas cerebelares29 resulta en la inhibición de la formación y crecimiento de las neuritas. También en este trabajo proporcionamos datos que muestran que en las ratas sanas entrenadas en el LAM se produce un aumento en la concentración de la proteína MAP-2, lo cual coincide con resultados previos.30 Otra forma de plasticidad dependiente de la actividad, como la LTP, requiere el incremento de la expresión del ARNm de MAP-2.31) Además, mostramos que, en animales con lesión de la FF y estimulación de la BLA, ocurre un incremento de la concentración de MAP-2. Por otra parte, ha sido demostrado que el ejercicio moderado es capaz de inducir un incremento de MAP-2 en el hipocampo.32
La síntesis de las proteínas GAP-43 y MAP-2 pueden ser actores importantes en la remodelación sináptica final inducida por la estimulación de la BLA. Las sinapsis recién emergidas podrían ayudar a compensar los efectos del déficit de memoria debido a la desaferentación subcortical después de la transección de la FF.
La estimulación eléctrica de la amígdala incrementa los niveles de expresión de la proteína c-Fos
Nuestros datos muestran que en las ratas sanas entrenadas en el LAM se produce un incremento significativo en el número de núcleos positivos a c-Fos en el hipocampo y en la corteza prefrontal. Este resultado es coincidente con lo reportado en la literatura.33 En cuanto a su papel en estos procesos, los datos previos de diversos laboratorios utilizando diferentes métodos que van desde animales modificados genéticamente, silenciamiento genético indican que la inducción de este de gen de expresión temprana (c-fos) durante el aprendizaje es un mecanismo clave para la consolidación de la memoria a corto plazo en una memoria a largo plazo.33 Esto se torna especialmente importante porque c-Fos, como otros genes de expresión temprana, es un factor de transcripción que puede promover la transcripción de varios genes.34 Los productos de estos genes activados por c-Fos pueden ser claves para ajustar las propiedades de las neuronas a un nuevo nivel de actividad.
Nuestros datos coinciden con los reportados con anterioridad en los cuales se muestra que la característica más prominente de la expresión de c-fos en el sistema nervioso central es el incremento dramático, rápido y transitorio del ARNm de c-fos y de los niveles de la proteína c-Fos seguido de estímulos específicos.35 Los niveles máximos de la expresión de c-fos fueron encontrados en las células granulares del giro dentado en el período de tiempo de 30 min a 60 min, lo cual coincide con nuestros datos.
Por último, debemos decir que la estimulación de la BLA también induce la activación de c-Fos en otras regiones cerebrales como el septum, el tálamo, la corteza visual, el estriado, la corteza entorrinal, la corteza temporal, el hipotálamo y el locus coeruleus. Todo lo cual es razonable pues se conoce que la amígdala tiene conexiones con casi todas las regiones cerebrales,36 en especial con las relacionadas con la conducta, la memoria y el aprendizaje. La activación de todas estas regiones puede participar en la recuperación de la memoria espacial observada en este trabajo.
Conclusiones
La BLA promueve mecanismos neuroplásticos funcionales y estructurales que pueden contribuir al aprendizaje, la memoria y a la recuperación de funciones perdidas; todo lo cual sugiere que la amígdala podría ser una estructura cerebral reguladora de la plasticidad neural que le permite a los animales no solo responder inmediatamente de modo más eficaz frente a un estímulo relevante; si no que contribuye a ampliar sus capacidades adaptativas para el futuro.














