Introducción
En el 2019, los Centros para el Control y la Prevención de Enfermedades comenzaron a monitorear el brote de un nuevo coronavirus, SARS-CoV-2 (del inglés severe acute respiratory syndrome coronavirus-2), que causa la enfermedad respiratoria que conocemos actualmente como COVID-19.
La detección del SARS-CoV-2 en diferentes órganos y diversas manifestaciones del COVID-19, como complicaciones del sistema nervioso central y cardiovascular, lesión renal y síntomas del tracto gastrointestinal, sugieren que los sitios de infección extrapulmonares contribuyen a la patogénesis de la enfermedad. 1 El análisis post mortem y el posible impacto del SARS-CoV-2 en diferentes órganos es valioso para comprender la propagación del virus y los mecanismos fisiopatológicos de la infección. Especialmente, la identificación del tropismo celular viral puede ser crítico para la patogénesis inducida por virus, siendo relevante para conocer los mecanismos de infección del SARS-CoV-2 e identificar nuevas dianas terapéuticas.
Este trabajo se basa en la caracterización por microscopía electrónica y confocal del virus SARS-CoV-2; desde su aislamiento en exudado nasofaríngeo reportándose el primer caso en Cuba del virus SARS-CoV-2; diagnóstico y caracterización viral en varios tejidos de pacientes con COVID-19 y su relación con la fisiopatogénesis, amplio tropismo, dianas moleculares y terapéuticas en autopsias de fallecidos por COVID-19.
Esta investigación consta de 2 bloques experimentales y objetivos:
Métodos
Las muestras analizadas en ambos bloques experimentales fueron de pacientes (bloque 1) y fallecidos (bloque 2) diagnosticados positivos al COVID-19, según su análisis de PCR en tiempo real (reverso-transcripción- reacción en cadena de la polimerasa), en el Hospital General Militar Dr. Luis Díaz Soto, La Habana. a) Se obtuvieron 4 muestras de la cavidad nasofaríngea y los hisopos (muestras clínicas) se colocaron en medio esencial mínimo (MEM) y suero bovino fetal al 1 %. Las células Vero E6 se cultivaron en MEM y se inocularon con muestras clínicas a 37°C. El efecto citopático (ECP) se registró diariamente bajo un microscopio invertido. Los pocillos en los que se observó un ECP se fijaron en glutaraldehído al 3,2 %, tetróxido de osmio y se deshidrataron en concentraciones crecientes de etanol. Las secciones ultrafinas de 50 nm se examinaron con un microscopio electrónico de barrido MIRA3-TESCAN, utilizando un detector de transmisión de electrones a las 72 h después de la infección. b) Se estudiaron 5 pacientes que fallecieron por COVID-19. Se obtuvieron muestras de órganos viscerales, incluidos los pulmones, el hígado y los riñones y cerebro dentro de las 3 h posteriores a la muerte. Para preparar criocortes, los tejidos se fijaron con paraformaldehído durante 2 h. El SARS-CoV-2 y las características patológicas se evaluaron mediante la tinción de tricrómica de Masson (TTM), 2 la microscopía electrónica (ME) 3 y la microscopia confocal (MC). 4 Las muestras se analizaron utilizando el microscopio de fluorescencia de barrido láser OLYMPUS FV1000 IX81 y el software de imágenes FlowView Viewer v3.1.
Resultados
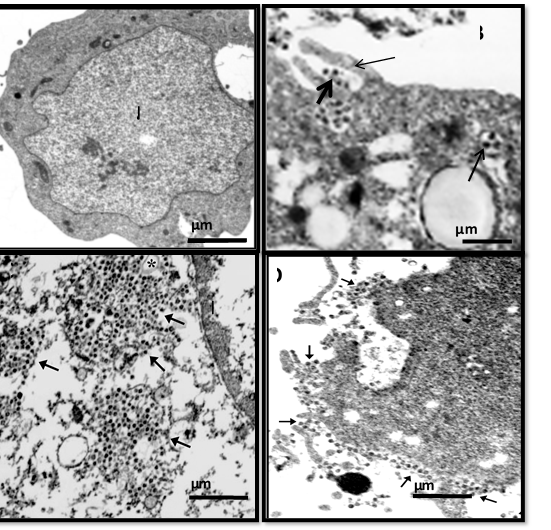
Análisis por microscopía electrónica, del aislamiento del SARS-CoV-2 de pacientes cubanos con COVID-19, en células Vero E6
Las células Vero E6 infectadas mostraron daño extenso o muerte celular. En las muestras clínicas se pudieron observar partículas de virus y viriones extracelulares, que variaban de 80 nm a 125 nm de diámetro (figura 1A). En particular, las partículas virales se mostraron en vesículas lisas intracelulares y viriones extracelulares en estrecho contacto con la membrana plasmática y las protuberancias de filopodio (figura 1B, 1D). Las células infectadas dañadas contenían abundantes partículas virales ubicadas cerca de las vesículas de doble membrana (figura 1C). Estas partículas pueden encontrarse en varias vesículas (figura 1C) que pueden detectarse en el medio extracelular.
Nuevas dianas celulares y moleculares involucradas en la patogénesis de COVID-19 en tejidos post-mortem de pulmón, riñón e hígado y cerebro
Pulmón
Tanto las evidencias clínicas como patológicas indican el desarrollo del síndrome de dificultad respiratorio agudo (SDRA) en todos los pacientes estudiados. El tejido pulmonar mostró evidencias de un patrón distintivo de daño alveolar difuso (DAD) con fases avanzadas predominantes (fases fibroproliferativas y fibróticas). A través de las técnicas de inmunohistoquímicas por MC, la proteína de la nucleocápside (NC) del SARSCoV-2 fue localizada en el epitelio alveolar ACE2+, en las células de tipo endotelial (CTE), en las células similares a macrófagos (CSM), en las células epiteliales bronquiales y en las alveolares (K10), en las células progenitoras endoteliales (CD34) (figura 2A) y en los monocitos/macrófagos (CD68).
Para agregar evidencia de la interacción del SARS-CoV-2 con componentes de la matriz extracelular (MEC) y en células similares a fibroblastos (CSF), analizamos la colocalización de la NC con las dianas moleculares claves involucradas en la respuesta de reparación tisular (RRT) y en la patogénesis pulmonar. La NC se codetectó con la fibronectina en los tabiques alveolares (figura 2B), revelando una tinción de tipo fibrilar y un patrón de partículas intracelulares en las células lipogénicas similares a fibroblastos pulmonares (CLSF). En particular, se encontró la NC en las células Vimentina+ (VMT+), incluidas las células similares a fibroblastos (CSF) (figura 2C). A continuación, se investigó la presencia del SARSCoV-2 en lipofibroblastos (LPF). Sorprendentemente, la NC pudo identificarse en las células intersticiales que mostraban la presencia simultánea de gotas de lípidos y PPARγ activado, lo que sugiere la presencia del SARS-CoV 2 en los lipofibroblastos (LPF) que muestran la señalización de PPARγ (figura 2D).
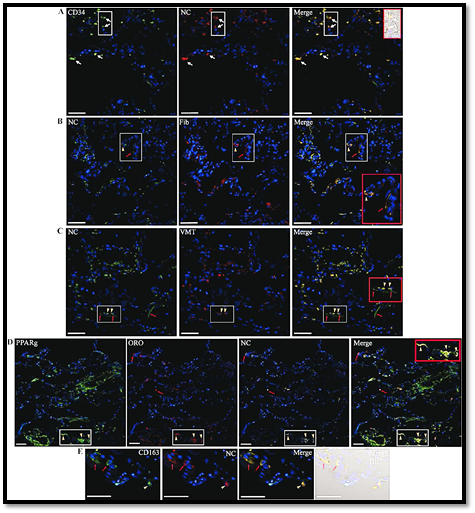
Fig. 2 Microscopía confocal de secciones de pulmón del paciente R incubadas con varias combinaciones de anticuerpos de conejo y ratón contra la nucleocápside (NC) y las proteínas del huésped, seguidas de Alexa 647-(A647) e IgG anti-ratón/conejo conjugadas con fluoresceína/FITC solas o en diferentes combinaciones, o teñido con Oil red (ORO, canal Tx Red); y DAPI para teñir el núcleo (canal azul). A) Nucleocápside (NC)-(A647) localizado en células de tipo endotelial CD34 + (FITC) (flechas). B) NC (FITC) y fibronectina (Fib) (A647) colocalizados (merge) en los tabiques alveolares con un patrón de partículas (punta de flecha) o una tinción similar a fibrilar (flecha) relacionada con las células productoras de Fibronectina (FiB9. C) Nucleocápside (NC) (FITC) co-localizado con vimentina (VMT) + (A647) (puntas de flecha). D) Se detectó NC (A647) en células que mostraban GL concomitantes (ORO) y PPARγ activado (FITC) (puntas de flecha) y también en células que contenían gotitas de lípidos (GL) pero no PPARγ activado (flechas). E) NC (A647) localizado en macrófagos alveolares (puntas de flecha) e intersticiales (flechas) CD163 + (FITC). Merge: colocalización. Barras: 50 μm.
Nuevas dianas celulares y moleculares involucradas en la patogénesis de COVID-19 en tejidos post-mortem de riñón
La NC también se localizó en las células intersticiales peritubulares con fibronectina y ACE2+. Es importante destacar que se observó la NC predominantemente en el aparato yuxtaglomerular. Además, se pudo detectar la NC en los podocitos, en las células mesangiales y en las endoteliales de algunos glomérulos. Además, se detectó la NC en la región medular, en el endotelio de los vasos CD34+ y en las células intersticiales.
Nuevas dianas celulares y moleculares involucradas en la patogénesis de COVID-19 en tejidos post-mortem de hígado
Por otra parte, la NC se observó en células sinusoidales endoteliales hepáticas (CSEH) en contacto con los hepatocitos infectados. Además, se detectó la NC en células CD34+. Curiosamente, la nucleocápside NC se colocalizó con la vimentina (VMT) en los hepatocitos que muestran un patrón de tinción granulado que indica una redistribución celular de la vimentina a sitios de replicación-morfogénesis viral.
Nuevas dianas celulares y moleculares involucradas en la patogénesis de COVID-19 en tejidos post-mortem de cerebro
La proteína de la NC se colocalizó en una variedad de células típicas del sistema nervioso central (SNC), que fueron identificados usando anticuerpos contra NeuN (neuronas), GFAP (astrocitos), CNPasa (oligodendrocitos) e Iba-1 (microglia). Posteriormente, se identificaron los mediadores potenciales de la patogenicidad de este virus en el SNC humano. En particular, también se observó coinmunotinción de la NC con un componente clave del eje neuroinflamatorio: el inflamasoma NLRP3 (figura 3).
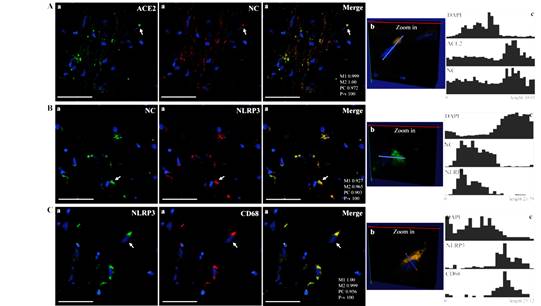
Fig. 3 Microscopía confocal de la nucleocápside (NC) del SARS-CoV-2 y los marcadores de la entrada del huésped viral y la neuroinflamación en la corteza cerebral de pacientes fallecidos con COVID-19.
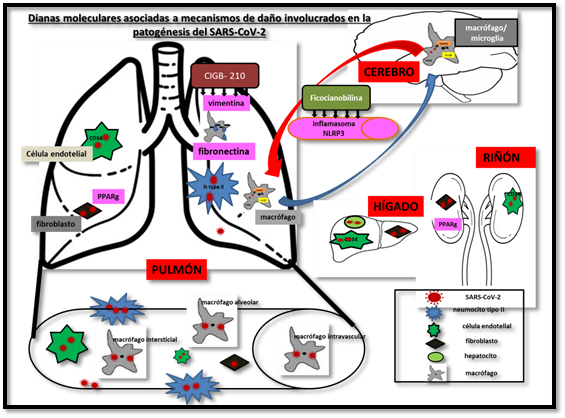
En la figura 4 se muestra esquema integrador de los diferentes tipos celulares y dianas terapéuticas que participan en la patogénesis de la infección por SARS-CoV-2.
Discusión
El análisis por microscopía electrónica de células Vero E6 con los aislamientos del SARS-CoV-2 ilustró la presencia de las partículas de virus y de viriones extracelulares similares a los descritos previamente para el SARS-CoV y para el SARS-CoV-2. 5 Los viriones extracelulares se observaron próximos a la membrana plasmática y alrededor de las protuberancias filopodiales. Esta característica parece ser importante para el ciclo de vida del SARS-CoV-2, lo que sugiere la participación de los filopodios en la transmisión del virus de célula a célula. 6 En este estudio, se confirmó por primera vez en Cuba en células Vero E6, el aislamiento del virus SARS-CoV-2 de exudados nasofaríngeos de pacientes con COVID-19, utilizando RT-PCR y ME. 7
La lesión pulmonar directa mediada por el SARS-CoV-2 se ha demostrado que es relevante en las primeras etapas de la infección, mientras que las etapas posteriores del desarrollo del DAD se han asociado principalmente con las respuestas del huésped. Mediante la TTM, se muestran evidencias experimentales de las 3 fases del DAD (Fases: exudativa, fibroproliferativa y fibrótica), estando interrelacionadas y superpuestas en el desarrollo del DAD. Sin embargo, se identificó un predominio de las etapas más avanzadas del DAD, respecto a la exudativa, en las muestras analizadas en este estudio. La presencia de la NC en la interfaz del endotelio capilar y de las células epiteliales alveolares, así como en el tejido conectivo adyacente, implica directamente al SARS-CoV-2 en el daño sostenido y en la interferencia con la interfase alveolar aire-sangre, en la desregulación de la respuesta inmune que conducen a un aclaramiento viral deteriorado, una regeneración epitelial reducida y una remodelación tisular patológica. Esto concuerda con otros estudios que describen la presencia de los componentes del SARS-CoV-2 en el endotelio capilar de los pulmones y un aumento de la expresión de ACE2 en el endotelio vascular. 8 Los nuevos hallazgos de este trabajo incluyeron la detección de los componentes del SARS-CoV-2, que sugieren una infección viral en una variedad de células incluidas: las células lipogénicas similares a fibroblastos (CLSF) pulmonares que muestran características de lipofibroblastos (LFP), como la señalización con PPARγ activado, las gotas de lípidos (GL) que expresan fibronectina y vimentina, siendo estas moléculas posibles dianas de terapias antivirales.
Otro hallazgo interesante fue la presencia de la NC tanto en la fibronectina cortical peritubular y medular renal, como en las células intersticiales ACE2+. Por otro lado, las células intersticiales del lecho capilar peritubular de la corteza renal han participado en la detección del contenido del oxígeno arterial que está relacionado con la tensión del oxígeno alveolar y con el intercambio de los gases alveolares. Este proceso regula la producción de eritropoyetina (EPO) y eritropoyesis por las células intersticiales renales. Este hallazgo plantea la posibilidad de que el SARS-CoV-2 pueda afectar directamente y desregular funciones críticas de estas células, como la regulación del sistema renina-angiotensina-aldosterona (SRAA) que está involucrado en la regulación de la presión arterial y la homeostasis de electrolitos. 9
Las características ultraestructurales relacionadas con el virus que se observaron en los hepatocitos fueron consistentes con las observadas en las muestras de pulmón y riñón que respaldan la infección hepática por SARS-CoV-2 y su posible participación en la patogénesis mediada por virus. Las mitocondrias dañadas fue un hallazgo común y parece ser un objetivo importante para la reprogramación metabólica mediada por los virus y la patogénesis in vivo.10 Por lo tanto, la presencia de SARS-CoV-2 en las células CD34 del hígado, puede estar relacionada con la patogénesis viral o con condiciones preexistentes del huésped como la esteatosis hepática.
El presente estudio ilustra que la NC se colocaliza con proteínas neuronales y gliales específicas en la corteza cerebral, lo que sugiere la posibilidad de que el tropismo celular diverso del SNC del SARS-CoV-2 podría ser altamente deletéreo como se propuso por Pan R y col. 11 Por otro lado, en una serie de 41 casos post mortem, se encontró activación microglial, lo que confirma el importante papel de este tipo de células del SNC en lesiones cerebrales por SARS-CoV-2. 12 Nuestro estudio revela que la infección del cerebro por SARS-CoV-2 ocurre en múltiples tipos de células del SNC e induce la activación del inflamasoma NLRP3 en la microglia, que puede estar involucrado en diversas complicaciones neurológicas relacionadas con COVID-19. Por lo tanto, nuestros datos apuntan a estrategias terapéuticas centradas en la inhibición del inflamasoma microglial NLRP3 para prevenir las secuelas neurológicas, así como para promover la recuperación neurológica de los pacientes con COVID-19.
La evidencia experimental acumulada apoya fuertemente la aplicación segura del compuesto tetrapirrólico natural Ficocianobilina (FCB) para el daño inducido por COVID-19 al Sistema Nervioso Central. 13 La FCB tiene potencial para contrarrestar los efectos posteriores de la activación del inflamasoma que están mediados por IL-1β, ya que se ha informado que la activación endosómica de NOX2 desempeña un papel catalítico en la señalización de IL-1β.
Por su parte, el CIGB 210 es un péptido de 18 aa derivado de la región 1A de queratina-10 14 y se ha asociado su efecto a la vimentina. Actualmente se asocia a la vimentina como posible diana para el tratamiento de COVID-19. 15 Dado que la vimentina tiene un papel en la enfermedad, el uso de fármacos dirigidos a la vimentina puede ofrecer una ventaja sinérgica para el tratamiento del SARS-CoV-2.
Conclusiones
Se realizó por primera vez el aislamiento del virus SARS-CoV-2 en Cuba en exudados nasofaríngeos de pacientes con COVID-19, en la línea celular Vero E6, utilizando la microscopía electrónica para confirmar también su efecto citopático. Se identificaron por primera vez novedosos procesos celulares y fisiopatológicos involucrados en la infección del virus SARS-CoV-2 en pulmón, riñón, hígado y cerebro. Se detectó la presencia de la proteína de la NC viral colocalizada con las moléculas claves tales como: la fibronectina, la vimentina, el PPARγ, lo que sugiere a estas moléculas como potenciales dianas antivirales. Se detectó la presencia de la proteína de la NC viral conjuntamente con el inflamasoma NLRP3 en cerebro, lo que sugiere el papel crítico de este tipo de inflamasoma, constituyendo una diana terapéutica para fármacos anti-SARS-CoV-2.