Introducción
Originarios de zonas templadas y subtropicales, los árboles y arbustos de Salicaceae, que incluyen álamos (Populus spp.) y sauces (Salix spp.) son de crecimiento rápido y de fácil propagación vegetativa. Muchas de las especies se adaptan a muy diversas condiciones de clima y suelo, desde el calor del desierto chino hasta el frío y el viento de los Andes sudamericanos. Son fáciles de cultivar y constituyen un componente importante de los sistemas agroforestales, a menudo para pequeños agricultores. Suministran una amplia gama de productos madereros, no madereros y servicios (Ball et al., 2005).
La especie Salix babylonica tiene un uso ornamental. Sin embargo, se emplea también en la fitorremediación de suelos afectados por sustancias peligrosas (Ghasemi y Mokhtari, 2019), considerada como una alternativa para la eliminación de cianuro de sodio. Esta especie es utilizada para la producción de energía renovable. Al respecto, Doffo et al., (2017) informaron la diversificación de las fuentes renovables como la biomasa forestal, producidas por Salix; para ello consideraron que la disponibilidad de agua es el principal factor que determina el rendimiento en biomasa seca, mientras que el genotipo y la densidad de plantación no tienen un efecto significativo en la variable mencionada.
Además, es conocido el uso de esta especie para la obtención del ácido acetilsalicílico o aspirina. Sin embargo, nuevas aplicaciones en el campo de la medicina y, particularmente, sus efectos antimicrobianos se han informado recientemente. Wahab et al., (2018) determinaron que los extractos metanólicos de hojas y corteza de S. babylonica poseen actividad antibacteriana contra Pseudomona aeruginosa, Klebsiella pneumoniae, Escherichia coli y Staphylococcus aureus. También, González et al., (2019) indicaron que los compuestos aislados del extracto hidroalcohólico S. babylonica podrían ser una alternativa natural y funcional para el tratamiento de enfermedades causadas por Escherichia coli, Staphylococcus aureus y Listeria monocytogenes.
En otros estudios, Rivero et al., (2019) demostraron que la administración oral de extracto hidroalcohólicos de S. babylonica podría ser una alternativa natural para el control de la coccidiosis en la producción de conejos.
La aplicación de los métodos biotecnológicos en diferentes especies de Salix se han centrado mayormente en la micropropagación (Naujok, 2007; Chornobrov, 2015; López et al., 2016; Grendysz et al., 2017) para responder a las necesidades de propagación acelerada de diferentes especies y genotipos, al enraizamiento de variedades recalcitrantes y como base para la aplicación de otras técnicas de cultivo in vitro.
Skálová et al., (2012) desarrollaron la micropropagación con ápices de brotes y segmentos nodales de especies de sauce (Salix sp.) comunes y en peligro de extinción, que pueden ayudar a reintroducir genotipos autóctonos en sus sitios naturales. Además, cultivaron anteras aisladas en medios seleccionados y lograron la formación de callos de S. caprea y S. viminalis.
Imran et al., (2018) produjeron semillas sintéticas no embriogénicas; al encapsular segmentos nodales de S. tetrasperma en un medio de cultivo con hidrogel de calcio, observaron que las yemas encapsuladas sobrevivieron al almacenamiento en frío a 4°C durante un período máximo de ocho semanas y lograron una frecuencia de conversión en plántulas del 71 %.
También los métodos biotecnológicos han sido utilizados para la conservación de germoplasma por crioconservación (Bonnart et al., 2014) y la obtención de callos como base para la organogénesis indirecta y la embriogénesis somática (Santos, 2005).
Para Cuba, la especie S. babylonica tiene amplias posibilidades de empleo ornamental, en la fitoremediación, la obtención de metabolitos secundarios y como biomasa energética. Sin embargo, tiene como limitante su escasa presencia de este árbol, por lo que resulta de interés disponer de métodos de propagación in vitro. Por ello, el objetivo de este trabajo fue establecer una vía para la micropropagación de S. babylonica en las diferentes etapas del proceso en condiciones in vitro.
Materiales y métodos
Material vegetal
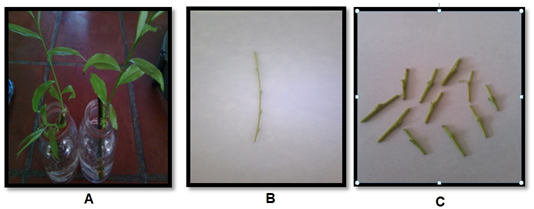
Se seccionaron esquejes semileñosos de 10 cm de longitud de la especie S. babylonica plantada en los jardines de la Universidad de Granma. Los esquejes se colocaron en frascos de cristal con un volumen de 50 ml de agua destilada durante un período de 15 a 30 días hasta la formación de brotes, de donde se tomaron los segmentos nodales (Figura 1).
Medios y condiciones de cultivo
El medio de cultivo basal utilizado para la realización de los diferentes experimentos estuvo compuesto por las sales y vitaminas MS (Murashige y Skoog, 2006), sacarosa 30 g L-1, como agente gelificante Agar 6,0 g L-1 y el pH se ajustó a 5,7 con pH metro (Crison Basic 20) y las variaciones se regularon con hidróxido de sodio y ácido clorhídrico. Posteriormente, el medio de cultivo se distribuyó en tubos de ensayo de 24 x 140 mm, a razón de 10 ml por tubo de ensayo. En el experimento III se precisan los medios de cultivo empleados.
La esterilización se realizó en autoclave vertical (BK-75) a 121 °C de temperatura y 1,2 kgf.cm-2 de presión durante 20 minutos. Los medios de cultivo se mantuvieron en reposo a la oscuridad durante tres días antes de su uso, para detectar cualquier tipo de contaminación.
La manipulación del material vegetal y la siembra en los recipientes de cultivo se efectuó en la cabina de flujo laminar horizontal (FASTER) bajo condiciones asépticas. Las condiciones de cultivo en las cámaras de crecimiento con luz solar fueron: temperatura, 25 °C; humedad relativa, 70-80 % y en condiciones de iluminación natural.
Experimento I. Desinfección de los segmentos nodales de Salix babylonica con el empleo del hipoclorito de sodio y bicloruro de mercurio
El experimento tuvo como objetivo desinfectar los segmentos nodales S. babylonica con el empleo de los diferentes tratamientos de hipoclorito de sodio (NaClO) y bicloruro de mercurio (HgCl2).
Los segmentos nodales se introdujeron en un frasco de vidrio (250 ml) que contenían una solución de agua y detergente al 1,0 %. Luego, se colocaron en el agitador magnético durante 30 minutos, para eliminar sedimentos y partículas grandes. Al finalizar, se lavaron con agua corriente y agua destilada. Posteriormente, se ubicaron 50 explantes en tres frascos diferentes para cada uno de los tratamientos de desinfección.
En la cabina del flujo laminar se procedió a sumergir los segmentos nodales aplicando los tres métodos de desinfección que se describen a continuación:
T1: NaClO al 1 % de cloro activo durante 20 minutos.
T2: HgCl2 al 0,1 % durante 10 minutos.
T3: se realizó la doble desinfección con NaClO al 1 % y HgCl2 al 0,1 % durante 20 y 10 minutos, respectivamente.
Para cada uno de los tratamientos se realizaron cuatro enjuagues con agua destilada estéril, luego de la aplicación de los desinfectantes. Se cortaron a una longitud aproximada de 1 cm y se sembraron en posición vertical en el medio de cultivo descrito en ese acápite con la adición de 6-BAP (2,0 mg L-1) a razón de un explante por tubo de ensayo con 50 explantes por tratamiento.
La evaluación de los resultados se realizó a los 14 días de sembrado mediante las variables porcentajes de explantes desinfestados, contaminados por bacterias, hongos y los necrosados.
Experimento II. Establecimiento in vitro de segmentos nodales de Salix babylonica con el uso de diferentes reguladores del crecimiento.
El objetivo de este experimento fue lograr el establecimiento in vitro de segmentos nodales de S. babylonica con el uso de distintas combinaciones de 6-bencilamino purina (6-BAP) con ácido giberélico (AG3), ácido indolacético (AIA) y ácido naftalenacético (ANA) en los medios de cultivo.
Se empleó un diseño completamente aleatorizado a partir de un mejor resultado en la desinfección del experimento anterior. Se utilizaron cuatro tratamientos:
T1 : 6-BAP 2 mg L-1
T2 : 6-BAP (2 mg L-1) + AG 3 (5 mg L-1)
T3 : 6-BAP (2 mg L-1) + AIA (1 mg L-1) y
T4 : 6-BAP (2 mg. L-1) + ANA (1 mg L-1)
La evaluación de los resultados se realizó a los 28 días de sembrados y se determinaron como variables: Porcentaje de establecimiento y longitud del brote (mm).
Experimento III. Multiplicación de los segmentos nodales de Salix babylonica en tres medios de cultivo.
El objetivo de este experimento fue multiplicar los segmentos nodales de S. babylonica en tres medios de cultivos específicos.
Se utilizaron segmentos nodales obtenidos in vitro del experimento anterior. La evaluación de los resultados se realizó a los 28 días de sembrado para las siguientes variables: explantes brotados (%) y número de segmentos nodales por explante (Tabla 1).
Tabla 1 - Medios de cultivos empleados para la multiplicación de los segmentos nodales de Salix babylonica
| Componentes | Medio de Chung y Carrasco (1998) | Medio Palomo-Ríos (2015) | MMULT-1 |
| Sales MS | 50 % | 50 % | 100 % |
| Vitaminas MS | 100 % | 100 % | 100 % |
| Myoinositol | 100 mg L-1 | 100 mg L-1 | 100 mg L-1 |
| 6-BAP | 0,1 mg L-1 | -- | 2 mg L-1 |
| AIA | - | - | 1 mg L-1 |
| IBA | - | 0,1 mg L-1 | - |
| AG3 | 1 mg L-1 | - | - |
| Sacarosa | 30 g L-1 | 30 g L-1 | 30 g L-1 |
| Agar | 6 g L-1 | 6 g L-1 | 6 g L-1 |
| pH | 5,7 | 5,7 | 5,7 |
MMULT-1: Medio de multiplicación
Experimento IV. Inducción del enraizamiento in vitro de segmentos nodales de Salix babylonica con la utilización de ácido indol butírico (AIB).
El objetivo de este experimento fue evaluar el efecto de distintas concentraciones de AIB en el enraizamiento de segmentos nodales de S. babylonica procedente de la fase de multiplicación in vitro.
Para este experimento se utilizaron segmentos nodales obtenidos en el experimento anterior en el medio de Palomo-Ríos. Cada tratamiento estuvo formado por 25 explantes. Los tratamientos consistieron en la adición al medio de cultivo basal MS por diferentes concentraciones de AIB (0; 0,05 y 0,25 mg L-1).
La evaluación de los resultados se realizó a los 28 días de sembrado, teniendo en cuenta como variables: porcentaje de enraizamiento, número de raíces y de hojas.
Análisis estadístico
Se aplicó un diseño completamente aleatorizado en cada uno de los experimentos realizados. Para las variables cuantitativas como el número de hojas, número de raíces y número de yemas se realizó un análisis no paramétrico de Kruskal-Wallis, luego que los datos no respondieran a los preceptos del análisis de varianza. Para estos análisis se empleó el paquete estadístico InfoStat (Di Rienzo et al., 2014).
Para los datos expresados en porcentaje, tales como explantes desinfectados, brotados, contaminados por hongos, bacterias y quemados por el desinfectante, brotación y el enraizamiento se aplicó el análisis de comparación de proporciones con el paquete estadístico CompraPro, según Castillo y Miranda (2014).
Resultados y discusión
Experimento I. Desinfección de los segmentos nodales de Salix babylonica con el empleo del hipoclorito de sodio y bicloruro de mercurio
Como se observa en la Figura 2, la doble desinfección con hipoclorito de sodio al 1 % y bicloruro de mercurio al 0,1 % durante 20 y 10 minutos respectivamente, resultó ser el tratamiento de mejores resultados para la desinfección de los segmentos nodales de S. babylonica, obteniéndose 71,4 % de explantes desinfestados a los 14 días, con diferencias estadísticas en relación a los otros dos tratamientos.
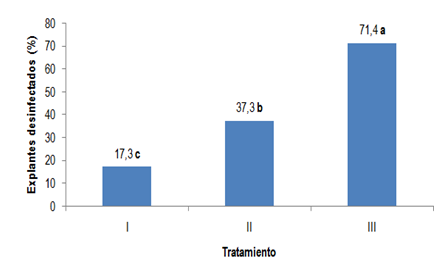
Fig. 2 - Efecto del hipoclorito de sodio y bicloruro de mercurio sobre el porcentaje de explantes desinfestados de Salix babylonica. Tratamientos I-T1, II-T2 y III-T3
Es probable que la concentración y el tiempo de aplicación de los desinfectantes hayan influido favorablemente en la eliminación de los contaminantes microbianos en los segmentos nodales de S. babylonica, lo que permitió ampliar el espectro de actividad antimicrobiana por la doble desinfección.
Variados son los resultados en la desinfección en esta especie en dependencia de los agentes desinfectantes empleados. Chung y Carrasco (1998) comprobaron que una mezcla de fungicidas (Benlate ®-Captan®) e hipoclorito de sodio al 10 % por 20 y 30 minutos permitió mantener niveles de asepsia mayores al 70 % en Salix sp. Por otra parte, López et al., (2016) obtuvieron resultados superiores en la propagación in vitro de esta misma especie, al obtener el 90 % de explantes libres de gérmenes con el empleo del hipoclorito de sodio a una concentración del 2 % durante 15 minutos.
Chornobrov et al., (2019) evaluaron en la desinfección de Salix spp. como agentes desinfectantes, el bicloruro de mercurio, nitrato de plata e hipoclorito de sodio en diferentes concentraciones y tiempos de exposición. Los mejores resultados los obtuvieron con un 85 % de explantes desinfectados en un tratamiento combinado de HgCl2 al 0,1 %, luego nitrato de plata al 1 % e hipoclorito de sodio al 2,5 % durante 5-6 minutos en cada solución por el orden descrito.
La contaminación microbiana causada por hongos y bacterias se comenzó a observar a partir de los siete días de cultivo, la mayor contaminación fue provocada por los hongos como se observa en la Tabla 2. Para este grupo microbiano se observó la mayor contaminación en el tratamiento con hipoclorito de sodio con un 63,5 % y con bicloruro de mercurio con un 49,0 %.
Tabla 2 - Efecto del hipoclorito de sodio y bicloruro de mercurio sobre el porcentaje de explantes contaminados por bacterias, hongos y necrosados en la desinfección de los segmentos nodales de Salix babylonica
| Tratamientos | Desinfectantes | Explantes contaminados por bacterias (%) | Explantes contaminados por hongos (%) | Necrosados (%) |
| T1 | NaClO (1%) | 11,5±0,13 | 63,5±0,08b | 7,7±0,13 |
| T2 | HgCl2 (0,1%) | 9,8±0,10 | 49,0±0,10b | 3,9±0,13 |
| T3 | NaClO+ HgCl2 | 10,2 ±0,09 | 16,3 ±0,13a | 2,0±0,14 |
Letras distintas por columnas difieren significativamente para P < 0,05
Para la contaminación causada por las bacterias no se obtuvieron diferencias significativas entre los tres tratamientos evaluados; el rango de contaminación estuvo entre 9,8 y 11,5 %. Como un elemento importante se debe destacar que no hubo grandes afectaciones en los explantes por necrosis. Los valores obtenidos fueron bajos, menores al 8 %, sin diferencias significativas entre los tratamientos. Estos resultados demuestran la importancia del empleo combinado de agentes desinfectantes que logran eliminar los dos principales contaminantes microbianos del cultivo de tejidos, las bacterias y los hongos, particularmente en las especies leñosas. Para los siguientes experimentos se utilizó el tratamiento combinado para la eliminación de los microorganismos contaminantes como método de desinfección.
Experimento II. Establecimiento in vitro de segmentos nodales de Salix babylonica con el uso de diferentes reguladores del crecimiento
En la Tabla 3, se presentan los resultados del establecimiento in vitro de segmentos nodales de S. babylonica. Los porcentajes de establecimiento estuvieron en un rango entre el 28,3 y el 32,6 % de respuesta. Los tratamientos con reguladores del crecimiento solo con BAP, BAP+AG3 y BAP+ANA tuvieron diferencias significativas para un 5 % con el medio de cultivo con BAP+AIA, según el análisis de comparación de proporciones. Estos resultados demuestran la complejidad de las plantas leñosas para el cultivo in vitro. Sin embargo, se puede considerar un resultado satisfactorio el logro de esos porcentajes de establecimiento in vitro.
Para la variable longitud del brote, no hubo diferencia significativa entre los tratamientos, ya que los valores estuvieron en un rango de 7,54 y 4,42 mm, lo que demuestra un pequeño tamaño de los brotes a los 28 días de cultivo. Estos resultados podrían estar relacionados con el estrés que sufren los explantes cuando son trasladados de condiciones naturales ex vitro hasta las condiciones in vitro.
Tabla 3 - Efecto de diferentes reguladores del crecimiento sobre las variables evaluadas en el establecimiento in vitro a los 28 días de cultivo
| Trata miento | Reguladores del crecimiento | Establecimiento (%) | Longitud del brote (mm) |
| T1 | 6-BAP (2 mg L-1) | 31,9±0,12a | 6,47±3,02 |
| T2 | 6-BAP (2 mg L-1 +AG3 (5 mg L-1) | 31,9±0,12a | 6,07±1,71 |
| T3 | 6-BAP (2 mg L-1)+AIA (1 mg L-1) | 28,3±0,12b | 7,54±4,14 |
| T4 | 6-BAP (2 mg L-1)+ANA (1 mg L-1) | 32,6±0,12a | 4,40±1,80 |
Letras distintas por columnas difieren significativamente para P < 0,05
También se considera que en los resultados no hubo diferencias significativas, porque en todos los medios de cultivo se empleó como citoquinina el 6-BAP a razón de 2 mg L-1 y otro elemento que pudo estar relacionado con la respuesta; el uso del AIA y el ANA a concentración de 1 mg L-1 causa la formación de un callo basal, lo que afecta el desarrollo de la yema axilar que origina el segmento nodal. Se sugiere, entonces, la necesidad de que en futuras investigaciones se utilicen diferentes concentraciones de otras citoquininas como kinetina, TDZ y las nuevas citoquininas del tipo topolinas, que son difíciles de degradar por la acción de las citoquininas oxidasas.
Chung y Carrasco (1998), en estudios de cultivo in vitro de varias especies de Salix, utilizaron la aplicación exógena de tres concentraciones de AG 3 (0,1; 0,5 y 1,0 mg L-1) en presencia o ausencia de 6-BAP; determinaron que los mejores resultados se obtienen con la mayor concentración de AG 3 (1,0 mg L-1) en presencia de 0,1 mg L-1 de 6-BAP, permitiendo un desarrollo rápido y vigoroso en un 76 % de las distintas procedencias de las especies analizadas.
En la especie S. viminalis,Grendysz et al., (2017) efectuaron el establecimiento satisfactorio de los explantes de tres variedades de la especie mencionada en el medio Murashige-Skoog (2006), sin reguladores del crecimiento durante dos semanas hasta la formación de raíces. Luego, los segmentos nodales se transfirieron a medios de cultivo con kinetina en concentraciones de 0,5; 1 y 2 mg L-1. Los autores no presentan resultados cuantitativos, pero sí imágenes que corroboran esos buenos resultados.
Experimento III. Multiplicación de los segmentos nodales de Salix babylonica en tres medios de cultivo
En la Tabla 4, se presentan los resultados de la comparación de los tres medios de cultivos. Los mejores resultados se obtuvieron con el medio de cultivo Palomo-Ríos con 0,1 mg L-1 de AIB para las variables evaluadas con diferencias significativas para el 5 % en relación a los otros dos medios de cultivos utilizados, donde el porcentaje de brotación fue de un 100 % y el número de segmentos nodales de 6,42 a los 28 días de cultivo. Por otro lado, el medio de Chung y Carrasco, al presentar 6-BAP a una concentración 0,1 mg L-1 y AG3 a 1 mg L-1 tuvo una respuesta morfológica favorable de los explantes obteniéndose un 88,09 % de brotación y un promedio de 1,91 segmentos nodales. Los valores alcanzados en el medio de Palomo y Ríos para los segmentos nodales es un indicador favorable para la propagación in vitro de esta especie. Es de esperar que cada segmento nodal emita nuevos segmentos cuando sea subcultivada en los nuevos ciclos de multiplicación in vitro, lo que debe ser evaluado en nuevas investigaciones.
Tabla 4 - Influencia de diferentes medios de cultivo sobre el porcentaje de brotación y el número de segmentos nodales en la multiplicación in vitro de Salix babylonica L a los 28 días de cultivo
| Tratamientos | Medios de cultivos | Brotación (%) | Número de SN |
| T1 | Chung y Carrasco (6-BAP-0,1 mg L-1 y AG3-1 mg L-1) | 88,09 ±0,05b | 1,91±1,57b |
| T2 | Palomo-Ríos (AIB-0,1 mg L-1) | 100± 0,00a | 6,42±2, 32a |
| T3 | MMULT-1 (6-BAP-2 mg L-1 y AIA-1 mg L-1) | 54,71 ±0,10c | 0,00±0,00c |
Letras distintas por columnas difieren significativamente para P < 0,05
El medio de multiplicación de Palomo-Ríos y el de Chung y Carrasco solo presenta un 50 % de las sales Murashige-Skoog, lo que favorece que los segmentos nodales tuvieran una mejor respuesta in vitro con esta concentración de sales y con bajas concentraciones de los reguladores de crecimiento empleados, a diferencia del medio MMULT-1 donde se utilizaron las sales Murashige-Skoog al 100 % y las concentraciones de BAP y AIA fueron superiores.
Palomo et al., (2015) describieron un método de micropropagación que podría generar plántulas en el orden de 5000 clones viables y trasplantables de una sola planta en solo 24 semanas y se utilizó para producir material de mejoramiento fitosanitario probado para la exportación, para superar la restricción en el transporte internacional de esquejes leñosos. Este método podría representar un valioso complemento biotecnológico para los programas de reproducción de sauces y podría acomodar la selección temprana mediante marcadores moleculares o bioquímicos.
En la Figura 3, se observa el desarrollo de los explantes en cada uno de los tratamientos utilizados, lo que muestra que no todos tuvieron la misma respuesta in vitro, observándose que la plántula en el medio Palomo-Ríos (T2) el brote tiene un mayor crecimiento con emisión de raíces y hojas con una mayor lámina foliar. En el medio Chung y Carrasco (T1) el brote, las raíces y las hojas muestran un menor desarrollo.

Fig. 3. - Plantas in vitro de Salix babylonica en los diferentes medios de cultivos empleados en multiplicación, 1-T1, 2-T2 y 3-T3
Según los resultados obtenidos en esta misma especie por López et al., (2016) plantearon que las bajas concentraciones de los reguladores del crecimiento utilizados como 6-BAP (0,045 mg L-1), ANA (0,020 mg L-1) y AG3 (0,050 mg L-1) fueron eficientes, ya que promovieron mayor número de brotes y longitud por explante con 5,6 y 12,4 mm, respectivamente.
Otros autores, como Chung y Carrasco (1998), utilizaron en la micropropagación de meristemas foliares de diferentes especies de Salix spp. en la fase de multiplicación y enraizamiento diferentes dosis de AG3 (0,1; 0,5 y 1,0 mg L-1) en presencia o ausencia de BAP (0,1 mg L-1) y BAP solo. Determinaron que los tratamientos que arrojaron mejores resultados fueron: la utilización de 1,0 mg L-1 de AG3 y 0,1 mg L-1de BAP y la combinación de ambas concentraciones hormonales.
En investigaciones realizadas por Regueira et al., (2018) en la especie S. viminalis, determinaron que el tipo de explante influyó en la calidad del brote y el coeficiente de multiplicación, con segmentos basales que muestran una mayor capacidad de proliferación que los segmentos apicales y de brote medio. Los brotes de sauce cultivados en recipientes plantform™ y RITA® produjeron coeficientes de multiplicación más altos que los brotes cultivados en medio semisólido.
En resumen, con el medio de Palomo-Ríos se logró un 100 % de brotación y un promedio de segmentos nodales con diferencia significativa en relación con los otros dos medios de cultivo empleados.
Experimento IV. Inducción del enraizamiento in vitro de segmentos nodales de Salix babylonica con la utilización de ácido indol butírico (AIB)
La evaluación del enraizamiento de los brotes obtenidos de la multiplicación arrojó como resultado que en la variable analizada porcentaje de enraizamiento, existió diferencia significativa entre todos los tratamientos evaluados, al ser el tratamiento 1 sin reguladores del crecimiento donde se obtuvo el porcentaje más elevado, con un 91,66. Estos resultados pueden estar relacionados con la presencia de auxinas endógenas que favorecen el enraizamiento, ya que se observó que cuando se colocaron esquejes semileñosos en agua destilada para obtener los brotes para el cultivo in vitro, los esquejes fueron capaces de formar raíces.
En la evaluación del número de hojas y de raíces, los mejores resultados se obtuvieron en los T1 y T2 con un promedio de 4,27 y 5,04 para la primera variable y para la segunda los valores fueron de 1,88 y 2,67, con diferencias significativas para el 5 % con el T3 para ambas variables, según puede observarse en la Tabla 5.
Tabla 5 - Efecto de diferentes concentraciones de AIB sobre porcentaje de enraizamiento, el número de hojas y de raíces en la fase enraizamiento a los 28 días de cultivo
| Trata miento | AIB (mg L-1) | Porcentaje de enraizamiento | Número de hojas | Número de raíces |
| T1 | 0,00 | 91,66±0,04a | 4,27±1,00a | 1,82±1,71a |
| T2 T3 | 0,05 0,25 | 78,26±0,06b 9,52±0,14c | 5,04 ±1,77a 1,95±1,60b | 2,67±1,90a 0,43±1,16b |
Letras distintas por columnas difieren significativamente para P < 0,05
Estos resultados evidencian que el aumento de la concentración del AIB redujo el comportamiento favorable en la inducción de raíces, lo que provocó una tendencia a la inhibición en el proceso de enraizamiento, como se observa en la Figura 4.

Fig. 4. - Plantas in vitro de Salix babylonica enraizadas en el medio de cultivo MS a los 28 días de cultivo
Otros autores, como López et al., (2016), obtuvieron los mejores resultados en esta fase en esta misma especie, al utilizar 1 mg L-1 de AIA, ya que promovió el mayor número y longitud de raíces con 2,19 y 2,41 respectivamente.
Por otro lado, Naujoks (2007) indujo la formación de las raíces en S. caprea con un tratamiento con AIB a 50 mg L-1 durante tres semanas y luego la transferencia a un medio de cultivo sin auxinas para el desarrollo de la raíz.
Gómez et al., (2014) obtuvieron excelentes resultados cuando emplearon el AIB a razón de 0,5 mg L-1 en el enraizamiento in vitro de la planta Populus tremula, una especie de la misma familia que S. babylonica.
Los resultados indican que no es necesario el empleo de auxinas tipo AIB para la inducción de raíces obtenidas in vitro de la especie estudiada.
Conclusiones
Los resultados alcanzados en la investigación permiten disponer de un protocolo para la propagación in vitro de Salix babylonica que abarca las etapas de desinfección de los explantes, establecimiento, multiplicación y enraizamiento in vitro. La desinfección de segmentos nodales se obtuvo con una doble desinfección, primero con hipoclorito de sodio al 1 % y luego bicloruro de mercurio al 0,1 % durante 20 y 10 minutos, respectivamente, con un 71 % de segmentos nodales desinfectados. El establecimiento in vitro se logró en el medio de cultivo solo con usar BAP 2 mg L-1 al obtenerse un 31,9 % de establecimiento. La multiplicación de los segmentos nodales fue superior en el medio de cultivo Palomo-Ríos con un 100 % de brotación y un número de segmentos nodales de 6,42. El enraizamiento se obtuvo en el medio de cultivo basal sin AIB con un 91,6 % de respuesta.
Agradecimientos
Los autores expresan su agradecimiento al Proyecto "In vitro Plant biotechnology to increase food security in eastern Cuba", financiado por el VLIR de Bélgica para la realización de esta investigación y a la técnica de laboratorio Leidis Arceo Elías por su apoyo y dedicación en el procesamiento de las muestras.











 texto en
texto en