Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.31 no.3 La Habana jul.-set. 2010
RELACIÓN DE LA SACAROSA FOSFATO SINTASA E INVERTASAS CON EL MOMENTO DE MADURACIÓN EN DOS CULTIVARES DE CAÑA DE AZÚCAR.
RELATIONSHIP sucrose phosphate synthase E INVERTASE MATURATION TIME WITH TWO CULTIVARS OF SUGAR CANE.
Ms.C. Isabel MedinaI, Dra.C. Rosa RodésII, Ms.C. E. de la FuenteIII, Ms.C. T. MatekaireIV
II Profesora Titular
III Profesor Auxiliar del departamento de Biología Vegetal, facultad de Biología, Universidad de La Habana, Cuba
IV Profesor en la Universidad de Harare, Zimbawe.
RESUMEN
Es imprescindible la comprensión de los factores determinantes en la acumulación de sacarosa en la caña de azúcar (Saccharum spp. híbridos), para la obtención de cultivares con mayores capacidades azucareras en el tiempo adecuado para la cosecha; sin embargo, estos no han sido aún totalmente descifrados. En este trabajo se utilizaron dos cultivares cubanos de caña de azúcar, caracterizados por su madurez temprana (C 1051-73) y tardía (My 5514). Se estudiaron la capacidad de acumulación de biomasa y sacarosa, la fotosíntesis neta, la respiración oscura y la actividad específica de las enzimas del metabolismo de la sacarosa, Invertasa Ácida Soluble (IAS) y Sacarosa Fosfato Sintasa (SFS), en dos etapas próximas a la maduración. Se apreciaron diferencias significativas entre cultivares en la fotosíntesis neta a las densidades de flujo fotónico de 1 400 y 2 427 μmoles de fotones.m-2.s-1, y en la concentración de sacarosa. Se encontró una relación lineal altamente significativa entre la diferencia de SFS y IAS, y los niveles de sacarosa en los dos cultivares analizadas (R2= 0.82, p≤0.001). Los mayores valores de concentración de sacarosa y SFS-IAS se alcanzaron antes en el cultivar de maduración temprana, por lo que se sugiere que la diferencia de la actividad de estas enzimas pudiera ser un marcador bioquímico de la maduración.
Palabras clave: caña de azúcar (Saccharum spp. híbridos), sacarosa, maduración, invertasa ácida soluble, sacarosa fosfato sintasa.
ABSTRACT
The determinant factors for the sucrose accumulation in sugarcane (Saccharum spp. hybrids), have not been totally decoded yet; however, they are essentials for improving the sugar capacities of varieties at the appropriate time for harvest. Two Cuban sugarcane cultivars, C 1051-73, as early, and My 5514, as late ripening genotypes, were used in this work. The biomass and sucrose accumulation capacity, net photosynthesis, dark respiration and the specific activity of sucrose metabolism enzymes, Soluble Acid Invertase (SAI) and Sucrose Phosphate Synthase (SPS), were studied in two stages close to ripening time. The varieties were significantly different in the net photosynthesis at 1 400 and 2 427 μmol photons.m-2.s-1 of photonic flux densities and sucrose concentration. A highly significant lineal relation was found between sucrose levels and the difference of SPS and SAI in the varieties analyzed (r2= 0.82, p≤0.001). The highest values of both, sucrose concentration and SPS-SAI, occurred before in the early-ripening variety, so the difference between these enzymatic activities could be used as a biochemical marker of ripening.
Keywords: sugarcane (Saccharum spp. hybrids), sucrose, ripening, soluble acid invertase, sucrose phosphate synthase.
INTRODUCCIÓN
La caña de azúcar (Saccharum spp. híbridos) es un cultivo de gran importancia para la humanidad, posee la característica particular de almacenar los fotoasimilados en forma de sacarosa en vez de almidón como la mayoría de las plantas, por lo que la sacarosa es el azúcar que se encuentra en mayor concentración en sus tallos; es responsable de alrededor del 70 % de la producción industrial de azúcar mundial (1).
Las triosas-P sintetizadas mediante el ciclo de Calvin pueden ser utilizadas competitivamente para la síntesis transitoria de almidón en el cloroplasto o de sacarosa en el citoplasma de las células de los tejidos fotosintetizadores de las hojas. La distribución de estas hacia uno u otro organelo depende de varios factores, principalmente de la demanda y capacidad de traslocación de la sacarosa hacia otras zonas de la planta (2). La demanda de las zonas no productoras, también llamada fortaleza del sumidero, se ha vinculado con las enzimas del metabolismo de la sacarosa en estos sitios, tales como las invertasas: Neutra (IN), Ácida Soluble (IAS) y Ácida Insoluble (IAI), la Sacarosa Sintasa (SS) y la Sacarosa Fosfato Sintasa (SFS). En especial, las invertasas ácidas (IAS y IAI) han sido estrechamente relacionadas con la fortaleza del sumidero en las plantas, por su posible papel de aumentar el gradiente de sacarosa entre el apoplasto y el floema al hidrolizarla a glucosa y fructosa (3). Una vez que las hexosas han ingresado al citoplasma de las células de los órganos sumideros, estas pueden ser utilizadas en el metabolismo celular o la sacarosa puede ser nuevamente sintetizada por la enzima SFS y acumulada en las vacuolas de las células de los tejidos almacenadores (4).
Desde los primeros estudios realizados en caña de azúcar, se detectó que la actividad de la invertasa ácida poseía una alta correlación negativa con el contenido de sacarosa en los tallos. Más recientemente, al analizar el balance síntesis-hidrólisis de sacarosa en los tallos de la caña de azúcar, se encontró la mejor correlación del contenido de sacarosa con la sustracción aritmética de las actividades de SFS y IAS en genotipos con diferente capacidad azucarera (4).
La caña de azúcar moderna es el fruto de la hibridación compleja de varias especies del género Saccharum (1). En dependencia del tiempo en que alcanzan su máximo de acumulación de sacarosa, se hace referencia a los cultivares de maduración temprana, media o tardía (5, 6). Lograr una clasificación adecuada de los cultivares es imprescindible, para que la industria alcance un alto recobrado en la producción de azúcar; sin embargo, aún no se han definido marcadores que permitan identificar a los cultivares teniendo en cuenta esta característica.
El objetivo del presente trabajo es comparar la actividad fotosintética, capacidad de formación de biomasa, actividad de las enzimas involucradas en la síntesis e hidrólisis de la sacarosa y acumulación de sacarosa en los tallos, en dos cultivares de caña de azúcar con diferente patrón de maduración, con vistas a la obtención de posibles indicadores bioquímicos del proceso de maduración.
MATERIALES Y MÉTODOS
Material vegetal y condiciones de cultivo. Los cultivares cubanos de caña de azúcar (Saccharum spp. híbridos) C 1051-73 (maduración temprana) y My 5514 (maduración tardía) se cultivaron en dos experimentos de casa de cristal (5) realizados en años diferentes (Experimento I yExperimento II). Las yemas fueron pre-germinadas a 27oC en la oscuridad y 20 plántulas de cada cultivar con similar desarrollo se trasplantaron al mismo número de macetas de 13 L. El suelo ferralítico se mantuvo a una humedad equivalente al 70 % de la capacidad de campo durante todo el desarrollo de las plantas y se aplicó fertilizante nitrogenado, fosfórico y potásico en el momento de la plantación, correspondiente a 200 kg de N.ha-1, 100 kg de P2O5.ha-1 y 100 kg de K2O.ha-1. En ambos experimentos se utilizó un diseño experimental completamente aleatorizado.
Muestreos y evaluaciones Determinación de la biomasa. Se emplearon cinco tallos por separado, de 10 meses de edad, para determinar la biomasa de las láminas, vainas y tallos, y se calculó la suma de estas para obtener la biomasa total; los resultados se expresaron como g de masa seca.planta-1. Para ello, cada una de las partes se seccionó en pequeñas porciones y se secó en estufa a 80oC hasta peso constante.
Determinación de los azúcares
Experimento I. A los ocho meses de edad de las plantas se tomaron 14 tallos, cada uno de ellos se separó en tres partes de cinco entrenudos cada una, según la posición en el tallo: ápice, entrenudos más jóvenes, medio (constituido por los entrenudos de la parte media del tallo) y base (aquellos entrenudos de la parte inferior del tallo). Al jugo extraído de estos segmentos se le determinó el porcentaje de pol y azúcares reductores (7).
Experimento II. Se evaluó la concentración de sacarosa y glucosa a los entrenudos +3, +7 y +12 por separado, mediante la apropiada combinación del método enzimático de la glucosa oxidasa (RapiGlucotest, IMEFA, Cuba) y la enzima invertasa reactivo (Sigma) (8). Estos se enumeraron igual que la hoja que se inserta en su nudo superior, considerada la primera hoja enrollada como 0 y numerándose estas hacia abajo. Se tomaron tres muestras, cada una compuesta por un tallo, a las edades de ocho y 10 meses.
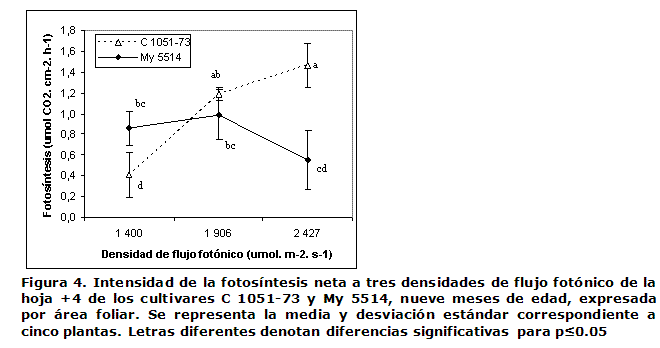
Actividad fotosintética y respiratoria. Se realizó en lasláminas de la hoja +4 de cinco plantas a los nueve meses de edad, mediante un sistema abierto de intercambio de gases (Qubit Systems IRGA) a tres densidades de flujo fotónico (1 400, 1 906 y 2 427 μmoles de fotones.m-2.s-1).
Actividad específica de las enzimas invertasa ácida soluble y sacarosa fosfato sintasa
Preparación del extracto enzimático. Se emplearon tres tallos individuales de ocho y 10 meses de edad, los cuales se fraccionaron según se explica en el epígrafe de las determinaciones de los azúcares; los segmentos se congelaron rápidamente por inmersión en N2 líquido y se almacenaron a -20oC hasta su análisis. La extracción enzimática se llevó a cabo a partir de 0.3 g de los entrenudos de la parte apical y media del tallo y de 0.6 g de los entrenudos basales, pesados después de haber sido eliminada la corteza. El tejido se maceró con N2 líquido en un mortero y se le añadieron 2 mL de tampón de extracción HEPES-KOH 50 µM de pH 7.5. La solución tampón contenía 12 mM MgCl2, 1 mM EDTA-Na2, 1 mM EGTA, 10 mM Na-dietilditiocarbamato, 2 mM benzamidina, 2 mM N-amino capronato, 10 mM DTT, 0.5 g. L-1 tritón X-100 y 200 mL.L-1 glicerol (4). El extracto se centrifugó a 15 000 g por 10 min a 4oC y el sobrenadante se desalinizó en una columna de 3 mL de Sephadex G-25. Se tomaron 300 µL del eluato cromatográfico para la cuantificación de la proteína (9) y el resto se mantuvo a 0oC hasta realizar el ensayo enzimático el mismo día de la extracción.
Medición de la actividad enzimática. Se determinó la actividad específica de las enzimas IAS y SFS (4), con la única diferencia de que la detección de la glucosa formada por la invertasa se realizó mediante el reactivo RapiGlucotest. Este método espectrofotométrico se adaptó a las muestras vegetales: después de ser detenida la reacción enzimática de las invertasas se tomaron 40 µL, a los que se les añadieron 500 µL del reactivo y se incubaron a 37oC durante 10 min, la lectura del complejo coloreado formado se realizó a 505 nm. La unidad de actividad específica se definió como un µmol de glucosa formada. g proteína-1.min-1 para la IAS o de sacarosa en el caso de la SFS.
Análisis estadístico de los resultados. Todas las determinaciones analíticas se realizaron por triplicado ylos resultados se analizaron mediante ANOVA simple, ANOVA bifactorial y Student Newman-Keuls (SNK), para la comparación múltiple de medias, luego de realizada la comprobación de la normalidad y homogeneidad de varianza de los datos, con el programa Statistica versión 6.0.
RESULTADOS
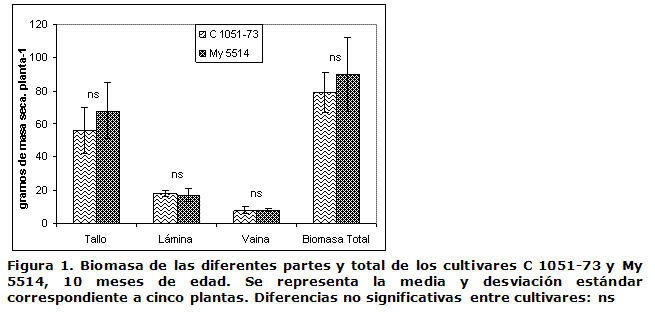
Formación de biomasa en los cultivares C 1051-73 y My 5514. En la Figura 1 se representa la biomasa de las diferentes partes y la biomasa total de las plantas a los 10 meses de edad. No se detectaron diferencias significativas entre los dos cultivares en ninguna de las partes analizadas.
Concentración de azúcares en diferentes zonas del tallo de dos cultivares de caña de azúcar. La comparación del contenido de sacarosa (expresada como porcentaje de pol en jugo) entre los entrenudos apicales, medios y basales de tallos de plantas de ocho meses de edad, reflejó que, en ambos cultivares, este fue significativamente superior en los entrenudos medios y basales respecto a los del ápice (Figura 2). Las zonas media y basal del cultivar C 1051-73 alcanzaron mayor valor respecto a las de My 5514, mientras que los ápices no se diferenciaron.
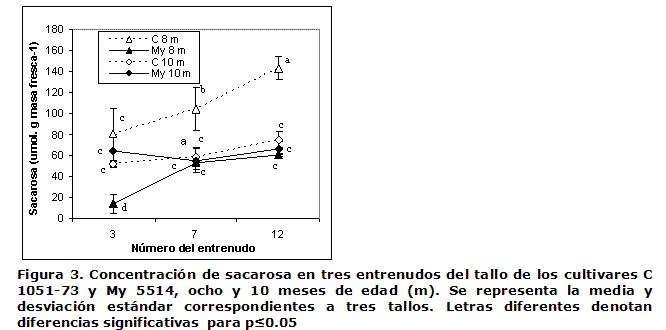
En los dos cultivares también se determinó el contenido de sacarosa y glucosa en entrenudos con diferente estado fisiológico a dos edades próximas a la maduración (ocho y 10 meses). Ha sido demostrado que el entrenudo +3 es inmaduro, el +7 se encuentra en proceso de acumulación de sacarosa y el +12 se puede considerar maduro (4, 6).

Actividad fotosintética y respiratoria. Se midió la absorción y el desprendimiento de CO2 en la hoja fuente +4 a la edad de nueve meses. Los dos cultivares evaluados mostraron valores semejantes en su actividad respiratoria de alrededor de 0.53 µmol CO2.cm-2.h-1 (datos no mostrados). La fotosíntesis neta medida para distintas densidades de flujo fotónico mostró diferencias dependientes de la luz y los cultivares (Figura 4). Los valores de la actividad fotosintética ante las tres densidades de flujo fotónico crecientes (1 400, 1 906 y 2 427 μmol de fotones.m-2.s-1) fueron diferentes para los cultivares; el C 1051-73 mostró un incremento mientras que en el My 5514 este proceso se mantuvo saturado, con tendencia a disminuir en la densidad más alta. Este comportamiento dio como resultado que en la primera densidad de flujo fotónico, el My 5514 tuviera mayor fotosíntesis que el C 1051-73, en la intermedia no existieran diferencias significativas entre cultivares y en la más intensa el C 1051-73 presentara un valor significativamente superior.
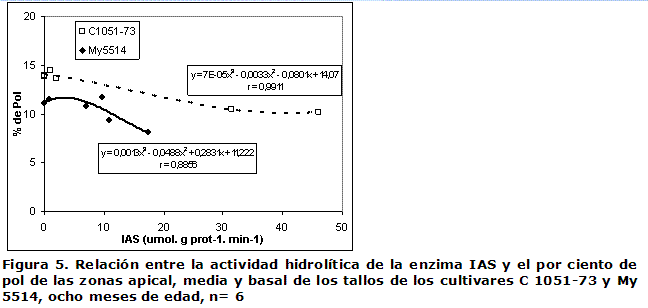
Actividad específica de las enzimas invertasa ácida soluble y sacarosa fosfato sintasa. Relación con los contenidos de azúcares. La Figura 5 muestra la relación entre la actividad IAS y el porcentaje de pol para los dos cultivares a los ocho meses. El C 1051-73 se caracteriza por tener mayores valores de por ciento de pol comparado con el My 5514 y aún para niveles muy elevados de actividad invertasa se mantuvieron valores altos de pol. El coeficiente de correlación de la actividad de la enzima IAS fue alto y negativo para el por ciento de pol, y alto y positivo para los azúcares reductores; sin embargo, no se encontró relación entre estos indicadores y la actividad de la enzima IN (datos no mostrados).
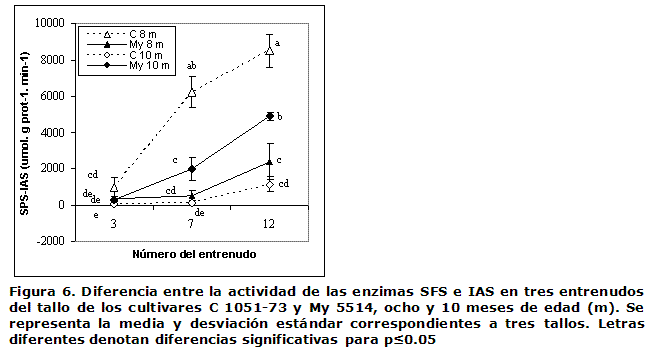
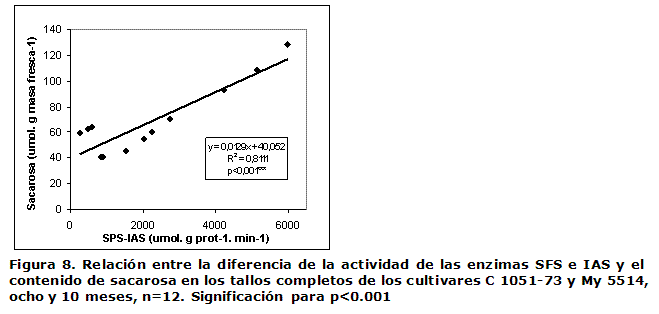
En la Figura 6 se muestra la diferencia entre las actividades de la SFS y la IAS, la cual experimentó un incremento desde los entrenudos del ápice hacia los más basales en ambos cultivares y edades analizadas; para el C 1051-73 esta fue superior a los ocho meses, mientras que el My 5514 presentó la mayoractividad sintética neta de la sacarosa a los 10 meses en el entrenudo +12.
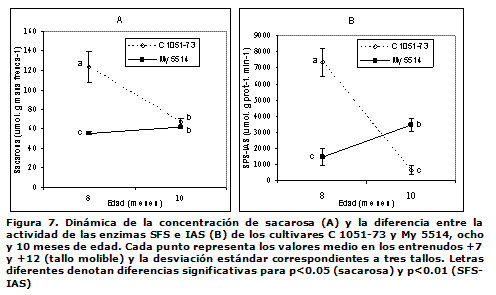
En la Figura 7 se reflejan las dinámicas de los valores medio del contenido de la sacarosa y la actividad enzimática de los entrenudos +7 y +12, por ser estos en los que el proceso de la acumulación de sacarosa está ocurriendo con mayor intensidad (1, 4, 6). Se observa que el contenido de sacarosa del cultivar de maduración temprana disminuye con la edad, mientras que esta se incrementa en el My 5514 y se alcanzaron similares valores de sacarosa para los dos cultivares a los 10 meses (Figura 7A). Así también la actividad enzimática disminuyó significativamente en el tiempo para el C 1051-73 y aumentó en el My 5514 (Figura 7B).
Formación de biomasa y concentración de azúcares. A pesar de las diferencias significativas en el contenido de sacarosa entre los cultivares estudiados, estas no se ven reflejadas en la biomasa de los tallos (Figuras 1 y 2). A la edad de ocho meses, ya ha cesado la etapa de auge del crecimiento de estas plantas y el cultivo se encuentra en la fase de maduración, la cual se caracteriza por una acumulación de materia seca en sus entrenudos (4, 6). Teniendo en cuenta que la sacarosa es el componente mayoritario de los sólidos solubles en los entrenudos del tallo de la caña de azúcar y puede alcanzar hasta un 50 % de su peso seco (10, 11), se puede inferir que la masa seca similar detectada en los cultivares (Figura 1) estuvo constituida por mayor contenido de compuestos insolubles en la My 5514, debido a que la sacarosa fue significativamente menor en este cultivar (Figura 2). Estos resultados pudieran indicar una desigual distribución de los asimilados que forman la biomasa entre los dos cultivares analizados desde la temprana edad de ocho meses. Es conocido que la acumulación de sacarosa se comporta de manera inversa con el contenido de fibra, así como que ocurre una redirección del carbono desde la fibra hacia la sacarosa, según va madurando el tejido y la planta, la cual puede disminuir del 50 % de la fracción insoluble a menos del 15 % entre el entrenudo 6 y el 12 (12).
Actividad fotosintética y respiratoria. En este experimento no se presentaron diferencias significativas entre cultivares en la intensidad de respiración de la hoja madura (+4) de las plantas (datos no mostrados), similar a lo encontrado anteriormente en seis cultivares cubanos con diferente acumulación de biomasa y sacarosa, en los cuales se comparó la respiración de las hojas maduras +4 y +6. Así tampoco se encontraron diferencias entre los cultivares en el consumo de glucosa diario en base al peso seco en el entrenudo +12, ni en la planta completa (13). La respiración de los entrenudos de la caña de azúcar es baja respecto a las hojas (12, 13) y sufre una disminución con la maduración de estos (12). Parece ser que la respiración está más relacionada con los órganos y su desarrollo fisiológico que con los cultivares.
El proceso de la fotosíntesis está compuesto por las etapas fotoquímica y bioquímica, las cuales en su conjunto son responsables de la producción de las triosas-P y la posterior síntesis de sacarosa, para su transporte a través de la planta hacia los sumideros. En este experimento se evaluó la intensidad de la fotosíntesis en la hoja fuente +4 y su respuesta al incremento de la iluminación incidente, lo que proporciona información acerca de las capacidades totales del proceso fotosintético y las potencialidades de la fase fotoquímica en los cultivares. En las condiciones experimentales utilizadas, se apreciaron diferencias estadísticas entre los cultivares en las densidades de flujo fotónico menor y mayor; sin embargo, en la intermedia la fotosíntesis fue similar (Figura 4). El efecto de los niveles de luz sobre el comportamiento de la fotosíntesis fue interesante, el C 1051-73 logró su mayor capacidad fotosintética en las dos densidades de flujo fotónico mayores, mientras que el otro cultivar se mostró saturado, aunque con tendencia a la foto-inhibición en la más alta densidad, lo que sugiere que el aparato fotosintético de la C 1051-73 podría ser más estable ante el incremento de la intensidad luminosa, ya sea porque ocurre en menor magnitud la foto-destrucción de los componentes del Foto-sistema II, o que tiene una mayor capacidad de regeneración respecto a la My 5514 (14).
La radiación en Cuba presenta poca variación durante el año, con valores diarios medio de 1 200 μmol fotones.m-2.s-1 (valor transformado, 15); teniendo en cuenta que ese valor pudiera sobrepasarse hasta más del doble en las horas de mayor insolación (15), el mantener una alta capacidad fotosintética en ambientes de alta intensidad luminosa, como el de nuestro país, sería una premisa importante para una alta productividad de los cultivares de caña de azúcar. En los cultivares cubanos se ha relacionado una menor producción de biomasa con la característica de la foto-inhibición de la fotosíntesis a nivel del transporte de electrones (13). El C 1051-73 presentó mayor valor de fotosíntesis que el My 5514 en la mayor densidad de flujo fotónico y a diferencia de este no mostró foto-inhibición en ese valor, que casi duplica la iluminación diaria media de Cuba , por lo que su aparato fotosintético debe ser estable o capaz de recuperarse de los daños; esta característica pudiera contribuir a la superior síntesis y acumulación de sacarosa de este cultivar.
A pesar de que la biomasa de las plantas y, por tanto, su productividad dependen de los procesos de la fotosíntesis y respiración, se han reportado resultados contradictorios acerca de la relación de estos procesos con los compuestos carbonados finalmente almacenados en las plantas. Esto es debido principalmente a la naturaleza compleja de los dos procesos y sus numerosos puntos de regulación, y a que la producción de la biomasa depende del balance que resulta en la asimilación neta de carbono, de la fuerza del sumidero y distribución de los fotosintatos entre los órganos fuente y sumideros, así como de la velocidad de transporte de la sacarosa entre estos a través del floema (2, 11).
Actividad de las enzimas Invertasas, Sacarosa Fosfato Sintasa y concentración de azúcares. El análisis del contenido de la sacarosa, que fue alcanzado por estos cultivares en relación con la actividad enzimática de las invertasas, corroboró la estrecha relación que ha sido encontrada (Figura 5) entre el contenido de sacarosa y la IAS (4, 6, 16), y la falta de relación para la IN y los contenidos de sacarosa (datos no mostrados) en la caña de azúcar (1, 4).
En la curvas de regresión mostradas en la Figura 5, se observa que los mayores valores del contenido de sacarosa, pero contradictoriamente también de la actividad IAS, correspondieron al cultivar de maduración temprana (C 1051-73). Se ha reportado para la enzima IAS un umbral de actividad, por debajo del cual la capacidad de acumulación de sacarosa en los cultivares estudiados dependió de la magnitud de la síntesis que ocurrió por la enzima SFS. Solo cuando la actividad estuvo por encima de ese umbral, esta enzima se convirtió en limitante para la acumulación de sacarosa en los tallos (4). Una mayor actividad de IAS asociada a un mayor contenido de sacarosa en el C 1051-73 pudiera indicar que este cultivar tiene una mayor actividad de la enzima SFS en las células reservantes del tallo, para resintetizar la sacarosa en relación al My 5514, y así acumular una cantidad significativamente mayor de sacarosa, a pesar de los altos niveles de la actividad hidrolítica que fueron detectados. Esta es la causa por la cual en el segundo experimento fuera incluida la determinación de la actividad de esa enzima.
En este caso, el análisis de las actividades enzimáticas por separado reflejó que tanto la IAS como la SFS fueron mayores en el C 1051-73 respecto al My 55-14 (datos no mostrados). La actividad IAS presentó mayores valores en los entrenudos más jóvenes, debido a su función de contribuir a la utilización de las hexosas en el crecimiento de los tejidos y al establecimiento de la fuerza del sumidero (3), mientras que la de la enzima SFS incrementó hacia el entrenudo +12, en correspondencia con su papel en la resíntesis de la sacarosa para su acumulación en el tejido reservante (4).
La Figura 6 muestra cómo la diferencia entre la SFS y la IAS resultó positiva en los dos cultivares aún en el entrenudo más inmaduro, pero esta solo comenzó a diferenciarse entre los cultivares y entrenudos a partir del +7 y con la mayor diferencia en el +12. El balance síntesis-hidrólisis estuvo en dependencia de la edad y fue mayor y significativo en el C 1051-73 a los ocho meses. Estos resultados se corresponden con el mayor nivel de sacarosa acumulado a esa edad por el mencionado cultivar (Figura 3). El mayor contenido de sacarosa en sus entrenudos, +7 y +12, posiblemente esté relacionado con la ocurrencia de una mayor disminución de la IAS e incremento de la SFS primero en el cultivar de maduración temprana respecto al tardío.
En las condiciones de casa de cristal de este experimento, el cultivar de maduración temprana (C1051-73) posiblemente debió madurar entre los ocho y 10 meses (5), ya que a los ocho meses de edad todavía existían apreciables diferencias en el contenido de sacarosa entre sus entrenudos y se conoce que en la maduración esta tiende a homogenizarse a lo largo del tallo (4). A los 10 meses, por el contrario, se observó la disminución de la sacarosa (Figura 3) e incremento de la glucosa (datos no mostrados), lo que apunta a que el cultivar se encontraba en etapa de pos-maduración, mientras que el My 5514 (madurez tardía) estuvo maduro a partir de los 10 meses (5), debido a que a esa edad la concentración de sacarosa se había igualado en los tres entrenudos (Figura 3).
Cuando cultivares con diferentes características, en relación con el tiempo en que alcanzan su máximo contenido de sacarosa, se plantan al mismo tiempo y están sujetos a las mismas condiciones ambientales, su maduración dependerá de sus características genéticas. Se ha encontrado que la velocidad de acumulación de sacarosa, en cultivares de diferente patrón de maduración, está muy relacionada con la detención en la elongación de los entrenudos y la disminución del contenido hídrico de estos (6, 16).
En este trabajo, la relación lineal encontrada entre la diferencia de la actividad de las enzimas (SFS-IAS) y el contenido de sacarosa en los tallos fue positiva, altamente significativa y con buen ajuste (p≤0.001, R2= 0,82). Tanto la sacarosa como la SFS-IAS estuvieron significativamente relacionadas con la edad y el cultivar, así como con la interacción de los factores, lo que indica que estos factores poseen una influencia en la maduración y no son independientes (Figura 7).
En numerosos genotipos de caña de azúcar con diferente capacidad de acumulación de sacarosa, se detectó una relación hiperbólica positiva entre el contenido de sacarosa y la diferencia de las actividades SFS-IAS (4), así como coeficientes de correlación significativos (16), por lo que se ha sugerido que estas enzimas sean determinantes en la acumulación de sacarosa en este cultivo (4, 16). También ha sido propuesta la actividad SFS por sí sola en los entrenudos en elongación, como indicador para discernir entre cultivares de alto y bajo potencial azucarero, quizás porque en todos los clones investigados la IAS mostró insólitamente muy bajos valores de actividad en los entrenudos jóvenes (1). El único trabajo que ha analizado el momento de maduración detectó una correlación significativa entre la diferencia SFS-IAS y el contenido de sacarosa final, aunque no con la velocidad de acumulación de esta, por lo que no se atribuyeron las diferencias en el tiempo de maduración entre los cultivares al balance de las enzimas (6).
En este trabajo se ha comprobado que la partición de los fotoasimilados ocurrió en mayor medida hacia la sacarosa en el C 1051-73 que en el My 5514, posiblemente esa fue la causa por la que alcanzó concentraciones mayores de sacarosa y más temprano que la My 5514, aún en condiciones de casa de cristal, y este comportamiento se mostró estrechamente relacionado con la diferencia entre SFS e IAS. Este cultivar también exhibió mayor estabilidad fotosintética a altas iluminaciones.
- Grof, C. P. L. [et al.]. Sucrose phosphate synthase, a biochemical marker of high sucrose accumulation in sugarcane. Crop Sci., 2007, vol. 47, p. 1530-1539.
- Taiz, L y Zeiger, E. Eds. Plant Physiology. 4th ed. Sunderland, Massachusetts: Sinauer Associates Inc. Publishers, 2006, 690 p.
- Minic, Z. Physiological roles of plant glycoside hydrolases. Planta, 2008, 227, p. 723–740.
- Zhu, Y. J., Komor, E. y Moore, P. H. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase. Plant Physiol., 1997, vol. 115, p. 609-616.
- Bernal, N. [et al.]. Variedades de caña de azúcar: Uso y manejo. Ciudad de La Habana, Cuba: Publicaciones IMAGO. 1997, 99 p.
- Lingle, S. E. Sugar metabolism during growth and development in sugarcane internodes. Crop Sci., 1999, vol. 39, p. 480–486.
- Martín, A. El laboratorio azucarero. La Habana: Ministerio de Industrias. 1963, 295 p.
- Hall, D. O. [et al.]. Eds. Photosynthesis and production in a changing environment: A field and laboratory manual. London: Chapman y Hall. 1993, 234 p.
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., 1976, vol. 72, p. 248-254.
- Singels, A. /et al./. Improving biomass production and partitioning in sugarcane: theory and practice. Field Crops Research, 2005, vol. 92, p. 291-303.
- Rae, A. L. /et al./. Sucrose partitioning between vascular bundles and storage parenchyma in the sugarcane stem: a potential role for the ShSUT1 sucrose transporter. Planta, 2005, vol. 220, p. 817-825.
- Bindon, K. y Botha, F. Carbon allocation to the insoluble fraction, respiration and triose-phosphate cycling in the sugarcane culm. Physiol. Plant., 2002, vol. 116, p. 12-19.
- Ortega, E. /et al./. Bases de la productividad de la caña de azúcar. La Habana, Cuba: Editorial Academia. Universidad de La Habana. 1989, 43 p.
- Vass, I., Cser, K. y Cheregi, O. Molecular mechanisms of light stress of photosynthesis. Ann. N.Y. Acad. Sci., 2007, vol. 1113, p. 114-122.
- Bérriz, L. y Álvarez, M. Las cocinas solares: ventajas y desventajas. [En línea]. Cuba. [Fecha de consulta: 30 de noviembre del 2009]. Disponible en: http://www.cubasolar.cu/biblioteca/Energia/Energia08/HTML/articulo06.htm.
- Lingle, S. E. y Tew, T. L. A comparison of growth and sucrose metabolism in sugarcane germplasm from Louisiana and Hawaii. Crop Sci., 2008, vol. 48, p. 1155-1163.
Recibido: 9 de febrero de 2010
Aceptado: 13 de mayo de 2010