Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.35 no.2 La Habana abr.--jun. 2014
Efectividad agrobiológica del producto bioactivo Pectimorf® en el cultivo del Rábano (Raphanus sativus L.)
Agrobiologycal effectiveness of Pectimorf® bioactive product on radish (Raphanus sativus L.) crop
Dra.C. Elein Terry Alfonso,I M.Sc. Josefa Ruiz Padrón,II M.Sc. Tamara Tejeda Peraza,II Dra.C. Inés Reynaldo EscobarIII
IInvestigadora Auxiliar del departamento de Fitotecnia, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
IIEspecialistas del departamento de Fitotecnia, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
IIIInvestigadora Titular del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba.
RESUMEN
El presente trabajo se desarrolló en el área experimental del Instituto Nacional de Ciencias Agrícolas (INCA), con el objetivo de evaluar la respuesta del cultivo del rábano a la aplicación del producto bioactivo Pectimorf®. Para dar cumplimiento al objetivo propuesto, se estudió el efecto del producto bioactivo en la germinación de las semillas así como en el crecimiento, desarrollo y rendimiento de las plantas; se estudiaron diferentes diluciones de 1-100 para la evaluación de respuesta a la germinación de las semillas, así como dosis de 0,1-1-10 mL.L-1 y tiempos de imbibición de 30 minutos, una y ocho horas para el experimento en campo. Se realizaron diferentes evaluaciones referidas a algunas variables de germinación, como el porcentaje e índice de velocidad de germinación así como largo del hipocotilo y la radícula. En el experimento en campo se evaluó la altura de las plantas, el diámetro de los frutos, la masa fresca de los frutos y el rendimiento por superficie. Los resultados mostraron la efectividad del producto bioactivo Pectimorf® en la fase de germinación de las semillas, siendo estimulado este proceso con la dosis de 10 mL.L-1 y de 30 minutos de imbibición. En el caso del estímulo del crecimiento, desarrollo y rendimiento del cultivo, se obtuvo el mejor resultado con la dosis de 5 mg.L-1 y una hora de tiempo de imbibición, superándose el rendimiento en un 41 % en relación con el testigo de producción.
Palabras clave: raíz tuberosa, bioestimulante, oligogalacturónidos, rendimiento agrícola.
ABSTRACT
The present work was developed in the experimental area of the National Institute of Agricultural Sciences (INCA), with the objective to evaluate the answer of radish crop with the application of Pectimorf® bioactive product. The objective was to study of effect of bioproduct on seeds germination as well as on growth, development and yield of plants; different dilutions were studied of 1-100 for the evaluation of seeds germination answer as well as doses of 0,1-1 10 mL.L-1 and imbibition times of 30 minutes, one and eight hours for the experiment in field. Were carried out different evaluation in relation with some germination variables as percentage, index of germination speed as well as large of hypocotyl and the radicle. In the field experiment were evaluating plant height, diameter of shoot, fresh mass of fruits and yield for surface. The results showed the effectiveness of Pectimorf® bioactive product in the seeds germination phase, being stimulated this process with the dose of 10 mL.L-1 and 30 minutes of imbibition. In the case of crop stimulus on growth, development and yield, the best result was obtained with the dose of 5 mg.L-1 and one hour of imbibition time, being overcome the yield in 41 % with regard to the production test.
Key words: tuberous root, biostimulator, oligogalacturonide, agricultural yield.
INTRODUCCIÓN
La agricultura ecológica surgió como una alternativa para proteger el medio ambiente y las diferentes especies de plantas y animales en peligro de la agricultura convencional o moderna. La producción en pequeña escala como parcelas y huertos es una opción para los productores, a partir de la cual logran mejorar los hábitos alimenticios y la nutrición de las familias, no contaminan el medio ambiente, se promueven prácticas agroecológicas al reciclar residuos biodegradables y producir alimentos y plantas sanas libres de contaminantes (1).
En Cuba, para la producción urbana se utilizan alrededor de 13 mil hectáreas, la producción de hortalizas en huertos orgánicos cada día se incrementa más ya que es una producción limpia, sana y de calidad. Esta forma de producir hortalizas de manera intensiva sobre sustratos orgánicos, favorece la obtención de altos rendimientos en los cultivos, pero a su vez requiere de una adecuada disciplina tecnológica; por otra parte, además de la fertilización orgánica, la misma debe complementarse con productos bioactivos los cuales estimulan el crecimiento y desarrollo de las plantas; además de ser inocuos y no contaminantes del medio ambiente.
Los productos bioactivos han sido utilizados para modificar el desarrollo de la planta desde su germinación, crecimiento vegetativo, reproducción, senescencia y preservación post cosecha, todo esto con el fin de facilitar su manejo por el hombre además de contar con nuevas fuentes alternativas (2).
Además de la necesidad de aumentar la productividad, la agricultura enfrenta altas exigencias para entregar productos sanos con mínimas cantidades de sustancias residuales durante el desarrollo del cultivo. Esta situación dicta la necesidad de una búsqueda de productos opcionales con poca acción residual y que no afecten los rendimientos.
Cuba cuenta con una amplia gama de productos bioactivos, dentro de ellos puede citarse el Pectimorf®, producto obtenido por el Instituto Nacional de Ciencias Agrícolas (INCA), y que son oligogalacturónidos con grado de polimerización entre nueve y 16 moléculas de ácido galacturónico, que se produce por la degradación parcial de la pared celular de la corteza de los cítricos y tiene una fracción molar que oscila entre 10,4 y 7,2 %. Es un estimulante del enraizamiento, crecimiento y diferenciación celular de diferentes especies vegetales; además, puede activar los mecanismos de defensa y disminuir o atenuar el estrés ambiental de las plantas, según se describe en la patente del producto (3).
El rábano (Raphanus sativus L.) es una planta de gran importancia por sus propiedades farmacéuticas y altos contenidos de vitaminas y minerales, es un cultivo de rápido crecimiento y alta capacidad productiva, lo que está estrechamente relacionado con el genotipo y las condiciones ambientales; a su vez, es un cultivo que permite un manejo intensivo y es fundamentalmente utilizado en siembras a pequeña escala (4). Sin embargo, existe muy poca información de su respuesta a la aplicación de productos bioactivos como productos estimuladores del crecimiento vegetal, algunos trabajos en los últimos años, se han referido al uso de rizobacterias promotoras del crecimiento vegetal y su efecto en la productividad del cultivo (5); el empleo de estas rizobacterias como supresoras de patógenos (6) y en Cuba, se ha evaluado el efecto de oligogalacturónidos en la morfología del cultivo (7). Por otra parte, se impone el desarrollo de investigaciones que demuestren que el Pectimorf® además de ser un efectivo enraizador es, a su vez, un bioestimulador del crecimiento de las plantas.
Basado en estas consideraciones, el presente trabajo se planteó con el objetivo general de evaluar la respuesta del cultivo del rábano (Raphanus sativus L.) a diferentes dosis y tiempos de imbibición en el producto bioactivo Pectimorf®.
MATERIALES Y MÉTODOS
El presente trabajo se desarrolló en el huerto intensivo de la finca “Las Papas” perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA), entre los meses de octubre-noviembre de 2010 y 2011. El suelo en el cual se desarrollaron los trabajos experimentales se clasifica como Ferralítico Rojo compactado éutrico de acuerdo a la Nueva Versión de Clasificación de los Suelos de Cuba (8), mostrándose alguna de sus características químicas en la Tabla I; donde, a excepción de la materia orgánica que es baja, tanto el pH como los cationes cambiables se encuentran en el rango considerado adecuado para el normal desarrollo del cultivo.
Los datos meteorológicos del período de desarrollo de ambos experimentos, fueron tomados de la Estación Meteorológica de Tapaste (provincia Mayabeque). En la Tabla II se muestran las medias mensuales de la temperatura, humedad relativa y precipitaciones.
El cultivo estudiado fue el rábano (Raphanus sativus L.), cultivar ´PS-9´, proveniente de la Empresa Nacional de Semillas. La siembra se realizó de manera directa en canteros de 1,20 m de ancho y 20,0 m de largo, ocupando cada tratamiento una superficie de 6,0 m2, la distancia empleada fue de 10 cm entre hileras y 5 cm entre plantas. El cantero recibió de base la aplicación de abono orgánico (estiércol vacuno) a razón de 1 kg.m-2; las atenciones culturales se realizaron según las recomendaciones del manual técnico para la agricultura urbana (9). Los tratamientos estudiados se distribuyeron bajo un diseño completamente aleatorizado con tres repeticiones.
Características del experimento de germinación
Para el experimento de germinación, las semillas de rábano fueron superficialmente desinfectada con hipoclorito de sodio al 5 % por tres minutos; luego, se prepararon las siguientes concentraciones del producto bioactivo Pectimorf®: 5, 10 y 15 mg.L-1, las cuales fueron comparadas con un control en agua destilada; igualmente se estudiaron tres tiempos de imbibición, según se muestra en la Tabla III. La Foto 1 muestra la forma de imbibición realizada.
Estas concentraciones fueron agitadas y vertidas en recipientes de cristal tapados con gasa simple, donde posteriormente fueron embebidas 60 semillas en cada uno de acuerdo a los tiempos en estudio.
Culminado cada tiempo, se ejecutó la siembra en placas petri preparadas con algodón y 10 mL de agua destilada a razón de 20 semillas por placa, las mismas estuvieron a temperatura ambiente (26ºC). Se emplearon tres placas por tratamiento, constituyendo cada una, una repetición, para un total de 36 placas en el experimento. Dichas placas se mantuvieron en la oscuridad y se evaluó diariamente el total de semillas germinadas, tomándose como criterio de germinación la emisión de la radícula.
Se calculó para cada réplica el porcentaje de germinación (considerando las semillas germinadas sobre el total de la muestra) (%), cuyos datos fueron transformados mediante la fórmula arcos√(%). Se calculó además el índice de velocidad de germinación (IVG) mediante la fórmula:
IVG = ∑(ni/ti)
donde:
IVG – índice de velocidad de germinación
ni – número de semillas germinadas
ti – tiempo necesario para alcanzar el mayor porcentaje de germinación
Características del experimento en campo
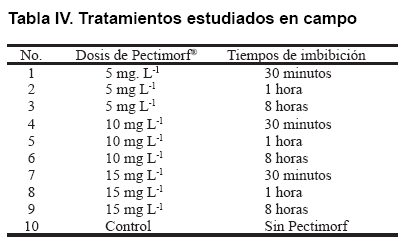
Para el desarrollo del experimento en campo, primeramente las semillas fueron embebidas en el producto bioactivo a dosis y tiempos diferentes, quedando los tratamientos de la siguiente manera (Tabla IV).
A un total de 15 plantas por tratamiento, a los 15 días posteriores a la germinación, les fueron realizadas evaluaciones de crecimiento y desarrollo tales como: altura (cm), diámetro del bulbo (cm) y masa fresca del bulbo (g); también, se calculó el rendimiento agrícola.m-2.
Los datos se procesaron estadísticamente para cada año de realizados los experimentos, a través de un análisis de varianza de clasificación simple y a las medias se les aplicó la prueba de rangos múltiples de Duncan en caso de existir diferencias significativas entre los tratamientos. Se utilizó el programa SPSS (versión 9.0).
RESULTADOS Y DISCUSIÓN
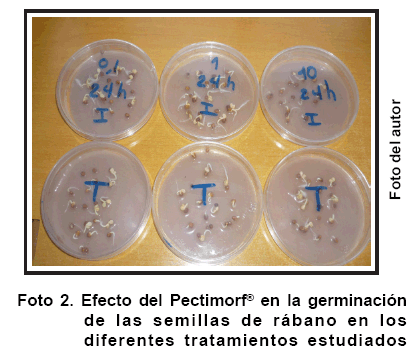
La germinación de las semillas es un proceso importante para lograr el éxito posterior en el crecimiento, desarrollo y rendimiento de los cultivos. Como se observa en la Foto 2, en todos los tratamientos se obtuvo una adecuada germinación de las semillas, tanto las embebidas solo en agua como las que fueron sumergidas en diferentes concentraciones del producto bioactivo.
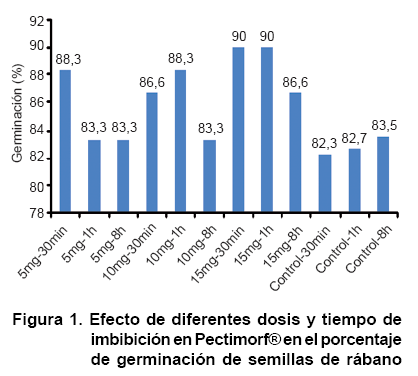
En la Figura 1 se observa cómo se logra un porcentaje de germinación por encima del 80 %, en el caso específico de los tratamientos estudiados, los tratamientos con 15 mg.L-1 durante 30 minutos y una hora, fueron los que alcanzaron un porcentaje de germinación del 90 % superando a los restantes, incluyendo a los tratamientos controles que de hecho son los que menores porcentajes alcanzan (82,33- 83,5 %). El no obtener en ningún caso un 100 % de germinación, puede estar relacionado con la calidad de la semilla utilizada, la cual pudiera estar perdiendo su viabilidad producto al tiempo de almacenamiento al cual estuvo sometida.
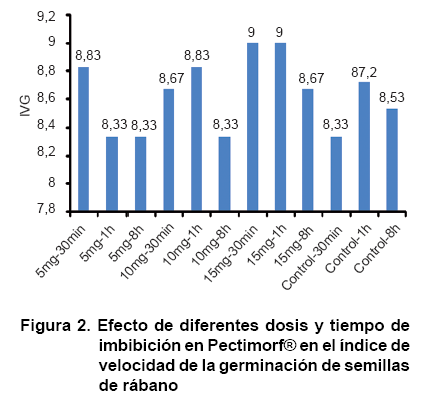
En concordancia con este resultado, también el índice de velocidad de la germinación (Figura 2) tuvo el mayor valor en ambos tratamientos, estando todos los valores entre 8 y 9,0. Este es un concepto importante que se relaciona con el vigor de las semillas al tener en cuenta el número de estas que germina y el tiempo que requieren para lograrlo (10). Por otra parte, se plantea que aun en agua no todas las semillas germinan simultáneamente, existiendo diferencias entre semillas de la misma población y que la distribución en el tiempo es un indicador de la uniformidad del lote de esas semillas (11). En cuanto al producto bioactivo estudiado, se plantea que puede estimular los procesos bioquímicos que dan origen al proceso de germinación de las semillas propiciando que ocurra la aceleración del mismo (12).
En la Tabla V se observa que el producto bioactivo Pectimorf® ejerció un efecto positivo tanto en el largo del hipocotilo como de la radícula, existiendo diferencias significativas entre los diferentes tratamientos. En cuanto al largo del hipocotilo este fue mayor en el tratamiento donde se utilizó 10 mg del producto y durante una hora se mantuvieron las semillas sumergidas (T8), siendo estadísticamente diferente de los tratamientos T1 y T4 donde se utilizaron las dosis de 5 y 10 mg.L-1 ambas con 30 minutos de imbibición de las semillas.
El largo de la radícula fue superior en los tratamientos 8 (10 mg.L-1 -1h) y 9 (10 mg.L-1-8h) sin diferencias con T2 (0,1 mg.L-1-1h) y T7 (10 mg.L-1-30 min), los cuales a su vez no fueron estadísticamente diferentes de los restantes.
En ambas evaluaciones, las diferentes dosis del producto superó a los controles indistintamente del tiempo de imbibición, por lo que se demuestra que el producto estimula el crecimiento de la plántula en su fase inicial.
El análisis general de este resultado conlleva a considerar la dosis de 15 mg.L-1 de Pectimorf®, independientemente del tiempo de imbibición, como la más adecuada para estas variables evaluadas, pudiéndose considerar entonces factible para el proceso de germinación, la imbibición de solo 30 minutos, lo que permite acortar el tiempo de este proceso, lo cual favorecería su posterior uso en la práctica productiva. Resultados similares han sido obtenidos con la aplicación de diferentes bioproductos para estimular la fase de germinación de semillas de garbanzos (13).
La aplicación del producto bioactivo Pectimorf® en el cultivo en la fase de campo fue positivo para cada una de las variables de crecimiento y desarrollo que fueron evaluadas, obteniéndose diferencias estadísticas entre cada uno de los tratamientos estudiados (Tabla VI). Para el caso específico de la altura, en ambos años todos los tratamientos con producto bioactivo fueron estadísticamente diferentes y superaron al control; el tratamiento donde se embebieron las semillas en la dosis de 5 mg durante una hora (T2) fue el que mayor resultado obtuvo, incrementando esta variable entre un 81 y 84 % con respecto al tratamiento control. En este sentido, trabajos realizados con oligogalacturónidos refieren que una posible vía por la cual se incrementa la altura de la planta es porque las oligosacarinas pueden estimular la actividad fotosintética; por tanto, hay una mayor ganancia de esqueletos carbonados que pueden ser utilizados para la síntesis de nuevos compuestos, como son las proteínas (14).
En cuanto al diámetro del fruto y su masa fresca, ambas variables muy correlacionadas con el rendimiento agrícola, se obtuvo que en correspondencia con el resultado descrito anteriormente, también el tratamiento donde se utiliza la dosis de 5 mg y el tiempo de imbibición de una hora (T2), difiere estadísticamente del resto de los tratamientos, logrando un incremento en relación al control entre un 56 y 45 % en cada año respectivamente, para el diámetro del fruto y en el caso de la masa fresca, duplica el valor obtenido por el tratamiento testigo. En la Foto 3, puede apreciarse el diámetro y tamaño de los frutos en ambos tratamientos. Sin embargo, para estas variables existieron tratamientos que no fueron estadísticamente diferentes del testigo y específicamente estuvo relacionado con la dosis de 15 mg.
En diferentes trabajos desarrollados con productos obtenidos a partir de una mezcla de oligogalacturónidos, coinciden en conferirles a estos productos una gran importancia al ser capaces de influir en diferentes procesos fisiológicos que ocurren en el vegetal que hace que estimulen el crecimiento y desarrollo de las plantas (15, 16).
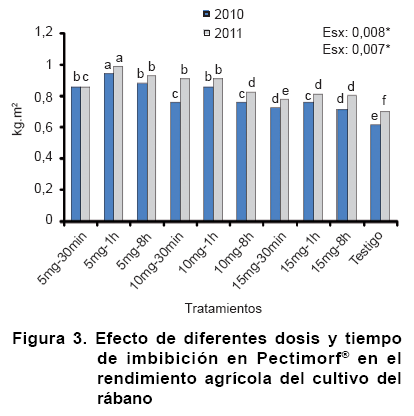
El análisis del rendimiento agrícola (Figura 3) en correspondencia con los componentes analizados anteriormente, conllevó a diferencias significativas entre los diferentes tratamientos estudiados, obteniendo un resultado similar en el 2010 y la repetición del mismo en el 2011. El rendimiento por m2 de superficie para ambos años, fue superior en el tratamiento donde se utilizó la dosis de 5 mg y las semillas estuvieron embebidas durante una hora en el producto bioactivo (T2), el cual incrementa al tratamiento control donde no se utilizó el Pectimorf® en un 54 % (2010) y 41 % (2011) respectivamente.
En sentido general, el producto bioactivo tuvo un efecto positivo en el rendimiento agrícola, demostrando ser un efectivo bioestimulante ya que indistintamente de la dosis o el tiempo de imbibición, todos los tratamientos superaron al testigo de producción; por otra parte, el rendimiento alcanzado en estas condiciones experimentales superaron al planteado por el manual de organopónico y huertos intensivos (9), donde se establece un rango entre 0,5 a 0,8 kg.m2 para esta variedad.
El rendimiento en el año 2011 fue superior al del año anterior, lo que pudiera estar relacionado con las condiciones climáticas imperantes en el período en que se desarrollaron los experimentos (Tabla II) donde la temperatura máxima fue menor y las precipitaciones en el mes de octubre fueron mayores; en cambio, en el mes de noviembre las temperaturas y humedad fueron similares en cada año y las precipitaciones en el 2011 fueron mucho menor que en el año anterior. Respecto al cultivo del rábano, en la literatura se refiere que el mismo requiere un óptimo de temperatura en un rango entre 18 y 22ºC y una humedad relativa de 60-80 % (17, 18); para ambos años, la temperatura mínima se encuentra por encima de la óptima sobre todo en el 2010, año en que ambas temperaturas fueron superiores a las del 2011, lo que pudo incidir negativamente en la formación de la raíz tuberosa y por consiguiente en su rendimiento.
Resultados similares en el cultivo del rábano con la utilización de una mezcla de oligogalacturónidos demostraron que en las plantas de este cultivo favoreció el crecimiento de los tallos y las raíces, de manera que se obtuvieron bulbos de mayor tamaño, esos resultados evidenciaron cambios morfológicos que evidenciaron su influencia en el crecimiento de la parte que se consume en esta hortaliza y desde los estadíos iniciales de su desarrollo, proponiéndose este producto bioactivo como alternativa para potenciar el rendimiento (7).
Los oligogalacturónidos son considerados actualmente como biorreguladores endógenos en el desarrollo de las plantas, pues pueden regular la síntesis y acción de las hormonas y distintos procesos de organogénesis y crecimiento y de manera directa y en específica regulan muchos de los procesos fisiológicos que se traducen en la formación de órganos en las plantas (19, 20).
De acuerdo a los resultados puede concluirse que el producto bioactivo Pectimorf® ejerce un efecto positivo en el cultivo del rábano (Raphanus sativus L.), estimulando en las plántulas el largo del hipocotilo y de la radícula; igualmente estimula el crecimiento y desarrollo de la planta, así como el rendimiento agrícola y sus componentes, superando entre un 40 y 50 % la producción del cultivo a partir de la aplicación de este producto bioactivo obtenido en Cuba, el cual demuestra su efectividad como bioestimulante.
REFERENCIAS
1. Gómez, A. R.; Jerónimo, G. L. y Nájera, L. J. Producción de frijol (Phaseolus vulgaris, L) y rábano (Raphanus sativus L.) en huertos biointensivos en el trópico húmedo de Tabasco. Universidad y Ciencia, 2008, vol. 24, no. 1, p. 11-20.
2. Aly, H. A.; Debbab, A.; Kjer, J. y Proksch, P. Fungal endophytes from higher plants: a prolific source of phytochemicals and other bioactive natural products. Fungal Diversity, 2010, vol. 41, no. 1, p. 1-16.
3. Instituto Nacional de Ciencias Agrícolas. Procedimiento de obtención de una mezcla de oligosacáridos pécticos estimuladora del enraizamiento vegetal. Cabrera, J. C.; Gómez, R.; Diosdado, E.; Hormaza, J. V.; Iglesias, R.; Gutierrez, A. y González, S. Patente. Cuba. Oficina de Registro de Patentes. Patente de producto, certificado 22859, RES 155/2003. Calificación internacional de patentes AO1N9/12, CO 7H/033. 2003.
4. Criollo, H. y García, J. Efecto de la densidad de siembra sobre el crecimiento de plantas de rábano (Raphanus sativus L.) bajo invernadero. Revista Colombiana de Ciencias Hortícolas, 2009, vol. 3, no. 2, p. 210-222.
5. Desai, S.; Grover, M.; Amalraj, L.; Kumar, P. y Ahmed, H. Exploting plant groth Promoting Rhizomicroorganisms for enhanced crop productivity. Microorganism in Sustainable Agriculture and Biotecnology, 2012, vol. 43, p. 227-241.
6. Sayyed, R.; Chincholkar, S.; Reddy, M.; Gangurde, N. y Patel, P. Siderophore Producing PGPR for Crop Nutrition and Phytopathogen Suppression. Bacteria Agrobiology Disease Management, 2013, vol. 32, p. 449-471.
7. Álvarez, B. I.; Reynaldo, E. I.; Cartaya, R. y Terán, V. Z. Efectos de una mezcla de oligogalacturónidos en la morfología de hortalizas de importancia económica. Cultivos Tropicales, 2011, vol. 32, no. 3, p. 69-74.
8. Hernández, A. J. Nueva versión de clasificación genética de los suelos de Cuba. Ministerio de la Agricultura. La Habana, Cuba. 1999. 23 p.
9. Manual de organopónicos y huertos intensivos. INIFAT. La Habana. Cuba. 2007. 183 p. ISBN 980-215-022-3.
10. Meot-Duros, L. y Magné, C. Effect of salinity and chemical factor son seed germination in the halophyte Crithmum maritimum. Plant and Soil, 2008, vol. 313, no. 1-2, p. 83-87.
11. Bazzigalupi, O.; Pistorale, M. S. y Andrés, N. A. Tolerancia a la salinidad durante la germinación de semillas provenientes de poblaciones naturalizadas de agropiro alargado (Thinopyrum ponticum). Ciencia e Investigación Agraria, 2008, vol. 35, no. 3, p. 277-285.
12. Izquierdo, H.; González, M. C.; Núñez, M.; Proenza, R. y Cabrera, J. C. Influencia de un oligogalacturónido en la aclimatización de vitroplantas de banano (Musa spp.) del clon ‘FHIA-18’ (AAAB). Cultivos Tropicales, 2009, vol. 30, no. 1, p. 37-42.
13. Serkan, E. y DumLupina, R. Progesterone and Estradiol Stimulate Seed Germination in Chickpea by Causing Important Changes in Biochemical. Parameters. Z. Naturforsch, 2010, vol. 65, p. 239-244.
14. Izquierdo, O. H. Los oligogalacturónidos de origen péctico y su acción en las plantas. Temas de Ciencia y Tecnología de México, 2009, vol. 13, no. 39, p. 31-40.
15. Field, A. R. Oligosaccharide Signalling Molecules. Plant-derived Natural Products, 2009, no. 3, p. 349-359.
16. Kollárová, K. y Zelko, M. Growth and anatomical parameters of adventitious roots formed on Mung Beans hypocotyls are correlated with galactoglucomannan oligosaccharides. New Forest, 2007, vol. 33, no. 3, p. 309-323.
17. Sakalauskaité, J.; Brazaityté, A.; Sakalauskiené, S.; Urbonaviciu¯te, A.; Samuoliené, G.; Šabajeviene, G. y Duchovskis, P. Impact of climate change factors on radish growth and photosynthetic pigments. Journal of Sodininkyste. ir Darzininkysté, 2009, vol. 28, no. 4, p. 131-139.
18. Young, C. E.; Cheol, S. T.; Lee, S. G.; Cho, H. I. y Stangoulis, J. Growth and physiological responses of Chinese cabbage and radish to long-term exposure to elevated carbon dioxide and temperature. Horticulture, Environment and Biotechnology, 2011, vol. 52, no. 4, p. 376-386.
19. Farouk, S. y Amany, A. Improving growtyh and yield of cowpea by foliar application of chitosan under wáter stress. Egyptian Journal of Biology, 2012, vol. 14, p.14-16.
20. Sudisha, J.; Sharathchandra, G. R.; Amruthesh, W. K.; Kumar, A. y Shekar, S. H. Pathogenesis related proteins in plant defense response. Plant Defense: Bological Control, 2012, vol. 12. no. 4, p. 379-403.
Recibido: 11 de agosto de 2012
Aceptado: 3 de junio de 2013
Dra.C .Elein Terry Alfonso, Investigadora Auxiliar del departamento de Fitotecnia, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700, Cuba. Email: terry@inca.edu.cu