Introducción
La osteoporosis es la enfermedad ósea más común de los adultos mayores. Es un importante problema de salud pública en todo el mundo.
La osteoporosis se caracteriza por una disminución de la masa ósea, por deterioro de la microestructura con compromiso de la resistencia ósea, lo que aumenta el riesgo de fractura. Por lo general, los pacientes con osteoporosis no experimentan síntomas hasta que sufren una fractura, lo que dificulta el diagnóstico y la prevención primaria.
Métodos
Las referencias se identificaron mediante la búsqueda en PubMed de publicaciones entre los años 2010-2020 en ingles con los términos: “osteoporosis”, “tratamiento de la osteoporosis”, “tratamiento en fracturas por osteoporosis”. Igualmente se revisaron artículos accesibles de forma libre o a través de los servicios Clinical Key e Hinari. Se añadieron artículos que sobrepasan los diez años de antigüedad, pero que son claves para el tema.
Epidemiología e impacto económico
La Organización Mundial de la Salud (OMS) define la osteoporosis como una densidad mineral ósea (DMO) en la columna vertebral o en la cadera de ≤ 2,5 desviaciones estándar (DE) por debajo de la DMO media de una mujer joven, medida por la absorción de rayos X de energía dual (DEXA). Una DMO entre 2,5 y 1 DE por debajo de la media representa la osteopenia.
La presencia de una fractura por fragilidad constituye diagnóstico de osteoporosis, incluso en ausencia de una disminución medible de la DMO.
La presencia de osteoporosis u osteopenia aumenta el riesgo de fracturas por fragilidad. Está incluida la cadera, la columna vertebral y la muñeca, también se considera fractura por fragilidad al húmero proximal. Estas aumentan su incidencia después de los 50 años.1
Existe una fuerte correlación entre la DMO y el riesgo de fractura por fragilidad. A la edad de 50 años, el riesgo de sufrir una fractura por fragilidad se estima en 40 % para las mujeres y 13 % para los hombres en los Estados Unidos; 46 % y 22 %, respectivamente en Suecia, y 42 % en general en Australia.2
Las fracturas de cadera comprenden solo alrededor del 14 % de las fracturas por fragilidad, las fracturas vertebrales y de muñeca también tienen secuelas significativas. A los 50 años, una mujer caucásica estadounidense tiene un riesgo del 32 % de sufrir una fractura vertebral clínica o radiográfica y una probabilidad del 15 % de sufrir una fractura de muñeca durante su vida.2
Las fracturas por fragilidad resultan en gastos sanitarios significativos. A pesar de comprender una minoría de las fracturas por fragilidad, las fracturas de cadera representan el 72 % del costo total del tratamiento de estas fracturas; en 2002, se estimó que una sola fractura de cadera costaba entre USD 34,000 y 43,000 según los datos del gobierno estadounidense de 2005. Para 2025, se proyecta que el costo anual de atención de fracturas en los EE. UU. será de USD 25,300 millones. En todo el mundo, se estima que el costo de las fracturas de cadera aumentará a USD 131,5 mil millones para 2050.3
En nuestra región no tenemos estadísticas actualizadas, en Argentina se registraron 34 000 casos de fracturas de cadera en 2009; se proyecta que se incremente a 76 000 casos para 2050. Es una tarea para realizar por nuestra asociación participar en los registros nacionales de fracturas.
Impacto clínico
La osteoporosis y las fracturas por fragilidad conllevan una morbilidad y mortalidad significativas:4
Al año, más del 50 % de los pacientes con fracturas de cadera continúan teniendo limitaciones funcionales significativas, con más de la mitad de los pacientes previamente independientes incapaces de caminar una manzana, subir cinco escalones, entrar y salir de la ducha, sentarse en el inodoro levantarse de una posición sentada sin ayuda de sus brazos.
Alrededor del 30 % de los pacientes con fractura de cadera requieren atención a largo plazo en un hogar de ancianos, y solo el 40% recupera completamente su nivel previo de funcionamiento.
Las fracturas vertebrales pueden causar dolor crónico; dificultad para inclinarse y levantar sus brazos sobre la cabeza; la cifosis produce disminución en la capacidad pulmonar y alteraciones en la anatomía abdominal con estreñimiento, saciedad temprana y disminución de la ingesta oral.
Todas las fracturas aumentan el riesgo de depresión y deterioro cognitivo.
Un paciente que sufre cualquier tipo de fractura por fragilidad tiene un 50-100 % más de probabilidades de sufrir otra, y los pacientes con fractura a menudo desarrollan miedo a caerse, lo que en sí mismo aumenta el riesgo de fractura.
Las fracturas también están asociadas con una mayor mortalidad.
La cirugía de fractura de cadera conlleva una mortalidad general del 4 % en la internación.
Aproximadamente 20 % de los pacientes con fractura de cadera muere dentro de un año del evento; las fracturas de cadera confieren un aumento de cinco a ocho veces en la mortalidad por todas las causas en los primeros 3 meses posteriores y este riesgo es mayor para los hombres. Se ha demostrado que las fracturas vertebrales tienen una mortalidad similar a las fracturas de cadera.4
Consideraciones prácticas para el período perioperatorio5
Test diagnósticos
Debido a que la presencia de una fractura por fragilidad indica osteoporosis incluso en ausencia de una disminución medible en la DMO. Para los pacientes sin un estudio previo, el DEXA a las 6-12 semanas después de la fractura es razonable para establecer una línea de base a partir de la cual monitorear la progresión de la enfermedad y la eficacia del tratamiento. Las medidas de diagnóstico en el entorno hospitalario, particularmente en los hombres, deben centrarse en la identificación de factores de riesgo modificables y causas secundarias de osteoporosis.
Las pruebas de laboratorio deben incluir calcio en suero (corregido para albúmina), fosfatasa alcalina, hemograma completo, función renal, 25-hidroxivitamina D, hormona tiroidea, electroforesis de proteínas séricas (para pacientes con fracturas vertebrales y sospecha de mieloma múltiple) y testosterona (para los hombres). No existe un papel para la medición de marcadores de resorción ósea en el entorno hospitalario.
Tratamiento de osteoporosis y prevención secundaria de fracturas
Después de la fractura por fragilidad, todos los pacientes deben recibir una cuidadosa revisión de la medicación, asesoramiento sobre la modificación del factor de riesgo y prevención de caídas, suplementos de calcio y vitamina D.
En ausencia de contraindicaciones, los pacientes con fracturas por fragilidad y una esperanza de vida superior a un año deben considerarse para la terapia con bisfosfonatos.5) Además de mejorar la DMO y reducir los marcadores de recambio óseo, los bisfosfonatos intravenosos y orales están asociados con un menor riesgo de fracturas posteriores y mortalidad después de una fractura de cadera.6
Sin embargo, no existe consenso sobre el momento óptimo de la terapia con bisfosfonatos para la prevención secundaria. Por un lado, la mayoría de los pacientes que han sufrido fracturas por fragilidad sostenida no reciben el tratamiento adecuado para la osteoporosis hasta dos años después de la fractura. El inicio temprano de la medicación puede reducir las fallas en la prescripción que pueden ocurrir durante las transiciones de la atención, subrayar la importancia de la terapia y maximizar el beneficio terapéutico. Por otro lado, el mecanismo de acción de los bisfosfonatos ha generado inquietud acerca de si estos agentes pueden retrasar la curación de la fractura. Los metanálisis recientes sugieren que la administración de bisfosfonatos dentro de los 3 meses posteriores a la fractura no parece afectar clínica o radiográficamente la curación de la fractura.7,8
La mayoría de los expertos en osteoporosis apoyan el inicio de los bisfosfonatos entre 6 y 12 semanas después de la fractura. Es razonable comenzar con la dosificación semanal de bisfosfonatos orales (Ej., alendronato 70 mg por semana). Los bisfosfonatos intravenosos, por ejemplo, ácido zolendrónico e ibandronato) pueden ofrecer ventajas en el cumplimiento o en pacientes hospitalizados que tienen contraindicaciones gastrointestinales a los agentes orales. Para pacientes con contraindicaciones para la terapia con bisfosfonatos, se pueden considerar otras terapias como la teriparatide y el denosumab en consulta con un experto en osteoporosis.5
Gestión continua
El manejo postoperatorio de la osteoporosis se encuentra dentro del alcance de la atención que debe dar el traumatólogo, y no implica una derivación especializada. Para pacientes con contraindicaciones para la terapia oral o enfermedad refractaria a la terapia oral, puede estar justificada la consulta con otros especialidades.5
Conceptos básicos del metabolismo óseo y la fisiopatología de la pérdida ósea asociada a la edad
La remodelación ósea es el proceso homeostático normal por el cual el hueso viejo es reabsorbido y reemplazado por hueso nuevo para mantener un esqueleto sano. Este proceso ocurre en varias etapas:5)
Activación: los precursores de osteoclastos llegan a la superficie del hueso formado.
Reabsorción: los precursores de osteoclastos se convierten en osteoclastos activos y crean un ambiente ácido, disolviendo así el contenido mineral del hueso.
Reversión: los osteoclastos sufren apoptosis y son reemplazados por precursores de osteoblastos.
Formación de hueso: los precursores de osteoblastos se activan a los osteoblastos y depositan colágeno.
Mineralización: los osteocitos incrustados en la matriz de colágeno contribuyen a su mineralización y endurecimiento en hueso nuevo.
La remodelación ósea ocurre bajo el control de varias hormonas y citocinas, incluidos los estrógenos y andrógenos, la vitamina D, la hormona paratiroidea (PTH), la osteoprotegerina y el activador del receptor del factor nuclear κB (RANK) y su ligando (RANK-L). Muchos de estos factores han proporcionado objetivos para el tratamiento farmacológico de la osteoporosis. En la figura se muestra un esquema del proceso de remodelación ósea.5
 OPG: osteoprotegerina. PTH: hormona paratiroidea.Fuente: Papaioannou A, Santesso N, Morin SN. Recommendations for preventing fracture in long-term care. CMAJ. 2015; 187(15):1135-44.
OPG: osteoprotegerina. PTH: hormona paratiroidea.Fuente: Papaioannou A, Santesso N, Morin SN. Recommendations for preventing fracture in long-term care. CMAJ. 2015; 187(15):1135-44.Fig Esquema de las claves en el proceso de remodelación ósea.
El proceso de remodelación favorece la formación de hueso nuevo hasta los 20 años, cuando la masa ósea de un individuo alcanza su punto máximo. Los afroamericanos alcanzan la masa ósea máxima más alta que los caucásicos, quienes alcanzan picos menores y los asiáticos los más bajos. Una tendencia hacia la pérdida ósea comienza inmediatamente después de alcanzar el pico de masa ósea. En las mujeres, la pérdida ósea se acelera después de la menopausia, cuando los niveles más bajos de estrógenos permiten una mayor resorción ósea por los osteoclastos sin un aumento correspondiente en la deposición ósea por los osteoclastos. En la séptima década de la vida, las disminuciones relacionadas con la edad en la absorción de calcio conducen a un hiperparatiroidismo secundario, que también aumenta la resorción ósea. Finalmente, en la vejez la producción renal de vitamina D disminuye mientras que aumenta la resistencia a la vitamina D endógena, lo que resulta en un aumento neto adicional en la resorción ósea. A medida que se envejece, la masa ósea de una mujer puede disminuir en un 30-40 % desde el nivel máximo.5
La osteoporosis representa un desequilibrio patológico entre la resorción y la formación óseas, predominando la primera. Además de la disminución de la masa ósea, la osteoporosis se caracteriza por alteraciones en la microarquitectura del hueso, con menos trabéculas óseas y más frágiles, así como una disminución de la viabilidad de los osteocitos que mantienen la mineralización ósea.
Evaluación, diagnóstico, y evaluación del riesgo de osteoporosis5
Cualquier fractura en un sitio esquelético importante, particularmente en la cadera o la columna vertebral, en un adulto de 50 años o más, debe considerarse relacionada con la osteoporosis a menos que las circunstancias clínicas indiquen otra etiología clara para la fractura, y el paciente debe ser evaluado en consecuencia.
Los factores de riesgo comunes para la baja DMO se enumeran a continuación:
Edad avanzada
Menopausia precoz
Raza caucásica o asiática
Antecedentes personales o familiares de fractura por fragilidad
Ingesta inadecuada de calcio y vitamina D
Uso excesivo de alcohol o tabaco
Bajo nivel de actividad física
Medicamentos:
Los pacientes considerados de alto riesgo de osteoporosis o caídas deben someterse a una determinación de DMO.
El DEXA central medido en la cadera total, el cuello femoral o la columna vertebral es el método más común de determinación de la DMO. La DMO de un paciente determinado, expresada en unidades de gramos de mineral por centímetro cuadrado escaneado (g/cm2), se compara con dos bases de datos, una que comprende una población de edad, género y etnia y otra que comprende un adulto joven, población del mismo sexo. Las desviación estándar de la DMO del paciente a partir de estas dos normas de base de datos producen puntuaciones Z y T, respectivamente.5
Las fracturas vertebrales definen la osteoporosis incluso en ausencia de un diagnóstico de DEXA. Estas fracturas a menudo no producen síntomas y pueden no diagnosticarse durante meses o años, pero su presencia es una indicación para el tratamiento farmacológico de la osteoporosis. Por lo tanto, algunos grupos recomiendan la medición anual de la estatura en pacientes mayores.
Además, la radiología vertebral debe considerarse en:
Mujeres mayores de 70 años y hombres mayores de 80 años con osteopenia definida por DEXA.
Mujeres de 65 a 69 años y hombres de 70 a 79 años con puntajes T de menos de -1.5.
Mujeres y hombres mayores de 50 años con fractura por trauma de baja energía durante la edad adulta, pérdida de altura de 4 cm o más o tratamiento a largo plazo con glucocorticoides. 9
La mayoría de las mujeres posmenopáusicas con osteoporosis no tienen una causa secundaria identificable. Sin embargo, el 50 % de los hombres, y las mujeres premenopáusicas pueden tener una condición tratable subyacente, como muestra la lista de causas seleccionadas de osteoporosis secundaria:9
Medicamentos, por ejemplo, glucocorticoides, anticonvulsivos, litio, inhibidores de la bomba de protones y otros.
Enfermedad reumática, por ejemplo, artritis reumatoide, lupus eritematoso sistémico y espondilitis anquilosante.
Endocrinopatías (Ej., síndrome de Cushing), hipertiroidismo, hiperparatiroidismo, hipogonadismo, diabetes tipo 2 y otros.
Otras afecciones médicas, como fibrosis quística, enfermedad pulmonar obstructiva crónica, infección por el virus de la inmunodeficiencia humana, insuficiencia renal y enfermedad hepática.
Factores nutricionales, por ejemplo, consumo excesivo de alcohol, anorexia, enfermedad celíaca y deficiencia de vitamina D.
Si bien no existen pautas formales para una evaluación adicional, puede justificarse una evaluación clínica cuidadosa seguida de pruebas de laboratorio en pacientes sospechosos de tener una etiología secundaria de osteoporosis.
Osteoporosis en hombres10
Aunque la osteoporosis es más común en mujeres que en hombres, un número significativo de hombres se ven afectados: en los EE. UU., 1,5 millones de personas mayores de 65 años, con otros 3,5 millones en riesgo.10 Uno de cada ocho hombres estadounidenses sufre una fractura osteoporótica en su vida. Los hombres tienen el doble de probabilidades que las mujeres de morir como resultado de sus fracturas, pero menos de la mitad de las probabilidades de ser evaluados por osteoporosis y menos de un quinto de probabilidades de ser tratados por osteoporosis después de una fractura. A pesar de la validez poco clara de las puntuaciones T en los hombres, DEXA sigue siendo el método de diagnóstico de elección.
Aproximadamente la mitad de los hombres con osteoporosis tienen una causa secundaria o factor contribuyente, más comúnmente abuso de alcohol, la mayoría de los hombres diagnosticados con osteoporosis deben someterse a una evaluación adicional. El tratamiento de la osteoporosis en hombres sigue principios similares a los de las mujeres.
Tratamiento no farmacológico
El tratamiento de la osteoporosis implica un enfoque multimodal que incluye educación, estrategias de prevención de caídas, ejercicio, suplementos de calcio y vitamina D y terapia farmacológica. Desafortunadamente, a pesar de la mayor prevalencia de osteoporosis, osteopenia y fracturas por fragilidad, la evidencia sugiere que muchos pacientes en riesgo no reciben educación y tratamiento para la disminución de la DMO.
Las limitaciones de tiempo a menudo limitan la cantidad de educación que se puede hacer durante una visita al consultorio de rutina u hospitalización, y en un estudio de aproximadamente 2800 mujeres con fracturas por fragilidad, solo el 4,6 % comenzó con tratamiento farmacológico de osteoporosis inmediatamente después de la fractura, solo 8.4 % se sometió a pruebas de DMO y solo el 42,4 % recibió tratamiento en los 2 años posteriores a la fractura.
Todas las mujeres posmenopáusicas, hombres mayores de 50 años y otros pacientes en riesgo de pérdida ósea acelerada deben recibir asesoramiento sobre la modificación del factor de riesgo, como dejar de fumar y moderar el consumo de alcohol. Los pacientes también deben recibir educación sobre estrategias de prevención de caídas, que incluyen iluminación adecuada, barras de sujeción, calzado adecuado y eliminación de riesgos de caídas como alfombras. Las evaluaciones de seguridad en el hogar pueden resultar invaluables para reducir el riesgo de caídas.
Los médicos deben minimizar el uso de medicamentos que contribuyen a la confusión, mareos, hipotensión o fatiga, y también deben evaluar las deficiencias visuales. Los fisioterapeutas y los terapeutas ocupacionales pueden desempeñar papeles críticos para abordar las anomalías existentes en el equilibrio y la marcha y las deficiencias cognitivas, así como para instruir a los pacientes en ejercicios regulares de carga y fortalecimiento muscular.
Los pacientes en riesgo de pérdida ósea acelerada deben ser educados sobre la importancia de una ingesta adecuada de calcio y vitamina D. En adultos mayores, el calcio sérico disminuye, la absorción intestinal de calcio disminuye y la excreción urinaria de calcio aumenta.
La vitamina D aumenta el calcio sérico al aumentar la absorción intestinal y la reabsorción renal de calcio, así como la resorción de calcio del hueso. En los adultos mayores, la producción de vitamina D inactiva en la piel disminuye, al igual que la conversión renal de vitamina D a su forma activa, lo que conduce al hiperparatiroidismo secundario y la posterior hipocalcemia y resorción ósea.
El carbonato de calcio 600 mg dos veces al día reduce la incidencia de fractura clínica en comparación con el placebo en pacientes que cumplen al menos un 80 %; pero a pesar de los efectos adversos mínimos, el cumplimiento puede ser tan bajo como 43 %. La administración de suplementos de vitamina D por sí sola no ha demostrado ser efectiva para disminuir las tasas de fracturas, aunque puede producir mejoras en la DMO. Sin embargo, la combinación diaria de calcio y vitamina D3 parece reducir la pérdida ósea y disminuir el riesgo de fracturas de cadera y otras fracturas no vertebrales entre las mujeres mayores en comparación con placebo.
Se recomienda que los pacientes con riesgo de pérdida ósea consuman 1200 mg de calcio diariamente, junto con vitamina D 800-1000 unidades internacionales (UI) diariamente. Se pueden sugerir suplementos de calcio para pacientes que no pueden obtener suficiente calcio de fuentes dietéticas. Las formulaciones de calcio disponibles incluyen carbonato de calcio y citrato de calcio. El primero es menos costoso y debe tomarse con las comidas, mientras que el segundo es más costoso, pero puede tomarse en cualquier momento. Ambas formulaciones causan estreñimiento y malestar abdominal. Para una absorción óptima, una dosis única de calcio suplementario no debe exceder los 500 mg de calcio elemental, y el calcio no debe administrarse dentro de varias horas de levotiroxina, fluoroquinolonas, fenitoína, inhibidores de la enzima convertidora de angiotensina y bisfosfonatos, que pueden interferir con su absorción.
La vitamina D está disponible como ergocalciferol (D2), que comúnmente se administra en una dosis de 50 000 UI por vía oral por semana durante 8 semanas, seguido de 50 000 UI cada 2 a 4 semanas. Alternativamente, los pacientes pueden tomar colecalciferol (D3) 1000-2000 UI por vía oral una vez al día. El objetivo de la suplementación con vitamina D es un nivel sérico de 25-hidroxivitamina D igual o superior a 29,6 ng/mL (74 nmol/L).
Tratamiento farmacológico de la osteoporosis
Existen diversas recomendaciones sobre qué pacientes deben recibir tratamiento farmacológico para la disminución de la DMO. Las mujeres posmenopáusicas y los hombres de 50 años o más deben ser tratados si:
Tienen una fractura clínica o radiográfica de cadera o vertebral, independientemente de los hallazgos de DEXA.
Tienen una puntuación T igual o inferior a -2,5 en la cadera, el cuello femoral o la columna lumbar.
Tienen un puntaje T entre -1,0 y -2,5 y una probabilidad de 10 años de fractura de cadera de al menos 3% o una probabilidad de 10 años de una fractura de fragilidad mayor de al menos 20 % según lo evaluado por el Riesgo de Fractura de la OMS Herramienta de evaluación (FRAX).11
Es probable que la esperanza de vida sea necesaria para acumular suficiente efecto farmacológico de la terapia de osteoporosis para que los beneficios valgan los riesgos.
Algunos expertos sugieren iniciar la terapia antirresortiva en cualquier paciente, particularmente mujeres, que toman glucocorticoides por más de 3 meses a dosis que exceden el equivalente de prednisolona 7,5 mg al día dado el fuerte efecto negativo de estos agentes sobre la calidad ósea.
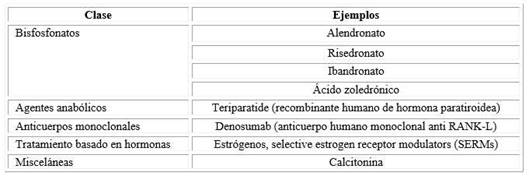
La Administración de Drogas y Alimentos de los Estados Unidos (FDA) ha aprobado múltiples clases farmacológicas para el tratamiento de la osteoporosis y se resumen en el cuadro.
Bisfosfonatos
Los bisfosfonatos son la base del tratamiento para la osteoporosis y la osteopenia. Son potentes agentes antirresortivos que se unen a los cristales de hidroxiapatita de calcio en la matriz mineral ósea e inhiben la actividad de los osteoclastos, disminuyendo así la remodelación ósea. Los bisfosfonatos en realidad se incorporan a la matriz ósea y, por lo tanto, sus efectos persisten durante años.
Los bisfosfonatos más utilizados tienen las características siguientes:
Alendronato: 70 mg VO semanal, reduce el riesgo de fractura en vertebra y cadera, indicado como tratamiento preventivo en osteoporosis posmenopáusica, osteoporosis en hombres y osteoporosis inducida por corticoides.
Risedronato: 35 mg VO semanal o 150 mg VO mensual, reduce el riesgo de fractura vertebral y de cadera, como tratamiento preventivo en osteoporosis post menopáusica, osteoporosis en hombres y osteoporosis inducida por corticoides.
Ibandronato: 150 mg VO mensual, reduce el riesgo de fractura vertebral. Indicado en la prevención y tratamiento de la osteoporosis post menopáusica.
Ibandronato: 3 mg EV cada 3 meses, incrementa la densidad ósea pero no tiene efecto en el riesgo de fracturas. Para el tratamiento de la osteoporosis posmenopáusica.
Ácido zoledrónico: 5 mg EV anualmente. Reduce el riesgo de fractura vertebral y de cadera. Actúa como prevención cuando se administra cada 2 años, y de tratamiento, en fracturas por fragilidad en osteoporosis posmenopáusica, osteoporosis en hombres y en osteoporosis inducida por corticoides.
Los bisfosfonatos orales están asociados con una mala absorción gastrointestinal y efectos secundarios en el tracto gastrointestinal superior, que incluyen disfagia, reflujo e inflamación esofágica. Estos medicamentos deben tomarse con el estómago vacío con un vaso lleno de agua; además, los pacientes deben esperar entre 30 y 60 minutos antes de reclinarse o consumir otras bebidas, medicamentos y alimentos. Reconocemos que la adherencia a estos agentes sea deficiente y pueda limitar su eficacia. Los bisfosfonatos intravenosos se toleran mejor, aunque el ácido zoledrónico puede asociarse con una reacción a la perfusión caracterizada por fiebre, dolor de cabeza, artralgia y mialgia. La hidratación adecuada y la premedicación con acetaminofeno reducen el riesgo de una reacción a la perfusión, y es menos probable que ocurra con infusiones posteriores. Los bisfosfonatos están contraindicados en pacientes con insuficiencia renal significativa (típicamente definida como aclaramiento de creatinina < 30 mL/min); esto puede ser un factor limitante para muchos adultos mayores frágiles.
Ha habido informes en la literatura de osteonecrosis de la mandíbula asociada a bisfosfonatos (ONM), que se cree que son el resultado de la supresión a largo plazo de la remodelación ósea y la acumulación de daño microscópico en el hueso. Los factores de riesgo para esta rara afección incluyen el tipo y la dosis acumulada de bisfosfonatos; la mayoría de los casos ocurren en pacientes con mieloma múltiple y otras neoplasias malignas que involucran lesiones óseas líticas que reciben dosis más altas y frecuentes de bisfosfonatos que las que se usan para el tratamiento de la osteoporosis.
El traumatismo dental y la infección también parecen predisponer a los pacientes a la ONM y, por lo tanto, se sugiere que estos reciban atención dental de rutina continua y se sometan a cualquier cirugía dental o tratamiento de infecciones orales necesarias antes del inicio de un bisfosfonato, si es posible. El tratamiento de la ONM implica el manejo del dolor, el control de infecciones, el desbridamiento del tejido necrótico y el cese frecuente de la terapia con bisfosfonatos. Debido a que la ONM es una complicación rara vez vista en pacientes que toman bisfosfonatos para la osteoporosis, la preocupación por su aparición no debe impedir el inicio de estos agentes si se indica lo contrario. Se informan tasas significativamente más altas de ONM en pacientes que reciben dosis frecuentes de bisfosfonatos para tumores malignos.12
Los bisfosfonatos también se han asociado con fracturas femorales atípicas, definidas como fracturas de bajo traumatismo de la diáfisis femoral media que conducen a un pródromo de incomodidad y debilidad vagas en el muslo. Nuevamente, la supresión excesiva de la remodelación ósea puede permitir la acumulación de grietas microscópicas en el hueso que eventualmente se unen en una lesión clínicamente aparente. Los estudios han demostrado que, si bien el riesgo relativo de fracturas femorales atípicas aumenta en pacientes que toman bisfosfonatos, el riesgo absoluto sigue siendo muy pequeño.13). Sin embargo, en pacientes con este tipo de fractura, se debe suspender la terapia con bisfosfonatos.
El riesgo de fractura femoral atípica y de ONM, aunque pequeño en ambos casos, parece aumentar con la duración del uso de bisfosfonato. Esta observación, junto con la larga vida media de los bisfosfonatos, ha introducido incertidumbre sobre la duración óptima de la terapia con estos.
Se ha sugerido un enfoque estratificado por riesgo para el tratamiento continuo con bisfosfonatos: los pacientes con bajo riesgo de fractura podrían considerar una
después de 3 a 5 años, mientras que los pacientes de mayor riesgo deberían continuar la terapia por un período más prolongado con una vacación más corta, tal vez con el uso de un agente alternativo durante las vacaciones. En cualquier caso, los pacientes deben ser reevaluados dentro de 1 a 3 años después del cese de la terapia y se reanudará un bisfosfonato si la DMO disminuye o si se produce una fractura."vacación farmacológica"
Agentes anabólicos
Teriparatide - Hormona paratiroidea. La hormona paratiroidea tiene un efecto neto de resorción sobre el hueso cuando se administra de forma continua y un efecto anabólico neto cuando se administra de manera intermitente. La teriparatide es una PTH humana recombinante que, cuando se dosifica a 20 µg por vía subcutánea al día, es un agente aprobado para el tratamiento de la osteoporosis que estimula la formación de hueso en lugar de limitar la resorción ósea. El mecanismo de acción de la teriparatide implica la inducción de citocinas, incluido el factor de crecimiento de insulina 1, el factor de crecimiento transformante B y RANK-L, así como la inhibición de la esclerostina, lo que resulta en la activación de los osteoblastos de construcción ósea. El efecto anabólico de lateriparatide comienza dentro de 1 mes de inicio y alcanza su punto máximo a los 6-9 meses. El agente aumenta la DMO vertebral, femoral y corporal total y disminuye el riesgo de fracturas vertebrales y no vertebrales. Está aprobado para mujeres y hombres posmenopáusicos con osteoporosis y alto riesgo de fractura y para pacientes intolerantes a los bifosfonatos. La teriparatide generalmente se tolera bien, con posibles efectos adversos que incluyen hipotensión ortostática, hipercalcemia transitoria, náuseas y calambres en las piernas. En modelos animales, se demostró que la teriparatide aumenta el riesgo de osteosarcoma. Por lo tanto, aunque no ha habido informes de malignidad en humanos que reciben dosis efectivas más bajas que los animales de laboratorio, el agente está etiquetado como contraindicado en pacientes con enfermedad de Paget, antecedentes de radiación esquelética y elevaciones inexplicables de suero fosfatasa alcalina. Lateriparatide se administra durante 2 años, después de lo cual, según sugiere un estudio, los pacientes deben hacer la transición a la terapia con bisfosfonatos para mantener las ganancias obtenidas en la DMO.14
Anticuerpos monoclonales
Denosumab. Denosumab es un anticuerpo monoclonal completamente humano dirigido contra RANK-L. Esta citocina media en la formación, función y supervivencia de los osteoclastos. El bloqueo de la interacción entre RANK y RANK-L inhibe la resorción ósea mediada por osteoclastos. Se ha demostrado que el denosumab aumenta la DMO en la columna vertebral y disminuye el riesgo de fracturas vertebrales radiográficas y fracturas clínicas de cadera y no vertebrales. Administrado como inyecciones subcutáneas de 60 mg cada 6 meses, está aprobado para el tratamiento de la osteoporosis en hombres ymujeres posmenopáusicas con alto riesgo de fractura, así como para el tratamiento de la pérdida ósea en mujeres y hombres que reciben terapias hormonales para el cáncer de mama y de próstata. Los efectos adversos más comunes incluyen hipocalcemia, erupción cutánea, celulitis y flatulencia. Al igual que con los bisfosfonatos, el denosumab rara vez se ha asociado con ONM (osteonecrosis mandibular) y fracturas femorales atípicas. Se desconoce la eficacia y seguridad a largo plazo de denosumab.
Terapias asociadas a hormonas
Estrógenos endógenos. Los estrógenos endógenos limitan la resorción ósea mediante la estimulación de la citosina osteoprotegerina. La osteoprotegerina, un antagonista natural de RANK-L, bloquea la interacción de RANK con RANK-L, disminuyendo la activación de los osteoclastos y, por lo tanto, la resorción ósea. A medida que los niveles de estrógenos endógenos disminuyen bruscamente en la menopausia, la activación de los osteoclastos aumenta y conduce a la pérdida ósea acelerada que se observa en las mujeres posmenopáusicas. Se ha demostrado que la administración de estrógenos exógenos, con o sin progesterona, reduce ligeramente el riesgo de fracturas vertebrales y de cadera. Sin embargo, los estrógenos confieren un mayor riesgo de accidente cerebrovascular, enfermedad tromboembolia, enfermedad coronaria y cáncer de mama; estos riesgos superan los beneficios óseos. Se recomienda limitar el uso de la terapia con estrógenos exógenos para la osteoporosis a mujeres con síntomasvasomotores moderados a severos, y solo por cortos períodos de tiempo.
Misceláneas
Calcitonina. La calcitonina endógena, secretada por la glándula tiroides, desempeña un papel en la homeostasis normal del calcio, protegiendo contra la hipercalcemia al actuar directamente sobre los osteoclastos para inhibir la resorción ósea. Se ha demostrado que una formula vía aerosol nasal de calcitonina de salmón, rociada en fosas nasales alternas a una dosis de 200 UI, disminuye la incidencia de fracturas vertebrales. También se ha encontrado que tiene un pequeño efecto analgésico en las fracturas vertebrales por compresión. No afecta el riesgo de fractura de cadera u otra fractura no vertebral. La calcitonina intranasal tiene pocos efectos secundarios inmediatos además de la rinitis, pero los estudios han sugerido un mayor riesgo de malignidad no especificada con este agente. La calcitonina es un agente de tercera línea para el tratamiento de la osteoporosis dada la disponibilidad de otros medicamentos con mayor eficacia.
Otras terapias
El “ranelato de estroncio” se usa en algunos países europeos para el tratamiento de la osteoporosis. Se ha demostrado que reduce el riesgo de fracturas vertebrales y de cadera en mujeres posmenopáusicas. Su mecanismo no está claro, pero se teoriza que se incorpora a la estructura cristalina del hueso y mejora la mineralización de la matriz. El estroncio se ha asociado con náuseas, diarrea, erupción cutánea y dolor de cabeza; ha habido informes de que la reacción al fármaco con eosinofilia y síndrome de síntomas sistémicos es potencialmente mortal.
Otros agentes nuevos se encuentran actualmente en ensayos preclínicos.
Consideraciones prácticas para el período posoperatorio
Luego de una fractura por fragilidad, el riesgo de presentar otra fractura es el doble, comparado con una persona que nunca se ha fracturado. Este riesgo se mantiene hasta 10 años después de la fractura original.
El 20 % de los pacientes con una fractura de cadera muere dentro de 1 año, esta cifra es mayor en hombres. Es probable que este riesgo sea tanto causa como consecuencia de la fractura por fragilidad.
El riesgo de fractura inminente dura de uno a dos años después de la fractura inicial, lo que está relacionado con las caídas y la no prevención secundaria de fracturas.
En el cierre de este capítulo se exponen recomendaciones del protocolo de indicaciones de alta en pacientes que fueron operados por una fractura de cadera, o que sufrieron una fractura por fragilidad.