Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión impresa ISSN 1010-2752
Rev. Protección Veg. vol.28 no.3 La Habana sep.-dic. 2013
COMUNICACIÓN CORTA
Metodología de superficie respuesta para evaluar estabilidad en almacén de un agente de control biológico
Response surface methodology to evaluate stability of a biological control agent in storage conditions
Ileana Miranda, Jersys Arévalo, Leopoldo Hidalgo-Díaz
Dirección de Sanidad Vegetal. Centro Nacional de Sanidad Agropecuaria, Apartado 10, San José de las Lajas, Mayabeque, CP 32700, Cuba. Correo electrónico: ileanam@censa.edu.cu.
RESUMEN
Se evaluaron 8 formulaciones elaboradas según combinación de polvo puro del hongo nematófago Pochonia chlamydosporia var. catenulata IMI SD 187, uso de zeolita como relleno (50%, 80%, 90%) y sellaje (ausencia o presencia de aire atmosférico), y se modificaron las condiciones de almacenamiento (4°C ó 25°C), para un total de 16 tratamientos. Para cada tratamiento, se midió el porcentaje de humedad y la concentración de hongo viable (UFC.g-1). Para identificar estabilidad se empleó la prueba no paramétrica de Friedman comparando cuatro momentos de evaluación (inicio, 15, 30 y 45 días). Mediante un análisis de componentes principales se identificaron los factores de mayor incidencia en la germinación de clamidosporas. Finalmente, por medio de la metodología de superficie respuesta se obtuvo la combinación de porcentaje de relleno de zeolita y temperatura de almacenamiento que favoreció la germinación. En todos los tratamientos el porcentaje de humedad permaneció por debajo del 10%, pero en solo 6 tratamientos la concentración de hongo viable se mantuvo estable. El oxígeno y nitrógeno del aire no modificaron significativamente los resultados. Se localizó un punto de máxima germinación de clamidosporas con el empleó de 30 a 40% de zeolita como relleno, almacenando el producto a 15°C. Se propuso un diseño compuesto central 10+2x2+2 para validar el proceso.
Palabras clave: Pochonia chlamydosporia, control biológico, formulación, tiempo de vida útil.
ABSTRACT
Eight formulations elaborated according to combinations of the pure powder of the nematophagous fungus Pochonia chlamydosporia var. catenulata IMI SD 187, zeolite as additive at 50%, 80% or 90%, sealing in absence or presence of atmospheric air, and storage at 4°C or 25°C, for 16 treatments were evaluated. For each treatment, the percentage of humidity and the concentration of viable fungi (UFC.g-1) were measured; for stability identification, Friedman's non-parametric test was used comparing four evaluation times (beginning, 15, 30 and 45 days). By means of the principal component analysis, the main factors influencing chlamydospore germination were identified. Finally, using the response surface methodology, a maximum of germination percentage was identified. In all the treatments, the humidity percentage remained below 10%, but the concentration of viable fungi was stable only in six treatments. Results were not significantly modified by the presence of air in the packages. A point of maximum chlamydospore germination was reached using 30 to 40% of zeolite and the storage at 15°C. A compound central design 10+2x2+2 was recommend to validate the process.
Key words: Pochonia chlamydosporia, biocontrol, formulation, shelf-life.
Una etapa importante para lograr la obtención de un bioplaguicida seguro, eficaz y confiable es el estudio de las preformulaciones, teniendo en cuenta que, por preformulación se define, al conjunto de actividades organizadas conducentes a la determinación de las características del principio activo y de los cambios químicos, físicos y microbiológicos que pueda sufrir el bioplaguicida solo o combinado con los auxiliares de la formulación, necesarios para la elaboración del producto final (1).
El Centro Nacional de Sanidad Agropecuaria (CENSA) cuenta con un producto bionematicida cuyo ingrediente activo son las clamidosporas producidas por el hongo nematófago Pochonia chlamydosporia (Goddard) Zare y Gams (ex Verticillium chlamydosporium Goddard) (2). El producto registrado bajo el nombre de KlamiC® (3), es obtenido mediante una tecnología de fermentación en estado sólido en bolsas, según Sistema de Gestión de la Calidad bajo la Norma Cubana NC ISO 9001 (4).
Entre los factores que inciden en la temprana fecha de caducidad del bioplaguicida se encuentran: el ingrediente activo (5), el aditivo (6), el proceso de secado (7), la temperatura de almacenamiento (8), la actividad del agua y la atmósfera de empaquetamiento (9). Además, se conoce que algunas formulaciones de esporas que incluyen materiales inertes como la zeolita lograron incrementar la estabilidad (10).
Por otra parte, una vez determinado los factores que se desean evaluar en el proceso de preformulación, se recomienda construir una superficie respuesta que permita identificar el diseño para efectuar la formulación del producto final (11).
En consecuencia, en el presente trabajo se empleó la metodología de superficie de respuesta para evaluar la estabilidad del polvo de clamidosporas de P. chlamydosporia var. catenulata cepa IMI SD187 mezclado con zeolita, en condiciones de almacenamiento.
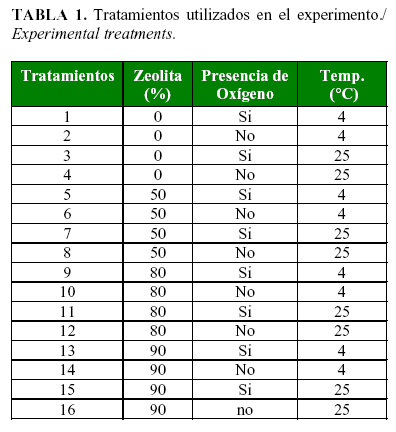
El trabajo se realizó en la Unidad de Investigación- Desarrollo de Hongos Agentes de Control Biológico del CENSA. Se utilizaron 6 Kg de KlamiC y se separaron en el Micoharvester para la obtención del polvo de clamidosporas concentrado. El polvo obtenido se mezcló con tres proporciones diferentes de zeolita estéril (50 %, 80 % y 90 %) en 50 g de producto final y se utilizó un tratamiento control de clamidosporas puras sin zeolita. Los productos obtenidos se empaquetaron en bolsas de polipropileno de baja densidad, herméticas y cubiertas con nylon para protegerlos de la luz. Se evaluaron diferentes condiciones, según combinaciones de sellaje al vacío o en presencia de oxígeno, almacenando el producto a temperatura controlada (25°C) o en refrigeración (4ºC) (Tabla 1).
En este diseño factorial completo, se realizaron dos réplicas por tratamiento. Las evaluaciones se efectuaron cada 15 días hasta los 45 días. Se midió: el porcentaje de humedad, con el uso de balanza infrarroja, la concentración de hongo viable (UFC.g-1) mediante el conteo del número de colonias a partir de la dilución de 1g de producto y siembra en placas de Agar Papa y Dextrosa (PDA) (PDA, BioCen: 39 g.L-1), las cuales se incubaron a 25ºC durante 5 días. El porcentaje de germinación de clamidosporas se evaluó a las 48 horas en Agar Agua con Antibiótico (AAA) (agar bacteriológico, BioCen: 15 g.L-1; cloranfenicol, clortetraciclina y sulfato de estreptomicina: 50 mg.L-1 de cada uno) (4).
El tratamiento que logró mayor estabilidad en la concentración de hongo viable (UFC.g-1) se seleccionó mediante la comparación de los momentos de evaluación, según la prueba no paramétrica de Friedman. Se empleó un análisis de componentes principales para determinar cuáles de los factores (proporción de zeolita, temperatura o presencia de aire atmosférico en el sellado) ejerció mayor influencia sobre la germinación. Finalmente, se construyó la superficie respuesta mediante regresión cuadrática, lo que permitió calcular el punto de máxima germinación de P. chlamydosporia, a partir del cual se podrá construir un diseño para la validación de los resultados.
La concentración de hongo viable (UFC.g-1) se mantuvo estable en los tratamientos con polvo de clamidosporas puras a 4°C sellando las bolsas en presencia o no de oxígeno (Tratamientos 1 y 2). Al introducir la zeolita como relleno a diferentes proporciones, la estabilidad fue variable; sin embargo, tratamientos con un relleno del 80% a 4°C resultaron estables (Tratamientos 9 y 10). Con otras combinaciones como: relleno de zeolita al 80 % a 25°C; relleno de zeolita al 90 % a 4°C sellando las bolsas con aire atmosférico (Tratamientos 12 y 14) también se obtuvieron buenos resultados. Los restantes tratamientos no mantuvieron la estabilidad (Tabla 2).
Para todos los tratamientos los porcentajes de humedad se mantuvieron en un nivel adecuado (por debajo del 10%) (10), lo que indicó que la zeolita contribuyó al secado de las esporas, manteniendo el contenido de humedad en un intervalo que se considera apropiado para la conservación del producto (4).
A través del análisis de componentes principales se pudo determinar que los tres factores son importantes para explicar las variaciones en la germinación del hongo (correlación cofenética 0,98); pero, la temperatura y la proporción de zeolita están correlacionadas de forma negativa con la germinación y la concentración de P. chlamydosporia explicando el 48% de las variaciones que se producen en cuanto a la viabilidad del producto final (Tabla 3).
La función matemática que relacionó la germinación de las clamidosporas con la proporción de zeolita y la temperatura, resultó ser una ecuación cuadrática con un máximo (Figura), lo que sugiere que los mejores resultados se obtendrán utilizando entre 30 y 40% de zeolita para el relleno y almacenando el producto a 15°C. Se estimó que la viabilidad de P. chlamydosporia declinará rápidamente a temperaturas superiores a los 25°C, lo cual coincide con otros estudios del efecto de las condiciones de anaquel sobre la viabilidad de P. chlamydosporia (8).
Para el estudio de validación, se recomienda probar valores de proporción de relleno de zeolita y temperatura de almacenamiento cercanos a 30% y 15°C, respectivamente; siguiendo para la selección de los puntos un diseño compuesto central 10+2x2+2; el cual es recomendado para optimizar procesos (12).
REFERENCIAS
1. Espinel C, Torres L, Grijalba E, Villamizar L, Cotes A. Preformulados para control de la mosca blanca Bemisia tabaci (Hemiptera: Aleyrodidae) en condiciones de laboratorio. Rev Colomb Entomol. 2008;34(1):22-27.
2. Hernández MA, Hidalgo-Díaz L. KlamiC®: Bionematicida agrícola producido a partir del hongo Pochonia chlamydosporia var. catenulata. Rev Protección Veg. 2008;23(2):131-134.
3. Registro Central de Plaguicidas, Ministerio de la Agricultura. Lista Oficial de Plaguicidas Autorizados en la República de Cuba. p. 325, 2010.
4. Montes de Oca N, Arévalo J, Núñez A, Riverón Y, Villoch A, Hidalgo-Díaz L. KlamiC: Experiencia Técnica-Productiva. Rev Protección Veg. 2009;24(1):62-65.
5. Elzein A, Kroschel J, Muller-Stover D. Optimization of storage conditions for adequate shelf-life of «Pesta» formulation of Fusarium oxysporum «Foxy 2», a Potential mycoherbicide for Striga: Effects of temperature, granule size and water activity. Biocontrol Sci Techn. 2004;14:545-559.
6. Guijarro B, Melgarejo P, De Cal A. Effect of stabilizers on the shelf-life of Penicillium frequentans conidia and their efficacy a biological agent against Peach Brown Rot. Int J Food Microbiol. 2007;103:117-124.
7. Teshler M, Ash G, Zolotarov Y, Watson A. Increased shelf-life of a bioherbicide through combining modified atmosphere packaging and low temperatures. Biocontrol Sci Techn. 2007;17:387-400.
8. Duan W, Yang E, Xiang M, Liu X. Effect of storage conditions on the survival of two potential biocontrol agents of nematodes, the fungi Paecilomyces lilacinus and Pochonia chlamydosporia. Biocontrol Sci Techn. 2008;18(6):613-620.
9. Faria M, Hotchkiss J, Hajek A, Wraight S. Debilitation in conidia of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae and implication with respect to viability determinations and mycopesticide quality assessments. J Invertebr Pathol. 2010;105(1):74-83.
10.Wraight S, Jackson M, Kock S. Production, stabilization and formulation of fungal biocontrol agents. Fungal Biocontrol Agents: Progress, Problems and Potential. CAB International, Wallingford, UK; 2001. p. 253-287.
11.Liu C, Chen Q, Tang B, Ruan H, He G. Response surface methodology for optimizing the fermentation medium of alpha-galactosidase in solid-state fermentation. Lett Appl Microbiol. 2007;45(2):206-212.
12.López E, Arteaga H, Castro P, Nolasco I, Siche R. El Método de Superficie Respuesta y la Programación Lineal en el desarrollo de un néctar mixto de alta aceptabilidad y mínimo costo. Scientia Agropecuaria. 2012;3(4):309-318.
Recibido: 10-5-2013.
Aceptado: 12-9-2013.