INTRODUCCIÓN
El garbanzo (Cicer arietinum L.) se considera una de las fuentes de alimentación más importantes en el mundo, tanto para humanos como animales, por su alto valor nutricional. En la actualidad se producen 14,2 millones de toneladas de garbanzo a nivel mundial, distribuidas en una superficie de 14,8 millones de hectáreas (1).
En Cuba, es un cultivo relativamente de nueva introducción, con bajos rendimientos por área, por lo que fue necesario para satisfacer el consumo interno realizar importaciones provenientes, mayoritariamente, de México, Canadá y España (2).
Los rendimientos del cultivo son afectados por diversas causas, entre estas las enfermedades juegan un papel relevante. En este sentido, la fusariosis es la de mayor significación debido a su amplia distribución a nivel mundial y severidad, con síntomas de pudrición de la raíz y marchitez vascular (3). Esta provoca pérdidas, tanto en el rendimiento del cultivo como económicas (4). Las pérdidas en la producción están alrededor del 10 % de las cosechas (5).
La causa de la Fusariosis en el garbanzo se debe a distintas especies del género Fusarium [ Fusarium oxysporum Schlechtend.: Fr. f. sp. ciceri (Padwik) Matuo & K. Sato, Fusarium solani (Martius) Appel & Wollenweber, Snyder & Hansen y Fusarium redolens Wollenweber] (6). En Cuba, la identificación de las especies de este hongo se relacionó con la marchitez ascendente causada por F. oxysporum y, la descendente, por F. solani (7). El manejo de la enfermedad es difícil y en su ejecución se involucran diferentes tácticas, incluyendo el control químico. No obstante, su manejo no es satisfactorio y continúa la búsqueda de nuevos elementos que pudieran ayudar a limitar el desarrollo de esta enfermedad. Las mejores medidas de control son preventivas, ya que no existe un control curativo que sea efectivo y económicamente rentable (8). En concordancia con esto, se investigan cepas de Trichoderma spp. promisorias como alternativa para incorporar en el programa de manejo integrado de la enfermedad (9), debido a los mecanismos de acción de este agente de control biológico (competencia por sustrato o espacio, antibiosis y el micoparasitismo), que se desencadenan ante la presencia de un fitopatógeno (10). Además, las cepas de este hongo pueden poseer otros mecanismos de acción indirectos que participan en la inducción de resistencia y el aumento de la tolerancia de la planta ante diferentes estreses (9).
El laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA) dispone de un grupo de cepas de T. asperellum, identificadas y caracterizadas morfofisiológica, patogénica y molecularmente. Estas cepas resultaron promisorias por su acción biocontroladora frente a agentes causales de enfermedades en arroz, tomate, melón, frijol y soya (11,12,13,14).
El objetivo del presente trabajo fue seleccionar cepas de T. asperellum in vitro, promisorias para el control de Fusarium spp. patógenas de garbanzo.
MATERIALES Y MÉTODOS
El trabajo se realizó en el laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA) (Latitud 22,991867 y Longitud -82,153892), municipio San José de las Lajas, provincia Mayabeque, Cuba.
Antagonismo de las cepas de T. asperellum frente a los aislados de Fusarium
El efecto antagónico de 13 cepas de T. asperellum (Ta.1, Ta.3, Ta.12, Ta.13, Ta.17, Ta.25, Ta.28, Ta.56, Ta.75, Ta.78, Ta.79, Ta.85, Ta.90) se evaluó por el método de Cultivo Dual (CD) frente a dos aislamientos de F. o. f. sp. ciceri (F-50 y F-51) y un aislamiento de Fusarium nygamai Burgess & Trimboli, seleccionados por su agresividad en garbanzo (2,15), pertenecientes al Laboratorio de Micología Vegetal del CENSA.
Los diferentes mecanismos de acción: competencia por espacio, micoparasitismo y antibiosis, se determinaron mediante cultivo dual CD, según lo descrito por Martínez y Solano (16).
Las condiciones de conservación de los cultivos de los hongos fueron: cepas de Trichoderma en medio de cultivo Agar Malta, incubadas a una temperatura de 28ºC±2°C y oscuridad; y los aislamientos de Fusarium en Papa Dextrosa Agar (PDA), mantenidos a temperatura de 25°C±2°C y oscuridad. Los cultivos de las cepas de T. asperellum y los aislados de Fusarium spp. para la realización del CD tenían tres y siete días de edad, respectivamente. Los discos (cinco mm de Ø) de ambos hongos, para establecer el CD, se tomaron de la periferia de las colonias.
Competencia por espacio
Se sembraron, diametralmente opuestos, discos de las cepas de T. asperellum y de los aislados de Fusarium a cinco mm del borde de la placa Petri (9 cm de Ø), contentiva de 15 ml de PDA (BIOCEN), incubadas a 25°C±2°C y oscuridad, condiciones requeridas para el crecimiento del patógeno. Se realizaron tres réplicas por cepa de T. asperellum y se incluyó un control de cada aislamiento de Fusarium, sembrado en la misma posición que en el CD, pero sin el antagonista.
Las evaluaciones se hicieron a las 24, 48, 72 y 96 horas, midiendo el crecimiento micelial lineal de ambos hongos con una regla graduada, hasta que uno de los dos completara el área de la placa. La capacidad antagónica se valoró mediante una escala de grados (17). Además, se evaluó el Porcentaje de Inhibición del Crecimiento Radial (PICR) a las 96 h, con el empleo de la fórmula:
Micoparasitismo
Del sitio de contacto entre los dos hongos se tomaron tres muestras por tratamiento (cepas de T. asperellum) a las 144 h, se depositaron sobre un portaobjeto con lactofenol-azul de algodón y se observaron al microscopio óptico (Zeiss), con aumento de 400x, para detectar el tipo de interacción hifal (penetración, granulación, vacuolización, lisis y/o enrollamiento), según Chet et al. (18). Se definió la sensibilidad de los aislados de Fusarium al parasitismo de las cepas de T. asperellum mediante el calculó del porcentaje de parasitismo según la fórmula:
Antibiosis
Se midió el crecimiento micelial lineal de los aislamientos de Fusarium con una regla graduada a las 72 h. Se halló la diferencia del crecimiento de este hongo en el control, menos el crecimiento del mismo en el cultivo dual con T. asperellum. Para determinar las cepas con mayor efecto inhibitorio del crecimiento de los aislamientos del patógeno se realizó un análisis de varianza y se compararon las medias por la prueba de la menor diferencia significativa (LSD Fisher). Además, se calculó la varianza entre las réplicas de cada tratamiento para determinar las cepas con mayor estabilidad. Se seleccionaron como promisorias las cepas de mayor eficacia y estabilidad frente a los aislamientos de Fusarium spp.
Efecto de los metabolitos volátiles de T. asperellum en la inhibición del crecimiento de los aislados de Fusarium spp.
Para la evaluación de los metabolitos volátiles se desarrolló el método de suspensión (13). En una misma placa Petri de 7 cm de diámetro contentiva de 15 mL de PDA, se sembró en la tapa de la placa el fitopatógeno y en la base de la misma el antagonista. Las placas se sellaron con doble capa de parafilm y, además, se incluyó un control del patógeno sin el antagonista. Todos los tratamientos se incubaron a una temperatura de 25°C±2°C y oscuridad, incluyendo el control. Las evaluaciones se realizaron cada 24 h hasta que uno de los hongos completara el área de la placa.
A partir de los datos obtenidos, se calculó el Porcentaje de Inhibición del Crecimiento Radial (PICR) en los aislados del patógeno, con la aplicación de la fórmula (I) descrita anteriormente. Los tratamientos con valores negativos se descartaron, ya que, desde el punto de vista biológico, no tienen perspectiva como agentes de control biológico. Para determinar la eficacia de los tratamientos se realizó un análisis de varianza con los datos de aquellos que tuvieron valores positivos; las medias se compararon por la prueba de la menor diferencia significativa (LSD Fisher). Además, se calculó la varianza de los tratamientos para determinar las cepas de mayor estabilidad. A partir de estos resultados se seleccionaron las cepas de mayor eficacia y estabilidad para el control de los aislamientos de Fusarium spp.
Efecto de metabolitos no volátiles en los filtrados de cultivos de T. asperellum sobre el crecimiento de los aislados de Fusarium spp.
Para la preparación del medio Caldo de Papa Dextrosa (CPD) se tomaron porciones de papa (200 g) de aproximadamente 1 cm, las cuales se hirvieron en agua destilada durante una hora. Posteriormente, al filtrado se le adicionó Dextrosa (20 g) y se agitó hasta disolverla completamente en el medio. Se esterilizó a 121ºC por 15 min.
Se inocularon tres discos de 0,6 cm de diámetro de cada cepa de Trichoderma, de manera independiente en Erlenmeyers de cristal de 100 ml con 20 ml de medio líquido CPD, ajustado a pH 5,5 e incubados a 28°C±2°C por cinco días estáticamente y en oscuridad. Para cada cepa se realizaron tres réplicas.
Los filtrados de cada tratamiento se obtuvieron asépticamente con el uso de filtros miliporos (Sartorius) de 0,2 (m. Se embebieron por separado discos de micelio (0,6 cm de diámetro) de un cultivo puro de siete días del patógeno en los filtrados del antagonista, durante cinco min. Seguidamente, se sembró un disco por placa Petri (7 cm de diámetro), sobre medio de cultivo PDA, y se incubaron a 25°C±2°C y oscuridad. Se realizaron tres réplicas por tratamiento. Se incluyó un control de cada uno de los aislamientos de Fusarium embebido en medio CPD estéril, sembrado e incubado de igual forma que los tratamientos descritos anteriormente. La inhibición del crecimiento del patógeno se evaluó hasta las 90 horas.
Los datos obtenidos en el ensayo se procesaron siguiendo la metodología descrita en el acápite anterior.
Se realizó un análisis integral de los resultados por las cepas de T. asperellum para cada mecanismo de acción y, los de estabilidad, frente a los aislamientos de Fusarium.
RESULTADOS Y DISCUSIÓN
Antagonismo de las cepas de T. asperellum frente a los aislados de Fusarium
Las trece cepas de Trichoderma evaluadas mostraron alta capacidad antagónica sobre los dos aislamientos de F. o. f. sp. ciceri y el de F. nygamai de garbanzo.
Competencia por espacio
Las cepas de T. asperellum evaluadas manifestaron un crecimiento más rápido que los aislamientos del patógeno, cubriendo completamente la colonia del patógeno a las 96 h, por lo que las mismas se ubicaron en la clase 1 de la escala de Bell et al. (17). Además, T. asperellum esporuló sobre la colonia del patógeno afectando su textura y esporulación (Fig. 1), lo que contribuyó a frenar el crecimiento de los aislados de Fusarium spp. Resultados similares obtuvieron diferentes autores (19,20,21), que ubicaron cepas de Trichoderma spp. en la clase 1, al presentar mayor velocidad de crecimiento y colonizar mayor espacio en el CD que los aislados de Fusarium spp.
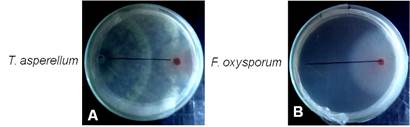
FIGURA 1 A.- Cultivo dual de T. asperellum (Ta.13) - F. o. f. sp. ciceri (F-50) y B.-Control de F. o. f. sp. ciceri (F-50) a las 96 h / Dual culture of T. asperellum (Ta.13) - F. o. f. sp. ciceri (F-50) and B.-control of F. o. f. sp. ciceri (F-50) at 96 h
El PICR (Fig. 2) ratificó el análisis cualitativo obtenido por la escala de Bell et al. (17), donde la mayoría de las cepas de Trichoderma inhibieron el crecimiento de los aislamientos de Fusarium spp. en más de 40 %, respecto a sus controles.
Las cepas del antagonista frente a F. nygamai y F. o. f. sp. ciceri (F-50) no mostraron diferencias estadísticas. No obstante, frente a F. nygamai se destacaron, con mayor porcentaje de inhibición, la cepa Ta.1 (53 %), y frente a (F-50) las cepas Ta.1, Ta.13 y Ta.78 (todas con 48 % de inhibición). Frente a F. o. f. sp. ciceri (F-51) (Fig. 2) sobresalieron las cepas Ta.56 y Ta.78 con una inhibición de 54 y 53 %, respectivamente, pero sin diferencias con el resto de las cepas, a excepción de la Ta.85. Todas las cepas de Trichoderma probadas, excepto esta última, mostraron alta capacidad competitiva por espacio frente a los aislados de Fusarium.
Estos resultados están en el intervalo (44-52 %) obtenido por Sanmartín-Negredo et al. (22) con cuatro aislados de T. asperellum frente a Fusarium sp. en CD.
Los resultados del presente trabajo se pueden considerar aceptables según los criterios de Mis-Mut et al. (21), que estiman como admisibles 40 % de inhibición del crecimiento radial de Fusarium moniliforme J. Sheld. y 35 % para F. oxysporum, al enfrentarlos a aislados de Trichoderma spp. La velocidad de crecimiento de Trichoderma es un elemento importante en su competencia por el espacio con otros hongos, ya que limita o detiene completamente el desarrollo del patógeno, al colonizar, con mayor rapidez, la zona de la rizosfera. (23)
No obstante, la inhibición del crecimiento de Fusarium spp., por las especies del género Trichoderma, no solo se debe a la alta velocidad de crecimiento del antagonista, sino a la acción de metabolitos, volátiles y no volátiles, algunos de los cuales inhiben el crecimiento de microorganismos, aun sin haber contacto físico entre ellos (24).
Micoparasitismo
Las observaciones microscópicas de los fragmentos de micelios de la zona de contacto entre Trichoderma y el patógeno en CD evidenciaron que la mayoría de las cepas de Trichoderma presentaron micoparasitismo, con dos o más tipos de interacción hifal, con predominio de vacuolización y granulación del contenido citoplasmático en las hifas del fitopatógeno (Fig. 3), seguido por la penetración y la lisis (Fig. 4) (Tabla 1).

FIGURA 3 Granulación y vacuolización del citoplasma de hifas de F-50 por acción de la cepa Ta. 25 de T. asperellum / Cytoplasmic granulation and vacuolization of F-50 hypha by action of T. asperellum (Ta.25 vs F-50)

FIGURA 4 Hifas de T. asperellum (Ta.25) penetrando y causando lisis en hifas de F. o. f. sp. ciceri (F-50) / Hyphae of T. asperellum (Ta.25) penetrating and causing lysis in hyphae of F. o. f. sp. ciceri (F-50)
TABLA 1 Tipos de interacciones hifales entre cepas de T. asperellum y aislamientos de Fusarium spp. procedentes de garbanzo / Types of hyphal interactions between strains of T. asperellum and Fusarium spp. isolates from chickpea
| Cepas de |
|||
|---|---|---|---|
|
|
G | V, G, P | V, G, P |
|
|
E, V, G, P | V, G, P, L | V, G |
|
|
E, V, G, P, L | G, P | V, G |
|
|
V, G | V, G, P | G |
|
|
V | G, P | V, G |
|
|
E, V, G, P | V, G, P | V, G |
|
|
V, G | V, G | V, G |
|
|
V, G | V, L | V, G, P |
|
|
V, G | V, G | V, G |
|
|
V, P | G, P, L | V, G, L |
|
|
V, G, P | V, P | V, G |
|
|
V, G, P | V, G | V, G |
|
|
V, G | V, G, P, L | V, G |
Leyenda: V - Vacuolización G - Granulación L - Lisis E - Enrollamiento P - Penetración
Las cepas mostraron diferencias en su actividad parasítica. No se observó una cepa de T. asperellum que sobresaliera por sus interacciones hifales frente a los tres aislados de Fusarium spp. No obstante, la cepa Ta.12 tuvo el mayor número (cinco) de interacciones hifales frente a F. nygamai, seguida de Ta.3 y Ta.25. La mayor cantidad de interacciones hifales con F. o. f. sp. ciceri (F-50) se ocasionó por las cepas Ta.3 y Ta.90; mientras que sobre F. o. f. sp. ciceri (F-51) se destacaron Ta.1, Ta.78 y Ta.56 con tres cada una. De acuerdo con Harman (25) y Howell (26), la penetración de las hifas del antagonista en las del patógeno se considera la culminación del parasitismo, entonces se puede inferir que, aún cuando el aislado F-51 de F. o. f. sp. ciceri se afectó con alto porcentaje de vacuolización y granulación, es el menos sensible a la penetración de las hifas de T. asperellum, con15,38 % de hifas de las cepas de T. asperellum detectadas en su organismo (Tabla 2), por lo que se debe tener en cuenta en las evaluaciones futuras de parasitismo.
TABLA 2 Porcentajes de interacciones hifales entre las cepas de T. asperellum y los aislamientos de Fusarium spp. de garbanzo en CD / Percentages of hyphal interactions between T. asperellum strains and Fusarium spp. isolates of chickpea in CD
| Interacciones hifales | |||
|---|---|---|---|
| Vacuolización | 92,31 | 76,92 | 92,31 |
| Granulación | 84,62 | 84,62 | 100 |
| Enrollamiento | 23,08 | 0 | 0 |
| Lisis | 7,69 | 30,77 | 7,69 |
| Penetración | 46,15 | 69,23 | 15,38 |
En estas interacciones hubo penetración de las hifas de T. asperellum en las del fitopatógeno, al igual que detectaron Bernal et al. (27) e Infante et al. (20), en evaluaciones de interacciones hifales de aislamientos de Trichoderma spp. sobre diferentes especies de Fusarium, patógenos de varios cultivos, al observar penetración en las hifas de estos últimos. Durman et al. (28) y Howell (26) informaron para Trichoderma estos tipos de interacciones micoparasíticas y las consideran de gran importancia para la selección de biorreguladores altamente promisorios, sobre todo para el control de hongos patógenos cuyo hábitat sea el suelo.
Al hacer un análisis integral de los resultados de micoparsitismo, se observa que no existe una cepa de Trichoderma de las evaluadas que tenga penetración de sus hifas en los tres aislados de Fusarium spp. No obstante, se destacaron frente a los aislamientos F-11 y F-50, las cepas Ta.3, Ta.12, Ta.25, Ta.78 y Ta.79, y frente a F -51, la cepa Ta.1, que también tiene efecto sobre F-50.
Antibiosis
Alrededor de las 72 horas, previo al contacto físico entre los agentes fitopatógenos y la cepa del antagonista, se observó un efecto inhibitorio del crecimiento de los primeros, con respecto al control, en la mayoría de los tratamientos en el CD.
La acción metabólica de la cepa Ta.78 mostró el mayor efecto inhibitorio frente a F. nygamai (Fig. 5-A1), aunque solo tuvo diferencias significativas con Ta.13, Ta.17 y Ta.85. La consistencia de los resultados de las cepas, expresada mediante el análisis de las varianzas (Fig. 5-A2), arrojó que la cepa más estable fue Ta.17, difiriendo estadísticamente del resto que no se diferenciaron entre sí.
Los metabolitos de la cepa Ta.79 resultaron ser los más efectivos en la inhibición del crecimiento del aislado de Fusarium F-50 (Fig. 5-B1), no mostraron diferencias significativas con los de las cepas Ta.1, Ta.13, Ta.25, Ta.28, Ta.56, Ta. 75 y Ta.78, pero sí con los de las restantes. La cepa más estable en los resultados fue igualmente Ta.79, presentando diferencias significativas con el resto. (Fig. 5-B2)
Los metabolitos de la cepa Ta.13 ejercieron la mayor inhibición del crecimiento del aislado de Fusarium F-51, pero solo con diferencias significativas con los de las cepas Ta.3, Ta.12, Ta.25, Ta.56 y Ta.85 (Fig. 5-C1). La cepa con mayor estabilidad en el efecto inhibitorio del crecimiento fue Ta.28 (Fig. 5-C2) con diferencias estadísticas con el resto, que no difiere entre sí.
El análisis integral de la acción metabólica de las cepas de Trichoderma en CD demostró que las cepas que causaron mayor inhibición del crecimiento micelial lineal frente a los tres aislados de Fusarium spp. fueron Ta.1, Ta.28, Ta.78 y Ta.79.
Efecto de metabolitos volátiles de T. asperellum en la inhibición del crecimiento micelial de los aislados de Fusarium spp.
Los metabolitos volátiles, secretados por las cepas de T. asperellum evaluadas, manifestaron efecto variable sobre el crecimiento de los aislados de Fusarium. Hubo metabolitos de algunas cepas que no inhibieron el crecimiento micelial del fitopatógeno, por lo que se descartaron, ya que estos no tienen perspectivas de uso desde el punto de vista de control biológico.
Los metabolitos volátiles de las cepas Ta.56 y Ta.85 presentaron los mayores efectos inhibitorios sobre el crecimiento de F. nygamai, los cuales difirieron estadísticamente del resto (Fig. 6-A); los más estables fueron los de la primera cepa. (Fig. 6-A1)
Los mayores valores de inhibición del crecimiento micelial lineal de F. o. f. sp. ciceri (F-50) los ocasionaron los metabolitos volátiles de las cepas Ta.1, Ta.28, Ta.75 y Ta.90 sin diferencias estadísticas significativas entre ellos, pero sí con los de las restantes cepas (Figura 6-B). Los metabolitos de las dos primeras cepas se comportaron como los más estables, aunque no tuvieron diferencias con los de la Ta. 90 (Fig. 6-B1).
La cepa Ta.12 secretó los metabolitos volátiles que provocaron la mayor inhibición del crecimiento del aislado de F. o. f. sp. ciceri (F-51), sin diferencias significativas con los de las cepas Ta.1, Ta.3, Ta.28, Ta.78 y Ta.79, y sí con los de las restantes (Fig. 6-C). De estas, los metabolitos de la Ta.28 fueron los más estables. (Fig. 6-C1)
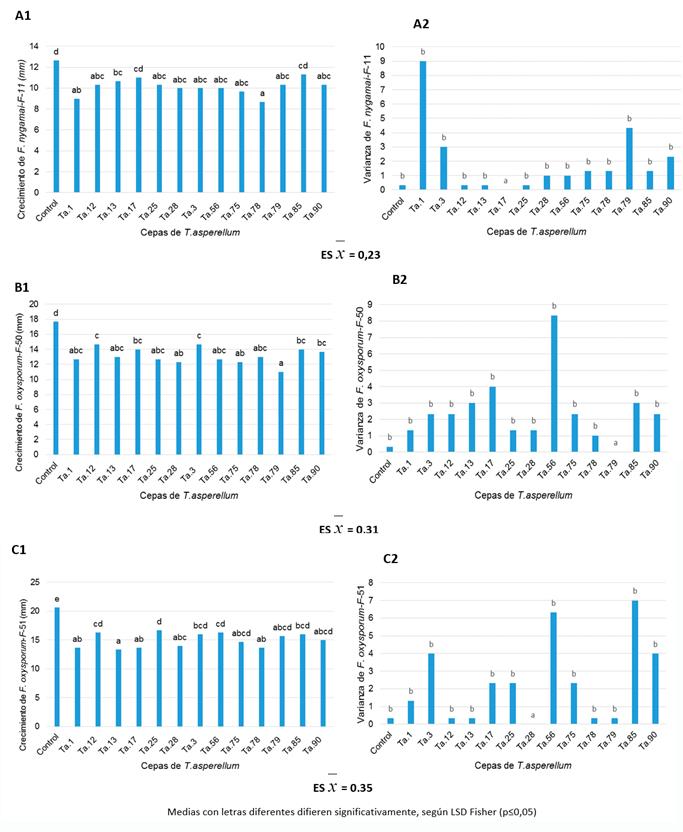
FIGURA 5 Crecimiento radial de Fusarium spp. (A1, B1, C1) y varianza de las réplicas del crecimiento de los aislados del patógeno (A2, B2, C2) en CD a las 72 horas [A1, A2: aislado F. nygamai (F-11), B1, B2: F. o. f. sp. ciceri (F-50), C1, C2: F. o. f. sp. ciceri (F-51)] / Radial growth of Fusarium spp. (A1, B1, C1) and growth replica variance of the pathogen isolates (A2, B2, C2) in CD at 72 h [A1, A2: isolate F. nygamai (F-11), B1, B2: F. o. f. sp. ciceri (F-50), C1, C2: F. o. f. sp. ciceri (F-51)].
Los resultados para F. o. f. sp. ciceri (F-50) y (F-51) se asemejan con los de Corallo (29), quien obtuvo una inhibición entre 1,3 y 20,6 % del crecimiento de F. nygamai frente a Trichoderma spp. con el uso del mismo método.
El análisis integral de los resultados de los metabolitos con mayor inhibición del crecimiento de los aislados de Fusarium spp., y las varianzas del crecimiento de estos (Fig. 6), mostraron que los metabolitos de la cepa Ta.56 fueron los que causaron mayor inhibición del crecimiento de F. nygamai, para el de F-50 los de la cepa Ta.1, y para el de F-51 los de la cepa Ta.28.
No hay una única cepa de Trichoderma que secrete metabolitos que puedan inhibir el crecimiento de los tres aislados de Fusarium. Al tener en cuenta el análisis de estabilidad de las cepas, se observa que los metabolitos de la cepa Ta.56 fueron los únicos que mantuvieron una inhibición estable del crecimiento del aislado F-11, mientras que, para F-50 y F-51, los más promisorios fueron los de la cepa Ta.28.
Efecto de metabolitos no volátiles en los filtrados de cultivos de T. asperellum sobre el crecimiento de los aislados de Fusarium spp.
Los filtrados de Trichoderma no tuvieron un efecto inhibitorio similar sobre todos los aislados de Fusarium de garbanzo. Al igual que, para el análisis del efecto de los metabolitos volátiles de T. asperellum sobre el crecimiento de los aislados de Fusarium spp., se eliminaron los valores negativos por la razón planteada anteriormente.
Los metabolitos de las cepas Ta.17, Ta.75 y Ta.79 causaron la mayor inhibición del crecimiento micelial de F. nygamai (F-11), difiriendo significativamente de los del resto de las cepas; los de la cepa Ta.79 mostraron la mayor inhibición del crecimiento micelial de F. o. f. sp. ciceri (F-50), y con los mayores porcentajes de inhibición sobre F. o. f. sp. ciceri (F-51) sobresalieron los de las cepas Ta.1, Ta.12, Ta.13, Ta.17, Ta.75 y Ta.79, difiriendo de los de Ta.90. (Fig. 7)
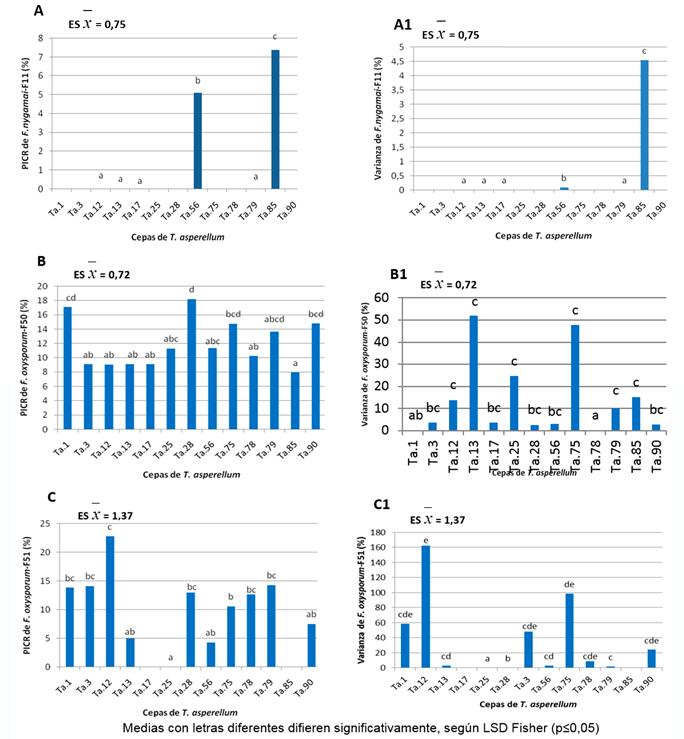
FIGURA 6 Efecto de los metabolitos volátiles de T. asperellum sobre el crecimiento de los aislados de Fusarium spp. (A, B, C) y varianza de las réplicas del crecimiento de los aislados del patógeno bajo tal efecto (A1, B1, C1), a las 48 horas [A, A1: aislado F. nygamai (F-11), B, B1: F. o. f. sp. ciceri (F-50), C, C1: F. o. f. sp. ciceri (F-51)] / Effect of T. asperellum volatile metabolites on growth of the Fusarium spp. isolates (A, B, C) and growth replica variance of the pathogen isolates under this effect (A1, B1, C1), at 48 h [A, A1: isolate F. nygamai (F-11), B, B1: F. o. f. sp. ciceri (F-50), C, C1: F. o. f. sp. ciceri (F-51)]

FIGURA 7 Efecto de los metabolitos no volátiles de filtrados de cultivos de T. asperellum en la inhibición del crecimiento de los aislados de Fusarium spp. a las 90 h / Effect of the non-volatile metabolites of filtrates of T. asperellum cultures on growth inhibition of Fusarium spp. isolates at 90 h.
Según los resultados obtenidos, el aislado F. o. f. sp. ciceri (F-50) fue el menos sensible a la acción de los metabolitos no volátiles de las cepas del antagonista (Fig. 7).
El análisis del efecto de estos metabolitos sobre los tres aislamientos de Fusarium spp. demostró que la cepa Ta.79 de T. asperellum mostró los mejores atributos para el control del patógeno. Al analizar la estabilidad de las mejores cepas por la acción de los metabolitos no volátiles, se determinó que las cepas Ta.17, Ta.75 y Ta.79 frente a F. nygamai (F-11), y Ta.12, Ta.17 y Ta.79 frente a F. o. f. sp. ciceri (F-51) mostraron similar estabilidad, respectivamente. (Fig. 8)
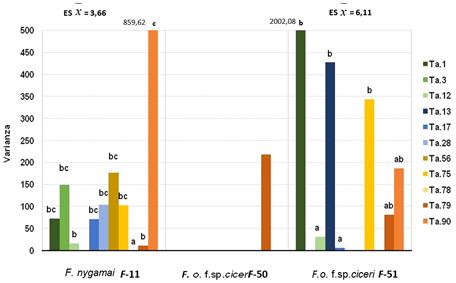
FIGURA 8 Varianza de las réplicas del efecto de los metabolitos no volátiles de T. asperellum sobre el crecimiento de los aislados de Fusarium spp. a las 90 h / Replica variance of the effect of T. asperellum non-volatile metabolites on growth of the Fusarium spp. isolates at 90 h.
Al integrar todos los resultados de los modos de acción de las cepas de T. asperellum frente a los aislados de Fusarium spp., se determinó a la cepa Ta.79 como la más promisoria por su parasitismo, antibiosis y acción de los metabolitos no volátiles frente a estos patógenos. Sin embargo, respecto al parasitismo sobre F. o. f. sp. ciceri (F-51), se destacó la Ta.1, mientras que en la inhibición del crecimiento de este y el de F. o. f. sp. ciceri (F-50) por metabolitos volátiles, sobresalieron Ta.1 y Ta.28, y en la de F. nygamai (F-11) Ta.56.
Según el estado del arte, no se dispone de literatura que avalen estos resultados relacionados con el efecto metabólico de T. asperellum sobre el crecimiento de Fusarium spp. de garbanzo. Estos constituyen un aporte al conocimiento del efecto metabólico de cepas de T. asperellum como inhibidoras del crecimiento de aislados de F. nygamai y F. oxysporum f. sp. ciceri patógenos en garbanzo.
Desde el punto de vista práctico, se podría evaluar en condiciones de campo una formulación de un producto donde se mezclen las cepas Ta.79 y Ta.1, a fin de tener mayor control y menor posibilidad de crear o inducir la aparición de formas resistentes en las especies de Fusarium evaluadas.















