Introducción
La leptospirosis es una zoonosis de gran impacto en la salud animal y en la salud pública; produce gran morbilidad y mortalidad en el mundo, principalmente en regiones de climas tropicales. Es un género de bacterias del orden de los espiroquetales, es un término amplio, aplicado a la infección causada por diversas serovariedades de Leptospira (L), antigénicamente diferentes y morfológicamente iguales, que afecta principalmente a animales tanto de vida libre como domésticos, constituyendo estas fuentes de infección para el hombre, siendo una zoonosis, de amplia distribución mundial. Históricamente se ha considerado como la zoonosis de mayor repercusión internacional y que mayores daños ha provocado desde el punto de vista social y económico.1
Dicha enfermedad es producida por una espiroqueta del género Leptospira, el cual incluye al menos 21 especies agrupadas en tres grupos: patógenas, no patógenas e intermedias basadas en su filogenia 16S ARNr.2
Esta zoonosis afecta a las más diversas especies animales de sangre caliente y fría y, por ende, al hombre y la mujer en cualquier etapa de su vida. La mujer embarazada corre un doble riesgo infectándose ella y también al producto concebido pues las leptospiras atraviesan la membrana placentaria. Esto daría lugar a graves trastornos en el desarrollo embrionario, siendo el riñón uno de los órganos más afectados.3
Las leptospiras colonizan, preferentemente, el riñón, debido a la gran cantidad de lípidos (ácidos grasos) que poseen estos órganos y, en menor frecuencia, colonizan el pulmón y el pericardio. El sitio anatómico de predilección son los túbulos renales proximales, donde pueden permanecer hasta 4 semanas después de una infección aguda en humanos y, de forma intermitente, por años, en animales.4
En la fase inmune aparecen los anticuerpos IgM. La leptospirosis ictérica o síndrome de Weil se caracteriza por daño en hígado, riñón y disfunción vascular, ocurre en 5 %-10 % de los casos y, de esos, son fatales alrededor de 20 %-40 %. Han sido reportados en la literatura casos de leptospirosis en la preñez y en el feto en que generalmente los fetos han sido abortados o han muerto en útero, también otros han nacido saludables.5
El feto puede estar en riesgo aun en caso de que la madre esté asintomática, especialmente en el primer y segundo trimestre ya que la inmunidad adaptativa del feto no funciona. El feto comienza a producir ciertos niveles de IgM durante el tercer trimestre pero aun así puede haber una placenta isquémica que puede causar su muerte por lo que se recomienda un monitoreo del embarazo.6
Los efectos de la leptospirosis sobre la madre y el producto de la concepción no están descritos con precisión, aunque sí se plantea que más del 90 % de las gestantes sintomáticas padecen la enfermedad de forma leve o moderada.6,7
El cuadro renal es predominante en la leptospirosis y hasta hace poco tiempo la causa principal de la mortalidad. Se ha observado la presencia de leptospiras en los riñones fetales, las anomalías de la función renal pueden ser profundas y desproporcionadas con respecto a los cambios histológicos observados en el riñón. El comprometimiento renal puede manifestarse en una amplia gama de grados que incluye desde simples alteraciones del sedimento urinario hasta cuadros gravísimos de insuficiencia renal aguda. Este último compromiso representa la principal causa de óbito.
La insuficiencia renal es primariamente el resultado del daño tisular y es habitual encontrar leptospiras en la luz tubular. Las alteraciones inflamatorias en el riñón pueden observarse en los estadios más tardíos del desenvolvimiento de la lesión renal. Las lesiones renales parecen iniciarse dentro de los glomérulos durante la migración de las leptospiras, luego surgen las alteraciones túbulo intersticiales causadas también por la migración de dentro de los capilares peritubulares para el intersticio y túbulos, responsabilizándose por el compromiso renal que puede variar de simple disminución de la función glomerular hasta insuficiencia renal. Por los daños que causa la leptospira a nivel renal consideramos que el estudio en fetos de ratas infestados por Leptospira canicola es de gran importancia ya que escasos reportes se han centrado en los cambios morfológicos atribuibles a la leptospirosis.6,7
Tiene una amplia distribución geográfica por el gran espectro de hospederos y reservorios mamíferos que mantienen la bacteria en sus riñones debido a que esta infecta y coloniza los túbulos proximales renales. Estos animales excretan en su orina de manera continua y muchas veces de forma crónica la espiroqueta al medio ambiente aumentando las probabilidades de infección de otros hospederos susceptibles.8
Globalmente se presentan entre 1 030 000 casos nuevos y 58 900 muertes al año aproximadamente. La incidencia de leptospirosis en América se ha estimado en 12,5 casos por 100.000 habitantes; según estudios poblaciones cada año se presentan más de 350 000 casos nuevos de leptospirosis, sin embargo, se notifican menos de los que en realidad ocurren. En los Estados Unidos de Norteamérica se identifican cada año entre 100 y 200 casos de esta enfermedad.5
Es una zoonosis potencialmente mortal, que predomina en regiones tropicales. Es endémica en Oceanía, Asia y América del Sur, pero en los últimos años ha aumentado el número de casos en Europa, América del Norte y África, considerándose una enfermedad mundialmente reemergente. Las tasas de leptospirosis humana varían según la región, desde 0,5 por cada 100 000 habitantes. En Europa se encuentra en 95 por cada 100.000 habitantes en África.9
En la Región de las Américas, la tasa anual de morbilidad fluctúa entre un mínimo de 3,9 casos por cada 100 000 habitantes, con mayor incidencia en el Sur de América Latina y un máximo de 50,7 casos en el Caribe.10
La leptospirosis es una enfermedad endémico-epidémica en Cuba. Desde 1980 se han reportado centenares de casos confirmados. Actualmente esta enfermedad ocupa el sexto lugar entre las enfermedades de declaración obligatoria. En contraste con su baja tasa de morbilidad, la enfermedad implica una alta probabilidad de muerte. En la actualidad esta afección clasifica entre las 35 primeras causas de muerte en nuestro país y en el 2013 causó más muertes que la tuberculosis.11
En dicha isla esta enfermedad constituye un problema de salud y cada vez cobra mayor importancia, esto ha sido demostrado por muchos trabajos publicados en el país de autores que han investigado desde el Oriente hasta el Occidente del mismo, haciendo estudios serológicos, bacteriológicos, clínicos y epidemiológicos y que son referidos por estos autores que mencionamos aquí. Por lo que el Programa Nacional de Prevención y Control de la Leptospirosis Humana guía las acciones a realizar en los diferentes niveles de salud.12
En los últimos años las tasas de incidencia han disminuido, sin embargo, de acuerdo con la literatura consultada y partiendo de las condiciones subtropicales de Cuba se favorece mucho la existencia de fuentes permanentes de infección para estos microorganismos, por cuanto posee condiciones muy semejantes a las de otros países de América y el Caribe.12
En la provincia de Pinar del Río, se ha notado una tendencia descendente de la morbilidad y mortalidad de la leptospirosis en los últimos años, sin embargo, la prevalencia de factores de riesgo que vulneran a la población, teniendo en cuenta las condiciones climatológicas, epidemiológicas y medioambientales hace que no se logren resultados estables en la disminución de la tasa de incidencia.13) Debido a esto la Universidad de Ciencias Médicas de Pinar del Río ha sido un centro donde se han realizado importantes investigaciones en relación al tema y en sus diferentes aristas que van desde el diagnóstico precoz, patogenia, estudios serológicos y experimentales en diferentes serovariedades. Algunos investigadores han estudiado a profundidad por más de una década tanto la enfermedad como el germen que da lugar a la misma.12
La leptospirosis una enfermedad reemergente, por todo lo anterior se decide realizar esta investigación con el objetivo de identificar las principales alteraciones morfométricas renales en fetos de ratas Wistar infectadas con serovariedad Leptospira canicola, en la Universidad de Ciencias Médicas de Pinar del Rio en el período comprendido entre 2017-2019.
Método
Se realizó un estudio experimental, en la Universidad de Ciencias Médicas de Pinar del Río, en el periodo comprendido entre 2017-2019 en ratas Wistar. El estudio fue conducido y se rigió por lo establecido en la Guía de Buenas Prácticas para el cuidado, uso y reproducción de los Animales para la Experimentación del CENPALAB.
Se escogió la rata pues es una especie aceptada para el estudio planteado por la factibilidad de su manejo, número de fetos, factibilidad económica de tenencia y manutención; además, presenta corto tiempo de gestación y estabilidad genética. Se utilizó la raza Wistar por su factibilidad al momento de la investigación.
Todas las hembras fueron alojadas en grupos de 3 en 6 cajas las que serían infestadas y un grupo control sano y los machos a razón de 2 por caja. Antes del apareamiento los machos fueron ubicados individualmente. Posterior al apareamiento, las hembras presuntamente preñadas, se alojaron a razón de 1 por caja hasta el final del estudio. Las cajas eran plásticas con tapa de rejilla (INPUD) y se ubicaron en estantes.
Se mantuvieron con encamado de bagazo de caña desmeollado esterilizado en autoclave (POT 01.01.05.003) en la Dirección de Animales Gnotobióticos.
Se les suministró dieta comercial granulada esterilizable EAO: 1004 (Cenpalab, AlyCo®) para roedores, con Certificado de Calidad, que se suministró a libertad durante el estudio. El agua se esterilizó (POT 05.01.06.021) y fue suministrada a libertad, en frascos de 250 y 500 ml.
Para el estudio se utilizaron 21 hembras, en dos oportunidades, que fueron seleccionadas y distribuidas aleatoriamente según el POT 05.01.03.002 en 6 grupos experimentales empleando el programa Labtools, administrándosele la serovariedad de leptospira.
Los machos fueron utilizados en el estudio como sementales solamente por lo que no fueron distribuidos en grupos experimentales, ni recibieron la administración de las sustancias a evaluar.
Durante cada periodo del estudio (antes del apareamiento, hembras alojadas en grupos de 1 por caja), estas fueron identificadas por grupos mediante tarjetas donde se registró la identificación del animal, el código, tipo y grupo de ensayo, especie, línea, sexo, edad, fecha de comienzo (día 0) y fecha de probable del parto (día 21).
Posterior al apareamiento fueron cambiadas las tarjetas por otras que reflejaron igualmente todos los datos de los animales y del estudio, pero incluyeron fecha del día 14 y 20 de la preñez. La sustancia de los ensayos fueron inóculos de una concentración bacteriana de 300 millones de leptospiras por ml, se inoculó 1 ml a cada animal por vía intraperitoneal (IP).
El apareamiento se realizó en 3 etapas.
Realización de exudado vaginal para determinar la fase del ciclo estral.
Este procedimiento se realizó una vez que la rata hembra ya se encontraba identificada; se cargó la pipeta con 100 ml de solución salina 0,9 %; se insertó la punta 1 o 2 mm dentro de la vagina y se descargó y cargó suavemente la solución salina. Se depositó el contenido celular en un portaobjeto limpio marcado con el número del animal. Posteriormente se pasó a identificar la fase del ciclo estral en que se encontraba.
La caracterización de cada fase estuvo basada en la proporción entre los 3 tipos de células observadas en el exudado vaginal: células epiteliales (redondeadas y nucleadas), células cornificadas (irregulares y anucleadas) y leucocitos (redondos y pequeños).
Si la rata se encontraba en proestro o estro se pasó a la etapa de apareamiento. Si se encontraba en metaestro se esperó 3 días para el apareamiento, si se encontraba en diestro se esperó 2 días.
Apareamiento propiamente dicho.
Se puso la rata hembra en una caja grande, se colocó en la misma un puñado de viruta del encamado con olor del macho que se utilizó, varias horas antes del apareamiento (preferiblemente en la mañana). Después de las 4:00 p.m. se colocó el macho seleccionado en la caja donde estaba la hembra. Al día siguiente, antes de 8:30 a.m., se sacó el macho y se regresó a su caja y se comprobó el apareamiento (pasado este tiempo se corre el riesgo de falsos negativos).
Realización de exudado vaginal comprobatorio del apareamiento.
Se realizó el mismo procedimiento que en la etapa 1. Para la recolección de muestra de contenido vaginal se utilizó una punta limpia para cada hembra para prevenir infecciones vaginales o trasladar espermatozoides de una rata a otra. Si había presencia de un tapón vaginal se anotó la hembra como preñada. Si no se halló tapón, se depositó el contenido celular en un portaobjeto limpio con el número del animal. Se examinó el portaobjeto bajo el microscopio con aumento de 10x10 para detectar la presencia de espermatozoides. Si hubo espermatozoides presentes se consideró la hembra como preñada, si no los hubo se consideró como no apareada.
De no haber ocurrido el apareo según la citología vaginal se determinó en qué fase del ciclo estral se encontraba para planificarlo nuevamente.
Las hembras con exudado vaginal comprobatorio positivo (+) fueron pesadas. Se anotó el peso y la fecha como día cero de la gestación y se calculó la fecha probable de parto. (Se pusieron todos estos datos en la tarjeta de identificación del animal).
Las hembras fueron pesadas en días alternos para comprobar el aumento de peso y confirmar la gestación (la ganancia de peso los primeros 10 días debe ser de más de 40 g aproximadamente).
De cada grupo de estudio fueron sacrificados todos los embriones y fetos, de cada embrión se estudió el riñón, se midió el peso y su morfometría
Para el sacrificio de los animales los mismos fueron narcotizados con éter dietílico, posteriormente desangrados por incisión de la vena femoral y, finalmente, se aplicó la dislocación cervical.
Los datos obtenidos se procesaron con la utilización de técnicas estadísticas descriptiva realizando el resumen de las variables cualitativas mediante frecuencias absolutas, relativas porcentual.
Se calculó la media y la mediana, así como la desviación estándar y se aplicaron las pruebas estadísticas U Mann Whitney para comparar variables cuantitativas y la prueba de Spearman para relacionarlas donde fue posible.
El ensayo fue conducido y se rigió por lo establecido en la Guía de Buenas Prácticas para el cuidado, uso y reproducción de los Animales para la Experimentación según las normas del CENPALAB, así como la realización de la eutanasia en animales de experimentación.10
Resultados
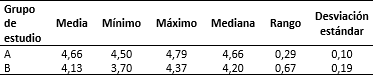
Se observó que el eje mayor del riñón fetal fue superior a la del grupo experimental (Tabla 1).
Se observó en el grupo experimental infestado por L. canicola una menor concentración de las mediciones renales (Figura 1), lo cual demostró que en este grupo las longitudes en los ejes fueron menores.
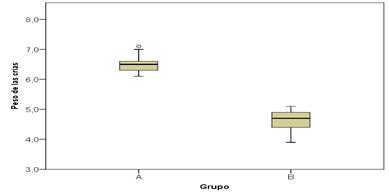
Se observó la diferencia existente del peso corporal de las crías en el grupo control y en el experimental infestado por L. canicola en el que fue menor este parámetro, según muestra la figura 2.
Existió una relación significativa entre el peso corporal y el peso renal de los fetos con una P=0,00 y R=0,92 para un 95 % de certeza. El valor de R fue próximo a 1 por lo que la relación fue directa y fuerte, demostrándose que a menor peso corporal menor peso renal.
Discusión
En la presente investigación se analizaron los riñones de los fetos infectados con L. canicola en la etapa prenatal y se detectó que la infección provocó disminución del tamaño de este órgano.
La información publicada sobre el efecto de la leptospirosis en cuanto a la morfometría en riñones fetales es limitada, no se encontró en la literatura abundante referencia de artículos o de investigaciones experimentales, especialmente en este modelo animal; no obstante en investigaciones revisadas se plantea que el desarrollo fetal se caracteriza por patrones secuenciales de crecimiento, maduración orgánica y tisular, determinado por el medio materno, la función uteroplacentaria y el potencial de crecimiento genético inherente al feto. Cuando las circunstancias son óptimas ninguno de estos factores tienen un efecto limitante sobre la velocidad del crecimiento y el desarrollo fetal.6
Monzón Tamargo13 en su estudio sobre Morfometría en corazón y pulmón en ratas Wistar infestadas por la L. canicola durante la gestación, demostró una disminución significativa en las dimensiones de estos órganos ante la infección por la espiroqueta.
L. icterohaemorrhagiae se asocia a una lesión primaria en hígado, en tanto que L. canicola produce frecuentemente una lesión renal.1
La leptospirosis es causante de ictericia neonatal, la infección es transmitida trasplacentariamente con leptospirosis intrauterina que puede causar placentitis o placenta isquémica, con hemorragias, cuadro hepatorrenal y puede terminar en la muerte, si el feto nace puede presentar desarrollo anormal.14
Por lo cual la predilección de la leptospira por los túbulos contorneados proximales y la presencia de la misma en etapa embrionaria puede afectar la formación del riñón definitivo, pues para ello es necesaria la inducción entre la yema ureteral y el blastema metanéfrico para formar la nefrona, unidad estructural y funcional del riñón.15
Con respecto a esto existen evidencias en animales que sugieren que el feto se adapta a un ambiente intrauterino adverso enlenteciendo su metabolismo y crecimiento a través de un proceso conocido como “programación intrauterina”. Esta estrategia adaptativa aparentemente incrementa la supervivencia a corto plazo, pero tiene consecuencias adversas para la salud a largo plazo.13
Belizan, et al.16 plantean en estudios realizados en Argentina que los principales trastornos y afecciones que causan un crecimiento intrauterino retardado son las alteraciones placentarias, enfermedades renales, cardiopatías, enfermedad hipertensiva, diabetes mellitus grave, entre otros; con el conocimiento de que las leptospiras tienen predilección por los riñones y afectan el desarrollo normal de los mismos, puede ser causa de la disminución de su peso debido a la infección por leptospiras relacionando esta con la disminución del peso corporal.
En el reporte de un caso de infección materna por L. canicola en el primer trimestre del embarazo, aún recibiendo tratamiento el feto se infecta y aparece la muerte en el periodo neonatal, al pasar desapercibida esta posible etiología.17
Conclusiones
Se concluye que la infección por Leptospira canicola en ratas Wistar preñadas provoca alteraciones en los riñones de los fetos lo que causa cambios en la morfometría de los ejes tanto mayor como menor, así como en el peso corporal del feto, lo que conlleva a una disminución del peso renal.