Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.20 n.1 Ciudad de la Habana ene.-abr. 2009
ARTÍCULOS ORIGINALES
Heterogeneidad de los trastornos metabólicos de las etapas iniciales de la diabetes mellitus 2
Metabolic disorders and its diversity during early stages of type 2 diabetes mellitus
Roberto M. González SuárezI; Pedro Perich AmadorII; Celeste Arranz CalzadoIII
IEspecialista de II Grado en Bioquímica Clínica. Investigador Titular. Laboratorio de Diabetes. Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIEspecialista de II Grado en Endocrinología. INEN. La Habana, Cuba.
IIILicenciada en Bioquímica. Máster en Ciencias Biológicas. Investigadora Auxiliar. INEN. La Habana, Cuba.
RESUMEN
ANTECEDENTES: la prediabetes ha sido definida como una situación de riesgo de padecer diabetes mellitus, que precede a la aparición de las formas clínicas de la enfermedad y es causada por trastornos de la secreción de insulina y de la sensibilidad a la insulina.
OBJETIVO: establecer el perfil de trastornos metabólicos de un grupo de sujetos en la etapa subclínica de la diabetes mellitus para identificar subpoblaciones susceptibles a intervenciones específicas.
MÉTODOS: se utilizó la información obtenida sobre el estado de la tolerancia a la glucosa, de la sensibilidad a la insulina y de la secreción de insulina en el estudio inicial de un grupo de 40 participantes en una investigación prospectiva, a los que, 2 años después, se les diagnosticó una diabetes manifiesta.
RESULTADOS: los sujetos con diabetes mellitus inicial presentaban un amplio rango de trastornos de la tolerancia a la glucosa (tolerancia a la glucosa normal, 22 %; tolerancia a la glucosa alterada, 35 %; y tolerancia a la glucosa alterada + glucemia en ayunas alterada, 43 %). El 95 % de los obesos y el 50 % de los no obesos presentaban resistencia a la insulina, mientras que se encontró una disminución de la secreción de insulina en el 50 % de los sujetos de ambos grupos. No se encontró asociación entre el grado de deterioro de la tolerancia a la glucosa y los trastornos metabólicos estudiados.
CONCLUSIONES: los sujetos en las etapas iniciales de la diabetes constituyen una población heterogénea con distintos grados de deterioro del metabolismo energético, por lo que las intervenciones para prevenir la diabetes en estas personas requieren un diagnóstico y tratamiento personalizado.
Palabras clave: Diabetes mellitus no insulinodependiente, prediabetes, intolerancia a la glucosa, prueba de tolerancia a la glucosa, resistencia a la insulina, secreción de insulina disminuida.
ABSTRACT
BACKGROUNDS: the prediabetes has been defined as a risk situation related with the presence of future diabetes, preceding appearance of clinical ways of the disease, and it is provoked by disorders from insulin secretion and the sensitivity to insulin.
OBJECTIVE: to establish a metabolic disorders profile from a group of subjects in the diabetes mellitus subclinical stage to identify subpopulations sensitive to specific interventions.
METHODS: we used the information gathered on glucose tolerance stage, on insulin-sensitivity, and on insulin secretion in an initial study of 40 patients participating in a prospective research, which two years later were diagnosed with manifest diabetes.
RESULTS: subjects with initial diabetes mellitus had a wide range of disorders related to a glucose tolerance (tolerance to normal glucose (22 %), tolerance to altered glucose (35 %), and tolerance to altered glucose + altered fast glycemia (43 %). The 95 % of the obese subjects and the 50% of the non-obese ones had a insulin resistance, whereas there was a decrease of insulin secretion in 50 % of subjects of both groups. There as not a association between deterioration level of tolerance to glucose and study metabolic disorders.
CONCLUSIONS: subjects in early stages of diabetes are a heterogeneous population with different levels of energy metabolism deterioration, where interventions to prevent diabetes in these persons need a diagnosis and personalized treatment.
Key words: Non-insulin-dependent diabetes mellitus, prediabetes, intolerance to glucose, glucose-tolerance test, resistance to glucose, decrease insulin secretion.
INTRODUCCIÓN
La prevención de la diabetes mellitus tipo 2 (DM 2) durante las etapas iniciales de su evolución constituye el proceder fundamental para enfrentar la creciente epidemia de diabetes que sufre toda la humanidad.1 Se considera que para poder establecer estrategias efectivas de prevención de la DM 2 es necesario determinar cuáles son los cambios metabólicos que determinan el deterioro de la tolerancia a la glucosa (TG) durante el proceso de instalación de la enfermedad, para poder seleccionar entonces las intervenciones adecuadas para interrumpir la progresión hacia la diabetes manifiesta.2,3 En las revisiones sistemáticas de ensayos clínicos de prevención de la DM publicadas recientemente,4-6 se encuentra que en la mayoría de los estudios identificados, el criterio de selección de los participantes solo fue presentar una tolerancia a la glucosa alterada (TGA) sin tener en cuenta ningún otro trastorno de la regulación del metabolismo energético, independientemente de la amplitud y profundidad del estudio clínico y metabólico que se les realizaba. La intervención empleada consistió fundamentalmente en medidas para mejorar la sensibilidad a la insulina, sin tener en cuenta si había criterios para establecer que la persona presentaba resistencia a la insulina, y la medida de resultado evaluada fue el diagnóstico de DM, sin analizar tampoco si la respuesta favorable o desfavorable de la TG estaba relacionada con cambios específicos de algún trastorno metabólico particular.
Esta estrategia asume que la población en riesgo de evolucionar hacia la diabetes es homogénea, y que un solo tipo de intervención puede ser efectiva en todas las personas. No obstante, los resultados de estos estudios muestran que, a pesar de que en una parte de los participantes se puede interrumpir o demorar la progresión del deterioro de la TG, cerca de la mitad, en dependencia del estudio, desarrollaron la enfermedad durante el período examinado, por lo que es concebible que la respuesta a la intervención de los respondedores y de los no respondedores no era uniforme, y que existen diversos mecanismos involucrados en el desarrollo de la diabetes, algunos de los cuales no son susceptibles a las intervenciones ensayadas. En ese caso, para que una intervención para prevenir la DM sea efectiva, debería comenzar por caracterizar previamente las particularidades del trastorno metabólico de los participantes, para identificar subgrupos de personas en riesgo y diseñar intervenciones específicas para cada población.7,8
En este estudio se examinaron los trastornos metabólicos de un grupo de personas en las etapas iniciales de la DM para determinar si presentaban un patrón metabólico característico que pudiera ser tratado con una intervención estándar, o si existen subgrupos de personas que requieran medidas particulares para poder intervenir en su trayectoria individual de progresión hacia la diabetes.
MÉTODOS
Población estudiada: para asegurar que la población de estudio cumpliera el requisito de encontrarse en una etapa subclínica de progresión hacia la diabetes, los datos se obtuvieron del estudio inicial de un grupo de 40 participantes en una investigación prospectiva de personas en riesgo de diabetes que presentaron DM 2 en el estudio evolutivo 2 años después. Todos los sujetos habían sido remitidos al Centro de Atención al Diabético del INEN, como personas en riesgo de diabetes para su diagnóstico y atención inicial, por tener antecedentes o sospecha de presentar trastornos de la TG. Después del estudio inicial, a los que no fueron diagnosticados como diabéticos, se les recomendaron las medidas preventivas e higiénico dietéticas habituales, y fueron citados para exámenes periódicos. Se consideró que los participantes que presentaron DM en un estudio evolutivo a los 2 años (mediana, 27 meses, IC del 90 %, 22 a 42 meses) se encontraban en la etapa de "prediabetes" o "diabetes inicial" cuando se realizó el primer estudio.
Estudio metabólico y métodos analíticos: en el estudio inicial y en el evolutivo se examinaron los cambios de la glicemia y de la insulinemia durante una prueba de tolerancia a la glucosa oral PTG(o). La prueba se realizó después de 12 h en ayunas, para lo cual se les administraron 75 g de glucosa en un volumen de 200 mL de agua por vía oral. Se obtuvieron muestras de sangre para las determinaciones analíticas antes de la administración del estímulo, y a los 30, 60, 120 y 180 min después de la administración. Se determinó la concentración de glucosa e insulina en cada muestra con los métodos de glucosa-oxidasa y radioinmunoanálisis en uso en el INEN.9,10 Los participantes fueron clasificados como de peso normal, sobrepeso u obesidad de acuerdo con el índice de masa corporal (IMC);11 si era menor de 25, entre 25 y 29, y de 30 o más respectivamente.
Parámetros metabólicos examinados y criterios diagnósticos:
1. TG a partir de los valores de glicemia en ayunas, a las 2 h, y el área bajo la curva (ABC) total de glucosa como parámetro integrador de los cambios de la glicemia durante toda la PTG, calculada por integración trapezoidal.12 Para el diagnóstico de la DM se utilizaron los criterios de la OMS.13
2. Secreción de insulina en ayunas, a los 30, 120 min y durante toda la PTG con el uso de los indicadores siguientes:
- Insulinemia en ayunas (I0) en pmol/L.
- Índice insulinogénico inicial (II0-30), calculado como el cociente del incremento de la insulinemia a los 30 min con relación al valor en ayunas de acuerdo con el incremento de la glicemia en el mismo período.14
- Índice insulinogénico a las 3 h (II0-180), calculado como el cociente del incremento del ABC de insulinemia entre 0 y 180 min con relación al valor en ayunas y el incremento del ABC de la glicemia en el mismo período.12
- Secreción de insulina total durante la prueba (ATI), calculada como el ABC entre 0 y 180 min de la prueba.12
3. Sensibilidad a la insulina determinada con los índices:
- Índice de resistencia a la insulina del modelo homeostático (RI HOMA), calculado a partir de los valores iniciales de glucosa e insulina siguiendo el modelo propuesto por Matthews y otros,15 de acuerdo con la fórmula RI=(insulina x glucosa)/22,5. La insulinemia expresada en microunidades por mililitro, y la glicemia en milimoles/L.
- Índice de Belfiore16 en ayunas y a las 2 y 3 h (Bel 0-2 h, Bel 0-3 h), calculado como: (BELt)=(2/[I/In x G/Gn] -1). Donde I/In y G/Gn representan el valor inicial, el área entre 0, 2 ó 3 h, según corresponda, de los valores de insulina o la glucosa durante la PTG, divididos por un valor de referencia calculado de la misma manera en una población considerada como normal.
Procesamiento e interpretación de los datos: los valores de las determinaciones de insulina, tanto en ayunas como durante las pruebas de estimulación, presentaron una distribución asimétrica. En este estudio se ha preferido el empleo de la mediana, y el rango entre los percentiles 5 y 95, en lugar de la media y la desviación estándar, para la presentación de los resultados. Igualmente, se emplearon métodos no paramétricos para los análisis estadísticos de las variables relacionadas con la insulinemia. La comparación de poblaciones se realizó por el método de Mann Whitney.17
Entre los múltiples indicadores de la sensibilidad y secreción de insulina propuestos en la literatura,18,19 se escogió un grupo que cubriera todo el período de la PTG, desde la situación en ayunas hasta los resultados globales de la prueba, y que en estudios previos mostraron mayor valor pronóstico de evolución hacia la diabetes,12,20 para poder evaluar los trastornos de la respuesta secretora inicial y total, así como los trastornos de la sensibilidad hepática y muscular a la insulina, que se expresan en distintos momentos de la PTG.21,22 Los puntos de corte para el diagnóstico se basaron en criterios de interpretación de los indicadores de secreción y sensibilidad a la insulina presentados previamente,12,20 y estimados a partir de los resultados obtenidos en un grupo de referencia de sujetos de peso normal y no diabéticos. Se consideró que tenían resistencia a la insulina los sujetos con valores del índice RI HOMA mayor de 3,2; y baja respuesta insulínica, aquellos con el índice insulinogénico inicial (II0-30) menor de 82.
RESULTADOS
La población estudiada estaba compuesta por 29 mujeres y 11 hombres, con edades comprendidas entre los 22 y 75 años (media de la edad, 53,4 años y DE 11,1). El 77,5 % presentaba sobrepeso u obesidad (IMC media, 30,8; DE 6,0); en el estudio inicial 9 participantes (22 %) presentaban glicemia en ayunas, mientras que a las 2 h durante la PTG dentro del rango normal (TGN), 14 (35 %) presentaban TGA y en los restantes 17 (43 %) se encontraba alterada la glicemia en ayunas y a las 2 h (TGA+GAA).
Todos los participantes presentaban alguno de los trastornos metabólicos explorados: resistencia a la insulina en 10 sujetos (25 %), disminución de la secreción de insulina en 16 (40 %) o ambos trastornos en 14 (35 %).
Las tablas 1 y 2 presentan la frecuencia de estos trastornos en la población estudiada clasificada de acuerdo con el peso corporal. Se encontró resistencia a la insulina en 21 de los 22 obesos (95 %) y en 9 de los 18 no obesos (50 %), y en ambos grupos el 50 % de los sujetos presentaba una baja respuesta insulínica (9/18 de los no obesos y 11/22 de los obesos). La frecuencia de personas con tolerancia a la glucosa normal fue superior en los no obesos (28 %) que en los obesos (18 %), pero esta diferencia no fue estadísticamente significativa.

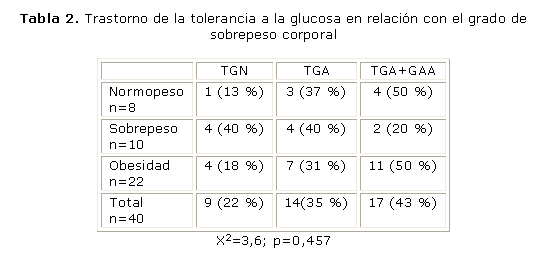
La tabla 3 presenta la frecuencia de resistencia a la insulina y de baja respuesta insulínica en la población clasificada de acuerdo con el estado de la tolerancia a la glucosa. No se encontró asociación, evaluada con la prueba de chi cuadrado, de alguno de los trastornos, en la comparación de los 3 grupos o de los grupos con y sin glicemia en ayunas alterada, o con y sin trastornos de la glicemia a las 2 h.
En la tabla 4 se presentan los valores de indicadores de la secreción de insulina y de la sensibilidad a la insulina que cubren todo el período de la PTG, en busca de algún trastorno específico en algún momento posterior al de los indicadores empleados en las tablas anteriores. Tampoco se encontró ningún patrón metabólico específico asociado al estado de la TG.
DISCUSIÓN
Nuestros resultados muestran que en la población estudiada se pueden identificar sujetos con diversas combinaciones de los trastornos metabólicos examinados, y con distinto grado de deterioro de cada uno. Aunque el subgrupo de obesos presentaba casi en su totalidad resistencia a la insulina, también en ellos la respuesta insulínica inicial era heterogénea y presentaba la misma variabilidad que la del grupo no obeso.
En estudios previos de nuestro grupo se ha podido identificar la existencia de una gran diversidad de la secreción de insulina durante la PTG en pacientes con DM 2 manifiesta, con un deterioro similar de la TG, que iba desde una notable disminución de la respuesta inicial y total, hasta patrones francamente hiperinsulinémicos.23,24 Actualmente se reconoce la heterogeneidad clínica y metabólica de la DM 2 manifiesta,25 y en sus etapas iniciales.26,27
Es notable el hecho de que cerca del 25 % de los participantes (9/40) no presentaba en el momento del estudio ningún trastorno de la tolerancia a la glucosa, y menos de la mitad (17/40) de este grupo no presentaba trastornos de la glicemia en ayunas, a pesar de que se encontraban en las etapas iniciales de la DM, y de que habían presentado en algún momento anterior alguna alteración de la TG, lo que no coincide con la definición actual de "prediabetes",28,29 basada en los trastornos de la TG. Este hallazgo se puede interpretar como que los trastornos de la TG en esta etapa de la evolución de la DM son inconstantes, fluctuantes o reversibles, lo que ha sido documentado recientemente en un estudio con adolescentes obesos con TGA, que mostraron una notable inconsistencia de los trastornos de la tolerancia a la glucosa en 4 estudios sucesivos realizados en un período de 4 años,30 o porque la metodología para su diagnóstico es poco precisa.
Se ha planteado que cada uno de los trastornos de la TG, la GAA y la TGA responden a un trastorno particular de la sensibilidad a la insulina,3,22,31 aunque otros autores32 no han encontrado esta relación. En este grupo particular de sujetos que evolucionaron hacia la DM en un período de 2 años no se pudo demostrar ningún tipo de asociación entre el grado y tipo de trastorno de la TG y un patrón definido de trastorno de la secreción de insulina, o de resistencia a la insulina, lo que no excluye que en la población general de sujetos en las etapas iniciales de la DM ocurra esta asociación.
Se conoce que en la progresión hacia la DM 2 ocurren paralelamente cambios de la TG, de la sensibilidad a la insulina, modificaciones de los patrones de secreción de esta hormona ante los cambios de los niveles de la glucosa en el plasma, y fenómenos aterogénicos y trombogénicos que dependen de estos trastornos,33-35 pero no se ha identificado claramente la secuencia de eventos que llevan a la hiperglicemia, ni los factores que desencadenan estos procesos.8 La interrupción de la progresión hacia la diabetes implica caracterizar, directa o indirectamente, la presencia y magnitud de los trastornos que dan lugar a la disregulación de la glicemia y que se pretenden corregir, y evaluar el efecto de las medidas empleadas sobre su evolución. Nuestro estudio, a pesar de que solo ha evaluado 3 aspectos del cuadro metabólico de la prediabetes, ilustra la complejidad y heterogeneidad del problema, y que la determinación de la glicemia en ayunas o durante una PTG no basta para caracterizarlo.
Los resultados de este estudio sugieren que las intervenciones para la prevención de la DM no deben dirigirse solo a las personas con hiperglicemia en ayunas o posprandial, y que la heterogeneidad del cuadro clínico y metabólico de esta etapa obliga a explorar ampliamente la constelación de manifestaciones clínicas y metabólicas de cada sujeto. De ahí que sea necesario contar con instrumentos clínicos y de laboratorio, simples, accesibles, y con utilidad diagnóstica probada, que permitan explorar la mayor cantidad posible de los factores implicados en la patogenia de la DM, para poder entonces ampliar la búsqueda de personas en riesgo y personalizar el diagnóstico y la terapéutica, de acuerdo con las particularidades de cada sujeto.
Por otra parte, la manifiesta heterogeneidad metabólica de las etapas iniciales de la DM plantea la interrogante de cuál sería en cada caso la trayectoria hacia la hiperglicemia y la evolución de las comorbilidades cardiovasculares que caracterizan la DM, por lo que en estudios subsiguientes se evaluará con más detalles los factores de riesgo cardiovascular asociados a la presencia de estos trastornos de la homeostasis de la glucosa, y la trayectoria de los trastornos metabólicos durante la progresión hacia la diabetes.
Los trastornos metabólicos de la población de personas que se encuentran en las etapas iniciales de la evolución de la DM 2 son heterogéneos, con distintos tipos y grados de deterioro del metabolismo energético, por lo que las intervenciones para prevenir la diabetes en este grupo requieren un diagnóstico y tratamiento personalizado.
REFERENCIAS BIBLIOGRÁFICAS
1. Zimmet P, Alberti G. The metabolic syndrome: progress towards one definition for an epidemic of our time. Nature clinical practice: endocrinology & metabolism. 2008;4:239.
2. Chiasson JL, Rabasa-Lhoret R. Prevention of Type 2 Diabetes Insulin Resistance and Beta Cell Function. Diabetes. 2004;53(Suppl. 3):S34-8.
3. Nathan DM, Davidson MB, Defronzo RA, Heine RJ, Henry RR, Pratley R, et al. Impaired Fasting Glucose and Impaired Glucose Tolerance Implications for Care. Diabetes Care. 2007;30:753-9.
4. Crandall JP, Knowler WC, Kahn SE, Marrero D, Florez JC, Bray GA, et al. The Prevention of Type 2 Diabetes. Diabetes Prevention Program Research Group, Nature Clinical Practice. Endocrinology and Metabolism. 2008;4:382-93.
5. Gillies CL, Abrams KR, Lambert PC, Cooper NJ, Sutton AJ, Hsu RT, et al. Pharmacological and lifestyle interventions to prevent or delay type 2 diabetes in people with impaired glucose tolerance: systematic review and meta-analysis. BMJ. 2007;334:299-308.
6. Yates T, Khunti K, Bull F, Gorely T,Davies MJ. The role of physical activity in the management of impaired glucose tolerance: a systematic review. Diabetologia. 2007;50:1116-26.
7. Nagi DK, Knowler WC, Charles MA, Liu QZ, Hanson RL, McCance DR, et al. Early and late insulin response as predictors of NIDDM in Pima Indians with impaired glucose tolerance. Diabetologia. 1995;38:187-92.
8. Festa A, Williams K, D'Agostino R, Wagenknecht LE, Haffner SM. The natural course of Beta Cell function in nondiabetic and diabetic individuals in the Insulin Resistance Atherosclerosis Study (IRAS). The Insulin Resistance Atherosclerosis Study Diabetes. 2006;55:1114_20.
9. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxigen acceptor. Clin Biochem. 1996;24:7.
10. Arranz C, González R. Utilización de un método para la separación de la hormona libre y unida en el radioinmunoensayo de insulina. Rev Cubana Invest Biomed. 1988;7(3):150-6.
11. Benuke AR. New concepts in heigt relationships in obesity. Cap.3. Philadelphia: Ed. ML Wilson; 1972.
12. González Suárez RM, Arranz Calzado MC, Perich Amador P. Trastornos de la sensibilidad a la insulina y de la tolerancia a la glucosa en la diabetes inicial. Rev Cub Endocrinol. 2000;11(2):69-77.
13. The expert committee on the diagnosis and classification of diabetes mellitus: report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care. 1997;20:1183-97.
14. Matsumoto K, Yamaguchi Y, Miyake S, Akasawa S, Yano M, Tominaga Y, et al. Glucose tolerance, insulin secretion, and insulin sensitivity in nonobese and obese subjects. Diabetes Care. 1997;20:1562-8.
15. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-9.
16. Belfiore F, Iannello S, Volpicelli G Insulin sensitivity indices calculated from basal and OGTT-induced insulin, glucose, and FFA levels. Mol Genet Metab. 1998;63:134-41.
17. Armitage P. Statistical methods in medical research. Oxford: Blackwell Scientific Pub. 1972:112.
18. Hanley AJG, Williams K, Gonzalez C, D'Agostino RB, Wagenknecht LE, Stern MP, et al. Prediction of Type 2 Diabetes. Using Simple Measures of Insulin Resistance. Combined Results From the San Antonio Heart Study, the Mexico City Diabetes Study, and the Insulin Resistance Atherosclerosis Study. Diabetes. 2003;52:463-9.
19. Trout KK, Homko C, Tkacs NC. Methods of Measuring Insulin Sensitivity. Biol Res Nurs. 2007;8:305.
20. González-Suárez RM, Arranz C. Evaluación de la secreción de insulina y la sensibilidad a la insulina por medio de la prueba de tolerancia a la glucosa por vía oral. Estudio en sujetos con tolerancia a la glucosa normal. Rev Cubana Endocrinol. 2000;11:23-30.
21. M Abdul-Ghani, Williams K, Defronzo RA, Stern M. What is the best predictor of future type 2 diabetes? Diabetes Care. 2007;30:1544-8.
22. Meyer C, Pimenta W, HJ Woerle, Van Haeften T, Szoke E, Mitrakou A. Different mechanisms for impaired fasting glucose and impaired postprandial glucose tolerance in humans. Diabetes Care. 2006;29:1909-14.
23. González-Suárez RM, Perich P, Rodríguez B, Claro A. Características de la secreción de insulina en pacientes con tolerancia a la glucosa alterada y diabetes mellitus no insulinodependiente. Actual Endocrinol. 1982;6:25-30.
24. González-Suárez RM. Alteraciones del metabolismo en la diabetes mellitus no insulinodependiente. Rev Cubana Med. 1982;22:15-7.
25. Birkeland KI, Kilhovd B, Thorsby P, Torjesen PA, Ganss R, Vaaler S, et al. Heterogeneity of non-insulin-dependent diabetes expressed as variability in insulin sensitivity, b-cell function and cardiovascular risk profile. Diabet Med. 2003;20:37-45.
26. Kasuga M. Insulin resistance and pancreatic Beta cell failure. The Journal of Clinical Investigation. 2006;116(7):1756-60.
27. Shaham O, Wei R, Wang TJ, Ricciardi C, Lewis GD, Vasan RS, et al. Metabolic profiling of the human response to a glucose challenge reveals distinct axes of insulin sensitivity. Molecular Systems Biology. 2008;4:1-9.
28. American Diabetes Association. Standards of Medical Care in Diabetes 2008. Diabetes Care. 2008;31(Suppl 1):S12-4.
29. Twigg SM, Kamp MC, Davis TM, Neylon EK, Flack JR. Prediabetes: a position statement from the Australian Diabetes Society and Australian Diabetes Educators Association. MJA. 2007;186:461-5.
30. Goran MI, Lane C, Toledo-Corral C, Weigensberg MJ. Persistence of prediabetes in overweight and obese hispanic children. Association with progressive insulin resistance, poor beta-cell function, and increasing visceral fat. Diabetes. 2008;57:3007-12.
31. Abdul-Ghani MA, Tripathy D, Defronzo RA. Contributions of Beta cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose. Diabetes Care. 2006;29:1130-9.
32. Kim SH, Reaven GM. Isolated impaired fasting glucose and peripheral insulin sensitivity. Not a simple relationship. Diabetes Care. 2008;31:347-52.
33. Ferrannini E, Gastaldelli A, Miyazaki Y, Matsuda M, Pettiti M, Natali A, et al. Predominant role of reduced beta-cell sensitivity to glucose over insulin resistance in impaired glucose tolerance. Diabetologia. 2003;46:1211-9.
34. Weyer C, Bogardus C, Mott DM, Pratley RE. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J Clin Invest. 1999;104:787-94.
35. Prentki M, Nolan CN. Islet Beta cell failure in type 2 diabetes. J Clin Invest. 2006;116:1802-12.
Recibido: 4 de marzo de 2009.
Aprobado: 14 de abril de 2009.
Roberto M. González Suárez. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza, Ciudad de La Habana, Cuba. E mail: mcara@infomed.sld.cu robertog@inend.sld.cu














