Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.28 no.2 Ciudad de la Habana may.-ago. 2017
ARTÍCULO ORIGINAL
Evaluación de tres metodologías para la predicción del riesgo de alteraciones del metabolismo de la glucosa en sujetos con sobrepeso y obesidad
Evaluation of three methodologies for risk prediction of impaired glucose metabolism in overweighed and obese subjects
Eduardo Cabrera Rode, Vladimir Rodríguez Camerón, Janet Rodríguez, Ileana Cubas Dueñas, Aimee Álvarez Álvarez, Yuri Arnold Domínguez, Oscar Díaz Díaz
Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
RESUMEN
Introducción: en la actualidad, en Cuba no existe una estrategia establecida para la pesquisa de las alteraciones del metabolismo de la glucosa.
Objetivo: evaluar la capacidad diagnóstica de tres metodologías para predecir el riesgo de alteraciones del metabolismo de la glucosa en sujetos con sobrepeso y obesidad.
Métodos: se realizó un estudio de evaluación diagnóstica longitudinal, con los datos de 90 sujetos con edades comprendidas entre 25 y 70 años, analizados 2,5 años después de la evaluación inicial. Se obtuvo la edad, el sexo, los antecedentes patológicos personales, los medicamentos empleados, el peso, la talla, el perímetro de cintura y la tensión arterial, así como las concentraciones de glucosa al inicio y a los 2,5 años ulteriores, la insulina y los triglicéridos, además de calcular la resistencia a la insulina en la evaluación inicial. Se utilizó un modelo de puntaje-riesgo para la diabetes tipo 2.
Resultados: la frecuencia de alteraciones del metabolismo de la glucosa (glucemia alterada en ayuna y diabetes tipo 2) a los 2,5 años ulteriores, de acuerdo con la presencia previa o no en los sujetos de glucemia alterada en ayunas, resistencia a la insulina y riesgo moderado/alto de diabetes tipo 2, fue superior en los sujetos con glucemia alterada en ayuna previa (72,4 % [21/29]), con resistencia a la insulina al inicio (65,6 % [40/61]) y con riesgo moderado/alto (54,4 % [43/79]), en relación con aquellos sin glucemia alterada en ayuna, sin resistencia a la insulina y con riesgo bajo de diabetes (41,0 % [25/61], p= 0,005; 20,7 % [6/29], p= 0,006 y 27,3 % [3/11], p< 0,0001 respectivamente). La resistencia a la insulina y el riesgo de diabetes tipo 2 moderado/alto mostraron una elevada sensibilidad para identificar sujetos con alteraciones del metabolismo de la glucosa (87,0 y 93,5 % respectivamente), por el contrario de la glucemia alterada en ayunas, que mostró una baja sensibilidad (45,7 %). De los 19 sujetos que desarrollaron diabetes tipo 2 a los 2,5 años, el 100 % presentó riesgo de diabetes tipo 2 moderado/alto y 94,7 % resistencia a la insulina al inicio.
Conclusiones: la resistencia a la insulina y el riesgo de diabetes tipo 2 podrían ser de gran utilidad en la identificación de individuos con alto riesgo para padecer diabetes.
Palabras clave: diabetes tipo 2; prediabetes; resistencia a la insulina; sobrepeso; obesidad.
ABSTRACT
Introduction: at present, there is no set strategy in Cuba for the screening of impaired glucose metabolism.
Objective: to evaluate the diagnostic capacity of three methodologies to predict the risk of impaired glucose metabolism in overweighed and obese individuals.
Methods: a longitudinal diagnostic evaluation study was carried out using data from 90 subjects aged 25 to 70 years, which were analyzed two and a half years after the initial assessment. Information about age, sex, personal pathological history, used medication, weight, height, waist circumference and blood pressure as well the glucose concentrations at the beginning and two and a half years later, insulin and triglyceride indexes was collected in addition to estimating the insulin-resistance index in the initial evaluation. A risk-score model for type 2 diabetes was also used.
Results: the frequency of impaired glucose metabolism (impaired fasting glycemia and type 2 diabetes) after two and a half years, according to the previous existence or not of impaired fasting glycemia, insulin resistance and moderate/high risk of type 2 diabetes, was higher in subjects with previous impaired fasting glycemia (72,4 % [21/29]), with insulin resistance at the beginning (65.6 % [40/61]) and with moderate/high risk (54,4 % [43/79]) than in those individuals without impaired fasting glycemia, insulin resistance and with low diabetes risk (41.0 % [25/61], p= 0,005; 20.7 % [6/29], p= 0.006 and 27.3 % [3/11], p< 0.0001, respectively). Insulin resistance index and moderate/high risk of type 2 diabetes showed high sensitivity to identify subjects with impaired glucose metabolism (87.0 and 93.5 %, respectively), in contrast to impaired fasting glucose whose sensitivity was low (45.7 %). Of 19 individuals who developed type 2 diabetes two and a half years later, 100 % had moderate/high risk of type 2 diabetes and 94.7 % had insulin resistance at the beginning.
Conclusions: insulin resistance and risk of type 2 diabetes could be very useful in detecting individuals with high risk of developing diabetes.
Keywords: type 2 diabetes; pre-diabetes; insulin resistance; overweight; obesity.
INTRODUCCIÓN
En los inicios del siglo XXI la cifra de personas con diabetes mellitus (DM) se incrementó de forma alarmante, y actualmente es reconocida como una epidemia.1,2 Es el trastorno endocrino más común, y afecta el 8,8 % de la población mundial adulta. En Norteamérica y el Caribe afecta al 11,5 % de los adultos y en Europa se notifica una cifra de prevalencia del 7,3 %.2 En Latinoamérica también se presenta una elevada prevalencia de DM tipo 2 (DM 2) en la población mayor de 20 años, que fluctúa entre el 5,6 y el 14,4 %.2,3 En la región del Sur y Centro América, se estimó que el 9,4 % (8,0-11,3 %) de la población adulta tiene DM.2
En 2015, la Federación Internacional de Diabetes (IDF por sus siglas en inglés) estimó una cifra de 415 millones de personas con DM, cifra que aumentará en los próximos años hasta alcanzar 642 millones en el año 2040, aunque unos 192 millones de personas con DM (46,5 %) están aún sin diagnosticar.2 Entre las causas del incremento de la prevalencia de la DM se encuentran: el incremento del sobrepeso y la obesidad, la inactividad física, así como al envejecimiento de la población.2
En Cuba existe igual tendencia al incremento en la notificación de la tasa de incidencia (TI) de DM que en otras regiones del mundo. En el año 1991 la tasa de prevalencia de la enfermedad era de 15 por cada 1 000 habitantes, cifra que se elevó al doble en 2005. Los datos más recientes reflejan que la DM continúa incrementándose a expensas del aumento de la TI (en 2015 la cifra fue de 56,7 por cada 1 000 habitantes).4-8
Los pacientes con DM 2 pueden permanecer asintomáticos durante mucho tiempo con niveles elevados de glucosa en sangre, colesterol, y valores de hipertensión arterial (HTA). De hecho, el diagnóstico de la DM muchas veces es asintomático hasta el desarrollo de complicaciones graves, cuya gestión es más difícil y costosa.
En las personas que desarrollan DM 2, existe una etapa previa de prediabetes, que se manifiesta con una glucosa alterada en ayunas (GAA) y/o una tolerancia a la glucosa alterada (TGA).7-10 La mayoría de las personas con cualquiera de las dos condiciones desarrollará DM 2 manifiesta dentro de un período de 10 años. La interpretación de los datos disponibles se complica aún más, ya que la GAA representa un estado altamente dinámico. La GAA puede revertir a un estado de glucemia en ayuno normal, progresar a TGA o DM 2, y mantenerse como GAA.10 Esta expresa la sensibilidad a la insulina, y la TGA, la capacidad funcional pancreática, por lo tanto, la presencia de una GAA puede sugerir un incremento de la resistencia a la insulina (RI).11
Es ampliamente conocido que la obesidad y la inactividad física son los principales factores de riesgo (FR) de desarrollar DM 2 en personas genéticamente susceptibles.12 La obesidad, fundamentalmente visceral, es causa de RI y condiciona un estado de hiperglucemia.13
La prevención primaria debe estar encaminada a la identificación de individuos normoglucémicos de alto riesgo, e intervenir con medidas terapéuticas que impidan su transición hacia la GAA, la TGA y a la DM 2.12,14
El cribado poblacional con la glucemia de ayunas ha sido propuesto como una herramienta útil para identificar a los individuos con alto riesgo de diabetes o con diabetes asintomática, pero en la práctica, este parámetro tiene una gran variación aleatoria, y solo da información de su estado en el momento en que se realiza. Sin embargo, el uso de otras herramientas de predicción de riesgo, podría ser una mejor alternativa para identificar a los individuos con alto riesgo de desarrollar DM 2.15
Sobre este tema, varios estudios han demostrado la utilidad de puntajes de riesgo para la predicción de DM 2, en diferentes contextos poblacionales.14-24 Estos instrumentos se basan en FR tradicionales para la DM 2, y permiten una pesquisa activa de individuos no diagnosticados con prediabetes o DM 2, a los que se les aplicarán estrategias tempranas de prevención e intervención terapéutica.25 Se han propuesto numerosos modelos de riesgo para DM 2, entre los que se encuentran, el Canadian Task Force on Preventive Health Care, FINDRISC (Finnish Diabetes Risk Score) o el basado en el STOP-NIDDM (Study to Prevent Non-Insulin-Dependent Diabetes Mellitus), todos ellos validados en diferentes poblaciones.14-16
Las puntuaciones de riesgo de DM 214,26 constituyen un enfoque sencillo, no invasivo, y de bajo costo para la estimación del riesgo de un individuo a desarrollar DM 2, y a su vez, si es moderado/alto ayudaría a reducir el número de personas que tienen que someterse a pruebas de tolerancia a la glucosa oral.15,27
En nuestro país, según nuestra investigación documental, no existen trabajos publicados que traten sobre la comparación de varias metodologías para predecir el riesgo a desarrollar DM 2, es por ello que nos propusimos evaluar tres procedimientos para predecir el riesgo a desarrollar DM 2 a los 2,5 años después de una evaluación inicial en sujetos sobrepeso y obesos.
MÉTODOS
Diseño del estudio
Se tomaron los datos de 350 sujetos adultos con sobrepeso y obesos, de ambos sexos, con edades compendiadas entre los 19 y 70 años, que habían sido reclutados consecutivamente de una consulta para sujetos con sobrepeso y obesidad del INEN de La Habana, Cuba, en el período comprendido entre 2012 y el 2013. A los dos años y seis meses posteriores a registrarse los datos de los pacientes, se realizó un estudio de evaluación diagnóstica, que incluyó los datos de 90 pacientes adultos con sobrepeso y obesidad, de ambos sexos, que fueron citados telefónicamente en el período comprendido entre 2014 y el 2015. Para el análisis se excluyó a las personas con diagnóstico previo de DM 2 y con enfermedades crónicas asociadas que requirieron tratamiento esteroideo o inmunosupresor.
Cada paciente tenía registrado en la base de datos antes mencionada las características clínicas (edad, sexo, antecedentes de enfermedad cardiovascular), medicamentos utilizados para el tratamiento de otras enfermedades asociadas; así como datos del examen físico (peso, talla, circunferencia de cintura, tensión arterial [TA], presencia o no de acantosis nigricans), y resultados de exámenes bioquímicos basales (triglicéridos, glucosa e insulina plasmática en ayunas). Se había evaluado también la presencia de RI mediante el cálculo del índice del modelo homeostático de Mathews (HOMA-IR). Los individuos citados firmaron el consentimiento informado antes de someterse al estudio de evaluación diagnóstica. Posterior a conceder su consentimiento, los sujetos fueron examinados por un especialista en Endocrinología.
A todos los sujetos se les realizó un examen físico y las mediciones antropométricas (peso [kg], talla [cm], circunferencia de cintura [cm], presencia de acantosis nigricans y determinación de la TA). Además, se les prescribió una prueba de glucosa en ayuna para determinar los sujetos con GAA y DM 2, y se aplicó el modelo puntaje de riesgo para la DM 2 (STOP-NIDDM risk-score).15
Evaluación de las variables antropométricas
A los sujetos se les determinó el peso, la talla, y el perímetro de cintura (PC) y de cadera. Se calculó el IMC (peso en kg/talla en m2). La medida del PC se tomó con una cinta métrica con el sujeto colocado de pie, en espiración, con el abdomen relajado, tomando como referencia el punto medio entre el borde inferior de la última costilla y la espina ilíaca antero-superior de cada lado. En los casos de abdómenes péndulos la medición se realizó en el punto más prominente del abdomen.
Medición de la TA
Se realizó la medición de la TA a cada sujeto con esfigmomanómetro con mango acorde con el tamaño del brazo. El sujeto debió permanecer sentado en reposo durante los 10 minutos previos a la toma de TA. El proceder se realizó tres veces en el brazo derecho del sujeto, con un intervalo de 5 minutos. Se utilizó el promedio de las tres TA obtenidas.
Procedimiento de las variables bioquímicas
Las determinaciones bioquímicas se realizaron a cada sujeto en el momento de obtención de la primera muestra de sangre venosa (basal), luego de aproximadamente 8-12 horas de ayuno. A los 2,5 años después del estudio inicial, se midieron las concentraciones plasmáticas de glucosa y triglicéridos en los sujetos con sobrepeso y obesos.
Evaluación de las variables de laboratorio
La concentración de glucosa en ayunas y triglicéridos al inicio y a los 2,5 años de la evaluación inicial se midieron en un analizador automático (Elimat, Francia) por métodos enzimáticos. Se consideró como valores de referencia de glucosa en ayunas los propuestos por las guías de la Asociación Latinoamericana de Diabetes (ALAD) sobre el diagnóstico, control y tratamiento de la DM 2 con medicina basada en la evidencia, y por la American Diabetes Association (ADA): regulación normal de la glucemia en ayunas (< 5,6 mmol/L), GAA (5,6-6,9 mmol/L) y DM 2 (≥ 7,0 mmol/L).3,8 La concentración de insulina plasmática en ayunas en muestra de sangre venosa (plasma) se midió por ensayo inmunoradiométrico (IRMA, Izotop, Hungría) (http://www.izotop.hu/pdf/immuno/rk400ct_a.pdf). El índice de RI fue calculado al inicio por el modelo HOMA-IR (insulina en ayunas μU/mL x glucosa en ayunas mmol/L/22,5).28,29 Se consideró RI tomando los valores de índice HOMA-IR iguales o superiores a 2,6, el cual fue establecido al estudiar 800 individuos sanos sin historia de diabetes.29
Modelo puntaje para riesgo de DM 2
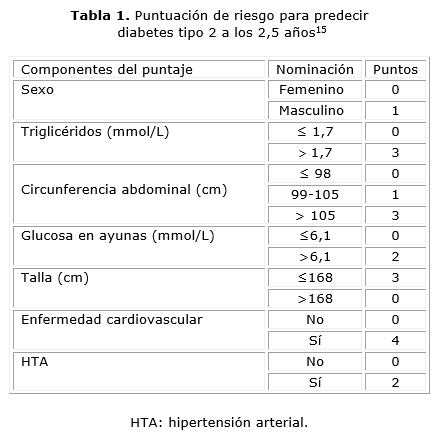
Se empleó el puntaje de riesgo STOP-NIDDM risk-score 15 para la DM 2 que incluye: sexo, circunferencia abdominal, talla, TA sistólica, enfermedad cardiovascular, glucosa en ayunas y triglicéridos. Se estratificó el riesgo a DM 2 de acuerdo con la predicción de este puntaje (tablas 1 y 2).15
Análisis estadístico
Para los cálculos estadísticos se utilizó el programa SPSS versión 11.5 para Windows. Se realizó un análisis descriptivo de la muestra expresando las variables en sus respectivas medidas de resumen: las cualitativas en cifras relativas y absolutas (números y por cientos). En cuanto a las variables cualitativas o categóricas, se empleó la prueba de McNemar para la comparación entre la presencia o no de alteraciones del metabolismo de la glucosa (AMG) a los 2,5 años después del estudio inicial en relación con la condición inicial: alteración o no de la GAA vs. no glucemia alterada en ayunas (NGAA), RI vs. no resistencia a la insulina (NRI), riesgo moderado/alto o bajo de padecer DM 2.
Se realizó el cálculo de la sensibilidad, especificidad, valores predictivos positivos (VPP) y negativos (VPN) de la puntuación de riesgo para la DM 2 (RDM2), la RI y de la GAA durante la evaluación inicial para identificar la presencia de AMG (GAA o DM 2) a los 2,5 años.
En todos los casos se trabajó para un nivel de confianza del 95 %, prefijándose un error alfa de 0,05 y una región crítica o de rechazo asociado al valor p= 0,05. Se admitieron como valores de significación estadística los valores de p< 0,05.
RESULTADOS
De los 90 pacientes con sobrepeso y obesos que acudieron a los 2,5 años después de la evaluación inicial, existió un predominio del sexo femenino 78,9 % (n= 78), con respecto al masculino 21,1 % (n= 19). El 61,1 % (n= 55) de los sujetos eran de color de piel blanca y el 70 % (n= 63) presentaron acantosis nigricans.
En la evaluación inicial de los sujetos se encontraron 29 de ellos con GAA (32,2 %) y 61 con RI (67,7 %), y de acuerdo con el puntaje de riesgo para DM 2, 12,2 % (n= 11), 67,7 % (n= 61) y 20,0 % (n= 18) con bajo, moderado y alto riesgo, respectivamente (tablas 3, 4 y 5).
Al comparar la frecuencia de AMG (GAA o DM 2) a los 2,5 años de acuerdo con la presencia o no de GAA en la evaluación inicial, se observa que estas fueron superiores en los individuos con una previa GAA (72,4 %; 21/29), que en los sujetos que no cumplían esta condición al inicio (41,0 %; 25/61; p= 0,005 GAA al inicio vs. NGAA al inicio). De los sujetos que presentaron GAA al inicio, 12 mantenían tal condición a los 2,5 años para el 41,4 %, regresó a la normoglucemia el 27,6 % (n= 8), y progresó a la DM 2 el 31,0 % (n= 9), teniendo 72,4 % (n= 21) de sujetos con alguna AMG. Por el contrario, de los sujetos con normoglucemia al inicio (n= 61), 59,0 % (n= 36) mantuvieron la glucemia normal, 24,6 % (n= 15) evolucionaron a GAA y el 16,4 % (n= 10) progresó hacia la DM 2, teniendo un total de 41,0 % (n= 25) de sujetos con AMG después del periodo analizado (tabla 3).
En la tabla 4 se muestra la frecuencia de AMG en relación con la presencia o no de RI al inicio. De los casos con RI al inicio (n= 61), 34,4 % (n= 21) permanecieron con la glucosa normal, el 36,1 % (n= 22) de los sujetos desarrolló GAA y el 29,5 % (n= 18) progresó a DM 2, alcanzando 65,6 % (n= 40) de sujetos con alguna AMG. Sin embargo, en los sujetos sin RI al inicio (n= 29), el 79,3 % (n= 23) se mantuvo con normoglucemia, 17,2 % (n= 5) evolucionó a GAA, y solo un individuo progresó hacia DM 2 (3,4 %), observándose que el 20,7 % (n= 6) de los sujetos mostró AMG a los 2,5 años después.
Estos datos muestran que existe mayor frecuencia de AMG (GAA+DM 2) a los 2,5 años de la evaluación inicial, en los sujetos con antecedentes de RI (65,6 %; 40/61), en comparación con los que no tuvieron esa condición (20,7 %; 6/29), con una diferencia que fue estadísticamente significativa de p= 0,006.
En el análisis de las variables de acuerdo con la puntuación de riesgo para la DM 2, se observó el predominio del grupo con riesgo moderado (n= 61); de ellos, el 52,5 % (n= 32) mantuvo la normoglucemia, 29,5 % (n= 18) presentó GAA y al 18,0 % (n= 11) se le diagnóstico DM 2, alcanzando 47,5 % (n= 29) de individuos con AMG a los 2,5 años ulteriores. Por el contrario, en el grupo de sujetos con alto riesgo (n= 18), el 22,2 % (n= 4) no mostró AMG, el 33,3 % (n= 6) evolucionó hacia GAA y el 44,4 % (n= 8) progresó a una DM 2. En este grupo de alto riesgo, el 77,8 % (n= 14) presentó AMG (GAA+DM 2) a los 2,5 años. Por último, en el grupo de sujetos con bajo riesgo (n= 11), el 72,7 % (n= 8) mantuvo los valores de glucosa normal, el 27,3 % (n= 3) desarrolló GAA, y ningún sujeto progresó hacia la diabetes. En general los sujetos con riesgo bajo mostraron menor frecuencia de AMG en relación con aquellos con riesgo moderado y alto en la evaluación final, con una diferencia significativa de p< 0,0001 (tabla 5).
Al comparar la sensibilidad y la especificidad de las distintas condiciones, la presencia de RI y un riesgo moderado/alto para DM 2 al inicio del estudio, alcanzaron una sensibilidad superior de identificar sujetos con AMG a los 2,5 años después, que aquellos con GAA al inicio (sensibilidad RI 87,0 %, riesgo moderado/alto 93,5 % y GAA 45,7 %, respectivamente). Sin embargo, se observó una mayor especificidad en los sujetos con GAA al inicio (81,8 %) (tabla 6).
La presencia de RI y de riesgo moderado/alto para DM 2 al inicio del estudio mostró mayor valor predictivo negativo (79,3 y 72,7 %) para detectar AMG a los 2,5 años de la evaluación inicial, en relación con la presencia de GAA (59 %).
En la tabla 7 se observan las características de los sujetos que progresaron a la DM 2 (n= 19); 63,2 % (n= 12) eran mujeres y el 36,8 % (n= 7) hombres. El 78,9 % (n= 15) de ellos mostraron edades superiores a los 45 años, el 68,4 % (n= 13) tenía acantosis nigricans, y se encontró un predominio de obesos del 89,5 % (n= 17) y una mayor frecuencia de HTA (84,2 %; n= 16).
Es importante destacar que la mayoría de los individuos que desarrollaron DM 2 (n= 19) después de 2,5 años de evolución, tenían previamente una RI (94,7 %; n= 18) y 100 % (n= 19) con riesgo de DM 2 moderado/alto. Por el contrario, los triglicéridos elevados (52,6 %; n= 10) y la GAA (47,4 %; n= 9), fueron los componentes que menos predominaron al inicio. Notable es el dato que el 52,6 % (n= 10) de los individuos que desarrollaron DM 2 eran normoglucémicos en la evaluación inicial.
DISCUSIÓN
La progresión de algunos individuos con sobrepeso y obesidad que transitan hacia la prediabetes y hasta la DM 2 está bien establecida.30-32 El incremento de la RI y la pérdida de la sensibilidad a la insulina (PSI), contribuye al deterioro de la función de las células beta del páncreas.30,31,33,34
En nuestro estudio, el riesgo de padecer AMG (GAA o DM 2) a los 2,5 años después de un estudio inicial varía según la condición inicial utilizada (GAA vs. NGAA, RI vs. NRI, riesgo moderado/alto o bajo de padecer DM 2). Se analizaron las condiciones iníciales anteriormente mencionadas en un grupo de sujetos con sobrepeso y obesidad. Las frecuencias encontradas de las AMG a los 2,5 años después fueron superiores en aquellos con una previa GAA (72,4 %) y RI (65,6 %), en comparación con la no presencia de tales condiciones al inicio (41,0 y 20,7 %, respectivamente) (tablas 3 y 4). Sin embargo, al comparar el grado de riesgo (alto, moderado y bajo) de padecer DM 2 al inicio, con el diagnóstico a los 2,5 años, se observó una mayor frecuencia de AMG en los sujetos con riesgo moderado/alto que en los de riesgo bajo (54,4 vs. 27,3 % respectivamente) (tabla 5).
La aparición solo de DM 2 a los 2,5 años después del estudio inicial fue significativamente superior, según las condiciones iníciales de RI en relación con la no presencia de RI (tabla 4). No hubo diferencia en cuanto a la presencia solo de DM 2 a los 2,5 años según presencia de GAA y NGAA al inicio del estudio (tabla 3).
En los últimos años ha ocurrido un incremento de personas con DM, tanto en Cuba como en todas las regiones.1-9 En Cuba las pesquisas poblacionales sobre las AMG (DM2 o GAA) son escasas.1,9,35-38
Diferentes estudios señalan la notable asociación de progresión hacia la DM 2 en los sujetos con presencia de GAA. 35,37,39,40 Inoue y otros40 sugieren que la persistencia de GAA está mucho más asociada al desarrollo de DM 2 que la presencia temporal de GAA (es decir, fluctuaciones de valores de GAA a NGAA y viceversa). En este trabajo se confirman los resultados antes expuestos (tabla 3). Otros estudios también han demostrado que un sustancial número de sujetos con GAA retornan a NGAA y viceversa.10,31,35,37,40-42
González y otros,37 en un estudio evolutivo en pacientes con sobrepeso y obesidad (73 %), encontraron que el 18,7 % (39/209) progresó a DM 2. En nuestra investigación la progresión a la DM 2 (21,1 %; 19/90) fue similar a la encontrada en el estudio antes mencionado,37 y superior al de otro trabajo realizado en obesos, en el que el 11,5 % (84/732) progresó a DM 2 en 7 años, dentro de los cuales, el 53,6 % (45/84) poseía una GAA al inicio.41 En cambio, los mismos autores encontraron que en aquellos sujetos con una glucosa en ayunas normal al inicio, el 31,4 % (161/512) y el 7,6 % (39/512) progresaron a GAA y DM 2 respectivamente.41 De manera similar, en nuestra serie, el 47,4 % (9/19) que desarrolló DM 2 presentó también GAA al inicio (tabla 3). Nosotros también observamos que a los 2,5 años después, en los sujetos con glucosa normal al inicio, el 24,6 y el 16,4 % progresaron a GAA y DM 2 respectivamente, resultados disímiles a los encontrados por Neelan y otros.41
Diferentes estudios señalan que la GAA sola quizás repercuta en una subestimación de la prevalencia de prediabetes y DM 2,7-10,37,43 por lo que sugieren utilizar la prueba de tolerancia oral a la glucosa (PTGO) para estimar la cantidad de sujetos con AMG (GAA y/o TGA y DM 2), pues esta detecta más sujetos con estas alteraciones, debido a que explora aquellos con GAA o TGA sola, o combinada; sin embargo, es costoso realizar una pesquisa determinando PTGO. Otros autores, proponen combinar la glucosa en ayunas con la HbA1c, la cual es aceptable como prueba complementaria para el diagnóstico de prediabetes y DM 2.3,8,9,39,43
La limitación de la alteración de la GAA en las etapas iníciales de la progresión hacia la DM 2 consiste en que son cambiantes o reversibles, y no son suficientes para fundamentar su diagnóstico precoz y las actividades preventivas o terapéuticas. No obstante, la aparición de GAA persistente podría indicar el inicio de una etapa de progresión acelerada hacia la DM 2, por lo que en este grupo es necesario intensificar las medidas para revertir o enlentecer el deterioro metabólico.31,37,40
La RI es la esencia de las alteraciones fisiológicas-patológicas en la progresión desde la normoglucemia a la GAA, TGA a DM 2.44 Es evidente que la DM 2 no ocurre en ausencia del fallo de las células beta.44 Por tal razón, no es del todo sorprendente que los índices de secreción de insulina y RI al inicio sean potentes para la predicción futura del desarrollo de DM 2.44,45 Un estudio inglés con 6 548 sujetos sin DM 2 seguidos durante los 13 años de investigación, reveló que los cambios en las concentraciones de glucosa, en la RI y la secreción de insulina fueron evidentes de 2 a 6 años antes del diagnóstico.46
Lo antes referido coincide con los resultados de nuestra investigación, en la que los sujetos con una RI anterior fueron los que manifestaron con mayor frecuencia las AMG a los 2,5 años después de la evaluación inicial. Al analizar la presencia de RI en años previos, entre los sujetos con NGAA y GAA + DM 2, se observó que la RI estaba presente en la mayoría de los individuos que desarrollaron tanto GAA como DM 2 a los 2,5 años después, en relación con los sujetos que no mostraron AMG (GAA + DM 2 [86,9 %; 40/46]) versus NGAA (47,7 %; 21/44; p< 0,0001 respectivamente) (tabla 4).
En otra publicación realizada en Cuba, se observó que el 53,8 % de los pacientes con AMG tenían una RI, frecuencia que fue aumentando de manera significativa en la medida en que las personas se acercaban al diagnóstico de DM.36
Otros estudios también encuentran una tendencia significativa a que la RI esté presente en sujetos con prediabetes, en comparación con los sujetos con concentraciones normales de glucosa.42,44 Estos resultados indican que la RI comienza años antes del desarrollo de DM 2 y del decremento de la función de las células beta, que está presente en el estadio prediabético.42,44-46
Tomando en cuenta todos los datos antes mencionados, podemos concluir que la RI favorece la progresión a la DM 2, y que forma parte de la historia natural de esta enfermedad, por lo que pudiera ser utilizada como marcador de progresión a las AMG, pero la medición de la insulina es un método costoso.
El empleo de modelos de riesgo que sean capaces de dar una estimación más eficiente sobre la tendencia del riesgo de progresión a la DM 2, parecen ser más efectivos que el resultado de un biomarcador individual.31
En la actualidad varios grupos de investigadores han demostrado la utilidad de puntajes de riesgo para identificar aquellos individuos con alto riesgo de progresar hacia la DM,14-27 y se han empleado en los ensayos clínicos, seleccionando a los individuos con alto riesgo de desarrollar DM 2, con el objetivo de prevenir la enfermedad o detectar aquellos sujetos que requieran una segunda prueba de pesquisa.15,19,25 En el presente estudio se utilizó el modelo puntaje de riesgo para la DM 2 (The STOP-NIDDM risk-score),15 debido a que es una herramienta útil para identificar los sujetos con mayor riesgo de progresar hacia la DM 2. Este modelo de puntaje tiene la ventaja que emplea dos biomarcadores (glucosa en ayunas y triglicéridos), así como otros factores de riesgo para DM 2 (obesidad abdominal y HTA). Los biomarcadores y FR utilizados en el puntaje están muy asociados con el riesgo a padecer DM 2.8,10,12,13,19,26,30,41-47
Es importante enfatizar que todos los sujetos que progresaron a DM 2 en nuestro estudio presentaron con antelación riesgo moderado o alto para desarrollar DM 2, según el puntaje de riesgo (tabla 5). El estudio STOP-NIDDM analizó personas con TGA, y a pesar del corto tiempo de seguimiento (2,5 años), encontró que el 35 % de los sujetos con riesgo alto de DM 2, la desarrolló. Los autores explican que con este modelo de riesgo fueron capaces de predecir la DM 2 con validez en población general con TGA.15 Nuestros resultados en sujetos con sobrepeso y obesidad, en relación con la proporción de sujetos que progresaron a una DM 2 (33,3 %), se asemeja bastante al de este estudio con el mismo puntaje de riesgo.
Diversos estudios han reportado que la sensibilidad, especificidad y valor predictivo positivo de la GAA, la RI y el puntaje de riesgo alto para identificar sujetos con DM 2, es bastante disímil. 14-27,36,37,40,42,45-52 La sensibilidad y especificidad para identificar sujetos con DM 2, al aplicar el puntaje de riesgo alto para DM 2, son elevados en los distintos estudios analizados, fluctúa entre el 40 y el 84 % y del 42 al 80 %, respectivamente, sin el empleo de biomarcadores de laboratorio; por el contrario, varía del 52 al 92 % y 56 al 88,5 % respectivamente, al usar biomarcadores. El valor predictivo positivo para ambas situaciones anteriores varía entre el 9 y el 25 % y del 11,9 al 40 %, respectivamente.14-27,42,52 Al contrario, al utilizar la GAA se demostró una baja sensibilidad para identificar a los individuos con DM 2 (41,7 al 48,7 %) y la especificidad varía desde el 69,5 al 95,3 %.40,48,49
Atabek y otros, al utilizar la RI encontraron que esta mostró una sensibilidad alta (88 %) y una especificidad del 59,1 % para identificar sujetos con DM 2.51 Al comparar los resultados de la literatura revisada con los de este estudio, en relación con la sensibilidad y especificidad para poder identificar personas con DM 2, pudimos observar que estos se asemejan, recalcando que, en esta investigación, tanto la RI (87 %), como el riesgo moderado y alto combinado (93,5 %), presentaron mayor sensibilidad para detectar individuos con AMG, en relación con el empleo solamente de la GAA (45,7 %) (tabla 6); en cambio, tanto la RI como el riesgo moderado y alto combinado, mostraron un mayor valor predictivo negativo (79,7 y 72,7 %), con relación aquellos con GAA (tabla 6), resultados que nos indican que estas dos condiciones identifican una mayor proporción de individuos realmente con AMG, que aquellos con una GAA al inicio (59 %), es decir, que el 20,3 y el 27,3 % de los sujetos con la condición inicial de RI, así como con riesgo moderado y alto combinado por el modelo de puntuación, con AMG a los 2,5 ulteriores, serían diagnosticados erróneamente como no enfermos, en comparación con los que presentaron GAA al inicio, de los que solo el 41,0 % quedará diagnosticado como sujetos sin AMG.
La alta sensibilidad encontrada para la RI y el puntaje de riesgo alto para la DM 2, así como riesgo a DM 2 moderado y alto combinado, nos indica que la RI debe estar relacionada con los individuos con riesgo a DM 2 moderado y alto. Datos no mostrados en el acápite de RESULTADOS demuestran que los sujetos con riesgo alto de DM 2 presentan mayor frecuencia de RI, en comparación con aquellos con riesgo bajo de DM 2 (83,3 %; 15/18 vs. 45,5 %; 5/11 respectivamente; p= 0,0478). Consecuentemente, se observó que en los individuos con riesgo moderado para la DM 2, la frecuencia de RI no difirió de aquellos con riesgo alto (67,2 %; 41/61). El hecho de no encontrar diferencias en relación con la presencia de RI al inicio en los sujetos con riesgo moderado y alto para la DM 2 y por mostrar alta frecuencia de sujetos con ulterior AMG, nos indica que ambos presentan mayor probabilidad a desarrollar DM 2.53
La asociación de la RI con el puntaje de alto riesgo confirma que podemos utilizarlo para predecir las alteraciones de metabolismo de la glucosa, y de esta forma presentarlo para el inicio de intervenciones, con el fin de prevenir el desarrollo de DM 2 y de enfermedad cardiovascular (ECV).15,50-52
En párrafos anteriores de este documento se plantea que el desarrollo de la DM 2 está precedido frecuentemente por una serie de alteraciones metabólicas, entre las que se incluyen la GAA, TGA, dislipemia y la RI, sobre todo, cuando se asocia a otros FR, como es la obesidad y la HTA, aunque no todos los pacientes con esas alteraciones evolucionan hacia la diabetes, pero el riesgo de desarrollar la enfermedad es significativamente mayor.8,30-32,36,37,42,45,47,54 De los sujetos que progresaron hacia la DM 2 en nuestro estudio, el 86,6 % (13/15) son obesos y el 73,3 % presentó acantosis nigricans, características que están muy asociadas al desarrollo de la DM 2 (tabla 7). Notablemente, los individuos que desarrollaron DM 2 presentaron una elevada frecuencia de RI (93,3 %; 14/15); el 80 % (12/15) de los sujetos presentaron HTA en la evaluación previa, y todos tenían un riesgo a DM 2 moderado o alto. No obstante, la presencia previa de GAA en los individuos que progresaron a DM 2 fue baja (40 %), lo cual ratifica que la glucosa en ayunas sola no es un buen indicador del riesgo para la DM 2.43
La limitación principal de este estudio radica en que, al haberse estudiado sujetos con sobrepeso y obesidad que acudieron de manera consecutiva a una consulta de obesidad, hace que sea un muestreo no probabilístico, y la muestra de pacientes no es representativa para que los resultados sean extrapolados a la población general. No obstante, en Cuba este sería el primer estudio publicado, del que se tenga conocimiento, en el cual se comparan tres metodologías, para la predicción del riesgo de DM 2 en sujetos con sobrepeso y obesidad.
Los resultados del presente estudio sugieren evaluar la aplicación del modelo de puntuación de riesgo de padecer DM 2, dado que este modelo es simple, efectivo y menos costoso que el resto de las metodologías empleadas, además nos permitirá, por consiguiente, identificar con mayor probabilidad individuos con AMG que los otros dos procedimientos utilizados. Así, también nos facultará para llevar a cabo acciones de prevención en aquellos individuos con riesgo moderado y alto para la DM 2, que estén transitando por los estadios iníciales de la enfermedad.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Arnold Y, Licea M, Aldana D. Algunos aspectos relevantes de la epidemiología de la diabetes mellitus en Cuba. Rev Peruana Epidemiol. 2011;15(3):1609-7211.
2. IDF Diabetes Atlas [homepage en Internet]; IDF, 2015 [citado 6 de abril de 2017]. Disponible en: http://www.diabetesatlas.org/
3. ALAD. Guías ALAD sobre diagnóstico, control y tratamiento de la Diabetes Tipo 2 con medicina basada en evidencia [homepage en Internet]; edición 2013, Revista ALAD 2013 [citado 11 de noviembre de 2013]. Disponible en: http://issuu.com/alad-diabetes/docs/guias_alad_2013
4. Cuba. Ministerio de Salud Pública (Minsap). Anuario Estadístico de Salud 2012 [homepage en Internet]; 2012 [citado 29 de diciembre de 2013]. Disponible en: http://files.sld.cu/dne/files/2013/04/anuario_2012.pdf
5. Cuba. Ministerio de Salud Pública (Minsap). Anuario Estadístico de Salud 2015 [homepage en Internet]; 2015 [citado 21 de septiembre de 2016]. Disponible en: http://files.sld.cu/dne/files/2016/04/Anuario_2015_electronico-1.pdf
6. Cuba. Ministerio de Salud Pública (Minsap). Proyecciones de la salud pública en Cuba para el 2015. La Habana: MINSAP; 2006. p. 35-6.
7. Grupo de Trabajo sobre Diabetes y Enfermedades Cardiovasculares de la Sociedad Europea de Cardiología (ESC) y de la Sociedad Europea para el Estudio de la Diabetes (EASD). Guías de práctica clínica sobre diabetes, prediabetes y enfermedades cardiovasculares: versión resumida. Rev Esp Cardiol. 2007;60(5):525.e1-e64.
8. American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care. 2017;40(sup 1):S1-S135.
9. Díaz O, Cabrera E, Orlandi N, Araña M, Díaz O. Aspectos epidemiológicos de la prediabetes, diagnóstico y clasificación. Rev Cubana Endocrinol. 2011;22(1):3-10.
10. Rosas J, Calles J, Friege F, Lara A, Suverza A, Campuzano R, et al. Consenso de Prediabetes. Documento de Posición de la Asociación Latinoamericana de Diabetes (ALAD). Rev ALAD. 2009;17(4):146-58.
11. Calderín RO, Monteagudo G, Yanes MA, García J, Marichal S, Cabrera E, et al. Síndrome metabólico y prediabetes. Rev Cubana Endocrinol. 2011;22(1):52-7.
12. García de los Ríos MA, Durrutya P. Prevención de la diabetes mellitus tipo 2. Rev Med Clin Condes. 2009;20(5):580-7.
13. Pereira O L. Diabesidad: una epidemia del siglo XXI. Medisan. 2012;16(2):295-8
14. Lindström J, Tuomilehto J. The diabetes risk score. A practical tool predicts type 2 diabetes risk. Diabetes Care. 2003;26(3):725-31.
15. Tuomilehto J, Lindström J, Hellmich M, Lehmacher W, Westermeiere T, Evers T, et al. Development and validation of a risk-score model for subjects with impaired glucose tolerance for the assessment of the risk of type 2 diabetes mellitus-The STOP-NIDDM risk-score. Diab Res Clin Pract. 2010;87(2):267-74.
16. Pottie K, Jaramillo A, Lewin G, Dickinson J, Bell N, Brauer P, et al. Canadian Task Force on Preventive Health Care. Recommendations on screening for type 2 diabetes in adults. CMAJ. 2012;184(15):1687-96.
17. Aekplakorn W, Bunnag P, Woodward M, Sritara P, Cheepudomwit S, Yamwong S, et al. A risk score for predicting incident diabetes in the Thai population. Diab Care. 2006;29(8):1872-7.
18. Rathmann W, Martin S, Haastert B, Icks A, Holle R, Lowel H, et al. Performance of screening questionnaires and risk scores for undiagnosed diabetes: the KORA Survey 2000. Arch Intern Med. 2005;165(4):436-41.
19. Schulze M, Hoffmann K, Boeing H, Linseisen J, Rohrmann S, Möhlig M, et al. An accurate risk score based on anthropometric, dietary and lifestyle factors to predict the development of type 2 diabetes. Diab Care. 2007;30(3):510-5.
20. Hippiisley J, Coupland C, Robson J, Sheikh A, Brindle P. Predicting risk of type 2 diabetes in England and Whales: prospective derivation and validation. BMJ. 2009;10:273-82.
21. Gray LJ, Taub NA, Khunti K, Gardiner E, Hiles S, Webb DR, et al. The Leicester Risk Assessment score for detecting undiagnosed type 2 diabetes and impaired glucose regulation for use in a multi-ethnic UK setting. Diabet Med. 2010;27(8):887-95.
22. Soriguer F, Valdés S, Tapia MJ, Esteva I, Ruiz de Adana MS, Cruz Almaraz M, et al. Validación del FINDRISC (Finnish Diabetes Risk Score) para la predicción del riesgo de diabetes tipo 2 en una población del sur de España. Estudio Pizarra. Med Clin (Barc). 2012;138(9):371-6.
23. Jølle A, Midthjell K, Holmen J, Tuomilehto J, Carlsen SM, Shaw J, et al. Impact of sex and age on the performance of FINDRISC: the HUNT Study in Norway. BMJ Open Diabetes Research and Care. 2016;4:e000217.
24. Salinero-Fort MA, Burgos-Lunar C, Lahoz C, Mostaza JM, Abánades-Herranz JC, Laguna-Cuesta F, et al. Performance of the Finnish Diabetes Risk Score and a Simplified Finnish Diabetes Risk Score in a Community-Based, Cross-Sectional Programme for Screening of Undiagnosed Type 2 Diabetes Mellitus and Dysglycaemia in Madrid, Spain: The SPREDIA-2 Study. PLoS ONE. 2016;11(7):e0158489.
25. Lindström J, Peltonen M, Ericksson JG, Aunola S, Hämäläinen H, Ilianne-Parikka P, et al. Determinants for the effectiveness of lifestyle intervention in the Finnish diabetes prevention study. Diabetes Care. 2008;31:857-62.
26. Lee CM, Colagiuri S. Risk scores for diabetes prediction: the International Diabetes Federation PREDICT-2 project. Diabetes Res Clin Pract. 2013;100(2):285-6.
27. Tankova T, Chakarova N, Atanassova I, Dakovska L. Evaluation of the Finnish Diabetes Risk Score as a screening tool for impaired fasting glucose, impaired glucose tolerance and undetected diabetes. Diabetes Res Clin Pract. 2011;92(1):46-52.
28. Mathews DR, Hosker JP, Rudenki AS, Nailor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and beta cell function from fasting plasma glucose and insulin concentration in man. Diabetologia. 1985;28(7):412-9.
29. Arranz C, González RM, Álvarez A, Rodríguez B, Reyes A. Criterios de referencia para los indicadores de secreción de insulina y de los parámetros lipídicos en una población mixta hospitalaria. Rev Cubana Endocrinol. 2010;21(1):1-12.
30. Riobó P. Obesity and diabetes. Nutr Hosp. 2013;28(sup 5):138-43.
31. Tabák AG, Herder C, Rathmann W, Brunner EJ. Prediabetes: A high-risk state for developing diabetes. Lancet. 2012;379(9833):2279-90.
32. Al Amiri E, Abdullatif M, Abdulle A, AL Bitar N, Zaki Afandi E, Parish M, et al. The prevalence, risk factors, and screening measure for prediabetes and diabetes among Emirati overweight/obese children and adolescents. BMC Public Health. 2015;15:1298.
33. Reaven G. Insulin Resistance and Coronary Heart Disease in Nondiabetic Individuals. Arterioscler Thromb Vasc Biol. 2012;32:1754-9.
34. Chen X, Su M, Wang C, Wu Z, Li S, Ying X, et al. Role of insulin resistance and β cell function in the development of newly diagnosed type 2 diabetes. Wei Sheng Yan Jiu. 2015 Nov;44(6):881-6.
35. Perich P, González RM, Valdés E, Arranz MC. Desarrollo de diabetes mellitus en pacientes con tolerancia a la glucosa alterada. Seguimiento de 18 años. Rev Cubana Endocrinol [serie en Internet]. 2002 [citado 15 de febrero de 2017];13(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532002000200002&lng=es
36. Bermúdez S, Buchaca E, Suárez del Villar Y, Rodríguez L, Alonso CA, Mansur M, et al. Trastornos de la glucemia y de la acción de la insulina en una población de riesgo de diabetes. Rev Cubana Endocrinol. 2009;20(3):120-30.
37. González RM, Perich P, Arranz C. Trastornos metabólicos asociados con la evolución hacia la diabetes mellitus tipo 2 en una población en riesgo. Rev Cubana Endocrinol. 2010;21(2):110-25.
38. Bustillo Solano EE, Bustillo Madrigal EE, Pérez Y, Pérez R, Brito A, González A, et al. Prevalencia de la diabetes mellitus y de la glucemia alterada en ayunas en un área de la ciudad de Sancti Spíritus. Rev Cubana Endocrinol. 2013;24(2):107-24.
39. Edwards CM, Cusi K. Prediabetes. A Worldwide Epidemic. Endocrinol Metab Clin N Am. 2016;45:751-64.
40. Inoue K, Inoue M, Matsumoto M, Akimoto K. Persistent fasting hyperglycaemia is more predictive of type 2 diabetes than transient fasting hyperglycaemia. Diab Med. 2012;29:e75-81.
41. Neelan J, Turer T, Ayers R, Powell-Wiley TM, Vega GL, Farzaneh-Far R, et al. Dysfuntional adiposity and the risk of prediabetes and type 2 diabetes in obese adults. JAMA. 2012;308(11):1150-9.
42. Sang R, Jeong W. The prediabetic period: Review of clinical aspects. Diab Metab J. 2011;35:107-16.
43. Ja J, Seung K, Hyuk K, Nan K, Jae K, Chul K, et al. Prevalence of diabetes and prediabetes according to fasting plasma glucose and HbA1c. Diab Metab J. 2013;37:349-57.
44. DeFronzo RA, Tripathy D, Schwenke DC, Banergi MA, Bray GA, Buchanan TA, et al. Prediction of diabetes based on baseline metabolic characteristics in individuals at high risk. Diabetes Care. 2013;36:3607-12.
45. Bergman M. Pathophysiology of prediabetes and treatment implications for the prevention of type 2 diabetes mellitus. Endocrine. 2013;43:504-13.
46. Tabak AG, Jokela M, Akbaraly TN, Brunner EJ, Kivimäki M, Witte DR. Trajectories of glycemia, insulin sensitivity and insulin secretion preceding the diagnosis of type 2 diabetes: The Whitehall II Study. Lancet. 2009;373(9682):2215-21.
47. de Lima CLJ, de Olivera PS, Costa Ferreira TM, da Silva EC, Lopes Ferreira JD, de Andrade RS, et al. Risk factors for type II diabetes mellitus: an integrative review. Int Arch Med. 2016;9(308):1-11.
48. Lyssenko V, Almgren P, Anevski D, Perfekt R, Lahti K, Nissén M, et al. Predictors of and longitudinal changes in insulin sensitivity and secretion preceding onset of type 2 diabetes. Diabetes. 2005;54:166-74.
49. Morrison KM, Xu L, Tarnopolsky M, Yusuf Z, Atkinson SA, Yusuf S. Screening for dysglycemia in overweight young presenting for weight management. Diabetes Care. 2012;35:711-6.
50. Noble D, Mathur R, Dent T, Meads C, Greenhalgh T. Risk models and scores for type 2 diabetes: systematic review. BMJ [serie en Internet]. 2011 [citado 6 de abril de 2017];343:d7163. Disponible en: http://www.bmj.com/content/bmj/343/bmj.d7163.full.pdf
51. Atabek ME, Pirgon O. Assessment of insulin sensitivity from measurements in fasting state and during an oral glucose tolerance test in obese children. J Pediatr Endocrinol Metab. 2007;20(2):187-95.
52. Colagiuri S. Epidemiology of prediabetes. Med Clin N Am. 2011;95:299-307.
53. Fernández R, Arranz C, Ortega JA, Hernández J. Resistencia a la insulina y cambios metabólicos en adultos obesos. Rev Cubana Endocrinol. 2011;22(2):78-90.
54. Soares Lima AC, Moura Araújo MF, Júnior Freire de Freitas RW, Zanetti ML, César de Almeida P, Coelho Damasceno MM. Factores de riesgo para diabetes mellitus tipo 2 en universitarios: asociación con variables sociodemográficas. Rev Latino-Am Enfermagem. 2014;22(3):484-90.
Recibido: 15 de enero de 2017.
Aprobado: 14 de abril de 2017.
Eduardo Cabrera Rode. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: diabetes@infomed.sld.cu