Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica Electrónica
versión On-line ISSN 1684-1824
Rev. Med. Electrón. v.31 n.1 Matanzas ene.-feb. 2009
HOSPITAL PEDIÁTRICO PROVINCIAL ELISEO NOEL CAAMAÑO .
Neumonia complicada por stafilococo epidermidis en un paciente con osteomielitis del fémur. Reporte de caso
Pneumonia complicated by staphylococus epidermidis in a patient with osteomyelitis of the femur. Report of a case
.
AUTORES
Dra. Daycee Breña Escobar. (1)
E-mail: pediat.mtzas@infomed.sld.cu
Dra. Lisset Font Pavón. (1)
Dr. Ricardo Busto Aguiar. (1)
Dra. María Elena Castellanos Ferreras. (2)
Dra. Vivian Reyes Carmenate. (2)(1) Especialistas de I Grado en Pediatría. Profesor Instructor.Máster en Atención Integral al niño. Hospital Pediátrico Provincial Eliseo Noel Caamaño.Matanzas.
(2)Especialistas de I Grado en Pediatría. Profesor Instructor. Hospital Pediátrico Provincial Eliseo Noel Caamaño.Matanzas.RESUMEN
Se presenta el caso de un niño varón de 5 años de edad que presentó una neumonía por estafilococo epidermidis complicada, con empiema, neumotórax a tensión y bulas parenquimatosas secundarias a una osteomielitis del fémur izquierdo. El paciente recibió tratamiento con vancomicina y clindamicina evolucionando satisfactoriamente. Se revisa en la literatura sobre infecciones por estafilococo epidermidis, germen que ha ido adquiriendo importancia creciente en la etiología de las infecciones intrahospitalarias.
DeCS:
NEUMONÍA/diagnóstico
STAPHYLOCOCCUS EPIDERMIDIS
OSTEOMIELITIS/quimioterapia
FÉMUR/cirugía
INFECCIÓN HOSPITALARIA/etiología
HUMANOS
MASCULINO
PREESCOLARINTRODUCCIÓN
Los estafilococos coagulasa-negativo son las bacterias más comunes aisladas en los laboratorios microbiológicos. Entre ellos el estafilococo epidermidis, que se caracteriza por ser coagulasa negativo y novobiacina sensible, fue considerado durante mucho tiempo como un germen contaminante de cultivos. Sin embargo, ahora se le reconoce como un patógeno importante y es considerado el agente causal de diferentes entidades clínicas, entre ellas: Infecciones urinarias intrahospitalarias, osteomielitis, endocarditis de válvula nativa, bacteriemia en paciente inmunocomprometidos, endoftalmitis después de cirugía ocular, infecciones de dispositivos médicos o cuerpos extraños (catéteres endovenosos, fístulas para hemodiálisis, catéteres de diálisis peritoneal, marcapasos, articulaciones protésicas, injertos valvulares, válvulas cardiacas protésicas e implantes de mama). Otra característica importante de esta bacteria es la susceptibilidad antimicrobiana que presenta, ya que el estafilococo epidermidis ha desarrollado resistencia a la meticillina en forma paralela al desarrollo de resistencia del estafilococo aureus, pero mostrando tasas mucho más elevadas que esta última, y que ha ido incrementándose de manera importante en los últimos 20 años. Mientras que a inicio de los años 80 se indicaban tasas de resistencia a la meticillina del 20 %, en 1999 éstas llegaron al 80 %. Ésta es la razón por la cual en la actualidad se considera que la vancomicina es el tratamiento de elección para infecciones causadas por este germen.
Se presenta el caso de un paciente que desarrollo una neumonía complicada por estafilococo epidermidis, posterior a una osteomielitis del fémur izquierdo, el cual respondió al tratamiento combinado de vancomicina y clindamicina.Caso Clínico
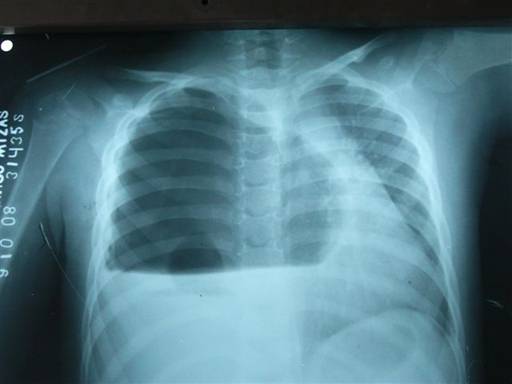
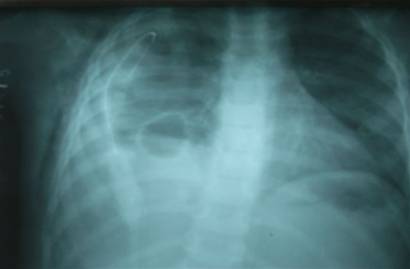
Paciente varón de 5 años de edad, procedencia rural, con antecedentes de salud, que reingresa después de 15 días de ser sometido a cirugía electiva por una osteomielitis del fémur izquierdo, se realizó curetaje óseo con irrigación continua, durante este ingreso se pone tratamiento con vancomicina y meropenen, fue dado de alta al vigésimoquinto día sin otras manifestaciones y evolución satisfactoria. Posterior al alta, 72 horas, comienza a presentar fiebre, toma del estado general, anorexia, etc., en vistas de la persistencia de los síntomas y presentar una crisis de bacteriemia acude nuevamente a emergencias donde se realizan una serie de complementarios, entre ellos una radiografía de tórax y se constata lesión inflamatoria que ocupa el lóbulo inferior de hemitórax derecho, con línea axilar, no otras alteraciones radiológicas (figura 1). Las heridas operatorias habían cicatrizado, el resto del examen físico fue normal.
Figura 1: Rx de tórax del reingreso.
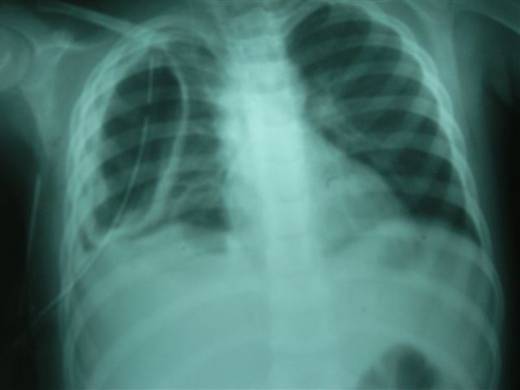
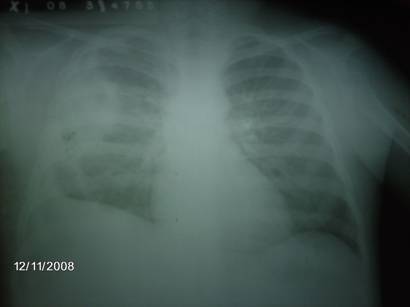
Los exámenes realizados de manera electiva mostraban caída de la hemoglobina (9 g/l), VSG aumentada (123mmm/h), marcada leucocitosis con desviación izquierda, se realizó ecografía toráxica y se constata presencia de líquido en espacio pleural con un volumen aproximado de 15 ml, se inicia tratamiento con vancomicina, a las 96 horas del reingreso el niño comienza con dificultad respiratoria, persistencia de la fiebre, gasometría con signos de hipoxemia y desaturación de la hemoglobina, por lo que se realiza Rx de tórax evolutivo, donde se encuentra un gran neumotórax a tensión, así como una gran bula parenquimatosa (neumatocele), hacia la región inferior del hemitórax derecho (figura 2).
Figura No.2 A-B: Neumotórax a tensión con neumatocele, 96 horas después del reingreso.
Fig. 2-A Vista antero-posterior
Fig. 2-B Vista Lateral
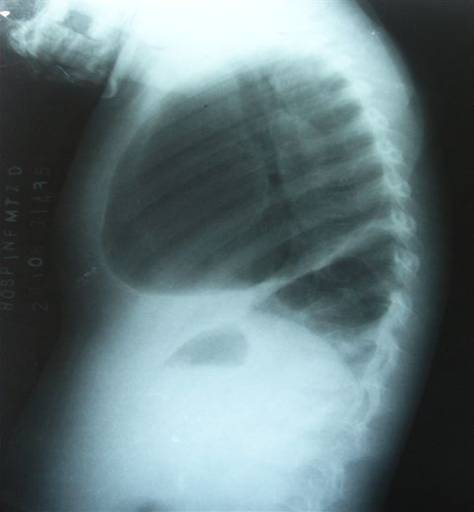
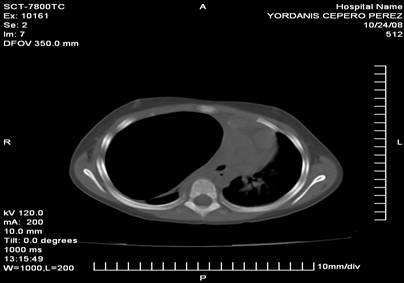
En vista de lo anterior es llevado al salón de operaciones y se realiza una pleurotomía de urgencias, se conecta a un frasco colector con sello de agua, se realiza Rx control sin otras complicaciones, como existió un empeoramiento clínico, radiológico y humoral se discute el caso en el comité de sepsis del hospital dados los antecedentes y se decide asociar al tratamiento clindamicina, posterior a esto se presenta una caída de la fiebre, comienza a mejorar el estado general del niño, la hemoglobina se mantiene sin reducción en sus valores, la VSG alcanza cifras de 82mm/h, durante el tiempo que trascurre posterior a esta conducta el estado general del niño mejora considerablemente, pero al realizar radiologías evolutivas se evidencia un neumotórax encapsulado (figura 3), que en controles radiológicos posteriores llega a ser un nuevo neumotórax a tensión que requiere otra pleurotomía alta, para evacuarlo y se conecta a un sello de agua, en esos momentos se realiza una TAC de tórax para confirmar el diagnóstico (figura 4).
Figura 3: Neumotórax Encapsulado
Figura 4: Gran Neumotórax a Tensión
Figura No.5: Rx evolutivo, reexpansión del pulmón, presencia de neumatoceles .
El paciente sólo contó con un hemocultivo que fue positivo a estafilococo epidermidis, por lo que llevó tratamiento como se comentó antes, con vancomicina (65 mg/Kg.), clindamicina (40 mg/Kg.) por un período de 15 días, después de esto se continuó con rifampicina (30 mg/Kg.) por 10 días y finalmente con ciprofloxacina (30 mg/Kg.). Desde el punto de vista óseo, no quedaron secuelas, pero desde el punto de vista radiológico se evidencia una paquipleuritis (figura 6) que requirió tratamiento esteroideo, el paciente fue dado de alta.
Figura 6: Rx evolutivo, desaparición del neumatocele, paquipleuritis residual.
DISCUSIÓN
El estafilococo epidermidis y otros estafilococos coagulasas negativos representan los mayores componentes de la microflora de la piel y mucosa humana. A pesar de su alta frecuencia como contaminante, el estafilococo epidermidis se ha convertido en un importante patógeno nosocomial, en parte probablemente debido al uso incrementado de dispositivos médicos como catéteres endovenosos de permanencia prolongada, injertos vasculares, válvulas cardíacas y articulaciones protésicas, representando el 24 % de los patógenos nosocomiales encontrados en la sangre; el paciente que presentamos estuvo expuesto a un catéter venoso profundo por 10 días, así como irrigación continua de la articulación por 5 días. Consideramos que durante el uso de estos dispositivos es que se produjo la colonización, con sus posteriores secuelas; en estudios de infecciones postoperatorias después de patologías óseas, el mayor número de infecciones del lecho operatorio fueron causadas por estafilococos epidermidis y el 30 % de los pacientes con estas infecciones no tenían comorbilidad, ni presentaban factores predisponentes que podrían ser correlacionados estadísticamente con un riesgo incrementado de infección. Los pacientes neutropenicos e inmunosuprimidos, así como los portadores de catéteres endovenosos o dispositivos protésicos son los que se encuentran en el grupo de mayor riesgo.
Debido a la alta frecuencia como contaminante, pero al mismo tiempo su importante rol patógeno, la interpretación de un único cultivo positivo a estafilococo epidermidis es subjetivo, ya que en algunos pacientes en riesgo de bacteriemia, la fiebre y otros síntomas inespecíficos pueden corresponder a otras causas. Lamentablemente en este caso sólo se obtuvo un hemocultivo positivo a estafilococo epidermidis, pero dada la presentación clínica, este resultado probablemente reflejaba una bacteriemia real y no un hallazgo incidental.
A diferencia del estafilococo aureus, se conoce poco sobre el mecanismo patogénico del estafilococo epidermidis, sin embargo, se reconoce como características de muchas cepas la formación de un biofilm, fabricado en base al ácido teicoico, el cual forma normalmente parte de la pared de estafilococo. Esta capa los protege de la acción de los neutrófilos y a su vez disminuye la penetración de los antibióticos, además la sustancia que también se le conoce como adhesina le confiere mayor afinidad por ciertas estructuras corporales como válvulas cardiacas o cartílagos, coloniza muy fácilmente materiales plásticos u otros que son utilizados en la fabricación de válvulas protésicas, implantes, catéteres, entre otros, ingresa fácil y frecuentemente por brechas en piel originadas por inserciones de catéteres, heridas quirurgicas, etc, situaciones presentes en el caso descrito.
Los estudios relacionados con la patogenia de las infecciones sobre material protésico causadas por S. epidermidis demuestran que se desarrollan en dos fases: en la primera, tiene lugar la adherencia de los microorganismos a la superficie del polímero de la prótesis, mediante interacciones hidrofóbicas, proteínas (SSP-1, SSP-2, Bhp) y polisacáridos (PS/A) de la pared celular bacteriana. Posteriormente, los estafilococos proliferan y sus factores de virulencia interaccionan con la matriz proteica formada a partir de componentes tisulares y séricos del hospedador (fibronectina, fibrinógeno, factor de Von Willebrand, etc.) que envuelve al cuerpo extraño. Esta película biológica generada sobre las superficies plásticas actúa como una barrera mecánica que protege a los microorganismos de la acción de los antibióticos y de los mecanismos de defensa del hospedador. Para conseguir erradicar la infección será imprescindible la retirada del material extraño.
Las manifestaciones clínicas de las infecciones causadas por estafilococos epidermidis difieren marcadamente de aquellas causadas por S. aureus. Los síntomas suelen ser sutiles e inespecíficos y el curso clínico es más subagudo e incluso crónico, sin signos fulminantes de infección, como en el caso presentado. También se describen casos de sepsis severa, especialmente en pacientes inmunosuprimidos, tienen procesos mórbidos asociados o simplemente son sometidos a procedimientos complejos como implantes de prótesis, catéteres de drenaje, entre otros.
El estafilococo epidermidis, dado que es un microorganismo de transmisión nosocomial, tiene una alta tasa de resistencia a múltiples antibióticos, cerca del 90 % produce betalactamasas, mientras que el 60 al 80 %, son resistentes a la meticillina, además estas bacterias suelen ser resistentes a macrólidos, lincosamidas, aminoglucosidos y fluorquinolonas. El fármaco de elección es la vancomicina asociada o no a la rifampicina, en tanto no se disponga del resultado del antibiograma y la duración del tratamiento varía con el tipo de infección, gravedad del cuadro clínico, la localización de la infección, la presencia o no de material extraño y la sensibilidad a los antimicrobianos de la cepa. Actualmente se han descrito cepas con sensibilidad disminuida a la vancomicina, por lo que la emergencia de resistencia a los glicopéptidos se convertirá en un serio problema de salud pública. El paciente evolucionó de manera adecuada con la vancomicina asociada a la clindamicina.Nuevos medicamentos y terapia actual
La Vancomicina : fue el primer glicopéptido que se aisló del Streptomyces orientales, existiendo actualmente en el mercado 2 moléculas (Vancomicina y Teicoplanina) y 2 más en investigación (Daptomicin y Ramoplanin), estos antibióticos han cobrado un auge tremendo con relación a la aparición de Staphylococcus aureus meticilino resistentes y Enterococos multirresistentes.
Mecanismo de acción: Inhibe el segundo paso de la síntesis del peptidoglucano de la pared celular, uniéndose a los precursores de la D-alanil -D-alanina y además, altera la permeabilidad de la membrana citoplasmática, teniendo efecto post-antibiótico.
Teicoplanina: a diferencia de vancomicina es más lipofílico, por lo que tiene mayor penetración intracelular, siendo su vida media más larga (40-70 hrs.), tiene alta unión proteica y lento aclaramiento renal, existiendo presentación intra-muscular con adecuada penetración tisular en general.
LINEZOLID: Es una nueva clase de antimicrobianos sintéticos: oxazolidinonas que actúan al inhibir de síntesis de proteínas a nivel de 50S, teniendo como gran ventaja una biodisponibilidad oral cercana al 100 %, teniendo un espectro de acción contra bacterias Gram positivas y dentro de ellas de S. aureus resistente a meticilina (MRSA) y GISA.
ESTREPTOGRAMINAS: Este nuevo grupo de antibióticos es derivado del Streptomyces pristinaspiralis (pristinamicin, virginamicin, synercid), los cuales son de acción bactericida al inhibir la función ribosomal 50S, siendo los usos clínicos aprobados para FDA: Infecciones de piel y partes blandas, infecciones por gram positivos resistentes y dentro de ellos se encuentra MRSA.
EVERNINOMICINA: Estos antibióticos oligosacaridos en fase de evaluación II y III (Avilamycin, evernimicin) se presentan en preparados parenterales, describiéndose actividad in vitro contra S. aureus Meticilina resistente, existiendo al momento limitada información sobre eficacia: infecciones de piel, respiratorias.REFERENCIAS BIBLIOGRAFICAS
1. Burke A. Antibiotic Resistance. Med Clin North Am. 2000; 84(6)
2. Turnidge J, Chang FY, Fowler VG. Staphylococcus aureus: Antimicrobial Therapy and Vaccines.Principles And Practice on Infectious Diseases. 2da ed.USA;2002.p. 631-58.
3. Fernández F, López J, Ponce LM, Machado C. Resistencia Bacteriana. Rev Cubana Med Milit.2003;32(1): 44-8.
4. Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, Karchmer AW, Carmeli Y. Comparison of Mortality Associated with Methicillin-Resistant and Methicillin-Susceptible Staphylococcus aureus Bacteremia: A Meta-analysis. Clin Infectious Diseases. 2006;36:53-9.
5. Melzer M, Eykyn SJ, Gransden WR,Chinn S. Is Methicillin-Resistant Staphylococcus aureus More virulent than Methicillin-Susceptible S. aureus ?. A comparative cohort Study of British Patients with Nosocomial Infection and bacteremia . CID. 2005; 37: 1453-60.
6. Salgado CD, Farr BM, Calfee DP. Community-acquired methicillin-resistant Staphylococcus aureus: a meta-analysis of prevalence and risk factors. Clin Infect Dis. 2003;36(2):131-9.
7. Salmenlenna S, LyytikainenVuopio-Varkila. Community-acquired methicillin-resistant Staphylococcus aureus . Finland. Emerg Infect Dis. 2007; 8: 602-7.
8. Powers JH. Development of drugs for antimicrobial-resistant pathogens. Curr Opin Infect Dis. 2003;16(6):547-51.
9. Von Eiff C, Proctor RA, Peters G. Coagulasa-negative staphylococci: pathogens have major role in nosocomial infections. Postgrad Med. 2007; 110: 63-76.
10. Acher G, Mandell, Douglas and Bennett's. Principles and Practices of Infectious Diseases. USA:Churchill Livingstone; 2006.p. 2092.
11. Archer G, Climo M. Antimicrobial susceptibility of coagulase-negative staphylococci. Antimicrob Agents Chemother. 2004; 38:2231-7.
12. Calvo J, Hernández JL, Fariñas MC, García-Palomo D, Agüero J. Osteomyelitis caused by Staphylococcus schleiferi and evidence of misidentification of this Staphylococcus species by an automated bacterial identification system. J Clin Microbiol. 2000; 38:3887-9.
13. De Paulis A, Predari S, Chazarreta C, Santoianni J. Five-test simple scheme for species-level identification of clinically significant coagulase-negative staphylococci. J Clin Microbiol. 2007; 41:1219-24.
14. Von Eiff C, Peters G, Heilmann C. Pathogenesis of infections due to coagulase-negative staphylococci. Lancet Infect Dis. 2002; 12:677-84.SUMMARY
We present the case of a male six-year-old child presenting pneumonia by staphylococcus epidermidis complicated with empyema, tension pneumothorax and parenchymatous bullas secondary to the left femur osteomyelitis. The patient was treated with vancomicine and clindamicine, evolving satisfactorily. We review the literature on infections by Staphylococus Epidermidis, germen that has been getting an increasing importance in the etiology of the intrahospital infections.
MeSH:
PNEUMONIA/diagnosis
STAPHYLOCOCCUS EPIDERMIDIS
OSTEOMYELITIS/drug therapy
FEMUR/surgery
CROSS INFECTION/etiology
HUMANS
MALE
CHILD,PRESCHOOLCÓMO CITAR ESTE ARTÍCULO
Breña Escobar D, Font Pavon L, Busto Aguiar R, Castellanos Ferreras ME, Reyes Carmenate V. Neumonía por Staphylococcus Epidermitis complicada con neumotórax a tensión, empiema y bulas parenquimatosas en un paciente con osteomielitis del fémur. Reporte de un caso. Rev méd electrón[Seriada en línea] 2009; 31(1). Disponible en URL: http://www.revmatanzas.sld.cu/revista%20medica/ano%202009/vol1%202009/tema15.htm [consulta: fecha de acceso]
.
.