Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica Electrónica
versión On-line ISSN 1684-1824
Rev.Med.Electrón. vol.37 no.5 Matanzas set.-oct. 2015
PRESENTACIÓN DE CASO
Infarto agudo del miocardio más doble lesión mitral en gestante del tercer trimestre
Acute myocardial infarct plus double mitral lesion in a pregnant woman in the third quarter
Dr. Raydel Manuel Rodríguez García, Dr. Raúl Pérez Sarmiento, Dr. Juan Orlando Roura Carrasco, Dra. Yohandra López Socarrás
Hospital Provincial Docente Clínico Quirúrgico Manuel Ascunce Domenech. Camagüey, Cuba.
RESUMEN
La incidencia de enfermedad coronaria durante el embarazo es de alrededor de 6,2/100 000. Se ha observado como principales factores de riesgo la edad maternal avanzada, la presencia de los factores de riesgo cardiovascular clásicos, la anemia severa y la necesidad de transfusión posparto. El infarto miocárdico agudo durante el embarazo y el posparto se ha asociado a una mortalidad de entre el 5,7 y el 37 %. Se presentó el caso de una gestante de 27 años de edad, con diagnóstico clínico, electrocardiográfico, enzimático y ecocardiográfico, de infarto agudo del miocardio con supradesnivel del segmento ST, de origen cardioembólico por doble lesión valvular mitral. Sí difirieron los procederes invasivos y la trombolisis, valorando las posibles complicaciones. Se realizó un manejo médico con betabloqueadores, diuréticos tiazídicos e inhibidores de la aldosterona, antiagregantes plaquetarios, anticoagulación con heparinas de bajo peso molecular, nitritos en su momento, hipolipemiantes y omeprazol. Se trataron oportunamente las complicaciones y se interrumpió el embarazo a las 34,2, semanas realizándose cesárea sin complicaciones. Tras su buena evolución, fue dada de alta y se programó la coronariografía en un mes a partir de la fecha de la cesárea.
Palabras clave: infarto agudo del miocardio, supradesnivel del segmento ST, doble lesión mitral, tercer trimestre, embarazo.
ABSTRACT
The coronary disease incidence during pregnancy is around 6.2/100 000. The mainly found risk factors have been: advance maternal age, the presence of classic cardiovascular risk factors, severe anemia and post-labor transfusion necessity. The acute myocardial infarct during pregnancy and post-labor has been associated to 5.7-37 % mortality. We presented the case of a pregnant woman aged 27 years with clinical, electrocardiographic, enzymatic and echocardiographic diagnosis of acute myocardial infarct with St-segment supra elevation, of cardioembolic origin due to a mitral valve double lesion. The invasive procedures and thrombolysis do differ when assessing the possible complications. We carried out a medical management with betablockers, thiazide diuretics and aldosterone inhibitors, platelet antiaggregator, anticoagulation with low molecular weight heparins, nitrites when needed, hypolipidemics and omeprazole. Complications were treated timely and pregnancy was interrupted at 34.2 weeks, carrying out a cesarean without complication. After good evolution, the patient was discharged and coronary angiography was programmed a month after the cesarean.
Key words: acute myocardial infarct, ST segment supra elevation, double mitral lesion, third semester, pregnancy.
INTRODUCCIÓN
Actualmente, un 0,2-4 % de todos los embarazos en los países industrializados occidentales se complican por enfermedades cardiovasculares (ECV), y el número de pacientes que sufre problemas cardiacos durante el embarazo aumenta. Sin embargo, el número de pacientes que acuden al médico individual es pequeño. No obstante, el conocimiento de los riesgos asociados a las ECV durante el embarazo y su tratamiento tiene una importancia fundamental para aconsejar a las pacientes antes del embarazo.(1) En los países occidentales, la cardiopatía materna es ahora la causa principal de muerte materna durante el embarazo.(2)
Se espera que el número de mujeres gestantes con enfermedad coronaria crezca debido a la edad gestacional materna avanzada, el desarrollo de técnicas reproductivas y el incremento de los factores de riesgo cardiovascular entre las mujeres.(3,4)
A pesar de que en los países desarrollados la fiebre reumática ha disminuido en los últimos años, sigue siendo un problema importante en los países en vías de desarrollo.(5)
La incidencia de enfermedad coronaria durante el embarazo es de alrededor de 6,2/100 000 en los Estados Unidos. Se ha observado como principales factores de riesgo la edad maternal avanzada, la presencia de los factores de riesgo cardiovascular clásicos, la anemia severa y la necesidad de transfusión posparto (que se ha atribuido a la utilización de oxitócicos).(6)
El infarto agudo del miocardio (IAM) durante el embarazo y el posparto se ha asociado a una mortalidad de entre el 5,7 y el 37 %.(7) La etiopatogenia del IAM durante el embarazo no se corresponde a la observada en otras situaciones. Acontece más frecuentemente antes del parto, en el 62 % de los casos; en el 13,5 % de los casos aparece en el período periparto (entre 24 horas antes del parto y 24 horas después), y en el 24 % de los casos en el posparto (pasadas más de 24 horas y hasta los 3 meses siguientes al parto). La mortalidad es mayor si sucede durante el parto.(8)
Se presenta una gestante de 27 años de edad, con diagnóstico clínico, electrocardiográfico, enzimático y ecocardiográfico, de infarto agudo del miocardio, con supradesnivel del ST, de sospechado origen cardioembólico por doble lesión valvular mitral.
PRESENTACIÓN DEL CASO
Gestante de 27 años de edad con antecedentes de salud aparente y tiempo de gestación por amenorrea de 27 semanas. Se recibe en nuestro servicio con motivo de ingreso: dolor en el pecho. El mismo se localizaba a nivel precordial, retroesternal, de carácter intenso, opresivo, con irradiación al cuello, mandíbula y región infraescapular izquierda. Sin alivio al reposo ni modificaciones con los cambios de posición. Refirió, además, ligera astenia y frialdad de la piel. Niega fiebre, síntomas catarrales, náuseas, vómitos, diarrea, sudoración, lipotimia y dificultad respiratoria, así como otros síntomas preguntados. Sin antecedentes patológicos personales, ni familiares, ni alergia a medicamentos, ni transfusiones previas, ni operaciones, ni traumatismos. Vacunación actualizada. Hábitos tóxicos: café (1 tacita diaria). Cinco embarazos, dos partos y dos abortos (instrumentados).
Datos de relevancia al examen físico
Útero grávido, dinámica uterina 0/10, movimientos fetales referidos y palpables, altura uterina 24 cm, dorso derecho, cefálico, no encajado.
A la auscultación respiratoria, polipnea ligera y murmullo vesicular ligeramente disminuido hacia las bases sin estertores. A la auscultación cardiovascular, primer ruido aumentado brillante, segundo ruido (2R) pulmonar ligeramente aumentado, chasquido de apertura mitral cercano al 2R, arrastre diastólico con reforzamiento presistólico (ritmo de Duroziev). Frecuencia cardiaca: 106 latidos por minuto (lpm) y presión arterial: 90/60 mmHg.
Complementarios al ingreso
Hematócrito: 0,35 vol%. Leucocitos: 18 x 109/L. Neutrófilos: 0,93. Linfocitos: 0,03. Tiempo de coagulación: 8 minutos. INR: 1,41. Conteo de plaquetas: 230 x 109/L. Glucemia: 4,2 mmol/L. Creatinina: 66,3 mmol/L. CK total: 326 UI; CK-MB: 89,76 UI (27 % de la CK total).
Rx de tórax (vista posterior anterior): partes blandas y óseas sin alteraciones. Silueta cardíaca pequeña, con arco de la arteria pulmonar rectificado. Se observan signos de congestión vascular ligera hiliar y parahiliar bilateral. No signos de condensación inflamatoria pulmonar. Ángulos costofrénicos y cardiofrénicos libres.
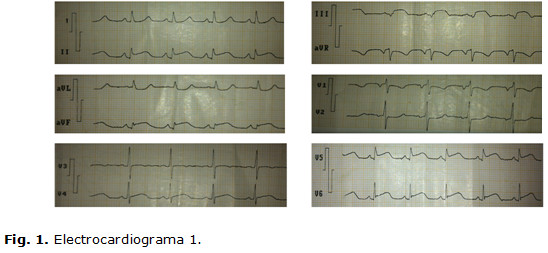
Electrocardiograma 1 (en sala de emergencia): ritmo sinusal, FC: 94 lpm; PR, QRS y QT normales; supradesnivel del ST-T de más de 2,5 mv en DII, DIII, aVF, V5 y V6; infradesnivel del ST-T en aVR. Q pequeña en DII, aVF, V5 y V6; QS en DIII. (Fig.1)
Electrocardiograma 2 (en UCI): ritmo sinusal, FC: 100 lpm; PR, QRS y QT normales; supradesnivel del ST-T de 1 mv en DII, V5 y V6, con T negativa en DIII y aplanada en aVF. Q en V5 y V6.
Evolución
La paciente a las pocas horas, tras las medidas generales, la oxigenoterapia con O2 por catéter nasal a 3 l/min, el reposo, anticoagulación con heparinas de bajo peso molecular (HBPM: fraxiheparina 0,6 ml subcutáneo cada 12 horas) y la administración de 25 mg de atenolol diario, el dolor desaparece manteniéndose estable en sus signos vitales, afebril, bien hidratada, sin signos de insuficiencia cardíaca, ni de congestión pulmonar, ni de hipoperfusión. Buena diuresis. Con iguales características el examen físico respiratorio y cardiovascular; y ligero edema en miembros inferiores.
Exámenes evolutivos de interés
Transaminasa glutámico oxalacética ligeramente elevada (TGO): 116 U/L.
CK universal: 321 U/L; CK-MB: 69,76 U/L.
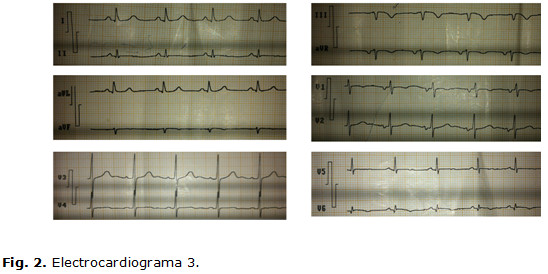
Electrocardiograma 3 (1er día de estadía): ritmo sinusal, FC: 78 lpm; PR, QRS y QT normales; T aplanada en DII, V5 y negativa en DIII, aVF y V6. Q pequeña en DII, V5 y V6, r embrionaria y S profunda en DIII y AVF. En DII largo se constata extrasístole ventricular monomórfico aislado. (Fig. 2)
ECG 4 y 5 (2doy 3er día de estadía): ritmo sinusal, FC: 75 lpm; PR, QRS y QT normales; T aplanada en DII, V5 y v6, negativa en DIII y aVF. Q pequeña en DII y V6, r embrionaria y S profunda en DIII y AVF.
ECG 6-9 (4to-7mo día de estadía): ritmo sinusal, FC: 72-75 lpm; PR, QRS y QT normales; regresan los cambios de la T en DII, V5 y V6 (se torna positiva), negativa en DIII y aVF. Q pequeña en DII, V5 y V6, r embrionaria y S profunda en DIII y AVF.
Ecocardiograma inicial al segundo día de su ingreso
Se describe un crecimiento de la aurícula izquierda (AI), con ventrículo derecho (VD) e izquierdo (VI) ligeramente aumentados de tamaño, según la superficie corporal de la paciente. Función sistodiastólica normal, con una fracción de eyección del VI del 70 %. Válvula mitral reumática, engrosada, moderadamente calcificada. Jet moderado de insuficiencia mitral. No se constata gradiente de insuficiencia tricuspídea (IT) para estimar hipertensión pulmonar. La válvula aórtica es trivalva sin gradientes patológicos. El pericardio posterior está ligeramente ecogénico con derrame de menos de 5 mm. No se observan masas intracardíacas.
Ecocardiograma evolutivo
Se confirma la doble lesión reumática mitral de moderada a severa con jet de insuficiencia hacia la pared posterolateral de la AI con ligera dilatación de la misma. VI ligeramente dilatado, no hipertrófico con función sistólica global conservada. Válvula aorta normofuncionante. Hipoquinesia y ligero afinamiento del septum basal y segmento inferobasal. Insuficiencia tricuspídea ligera que permite estimar una presión de la arteria pulmonar de 23 mmHg.
Ante estos hallazgos, evolución clínica favorable y ausencia de complicaciones, se decidió posponer la realización de la coronariografía hasta un mes después del parto; y se mantuvo hospitalizada bajo pauta de aspirina 125 mg diarios, atenolol 25 mg al día, hipolipemiantes y omeprazol.
A los 20 días de evolución con tiempo de gestación de 29,6 semanas y tras haber recibido las dosis de los inductores de la madurez pulmonar, realiza un edema agudo del pulmón cardiogénico. El mismo resuelve con diuréticos de asa (furosemida 20 mg), nitroglicerina sublingual 3 dosis, y luego furosemida 20 mg EV cada 12 horas, espironolactona 12,5 mg cada 12 horas, atenolol 25 mg cada 12 horas, e igual dosis de aspirina, heparinas de bajo peso molecular, hipolipemiantes y omeprazol. Se decidió por el equipo multidisciplinario interrumpir el embarazo al cumplir las 34 semanas por cesárea programada, esperándose 6 semanas desde el evento isquémico. A las 34,1 semanas hace otro evento de edema pulmonar cardiogénico, el cual resuelve con la medicación ya descrita.
Una semana antes ya se había suspendido el antiagregante plaquetario (aspirina) para minimizar las pérdidas hemáticas y facilitar determinados métodos anestésicos; colocándose HBPM de dosis profiláctica (0,3 ml subcutáneo cada 12 horas) a dosis terapéutica (0,6 ml subcutáneo cada 12 horas), retirándose 24 horas antes de la cesárea y colocándose heparina sódica en infusión continua titulándose dosis terapéutica por tiempo de tromboplastina activado hasta 6 horas antes del acto quirúrgico.
Se programa la cesárea y se interrumpe a las 34,2 semanas decidiéndose como método anestésico: anestesia general endotraqueal. A su llegada al quirófano, la enferma estaba asintomática y en clase II de la NYHA. Se monitorizaron continuamente los siguientes parámetros: frecuencia cardíaca, frecuencia respiratoria, trazado electrocardiográfico, oximetría de pulso, presión arterial no invasiva, y foco fetal.
Se induce con 150 ug de fentanilo endovenoso, 2 mg de vecuronio y 100 mg de Lidocaína endovenosos; luego 10 mg de midazolan y 4mg de Vecuronio endovenosos sin complicaciones. Intubación fácil, única, de secuencia rápida, con tubo endotraqueal No. 7,5; y se acopla a máquina de anestesia fabius en volumen control con un volumen tidal a razón de 7 mL/Kg, frecuencia respiratoria de 12 rpm, volumen minuto de 5,04 L/min, FiO2 al 40 %, relación inspiración-espiración 1:2 y con presiones intrapulmonares normales. Se mantiene monitoreo estricto de signos vitales, pulsioximetría, capnografía, registro electrocardiográfico, parámetros ventilatorios, gasométricos y pérdidas hemáticas.
Cursa con un transoperatorio estable, bajo drogas de mantenimiento con método balanceado: midazolam 10 mg, fentanilo 100 ug y vecuronio 4 mg. Tiempo anestésico de 35 minutos y operatorio de 20 minutos. Se administró en total 1 000 mL de solución salina fisiológica al 0,9 % y se constataron 400 mL de pérdidas hemáticas (que representaron el 7,7 % de la volemia).
Después del parto se realizó el masaje uterino, para intentar garantizar la hemostasis del lecho placentario en el sentido de disminuir las necesidades de oxitocina. Se administraron 20 unidades de la misma vía endovenosa diluidas en 100 mL de dextrosa al 5 % en 1 hora. Se realizó la ligadura tubárica previamente consentida de modo informado.
Tras signos de recuperación se decurariza con 1,5 mg de neostigmina más 0,5 mg de atropina, y se revierte sedación con 1 mg de flumazenil. Se extuba sin complicaciones y sale despierta y respirando espontáneamente del salón.
La aspirina fue restituida en 24 horas posparto, al igual que la fraxiheparina a 0,3 ml subcutáneos cada 12 horas. Se restituyó además tratamiento con furosemida 20 mg cada 12 horas, espironolactona 12,5 mg cada 12 horas, propranolol 40 mg cada 8 horas, hipolipemiantes y omeprazol.
Tras su buena evolución, fue dada de alta de la unidad de cuidados intensivos a los 5 días, y se programó la coronariografía en un mes a partir de la fecha de la cesárea.
DISCUSIÓN
Indudablemente son pocos los casos de IAM descritos en la literatura. Se describen entre 144 y 200 casos a nivel de la bibliografía consultada.
La cardiopatía en el embarazo se considera la primera causa de morbimortalidad materna de causa no obstétrica. Las cardiopatías reumáticas y congénitas son las más frecuentes en la mujer embarazada, seguidas por la cardiopatía hipertensiva, la cardiopatía isquémica y las arritmias.(6)
La enfermedad coronaria es rara en las mujeres en edad fértil y la aparición de infarto de miocardio (IAM) periparto se puede considerar casi anecdótica, de forma que su diagnóstico se retrasa a menudo durante el embarazo, debido a su bajo nivel de sospecha.(9) Sin embargo, esta patología se asocia a una elevada mortalidad. Un IAM que ocurre alrededor de dos semanas previas o posteriores al parto está ligado a una mortalidad del 45 %.(10)
Son muchos los cambios que sufre el aparato cardiovascular durante el embarazo y no es de extrañar el diagnóstico de valvulopatías desconocidas hasta ese momento. Los principales cambios fisiológicos durante la gestación son el incremento del volumen plasmático, la frecuencia cardiaca y el gasto cardiaco y el descenso de las resistencias periféricas.(11) El incremento del volumen sanguíneo (30-50 %) es un proceso adaptativo, inducido por la demanda metabólica del feto, que empieza en la sexta semana de gestación, alcanza su máximo entre las semanas 20 y 24 y se mantiene hasta el parto. A medida que este volumen plasmático aumenta, se produce un aumento paralelo del gasto cardiaco (GC) (30-50 %). Al principio de la gestación, este incremento es atribuible al volumen sistólico, mientras que, con el avance de la gestación, el aumento de la frecuencia cardiaca constituye el factor predominante.(12) Debido a esta situación hiperdinámica, prácticamente todas las mujeres presentan un soplo suave y mesosistólico en la auscultación durante el embarazo. Ocasionalmente, dado el incremento del flujo mamario, se puede auscultar un soplo continuo. A pesar de que un soplo diastólico puede ser fisiológico durante el embarazo, se debe descartar cardiopatía si la hay. Este incremento del GC no es constante, ya que existe una fluctuación por la posición materna: la compresión de la vena cava inferior por el útero grávido en decúbito supino disminuye el retorno venoso, lo que implica un descenso en el GC.(13)
Los diámetros ventriculares aumentan ligeramente, aunque se mantienen dentro del límite de la normalidad. La contractilidad del ventrículo izquierdo se deprime ligeramente, pero la fracción de eyección se mantiene, dadas las condiciones de precarga y poscarga.(14) Las velocidades transvalvulares aumentan debido al estado hiperdinámico y la presencia de insuficiencia valvular ligera es normal.(15) El diámetro de la raíz aórtica también aumenta durante el embarazo.(16)
Por último, el descenso de las resistencias vasculares periféricas es de alrededor del 30 % y constituye un factor fundamental de los cambios fisiológicos durante la gestación. Esta reducción de la poscarga se debe a que la placenta es un circuito de alto flujo y baja resistencia. Las presiones pulmonares permanecen normales durante el embarazo; probablemente se produce una reducción de las resistencias vasculares pulmonares que compensa el incremento del flujo sanguíneo.
Durante el parto se producen cambios hemodinámicos muy importantes a causa del dolor, la ansiedad y las contracciones uterinas. Los dos primeros tienen efectos significativos en la frecuencia cardiaca y la presión arterial, tanto la presión sistólica (PAS) como la diastólica (PAD) aumentan durante las contracciones y especialmente durante la fase expulsiva del parto. Además, las contracciones uterinas implican un incremento agudo de un 50 %, tanto en la frecuencia cardiaca como en el volumen intravascular, dado que en cada contracción uterina de 300 a 400 ml de sangre se transfieren desde el útero hacia la circulación y, por tanto, el GC aumenta un 50 % en cada contracción. La magnitud de este incremento es superior cuanto más avanzado es el parto.(16)
A pesar de la hemorragia externa, el gasto cardiaco aumenta en el posparto inmediato, de un 60 a un 80 %, lo que se debe a la descompresión de la vena cava inferior y a la transferencia de sangre desde el útero contraído. Por ello, el período posparto especialmente implica riesgo en las gestantes con cardiopatía, y se ha descrito que gran parte de las complicaciones se producen en dicho período.(15)
El diagnóstico de IAM durante el embarazo o puerperio se confirma de la misma forma que en pacientes no gestantes. Este puede retrasarse debido al bajo nivel de sospecha, debiendo tener en cuenta aspectos importantes. Primero, que hasta el 37 % de las mujeres sometidas a cesárea tienen alteraciones de la repolarización que no reflejan isquemia miocárdica y que el parto vaginal puede aumentar la creatininfosfocinasa y su fracción MB sin existir necrosis miocárdica. Por otro lado, el diagnóstico diferencial del IAM se realiza con patologías que son más frecuentes en pacientes obstétricas como pueden ser el tromboembolismo pulmonar o la preeclampsia. Si bien la clínica puede dar lugar a confusión con manifestaciones normales del embarazo, el diagnóstico se realiza de forma primaria con un electrocardiograma, y más tarde con alteración de las enzimas cardiacas.(1)
La ecocardiografía es un método diagnóstico seguro y fácil de realizar en la paciente gestante en cualquier momento del embarazo. La gammagrafía de perfusión miocárdica con talio-201 o tecnecio-99 debe reservarse a aquellos casos en los que sea estrictamente necesario, debido a la exposición fetal a las radiaciones.(3)
La coronariografía se realizará en aquellos casos donde se sospeche la necesidad de una actitud terapéutica concreta e inmediata (angioplastia, stent, fibrinolisis local e incluso cirugía urgente).(16)
El tratamiento médico es el habitual, la utilización de fibrinolíticos solo está indicada ante un diagnóstico precoz y en situación extrema, debido a la incidencia de hemorragias en el feto y la madre; y al riesgo de parto prematuro. Los vasodilatadores coronarios (nitritos) son seguros para el feto siempre que se ajuste la dosis para evitar hipotensiones.(2) La aspirina a bajas dosis no ha demostrado efectos adversos sobre el feto. La heparina no atraviesa la placenta, no es teratogénica y no se asocia a elevación de la morbilidad fetal, por lo que constituye el anticoagulante de elección durante el embarazo, siendo las heparinas de bajo peso molecular una excelente alternativa a la no fraccionada, debido a su gran biodisponibilidad.(17)
Los fármacos betabloqueantes y calcioantagonistas (en especial el nifedipino) son seguros, estando contraindicada la utilización de los inhibidores de la enzima convertidora de angiotensina, por el riesgo que implica la causa de hipotensión, fallo renal y muerte neonatal.(18-20)
La forma de terminar el embarazo en la paciente gestante que ha sufrido un IAM debe ser valorado conjuntamente por cardiólogos, anestesistas y obstetras, basándose primordialmente en razones obstétricas y en la situación clínica de la paciente.(14)
La cesárea electiva permite controlar sobre el momento del parto y evitar el período de dilatación. La anestesia epidural minimiza el riesgo de inestabilidad hemodinámica por el bloqueo simpático, la anestesia intradural no es apropiada, ya que se asocia a un bloqueo simpático de instauración rápida y brusca con una mayor incidencia de hipotensión y taquicardia refleja. En caso de optar por realizar una anestesia general, se debe tener en cuenta el estrés que supone el momento de intubación y extubación de la paciente, así como el riesgo de broncoaspiración de toda gestante. Independientemente de la técnica anestésica que se realice, toda cesárea implica desventajas asociadas como son: la elevada pérdida sanguínea, el riesgo de infecciones, el dolor agudo postoperatorio, lo cual aumenta el riesgo de nuevos episodios isquémicos.(21-23)
Muchos autores recomiendan evitar el uso de oxitocina o ergotamina en bolo intravenoso o intramuscular, tanto en el parto como en el postparto, debido al riesgo de hipotensión, taquicardia, aumento del gasto cardiaco, de espasmo coronario y muerte súbita que implica. Sin embargo, los efectos adversos de la infusión lenta endovenosa son menos marcados, poco frecuentes y más fácilmente reversibles. Se debe valorar el riesgo-beneficio de la administración lenta de oxitocina bajo monitorización hemodinámica exhaustiva, ya que probablemente los efectos cardiovasculares de una hemorragia postparto en una parturienta con enfermedad coronaria son potencialmente más serios que dicha infusión.(24)
La ligadura tubárica era particularmente importante, pues la función ventricular izquierda estaba moderadamente comprometida, y no era pertinente otro embarazo.(22)
La decisión de practicar métodos diagnósticos y terapéuticos invasivos previos al parto u optar por tratamiento médico, así como la elección de parto vaginal o cesárea, debe de ser tomada de forma individualizada por el equipo médico implicado en el proceso.(16) Y sin lugar a dudas enfrentarse a una gestante infartada, sea cual sea la causa, continúa siendo un reto para los equipos multidisciplinarios que atendemos a las maternas gravemente enfermas.
REFERENCIAS BIBLIOGRÁFICAS
1- Dalmia S, Ruprai CK, Masson EA, Allan BJ, Oboh A, Lindow SW. Spontaneous coronary artery dissection in pregnancy. J Obstet Gynaecol [Internet]. 2013 Oct [citado 12 Ene 2015];33(7). Disponible en: http://informahealthcare.com/doi/abs/10.3109/01443615.2013.820270?journalCode=jog
2- Schmiegelow MD, Andersson C, Køber L, Andersen SS, Olesen JB, Jensen TB, Azimi A, Nielsen MB, Gislason G, Torp-Pedersen C. Prepregnancy obesity and associations with stroke and myocardial infarction in women in the years after childbirth: a nationwide cohort study. Circulation [Internet]. 2014 Jan 21 [citado 12 Ene 2015];129(3):330-7. Disponible en: http://circ.ahajournals.org/content/129/3/330.full
3- Nickens MA, Long RC, Geraci SA. Cardiovascular disease in pregnancy: (women's health series). South Med J [Internet]. 2013 Nov [citado 12 Ene 2015];106(11):624-30. Disponible en: http://europepmc.org/abstract/med/24192594
4- Uebing A, Steer P, Yentis S, Gatzoulis MA. Pregnancy and congenital heart disease. BMJ. 2012;332(7538):401-6. Citado en PubMed; PMC: 1370974.
5- Bezgin T, Elveran A, Doğan C, Karagöz A, Külahçioğlu S, Kahveci G, Metizn Esen A. Acute ST-elevation myocardial infarction in early puerperium due to severe left main coronary stenosis in a woman with familial hyperlipidaemia. Cardiovasc J Afr. 2013 May 23;24(4):313-6.
6- Sliwa K, Böhm M. Incidence and prevalence of pregnancy-related heart disease. Cardiovasc Res [Internet]. 2014 Mar 15 [citado 12 Ene 2015];101(4):554-60. Disponible en: http://cardiovascres.oxfordjournals.org/content/101/4/554.full-text.pdf
7- Ladner HE, Danielsen B, Gilbert W. Acute myocardial infarction in pregnancy and the puerperium: a population-based study. Obstet Gynecol [Internet]. 2005 [citado 12 Ene 2015];105:480-4. Disponible en: http://journals.lww.com/greenjournal/Fulltext/2005/03000/Acute_Myocardial_Infarction_in_Pregnancy_and_the.6.aspx
8- De Miguel S, García A, Hernández JM, De la Fuente P. Infarto agudo de miocardio durante el primer trimestre del embarazo. Progresos Obstet Gynecol [Internet]. 2003 Mar [citado 12 Ene 2015];46(12):564-7. Disponible en: http://www.sciencedirect.com/science/article/pii/S0304501303759500
9- Mohammed S, Karnawat R, Bhatia P, Biyani G. Myocardial infarction during pregnancy: A rare occurrence. Indian J Anaesth [Internet]. 2014 Jan [citado 12 Ene 2015];58(1):94-6. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3968674/
10- O’Shanahan Navarro G, García Martul M, Santana Cabrera L, Eugenio Robaina P, Hernández Medina E, Sánchez Palacios M. Síndrome coronario agudo sin elevación del ST durante el embarazo. A propósito de un caso. Med Intensiva [Internet]. 2006 [citado 12 Ene 2015];30(4):180-2. Disponible en: http://scielo.isciii.es/scielo.php?pid=S0210-56912006000400007&script=sci_arttext
11- Poppas A, Shroff S, Korcarz CE, Hibbard JU, Berger DJ, Lindheimer MD, et al. Serial assessment of the cardiovascular system in normal pregnancy. Circulation [Internet]. 1997 [citado 12 Ene 2015];95:2407. Disponible en: http://circ.ahajournals.org/content/95/10/2407.full
12- Elkayam U, Jalnapurkar S, Barakkat MN, Khatri N, Kealey AJ, Mehra A, Roth A. Pregnancy-associated acute myocardial infarction: a review of contemporary experience in 150 cases between 2006 and 2011. Circulation [Internet]. 2014 [citado 12 Ene 2015];129(16):1695-702. Disponible en: http://circ.ahajournals.org/content/129/16/1695.full
13- Mittal SR. Acute myocardial infarction in a 20 year pregnant female with prosthetic mitral valve. J Assoc Physicians India [Internet]. 2013 Sep [citado 12 Ene 2015];61(9):664-5. Disponible en: http://europepmc.org/abstract/med/24772710
14- Smukowska-Gorynia A, Mularek-Kubzdela T, Araszkiewicz A. Recurrent acute myocardial infarction as an initial manifestation of antiphospholipid syndrome: treatment and management. Blood Coagul Fibrinolysis [Internet]. 2015 [citado 28 Ene 2015];26(1). Disponible en: http://journals.lww.com/bloodcoagulation/Abstract/2015/01000/Recurrent_acute_myocardial_infarction_as_an.15.aspx
15- Zoet AM, NijBijvank SW, Remkes WS, Lely AT. Pulmonary oedema in pregnancy: myocardial infarction as a possible cause. Ned Tijdschr Geneeskd [Internet]. 2014 [citado 28 Ene 2015];158:A6925. Disponible en: http://europepmc.org/abstract/med/24780570
16- Pérez-Lozana B, García A, Lobato F, Rupérez A, Franco JA, Gosalbez J. Cesárea en una paciente con infarto agudo de miocardio durante la gestación. Rev Esp Anestesiol Reanim [Internet]. 2007 [citado 28 Ene 2015];54:188-191. Disponible en: http://www.sedar.es/vieja/restringido/2007/n3_2007/9.pdf
17- Koneru J, Cholankeril M, Patel K, Alattar F, Alqaqa A, Virk H, Shamoon F, Bikkina M. Postpartum coronary vasospasm with literature review. Case Rep Cardiol. 2014;2014:523023. Citado en PubMed; PMC4109216.
18- Tamhane P, O’Sullivan G, Reynolds F. Oxytocin in parturients with cardiac desease. Int J ObstetAnesth. 2006;15(4) 332-3.
19- Janion-Sadowska A, Sadowski M, Zandecki L, Kurzawski J, Polewczyk A, Janion M. Pregnancy after myocardial infarction and coronary artery bypass grafting - is it safe? Postepy Kardiol Interwencyjnej. 2014;10(1):29-31. Citado en PubMed; PMC4007295.
20- Pacheco LD, Saade GR, Hankins GD. Acute myocardial infarction during pregnancy. Clin Obstet Gynecol [Internet]. 2014 Dec [citado 28 Ene 2015];57(4):835-43. Disponible en: http://journals.lww.com/clinicalobgyn/Abstract/2014/12000/Acute_Myocardial_Infarction_During_Pregnancy.21.aspx
21- McLachlan CS, Tay SK, Almsherqi Z, et al. Atherothrombotic events and clopidogrel therapy. CMAJ. 2007;176:349. Citado en PubMed; PMC1780104.
22- Nasser S, Von Heymann C, Feldheiser A, Schäfer-Graf U, Klempert I, Pöllinger A, et al. A rare case of ovarian cancer in pregnancy complicated by pulmonary embolus and myocardial infarction: management dilemmas. J Surg Case Rep. 2014 Oct 13;2014(10). Citado en PubMed; PMC4194630.
23- Pires Duarte F, O’Neill P, João Centeno M, Ribeiro I, Moreira J. Infarto Agudo del miocardio en la 31ª Semana de Embarazo - Relato de Caso. Rev Bras Anestesiol [Internet]. 2011 [citado 28 Ene 2015];61(2):120-3. Disponible en: http://www.scielo.br/pdf/rba/v61n2/es_v61n2a12.pdf
24- Levy DM, Olufolabi AJ, Charlton GA. Anaesthesia for Caesarean section in women with heart disease. Br J Anaesth [Internet]. 2003 [citado 28 Ene 2015];90:401-2. Disponible en: http://bja.oxfordjournals.org/content/90/3/401.full
Recibido: 13 de febrero de 2015.
Aceptado: 12 de junio de 2015.
Raydel Manuel Rodríguez García. Hospital Provincial Docente Clínico Quirúrgico Manuel Ascunce Domenech. Carretera Central Oeste Km 4 1/2. Camagüey, Cuba. Correo electrónico: raydelrg@nauta.cu