INTRODUCCIÓN
La cisticercosis es una infección causada por Cysticercus cellulosae, forma larvaria del helminto Taenia solium o “tenia del cerdo”, que puede producir dos formas de infección: teniasis intestinal (tenias maduras) o por cisticercos que anidan en distintos órganos y tejidos. Cuando la localización de los cisticercos es en el sistema nervioso central se denomina neurocisticercosis (NCC).1
La neurocisticercosis es la enfermedad parasitaria más frecuente del sistema nervioso central en todo el mundo. Su cuadro clínico puede ser asintomático o provocar una gama de manifestaciones clínicas, siendo la principal causa de convulsiones y epilepsia en países en vías de desarrollo. La Taenia solium, pertenece al reino animal, filo Platyhelminthes, clase cestoda, orden Cyclophyllidea, familia Taeniidae y género Taenia.2
La cisticercosis humana es una enfermedad antigua. Hay evidencias que sugieren su presencia en el Antiguo Egipto y en el Imperio Romano. Los antiguos griegos describieron lesiones quísticas en las lenguas de los cerdos y los consideraban animales impuros, como posteriormente lo hicieron los musulmanes. Es probable que la sospecha de su origen haya sido lo que llevó a las religiones judaica e islámica a prohibir la ingesta de carne de cerdo.3
En 1558 Gessner, y en 1588 Rumler, describieron el estado larvario de Taenia solium (cisticercos) en humanos.1 En el Perú de 1792, Hipólito Unanue, desconociendo aún el diagnóstico de cisticercosis, escribe una nota donde lamenta no disponer de una mesa de autopsias acerca de un soldado fallecido a raíz de una crisis epiléptica de tres días de duración durante la cual, entre otras medidas, le fueron suministrados purgantes, llevándolo a excretar una tenia.3 Pero no será hasta mediados del siglo XIX, cuando patólogos alemanes - Friedrich Küchenmeister (1855) y Rudolf Leuckart (1856)- identifican la Taenia solium como la misma causa de la teniasis intestinal y la cisticercosis, cerrando su ciclo biológico. Los brotes de NCC en soldados repatriados de la India a Reino Unido en el siglo XX, o la epidemia en Papúa Guinea tras la importación de cerdos desde Indonesia en la década de 1970, son una muestra de que la NCC puede manifestarse años después de la infestación.4
La Organización Mundial de la Salud considera que la NCC es la parasitación cerebral más frecuente en el mundo y la primera causa prevenible de epilepsia. Es endémica en países subdesarrollados, con excepción del mundo musulmán y muy prevalente en América Latina, África Subsahariana, India, China, Sudeste de Asia y algunas islas de Oceanía.2 Se estima que existen entre 3 y 8 millones de pacientes con NCC en el mundo, y de 2,5 a 4 millones de epilépticos por esta enfermedad, que causa al menos 50 000 muertes al año.
La prevalencia de la NCC es difícil de determinar, dada la inespecifidad de sus manifestaciones clínicas y que en la mitad de los casos cursa de forma asintomática. En una revisión publicada en 2015, en 39 271 participantes provenientes de 19 países de África, Latinoamérica y Asia, se encontraron seroprevalencias de 17,37 % en África, 13,03 % en Latinoamérica y 15,68 % en Asia, lo que demuestra la elevada distribución mundial de la enfermedad;5 en India se describe un 0,89 %.
En América Latina, hasta 2005, unos 75 millones de personas (incluyendo niños y adultos) vivían en zonas donde la cisticercosis es endémica; aproximadamente 400 000 padecían la enfermedad sintomática en zonas donde la neurocisticercosis es la principal causa de convulsiones, o sea, el 32,3 % de los epilépticos lo son por NCC. Colombia notifica seroprevalencia desde un 14,9 % hasta un 52,9 %.6 En México, Guatemala, Perú, Ecuador y Bolivia se ha estudiado la prueba de inmunoblot en poblaciones rurales, con positividad entre 4,9 y 34 %. En Perú, la enfermedad es diagnosticada entre el 10 y el 12 % de las consultas neurológicas, y los estudios en zonas rurales han demostrado que hasta el 8 % de la población presenta anticuerpos, los cuales también han sido encontrados entre el 30 y el 60 % de los cerdos estudiados. En una comunidad rural de la costa norte de Perú, se encontró una seroprevalencia de 24,2 %, en tanto que en una comunidad de los Andes centrales, fue de 3,3 %.5
Otro país latinoamericano con numerosos estudios epidemiológicos sobre cisticercosis es México, donde en comunidades rurales se han encontrado prevalencias de 4,9 a 43,8 %. En Brasil se halló una seroprevalencia del 24 %, mientras que en otras comunidades rurales similares se detectaron prevalencias bajas, de solo 3,4 y 5,7 %. En Ecuador, se registró una seroprevalencia de 8,6 %, al igual que en Colombia, donde se notificó un 8,55 %.6,7
La NCC es excepcional en países desarrollados, pero en las últimas décadas ha resurgido con relación a la inmigración desde zonas endémicas y con los viajes. En Estados Unidos hay un notorio aumento de casos de NCC, más en Texas y California, donde un 2 % de casos de epilepsia atendidos en urgencias se deben a esta enfermedad. En España se consideraba endémica entre 1960 y1970, pero con el desarrollo sociosanitario de las últimas décadas se ha observado una importante disminución en su prevalencia; sin embargo, persisten casos autóctonos al igual que en otros países europeos, donde la incidencia de NCC es aún mayor, como Portugal y varios países del Este, como Polonia y Rusia.3,8
En un estudio realizado en la provincia de Huambo, en Angola, entre 2011 y 2013, se observaron prevalencias que oscilan de 5,1 a 21,6 %.8 A pesar de que la incidencia de esta entidad clínica es frecuente en el continente africano, no existen abundantes publicaciones al respecto. En consecuencia, se describir un caso clínico de neurocisticercosis activa en la provincia de Bie.
PRESENTACIÓN DEL CASO
Nombre: Emiliana Natalia
Edad: 10 años
Área: Consulta Externa de Neurología
MI: Movimientos involuntarios.
HEA: Paciente negra, femenina, de 10 años, procedente de zona rural. Acude a consulta traída por la madre, quien refiere que desde hace aproximadamente seis meses la niña comenzó a presentar pérdida de la visión, disminución de la fuerza muscular, sobre todo del lado derecho del cuerpo, tuvo episodios de alucinaciones, dolores de cabeza, lenguaje incoherente, y desde hace siete días, movimientos involuntarios de todo el cuerpo, de duración aproximada de 5 minutos, con una frecuencia diaria y hasta dos veces al día, por lo que acude al servicio, donde se decide su ingreso para mejor estudio y tratamiento.
Examen físico positivo
Neurológico: Paciente aparentemente invidente, desorientada en tiempo, espacio y persona, con lenguaje incoherente y agitación psicomotora. Disminución de fuerza muscular en hemicuerpo derecho, con maniobras de Barré y Minganzini positivas.
Exámenes complementarios
Informe de la tomografía axial computarizada:
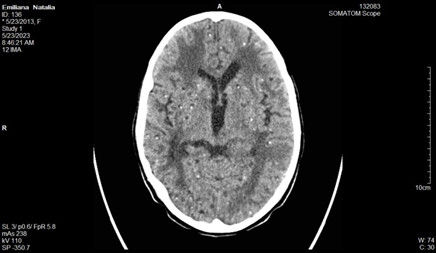
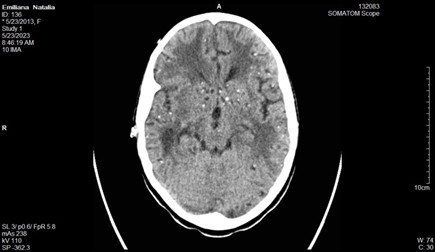
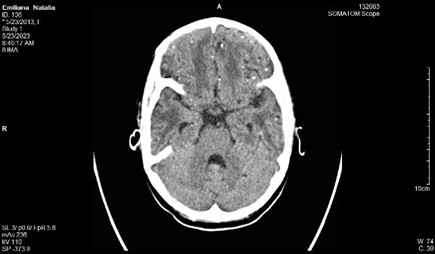
Se realizan cortes a 3 mm, observándose presencia de múltiples lesiones focales diseminadas por todo el parénquima cerebral, con distribución aleatoria, muchas de las cuales presentan calcificaciones, y otras son de aspecto quístico en relación con neurocisticercosis. (Figuras 1, 2, 3 y 4)
No se definen alteraciones del sistema ventricular; no desplazamiento de estructuras de la línea media, y no alteraciones óseas.
Se realiza interconsulta con Oftalmología, y se diagnostica ceguera cortical.
Se decide el traslado de la paciente al hospital provincial y su ingreso en Pediatría, con tratamiento específico, iniciándose manejo cesticida, anticonvulsivante y antinflamatorio.
Indicaciones:
Prednisona (20 mg): 2 comprimidos diarios durante 5 días, y luego reducción de dosis paulatinamente.
Praziquantel (500 mg): 1 comprimido 8/8 h durante 14 días.
Furosemida (40 mg): 1/4 comprimido 12/12 h.
Carbamacepina (200 mg): 1 comprimido 12/12h.
Medir tensión arterial diario.
DD: epilepsia sintomática en curso de neurocisticercosis activa.
DISCUSIÓN
La Taenia solium es plana, como otros gusanos platelmintos, y vive en el tracto gastrointestinal del huésped único huésped definitivo: el ser humano. Los cerdos pueden ingerir los huevos liberados en el medio, y estos huevos maduran en la luz intestinal porcina a oncosferas, que son capaces de atravesar la mucosa intestinal y alcanzar la circulación sanguínea. Se diseminan a través de la sangre y anidan en diferentes tejidos y órganos del cerdo, en especial el músculo estríado, madurando a cisticercos. El hombre, al comer carne de cerdo poco cocinada, puede ingerir los cisticercos, que formarán la tenia adulta en su intestino. El cerdo es el huésped intermediario habitual, aunque excepcionalmente lo pueden ser otros animales, como corderos, gatos y perros. Por otra parte, las personas pueden ingerir huevos que contaminan el ambiente (aguas, vegetales) o a través de transmisión oral-fecal de un portador con teniasis. Estos huevos, al atravesar la mucosa intestinal humana, de forma similar a lo que ocurre en el cerdo, desarrollarán cisticercosis en diferentes órganos y tejidos, como el músculo estriado, pero con especial afectación del sistema nervioso central, causando la NCC. La Taenia solium tiene la particularidad de tener al ser humano como huésped definitivo y como huésped intermediario. Por tanto, si la persona ingiere el cisticerco de la carne de cerdo infestada, desarrollará la teniasis intestinal; si ingiere huevos por transmisión persona a persona, transmisión oral-fecal, e incluso autoinfestación, desarrollará cisticercosis. En el 10-25 % de los pacientes con NCC existe doble infestación, es decir, tienen teniasis intestinal concomitante.1
En el sistema nervioso central los parásitos se alojan en el espacio subaracnoideo (forma meníngea), en ventrículos cerebrales (forma ventricular) y en el parénquima cerebral y de médula espinal (forma parenquimatosa). Los que se encuentran en los ventrículos cerebrales y los subaracnoideos, son más grandes y con frecuencia multilobulados (forma racemosa). Los parenquimatosos, por lo general, son vesículas únicas, ovoides o esferoides, más o menos homogéneas, de 0,5 a 1 cm de diámetro, que son las que se observan regularmente en el paciente pediátrico, y con frecuencia se presentan como una lesión única.2
La forma parenquimatosa siempre se localiza en las zonas más vascularizadas, como son la sustancia gris cortical y los núcleos subcorticales, aunque no es raro encontrarlos en la sustancia blanca subcortical. Son con mayor frecuencia afectados los hemisferios cerebrales y menos el tallo cerebral, cerebelo o médula espinal. En la forma ventricular, las vesículas afectan al cuarto ventrículo con más frecuencia. Las subaracnoideas pueden encontrarse en forma aislada; están sobre todo en la convexidad de los hemisferios cerebrales. El otro tipo es la racemosa, que se forman en las cisternas subaracnoideas de la base, del opérculo, cerebelo, mesencefálica, ambiens y en la magna. En la mayoría de los casos, se muestran las vesículas en localización mixta.9 El mayor determinante de la clínica de la NCC y de su pronóstico es la localización parenquimatosa (40-62 %), que es la más frecuente, o extraparenquimatosa (27-56 %) de los cisticercos. En un 20 % de los casos coexisten las dos localizaciones. Las lesiones cerebrales únicas son más frecuentes en los jóvenes, mientras que la afectación extraparenquimatosa y la presencia de un mayor número de quistes, son más frecuentes en edades avanzadas.10
La edad en que aparecieron las manifestaciones clínicas en este caso fue 10 años. Los estudios realizados a nivel internacional varían mucho en este aspecto. Se desconoce el tiempo que transcurre entre la infección y sus manifestaciones clínicas, porque existen pacientes con síntomas ya en el primer año de vida. La mayoría de los estudios publicados sobre neurocisticercosis afirman que la enfermedad es más común en adultos jóvenes, debido a su largo período de incubación.6
La infección puede ocurrir a lo largo de toda la vida, con un pico a los 5 y otro a los 15 años de edad, mientras que la clínica se suele manifestar entre los 15 y 40 años en la mayoría de los casos. La neurocisticercosis no es frecuente en los niños. Los pacientes menores de 17 años representan el 0,8-27,8 % de los casos; esta menor frecuencia ha sido atribuida al prolongado período de incubación de la enfermedad, que va desde varios meses hasta 30 años (promedio de 4,8 años). En general, los cisticercos pueden permanecer asintomáticos durante períodos prolongados. La mayoría de los síntomas ocurren después de que el quiste inicia su proceso de degeneración, debido a la respuesta inflamatoria que induce. En población pediátrica, se ha visto un leve predominio en féminas (55,3 %); la edad media del diagnóstico es de 7,7 años (media de 7,44 ± 3,76 años).11
Esta edad de presentación del caso coincide con algunos estudios realizados en Latinoamérica, en países como Honduras y Costa Rica, donde plantean de 5 a 8 años,4 al igual que Colombia, donde la media de la edad de los pacientes fue 10,4 años.9 En otros estudios realizados en España, Venezuela, Perú y Guatemala, describen una mayor incidencia entre los 20-50 años,1-3,7 al igual que en un estudio realizado en el propio país de Angola.8
Con respecto al sexo más afectado, los estudios realizados al respecto varían. De forma general, la prevalencia de NCC es mayor en los hombres. Por otro lado, hay investigaciones que han demostrado que las mujeres jóvenes son más afectadas. Aunque el género puede no desempeñar un papel importante en los datos epidemiológicos de esta patología, se considera que la variación de la prevalencia basada en el género es ambigua.2
Una gran diferencia del cuadro clínico en niños con respecto al del adulto, es la presencia de crisis convulsivas; es la primera manifestación de localización parenquimatosa hasta en un 94 % de los casos, y rara vez hay un cuadro de hipertensión endocraneal o de focalización.10 Estas crisis, la mayoría de veces, son de tipo focal, seguidas de las focales secundariamente generalizadas; las crisis generalizadas tónico-clónicas ocupan el tercer lugar en frecuencia de presentación.7,11 El caso que se expone presentó convulsiones tónico-clónicas generalizadas durante siete días. En un estudio realizado en Colombia por cinco años, se constató las crisis tónico-clónicas generalizadas en segundo lugar.6 En otro estudio, de 2021, en este mismo país, el 60 % de las crisis fueron generalizadas, de las cuales un 62,9 % fueron tónico-clónicas, siendo el tipo de crisis predominante de características motoras.9
Entre los mecanismos epileptógenos, se destacan reacciones inflamatorias locales como parte de la respuesta inmune y la gliosis perilesional, que se genera alrededor del quiste, así como algunos casos de lesiones calcificadas, que pueden representar un foco epileptógeno. Llama la atención el gran número de publicaciones referentes a epilepsia y NCC; la NCC como modelo natural humano de la epileptogénesis.1,6 La epilepsia es infrecuente en las lesiones en fase vesicular sin edema; en general se manifiesta cuando el quiste empieza a degenerar (fase coloidal y granulosa) y hay edema perilesional.
Otra de las manifestaciones clínicas de localización parenquimatosa es la cefalea, que ocurre en el 27 % de los casos, y es común tanto en las formas parenquimatosas como en las extraparenquimatosas; se considera que su prevalencia está infraestimada. Puede ser hemicraneal o bilateral, similar a la migraña o de características tensionales. En zonas endémicas, se ha sugerido descartar NCC en pacientes con cefalea crónica, aunque la disponibilidad de pruebas de neuroimagen es el gran problema.
Los déficits focales se dan en el 16 % de los casos de NCC y los más frecuentes son motores, piramidalismo y ataxia cerebelosa. Otras manifestaciones clínicas que se consideran infraestimadas son las alteraciones psiquiátricas y distintos grados de deterioro cognitivo (5 %). La paciente del caso cursó con un cuadro de hemiparesia derecha como manifestación de déficit motor, la cual está ampliamente reportada en varias literaturas.6,7,12
Para evaluar la actividad de la enfermedad, se utilizaron la clasificación de Sotelo y el estudio de Carpio. En los estudios de neuroimagen como la TAC simple de cráneo o la resonancia magnética, se pueden identificar las diferentes etapas de la NCC. Estas consisten fisiopatológicamente en la presencia del quiste en el parénquima cerebral, que evoluciona en cuatro etapas: en la etapa vesicular, el quiste se llena con un líquido claro, tiene una pared semitransparente delgada y un escólex opaco excéntrico de 4 a 5 mm, que producen cambios inflamatorios escasos y generalmente son asintomáticos. Cuando el sistema inmunitario del huésped supera los mecanismos protectores del quiste, este comienza a degenerar, y la larva sufre una degeneración hialina y el líquido transparente del quiste se reemplaza con material gelatinoso, a esta fase se la conoce como coloidal. Posteriormente, el quiste se contrae, las paredes se reemplazan por nódulos linfoides focales y necrosis, y el escólex se transforma en gránulos mineralizados gruesos, que forman la etapa nodular granular. Finalmente, el tejido de granulación se reemplaza por estructuras de colágeno y la calcificación da lugar a la fase calcificada nodular; en este momento el edema cede, pero hay cambios astrocíticos perilesionales.13
Es frecuente encontrar en el mismo paciente parásitos en diferentes estadios, tal y como sucedió en este caso.13 Existen diferencias genéticas en la Taenia solium en distintas zonas del mundo, que determinan la frecuencia de algunas presentaciones clínicas: en la India es notoria la mayor prevalencia de NCC con quistes únicos, y en Latinoamérica, la NCC presenta múltiples lesiones.1
La poca especificidad de los hallazgos clínicos y radiológicos han llevado al desarrollo de criterios diagnósticos de la NCC (Del Brutto et al., 2001, revisados en 2012). Se basan en datos clínicos, radiológicos, inmunológicos y epidemiológicos, estableciéndose grados de certeza diagnóstica.
Criterios de diagnóstico de neurocisticercosis
Absoluto:
Confirmación histológica del parásito por biopsia de cerebro o de la médula espinal.
Las lesiones quísticas que muestran el escólex en la TAC o una resonancia magnética.
Visualización directa de parásitos subretiniano por el fondo de ojo.
Mayor:
Lesiones altamente sugestiva de neurocisticercosis en imágenes como lesiones quísticas sin escólex, lesiones que realzan y calcificación parenquimatosa.
Anticuerpo anticisticercosis positivo en suero.
Resolución de lesiones quísticas intracraneales después de la terapia con albendazol.
Resolución espontánea o eventual calcificación de una lesión cerebral.
Menor:
Lesiones compatibles con neurocisticercosis en estudios de imagen no clasificada en el criterio mayor.
Manifestaciones clínicas sugestivas de neurocisticercosis.
Examen de sangre ELISA (enzimoinmunoanálisis de adsorción) positivo.
Cisticercosis fuera del sistema nervioso central.
Epidemiológico:
Evidencia de un contacto en el hogar con infección por Taenia solium.
Procedente/residente en área donde la cisticercosis es endémica.
Historial de viajes frecuentes a áreas donde la cisticercosis es endémica.
Diagnósticos de neurocisticercosis
Definitivo:
Presencia de un criterio absoluto.
Presencia de dos criterios mayores + uno menor + uno epidemiológico.
Probable:
Presencia de un criterio mayor + dos criterios menores.
Presencia de un criterio mayor + un criterio menor + un criterio epidemiológico.
Presencia de tres criterios menores + criterio epidemiológico.
En el caso de la paciente de estudio, se realizó un diagnóstico definitivo, debido a la presencia de dos criterios mayores + uno menor + uno epidemiológico; lesiones altamente sugestivas de neurocisticercosis en imágenes como lesiones quísticas sin escólex, lesiones que realzan y calcificación parenquimatosa; resolución de lesiones quísticas intracraneales después de la terapia con prazicuantel; manifestaciones clínicas sugestivas de neurocisticercosis, y procedente/residente en área donde la cisticercosis es endémica.
Dentro de los análisis complementarios que se pueden realizar, se encuentran el hemograma, que sirve de orientación y debe tenerse de línea de base para monitorizar potenciales alteraciones, debido a la terapia antiparasitaria o antiepiléptica, al igual que las pruebas de función hepática.
El estudio del líquido cefalorraquídeo (LCR) mediante la punción lumbar, puede mostrar proteínas aumentadas, glucosa baja, aumento de leucocitos, principalmente linfocitos y eosinófilos. Los anticuerpos o antígenos en el LCR están más elevados en la NCC racemosa. Se debe recordar que este procedimiento está contraindicado en pacientes con hipertensión endocraneana.
Los exámenes de fundoscopía y ecografía ocular, son importantes para descartar la presencia de quistes oculares (mayormente en el vítreo o la retina), porque el daño causado al parásito por la terapia antiparasitaria puede comprometer la visión y causar daño permanente. El estudio mediante la biopsia, en los raros casos con quistes subcutáneos o aquellos que van a cirugía, permite confirmar el diagnóstico.7,9
La NCC puede cursar de forma asintomática en un 50 % de los casos. Los signos y síntomas son inespecíficos y la NCC se considera en zonas endémicas “el gran imitador”, pues puede simular cualquier trastorno neurológico. El caso que se presenta se trata de una paciente que acude por atención médica debido a que manifiesta crisis, enmarcado en el síndrome neurológico convulsivo; para ello hay que descartar una serie de patologías para realizar un abordaje adecuado, como tuberculoma, meningoencefalitis, absceso cerebral piógeno o granuloma micótico, traumatismo craneoencefálico, epilepsia idiopática, tumor cerebral primario o metastásico.
Se descarta el tuberculoma, el cual está dado por conglomerados de focos granulomatosos dentro del parénquima cerebral, desarrollados a partir de tubérculos coalescentes adquiridos durante un período anterior de bacilemia hematógena, pero la paciente no presentó clínica característica de tuberculosis, como pérdida de peso o síntomas respiratorios de más de 15 días de evolución.
El absceso cerebral piógeno también es descartado, ya que la paciente no presentaba un deterioro importante, fiebre, signos de hipertensión intracraneana, coma, o signos imagenológicos característicos. Asimismo, la meningoencefalitis queda descartada, debido a la ausencia de su tríada clásica, dada por fiebre, rigidez nucal y un cambio en el estado mental. De igual forma sucede con el granuloma micótico, que produce sintomatología de encefalitis.
Por otra parte, el trauma craneoencefálico es descartado, pues la paciente no tiene antecedentes de traumatismos. En contraste, el tumor cerebral primario o metastásico produce cefalea, crisis focales con relación a la localización de la lesión, y pueden ser repetitivas y estereotipadas, déficits focales, disfunción cognitiva, con signos de elevación de la presión intracraneal.2
En zonas endémicas son frecuentes otras patologías infecciosas coexistentes: malaria, neuroesquistosomiasis, toxoplasmosis, neurolúes, hidatidosis, estrongiloidiasis, o la enfermedad de Chagas,1 mientras que en países desarrollados debe sospecharse mezcla o consumo de drogas o medicamentos, hipoglicemia, trastornos hidroelectrolíticos, accidente cerebrovascular isquémico, hemorragia intracraneal y drogas proconvulsivantes, entre otras.7
En cuanto al manejo y tratamiento, las pautas fueron realizadas y analizadas por un equipo de especialistas de la Sociedad de Enfermedades Infecciosas de América (IDSA por sus siglas en inglés) y la Sociedad Americana de Medicina Tropical e Higiene (ASTMH por sus siglas en inglés), las cuales tiene como pilar fundamental el manejo sintomático a través del uso de medicamentos antiepilépticos, y probablemente se necesite de los esteroides para controlar el edema y la inflamación asociados con las lesiones, como la prednisona o dexametasona a 0,1 mg/k/d desde el segundo día del tratamiento antiparasitario y, al finalizarlo, realizar una retirada lenta. La cefalea asociada a hipertensión y/o hidrocefalia, precisará de tratamiento con diuréticos osmóticos, esteroides y/o cirugía. Pese a ello, debido a la existencia de diferencias referentes a la ubicación, tamaño y etapa de degeneración del quiste, el tratamiento también puede variar.13,14
Actualmente, existe una fuerte controversia entre el uso o no de cisticidas (por ej.: praziquantel o albendazol) para la NCC, debatiéndose si la aceleración de la destrucción de los quistes en el cerebro es sintomáticamente beneficiosa o no para el huésped, aunque se intuye que podría ser beneficiosa, debe reconocerse que las manifestaciones del NCC surgen de la involución o destrucción espontánea del parásito, puesto que la reacción inflamatoria que acompaña a la muerte del parásito aparece de forma aguda como edema cerebral alrededor del parásito junto con la liberación de citoquinas proinflamatorias, que dan lugar a la formación de una cicatriz gliótica (crónico). Se concluye que los sucesos agudos y crónicos pueden llevar a la manifestación de incremento de la presión intracraneal (por el edema), convulsiones (por liberación de citoquinas y otros neurotóxicos) y cicatriz epiléptica crónica, siendo este fundamento la base para el argumento en contra de la administración de medicamentos cesticidas.2
Un metaanálisis (grado I de evidencia) demuestra la eficacia del tratamiento antiparasitario en los quistes intraparenquimatosos, salvo en los calcificados, con destrucción del 60-80 % de estos quistes y resolución completa del 40 %, con una mayor eficacia del albendazol (15 mg/kg/d, durante 14 días) sobre el praziquantel (50 mg/kg/d, durante 14 días); además, se reduce el riesgo de crisis epilépticas recurrentes. Algunos autores repiten a los 6 meses si persiste la imagen en resonancia magnética o TAC. El albendazol es más eficaz en el tratamiento de las formas subaracnoideas e intraventriculares; se recomienda doblar su dosis y siempre realizar previamente tratamiento con esteroides; es el tratamiento de elección en la NCC, por su mayor penetración en el sistema nervioso central, mayor poder cesticida, menos interacciones farmacológicas y menor coste. El tratamiento conjunto praziquantel y albendazol, no ha demostrado mayor eficacia; praziquantel eleva los niveles séricos de albendazol. En general, en las formas calcificadas no está indicado tratamiento antiparasitario.1
El tratamiento de la epilepsia causada por NCC no difiere de otras formas similares de epilepsia secundaria. Si se va a realizar tratamiento antiparasitario hay que asociar el tratamiento anticonvulsivante y mantenerlo hasta, al menos, seis meses después de la resolución de la lesión. La retirada del tratamiento de la epilepsia no se recomienda en pacientes con múltiples quistes. En la paciente del caso, se utilizó tratamiento con prazicuantel, prednisona y carbamacepina, con resolución parcial de los síntomas y seguimiento por neurología. Actualmente realiza fisioterapia, ha recuperado la fuerza muscular perdida y no presenta convulsiones. Lamentablemente quedó como secuela una ceguera cortical.