Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Anestesiología y Reanimación
versión On-line ISSN 1726-6718
Rev cuba anestesiol reanim vol.15 no.1 Ciudad de la Habana ene.-abr. 2016
ARTÍCULO DE REVISIÓN
Reversión o no del bloqueo neuromuscular posanestésico
Idoris Cordero Escobar, Gisela Pérez Martínez
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: los bloqueantes neuromusculares y su reversión se utilizan de forma cotidiana en la práctica anestesiológica. Sin embargo, la parálisis muscular residual producida por dichas drogas debido a la reversión incompleta del fármaco, pueden producir complicaciones que pueden llegar a ser fatales.
Objetivo: realizar una actualización sobre, si es conveniente o no, revertir el bloqueo neuromuscular.
Desarrollo: la reversión del bloqueo neuromuscular por drogas anticolinesterásicas es dependiente de la labilidad de la acetilcolina para liberar los receptores ocupados por agentes bloqueantes neuromusculares no despolarizantes. El sugammadex, es una ciclodextrina tipo gamma modificada, que se diseñó para revertir el bloqueo neuromuscular profundo inducido por rocuronio. Su mecanismo de acción se produce por la alta afinidad y gran selectividad para encapsular la molécula de rocuronio. Una vez que se une al bloqueante neuromuscular ya no puede producir efecto. En muchas ocasiones, se revierten estos fármacos, sin tener en cuenta la respuesta individual, ni las interacciones farmacológicas, ni las dosis administradas y su frecuencia, ni si tienen efectos acumulativos, por sólo citar algunos.
Conclusiones: el bloqueo neuromuscular y su recuperación ocurre en cada paciente individualmente tras la administración de agentes bloqueadores competitivos, donde la variación individual en la farmacología de estas drogas, no permiten predecir con exactitud sus efectos.
Palabras clave: bloqueantes neuromusculares; reversión parcial; complicaciones.
INTRODUCCIÓN
Los bloqueantes neuromusculares (BNM) y su reversión se encuentra ampliamente difundido en la práctica anestesiológica; sin embargo, la parálisis muscular producida por dichas drogas no siempre se pueden antagonizar con seguridad y puede ocurrir reversión parcial y como consecuencia accidentes en las Salas de Cuidados Posanestésicos, que pueden ser fatales.1,2
Bustamante Bozzo,1 publicó que existen evidencias que indican que el bloqueo residual posoperatorio (BRPO), puede causar peligros potenciales de complicaciones y comprometer la seguridad del paciente. Este autor señaló que su incidencia es alarmantemente alta, toda vez que asciende al 51 % al momento del ingreso a la Sala de Cuidados Posanestésicos y 47 % a los 5 min del ingreso, lo que significa que la mitad de los pacientes, aunque puedan tener parámetros clínicos de recuperación adecuados (fuerza inspiratoria e incluso capacidad vital), también pueden estar expuestos a debilidad muscular generalizada, diplopía, trastornos de la deglución, respuesta a la hipoxia disminuida y obstrucción de la vía aérea superior.
Algunos autores,3-5 plantearon que la frecuencia de BRPO oscila entre 4-57 %, mientras que para otros autores,6-9 varía entre 5 y 88 %.
Cuando se monitoriza la función neuromuscular, la parálisis residual se define como la relación del T4/T1 < 0,9 a nivel del músculo aductor del pulgar.2
El bloqueo residual posoperatorio, se describe como la parálisis residual posanestésica y es consecuencia de la debilidad o parálisis muscular posoperatoria proveniente de un antagonismo incompleto o ausente de los BNM.6-8
Se ha señalado que en el posoperatorio, puede ocurrir prolongación del tiempo total del bloqueo, cuya causa pudiera ser la sobredosis indebida de BNM; pero que generalmente se corresponde con la acumulación de sus metabolitos.1,6
Tanto el vecuronio, el rocuronio, como el pancuronio son metabolizados principalmente en el hígado, donde sufren una hidrólisis por desacetilación y originan tres metabolitos diferentes el 3, 17 y 3-17 desacetilvecuronio o pancuronio, según corresponda. Los grupos acetilo de las posiciones 3 y 17, son reemplazados por grupos hidroxilo. El hígado es el principal órgano de eliminación en animales de experimentación.7-10
Los 3 desacetil y 3 hidroximetabolitos, son los que se producen en mayor proporción y son potentes bloqueadores neuromusculares, que asciende al 80 y 50 % del compuesto original, respectivamente. Los otros metabolitos, tienen una potencia 60 veces inferior y no participan en el bloqueo. El 3-desacetilvecuronio y el 3-desacetilpancuronio pueden sufrir acumulación durante períodos prolongados de administración. Los fármacos del grupo farmacológico benzolisoquinolineos, son responsables de algunos episodios de parálisis prolongada, los cuales ocurren luego de infusiones prolongadas o incluso después de algunas dosis a repetición, especialmente en pacientes críticos y en mujeres con mayor o menor grado de insuficiencia renal. En pacientes con insuficiencia renal se encontró concentraciones elevadas de sus metabolitos cuatro días después de descontinuada la infusión.8-12
Los factores que inciden en el BRPO tienen gran variabilidad, pues se debe considerar los diferentes métodos anestésicos utilizados, si se monitorizó o no el recobro de la función neuromuscular, los valores medios de la relación T4/T1.13 El uso de diferentes BNM de variados tiempos de duración total.7 Si se administraron dosis únicas, repetidas o en infusión continua.8 Si se revirtió o no el bloqueo neuromuscular al finalizar del acto anestésico, con que agentes se revirtió, dosis e intervalo entre el uso de anticolinesterásicos y la aparición de los signos de recurarización, el método de evaluación del BRPO, la edad, la presencia de disfunción renal, hepática, cardiaca o neuromuscular, la utilización de fármacos que pueden alterar la farmacodinámica y/o farmacocinética de los BNM, así como de los bloqueantes de canales de calcio, magnesio, litio, antibióticos, anestésicos locales, anestésicos inhalatorios, opioides, benzodiazepinas y las alteraciones electrolíticas, acidosis metabólica o respiratoria y la hipotermia. 1,8-12
Constituye el objetivo de esta revisión, realizar una actualización sobre si es conveniente o no revertir el bloqueo neuromuscular.
DESARROLLO
La reversión del bloqueo neuromuscular por drogas anticolinesterásicas es dependiente de la labilidad de la acetilcolina para liberar los receptores ocupados por agentes BNM no despolarizantes.13,14
Dentro de los anticolinesterásicos más utilizados se encuentran el edrofonio o tensilón y la neostigmina; pero su uso condicionan efectos muscarínicos indeseables. La recurarización parcial, es la complicación más temida, pues se puede presentar parada respiratoria y el aumento de su potencial letal. Basados en estos principios algunos autores recomiendan realizar la descurarización siempre que se monitorice la función neuromuscular de estos pacientes.7,10-15
El sugammadex, es una ciclodextrina tipo gamma modificada, que se diseñó para revertir el bloqueo neuromuscular profundo inducido por rocuronio. 14,15 Su mecanismo de acción se produce por su alta afinidad y gran selectividad para encapsular la molécula de rocuronio. Una vez que se une al bloqueante neuromuscular ya no puede producir efecto.15-18
Su estructura tridimensional tiene un exterior hidrofílico (por sus grupos hidroxilo) y un interior hidrofóbico, donde se acoplan las sustancias con las que forman complejos mediante uniones no covalentes (encapsulación o quelación) que permiten su estabilización, solubilidad y reducción de volatilidad.
Se consideran moléculas seguras, a pesar de que algunos autores hayan discutido su toxicidad hística y su carcinogenicidad. En administración endovenosa no se metabolizan, no desencadenan respuesta inmune y son excretadas por vía renal, por lo que son útiles como excipientes.14
Es un antagonista verdadero, que produce una rápida reversión y previene la recurarización residual. Tiene pocos efectos hemodinámicas y ausencia de efectos nicotínicos y muscarínicos.15-18
En Septiembre del 2013, los laboratorios Merck informaron que la FDA no aprobó el uso de Bridion o sugammadex, para revertir los efectos de los BNM esteroideos luego de la anestesia y el proceder quirúrgico, por reacciones alérgicas y sangramientos.19-22
El hecho de revertir un BNM, es un riesgo si no se tiene un monitor de función neuromuscular. En muchas ocasiones se revierten, y no se tiene en cuenta la respuesta individual al fármaco, las interacciones farmacológicas, las dosis administradas y su frecuencia, y si no tiene efectos acumulativos, por sólo citar algunos. El uso de BNM y su reversión se encuentra ampliamente difundida en la práctica anestesiológica; sin embargo, el BRPO producido por dichas drogas no siempre se puede revertir con seguridad u ocurre en ocasiones, la reversión parcial y como consecuencia accidentes en las SRPA, que pueden ser fatales.15,23-25
Kocaturk y otros,26 evaluaron la incidencia de BRPO y los factores de riesgo relacionado en los períodos posoperatorios tempranos y tardíos en 208 pacientes ASA I y II, con edades 18-70 años, que fueron intervenidos con anestesia general y BNM de acción intermedia. Estos autores, monitorizaron la función neuromuscular y definieron los efectos residuales cuando se utilizó monitorización neuromuscular en TOF y consideraron que si la relación T4/T1 era < 90 % tenía riesgo de BRPO y si era ≥ 90 % la recuperación neuromuscular era adecuada, al principio y final del período de recuperación. Encontraron que la tasa de curarización residual fue del 10,6 % en el período de recuperación temprana y corta duración de la anestesia. Dosis repetidas y el no empleo de reversión fueron factores de riesgo para la curarización residual. Sin embargo, la tasa de BRPO fue de 2,9 % en el período de recuperación tardío y el único factor de riesgo fue las dosis de repetición. El uso de reversión demostró reducir los efectos residuales de los BNM de acción intermedia en período de recuperación temprana, mientras que en aquellos que se administraron dosis repetidas de BNM, aumentaron el riesgo de BRPO a los 30 min de permanecer en las SCPA.
Al comparar la incidencia y la duración de BRPO después de la administración de dosis múltiples de cisatracurio y de rocuronio, se constató que al final del procedimiento quirúrgico, la incidencia fue significativamente menor con rocuronio (44 %) que con cisatracurio (57 %), pero el tiempo para alcanzar la relación T4/T1 < 0,9 después de la última dosis fue significativamente mayor para el rocuronio. 13,25
La relación entre el tiempo de permanencia en la SRPA y BRPO, cuando se administraron BNM de duración intermedia, mostró que la edad y la relación T4/T1 ≤ 0,9 fueron variables independientes asociadas con el tiempo de permanencia en la SRPA, pero no con el tipo de BNM´s (vecuronio y cisatracurio).13,26
La relación de T4/T1 < 0,9, es un factor de riesgo establecido para eventos críticos respiratorios posoperatorios y aumento de la morbilidad.
Abreu Darias y otros,22 publicaron que para revertir un bloqueante neuromuscular se debe valor su tiempo de duración, las enfermedades asociadas del paciente, así como las dosis recomendadas para prevenir las posibles complicaciones, algunas letales, durante el posoperatorio inmediato. Se corroboró la capacidad del sugammadex para revertir el bloqueo con vecuronio y concluyeron que el tiempo transcurrido entre la administración de sugammmadex y la reversión del bloqueo fue 6,54 veces más prolongado con neostigmina. La calidad de la recuperación fue 1,34 veces mejor con de sugammadex y las reacciones adversas fueron 11,02 veces más frecuentes con neostigmina.
Con relación a los aspectos farmacoeconómicos, se ha demostrado que sugammadex es más eficaz que la neostigmina por la reducción del tiempo de recuperación de los músculos después de la inducción de un bloqueo neuromuscular moderado o profundo con rocuronio o vecuronio.26
Sin embargo, en comparación con los costos la reversión del bloqueo con sugammadex resulta mucho más costoso que con los inhibidores de la acetilcolinesterasa. Existen pocos estudios basados en la evidencia, que evalúen los aspectos farmacoeconómicos de la reversión con sugammadex, aunque varios estudios de opinión de la relación coste-eficacia que lo comparan con los de los inhibidores de la colinesterasa concluyeron que resulta muy caro, hecho a tomar en consideración para nuestros pueblos de Latinoamérica.
La reducción de los tiempos de recuperación con sugammadex reducirá la incidencia de intubación prolongada y puede aumentar el rendimiento; sin embargo, la reducción de los costes alcanzable depende de los factores de organización individuales.27
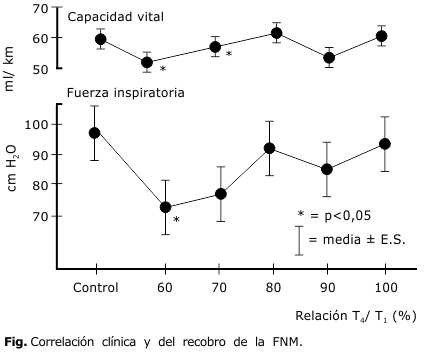
La correlación clínica y de la recuperación del bloqueo es muy importante pues cuando la relación del cociente T4/T1 es de 0, existe un bloqueo profundo. Cuando es < 0,4 existe imposibilidad para levantar la cabeza. Cuando es < 0,6, mantienen la cabeza erguida por 3 s aunque tienen la capacidad vital y la fuerza inspiratoria disminuida. Cuando es < 0,75 los pacientes pueden abrir los ojos ampliamente, sacan la lengua, tienen reflejo tusígeno limitado. Cuando el resultado del cociente es < 0,8 existe debilitamiento de la función faríngea, riesgo aspiración en caso de regurgitación y mantienen la cabeza erguida por 5 s. Cuando la relación T4/T1 es ≥ 0,9 existe correlación de la capacidad vital y de la fuerza inspiratoria normal y cuando equivale a 1, existe recobro completo.14
Obsérvese en la figura, como se correlaciona el recobro de la FNM, con la capacidad vital y la fuerza inspiratoria.
Los pequeños grados de debilidad muscular residual pueden potencialmente perjudicar la recuperación después de cualquier procedimiento quirúrgico y producir complicaciones posoperatorias. Estudios clínicos informan, que puede ser difícil diferenciar los efectos fisiológicos adversos resultantes de la recuperación neuromuscular incompleta, de los efectos residuales de los opioides, benzodiacepinas, anestésicos volátiles, o de los inductores de la anestesia.28
Se concluye que el bloqueo neuromuscular y su recuperación ocurre en cada paciente individualmente, tras la administración de agentes bloqueadores competitivos donde la variación individual en la farmacología de estas drogas, no permiten predecir con exactitud sus efectos.
Los métodos de valoración corriente del grado de relajación y la administración de potentes bloqueadores neuromusculares, traen aparejados una innecesaria e inaceptable alta proporción de pacientes con riesgos de curarización residual.
Para revertir un bloqueador neuromuscular se debe valorar el tiempo de duración, las enfermedades asociadas del paciente, así como las dosis recomendadas para prevenir las posibles complicaciones, algunas letales, durante el posoperatorio inmediato.
REFERENCIAS BIBLIOGRÁFICAS
1. Bustamante Bozzo R. Bloqueo residual. Editorial. Rev Chil Anest. 2011;40:301-4.
2. Donati F. Residual paralysis: a real problem or did we invent a new disease? Can J Anaesth. 2013;60(7):714-29.
3. Andrade da Silva Telles ML, Gracco de Bernardis RC. Parálisis Residual Postoperatoria. Rev Bras Anestesiol. 2012;62:3:439-50.
4. Butterly A, Bittner EA, George E, Sandberg WS, Eikermann M, Schmidt U. Postoperative residual curarization from intermediate acting neuromuscular blocking agents delays recovery room discharge. Br J Anaesth. 2010;105:304-49.
5. Kocaturk O, Kaan N, Kayacan N, Ertugrul F. The incidence of postoperative residual curarization following the use of intermediate-acting muscle relaxants and related factors. Middle East J Anaesthesiol. 2014;22(6):583-90.
6. Butterly A, Bittner EA, George E, Sandberg WS, Eikermann M, Schmidt U. Postoperative residual curarization from intermediate-acting neuromuscular blocking agents delays recovery room discharge. Br J Anaesth. 2010;105(3):304-9.
7. Di Marco P, Della Rocca G, Iannuccelli F, Pompei L, Reale C, Pietropaoli P. Knowledge of residual curarization: an Italian survey. Acta Anaesthesiol Scand. 2010;54(3):307-12.
8. Ortiz-Gómez JR, Fabregat-López J. On extubation, residual curarization, and their circumstances. Rev Esp Anestesiol Reanim. 2009;56(6):335-8.
9. Claudius C, Garvey LH, Viby-Mogensen J. The undesirable effects of neuromuscular blocking drugs. Anaesthesia. 2009;64 (Suppl 1):10-21.
10. Tsai CC, Chung HS, Chen PL, Yu CM, Chen MS, Hong CL. Postoperative residual curarization: clinical observation in the post-anesthesia care unit. Chang Gung Med J. 2008;31(4):364-8.
11. Adamus M, Koutná J, Neoral C. The incidence of postoperative residual curarization in the recovery room after rocuronium administration. Rozhl Chir. 2007;86(1):11-6.
12. Srivastava A, Hunter JM. Reversal of neuromuscular block. Br J Anaesth. 2009;103:115-29.
13. Naguib M, Kopman AF, Ensor JE. Neuromuscular monitoring and postoperative residual curarization: a meta-analysis. Br J Anaesth. 2007;98:302-16.
14. Cordero Escobar I. Reversión de los relajantes musculares. En: Cordero Escobar I. Los relajantes musculares en la práctica anestesiológica. Cap. 20. La Habana: ECIMED; 2010. p. 195-9.
15. Kopman AF. Neuromuscular monitoring: old issues, new controversies. J Crit Care. 2009;24(1):11-20.
16. Viby-Mogensen J, Claudius C, Eriksson LI. Neuromuscular monitoring and postoperative residual curarization. Br J Anaesth. 2007;99(2):297.
17. Díaz Jacobo TJ, Athíe García JM, Martínez Rosete V. Reversión satisfactoria y eficaz del bloqueo neuromuscular residual. Neostigmina versus sugammadex en pacientes sometidos a rinoseptoplastia en el Hospital Ángeles Mocel. Acta Médica Grupo Ángeles. 2014;12(4):189-93.
18. Booij LH. Cyclodextrins and the emergence of sugammadex. Anaesthesia. 2009;64(Suppl 1):31-37.
19. Cordero Escobar I. Sugammadex. En: Cordero Escobar I. Los relajantes musculares en la práctica anestesiológica. Cap. 21. La Habana: ECIMED;2010. p.200-4.
20. Kirienko PA, Babaiants AV, Shmakov IA, Gorobets ES, Él'dzharkiev AA, Gel'fand BR. Assessment of sugammadex use efficiency and safety for neuromuscular block reversion. Anesteziol Reanimatol. 2013;(6):46-51.
21. Della Rocca G, Di Marco P, Beretta L, De Gaudio AR, Ori C, Mastronardi P. Do we need to use sugammadex at the end of a general anesthesia to reverse the action of neuromuscular bloking agents? Position Paper on Sugammadex use. Minerva Anestesiol. 2013;79(6):661-6.
22. Abreu Darias MG, Cordero Escobar I, Pérez Martínez G. Reversión del bloqueo neuromuscular inducido por vecuronio: sugammadex o neostigmina. Rev Cubana de Anestesiología 2014 [citado 1 junio 2015];14(13):3. Disponible en: http://bvs.sld.cu/revistas/scar/vol13_3_14/scar05314.htm
23. Mizikov VM, Stamov VI, Deshko IuV, Ialich AIu. Problem of neuromuscular block reversion: neostigmine and sugammadex. Anesteziol Reanimatol. 2010;(2):40-3.
24. de la Torre-Anderson J, de la Torre-Buendía J, Zamora-García V. Efi cacia y seguridad del sugammadex. Rev Mexicana Anest. 2014;37(2):77-82.
25. Forneiro Martin Viaña Y, Vega Fernández D, Cordero Escobar I, Martínez Sardiñas AB, Sánchez Hernández Y, Alfonso Zayas LM. Ensayos en ambiente hospitalario de técnicas de monitorización del bloqueo neuromuscular. Resultados preliminares. Rev Ciencia e Innovación Tecnológica. 2014; 2(2):54-62.
26. Kocaturk O, Kaan N, Kayacan N, Ertugrul F. The incidence of postoperative residual curarization following the use of intermediate-acting muscle relaxants and related factors. Middle East J Anaesthesiol. 2014;22(6):583-90.
27. Fuchs-Butler T, Meistelman C, Schreiber JU. Sugammadex es económicamente viable para su uso rutinario. Curr Opin Anaesthesiol. 2012;25(2):217-20.
28. Murphy GS, Sorin JB. Residual Neuromuscular Block: Lessons Unlearned. Part I: Definitions, Incidence, and Adverse Physiologic Effects of Residual Neuromuscular Block. Anesth & Analg. 2010;111(1):120-8.
Recibido: 12 de septiembre de 2015.
Aprobado: 30 de octubre de 2015.
Idoris Cordero Escobar . Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10300.