Introducción
En diciembre de 2019, la Comisión Municipal de Salud y Sanidad de Wuhan (provincia de Hubei, China) informó de una serie de casos de neumonía de etiología desconocida, con una exposición común en un mercado mayorista de la ciudad. El 7 de enero de 2020, las autoridades chinas identificaron como agente causante del brote un nuevo tipo de virus de la familia Coronaviridae, denominado SARS-CoV-2. Desde entonces se han notificado miles de casos con una diseminación global.1
Al momento de la confección de esta comunicación (marzo 9 de 2021) se han reportado un total de 116 363 935 casos a nivel mundial, de ellos 2 587 225 fallecidos.2
Las manifestaciones clínicas de la COVID-19 (enfermedad producida por el virus), varían desde enfermedad asintomática, tos y fiebre como los síntomas más frecuentes, hasta síndrome de distrés respiratorio agudo (SDRA). Un pequeño porcentaje exhibe síntomas atípicos como náuseas, vómitos y diarrea. Las manifestaciones neurológicas son frecuentes, con una incidencia de hasta un 36 % y aumentan con la gravedad de la enfermedad. En estos pacientes se describen trastornos de la conciencia, parestesias, ataxia, miopatías, encefalitis, síndrome de Guillain-Barré y enfermedad cerebrovascular.3,4
Algunos autores exponen que la incidencia de accidente cerebrovascular (ACV) en el paciente con COVID-19 varía del 0,9 al 1,2 % (incidencia ponderada de 1,2 %), otras series expresan valores más altos de un 3,7 a 5 %.3,5
El índice de mortalidad es, particularmente, elevado en el caso de que el ictus se asocie a insuficiencia respiratoria grave. Este riesgo puede incluso triplicarse.6,7
Un punto de inflexión en este asunto está dado por el criterio de que el ictus isquémico (ACVi) en el curso de la COVID-19 (ACVi+COVID-19) ocurre en la enfermedad más grave, fundamentalmente, entre aquellos que necesitan ventilación mecánica artificial (VMA) por la presencia de SDRA. En el estudio de Benny y otros,8 entre 100 pacientes que fueron diagnosticados con ACV en el curso de la infección por COVID-19, 47 presentaban SDRA y falleció el 51,1 % (p=0,001). De los 78 pacientes que desarrollaron ACVi, 21 recibieron VMA. En la serie de Ortiz y otros,3 la gravedad de la enfermedad se informó en 24 pacientes de 40 en total, de ellos un 16,6 % presentó enfermedad crítica.
La terapéutica avalada en el caso del SDRA (tanto en pacientes con COVID-19, como en los no COVID-19) es conocida como “ventilación protectora pulmonar” (VP) la cual consiste en usar niveles de volumen tidal (Vt) entre 4-8 mL/kg de peso predicho (Pp), mantener la presión meseta pulmonar (Pplateau) <30 cmH2O, presión de distención alveolar (Dp) <15 cmH2O y titular la presión positiva al final de la expiración (PEEP) a partir de 10 cmH2O para aquellos pacientes que lo necesitan. También se ha sugerido el uso de maniobras de reclutamiento alveolar (MRA) y ventilación en decúbito prono (PP).9,10
Sin embargo, esta estrategia puede inducir efectos dañinos a nivel neurológico debido a las interacciones fisiológicas complejas entre los compartimientos venosos intratorácicos e intracraneanos. Adicionalmente, la seguridad y eficacia de otras terapias de rescate pulmonar como las MRA y el uso de PP no han sido bien establecidas en esta población.11
Si se toma en consideración que el tejido cerebral está dañado previamente, el manejo ventilatorio deviene en un “verdadero dilema” para el médico de asistencia quien, en busca de disminuir el daño pulmonar inducido por la infección, puede generar más daño cerebral.
Hasta este momento se desconoce por parte de los autores de esta comunicación si se han publicado consideraciones sobre las estrategias de VMA en pacientes con COVID-19 y ACVi (VMA/COVID-19+ACVi). La búsqueda bibliográfica referente a este tópico no arrojó resultados concretos, razón por lo cual el objetivo de esta revisión fue describir elementos de interés sobre el uso de la ventilación mecánica artificial en pacientes con ictus isquémico y COVID-19.
Ante la ausencia de evidencia directa, los criterios expuestos por los autores se realizaron sobre la base de lo publicado para pacientes con ACVi y VMA con/sin SDRA.
El objetivo de la investigación fue describir elementos de interés sobre el uso de la ventilación mecánica artificial en pacientes con ictus isquémico y COVID-19.
Métodos
Estrategia de búsqueda y criterios de selección
Las referencias fueron identificadas en PubMed/Medline, SciELO y Google académico. Se realizó en 3 momentos, primero se revisó la literatura disponible sobre ACVi en el curso de la COVID-19, sus características, fisiopatología y uso de la VMA, luego se revisaron los documentos disponibles sobre la VMA en el ACVi y el paciente con daño cerebral agudo (DCA), con la bibliografía disponible, se discutió entre los autores y se realizaron las recomendaciones para el manejo ventilatorio en esta población especial. Entre los términos de búsqueda se incluyeron: “COVID-19”, “SARS-CoV-2”, “neurological manifestations”, “mechanical ventilation”, “respiratory failure”, “ARDS”, “acute ischemic stroke”, “acute brain injury”, “neurocritical care” y sus respectivas traducciones al español. Se tomó en consideración contenido de libros dedicados a la “medicina de los cuidados críticos”, “neurointensivismo” y “ventilación mecánica artificial”. Solamente se revisaron publicaciones en inglés y español.
Los criterios de inclusión fueron: artículos de acceso libre, originales, revisiones narrativas y sistemáticas (con/sin meta-análisis), ensayos clínicos, editoriales, cartas al editor y documentos de consenso.
Fueron excluidos artículos resúmenes, de corte pediátrico y aquellos que abordan otros tipos de daño cerebral (trauma craneoencefálico [TCE], enfermedades neuromusculares y desmilienizantes, entre otros).
El período de búsqueda incluyó los últimos 10 años. Se seleccionaron 36 referencias que cumplieron con los criterios de selección. De ellas el 94,4 % corresponden a los últimos 5 años. La revisión se realizó entre los meses de enero y marzo de 2021.
Génesis del problema e influencia de la ventilación mecánica artificial
Al igual que otros virus respiratorios, la infección por SARS-CoV-2 podría ser un factor precipitante de ictus.12
Los eventos fisiopatológicos que explican la aparición del ACVi en el curso de la infección no han sido dilucidados a pesar de identificarse algunos mecanismos. Este complejo sistema incluye la propagación desde la lesión orgánica inicial (pulmones) a otros órganos como el corazón y el cerebro de mediadores proinflamatorios (interleucinas 2, 6 y 7, factor de necrosis tumoral alfa, proteína quimio-atrayente de monocitos; proteína inflamatoria de macrófagos, factor estimulante de colonias de granulocitos, proteína C reactiva, procalcitonina y ferritina), factores de la coagulación (VIII, VW, X y XIII), fibrinógeno, plasminógeno, inmunoglubulina M anticardiolipina, anticuerpos antifosfolípidos, productos de degradación de la fibrina (dímero D), la disminución del metabolismo aerobio y la síntesis de antiinflamatorios. El resultado final se resume en desestabilización de la placa de ateroma, vasculitis local y oclusión trombótica.12,13,14,15
A los elementos antes descritos se añaden resultados de investigaciones publicados en las cuales el efecto de la ventilación mecánica artificial (VMA) en pacientes con neumonía por COVID-19 se comportó como factor pronóstico en la aparición del evento neurológico.
El estudio multinacional conducido por Shahjoueia S y otros16 evaluó 17 779 pacientes con COVID-19, de ellos 123 desarrollaron ACVi. Al comparar el grupo con la presencia de ictus con aquel sin el evento, la regresión logística binaria sugirió que la VMA (OR: 1,9; 95 % CI: 1,1-3,5, p=0,028) es un factor pronóstico independiente de aparición del accidente cerebrovascular.
Dichos elementos no están definidos totalmente. A razón de los autores de este texto, la justificación fenomenológica depende del efecto hipotético de la VMA sobre el cerebro, la asincronía ventilatoria (causante de disconfort, dolor y delirium), la falla cardiaca inducida por la VMA (con la consiguiente hipoxemia), el uso de terapias accesorias agresivas (vasopresores e inotrópicos, terapia de remplazo renal y oxigenación con membrana extracorpórea) y la falla pluriparenquimatosa inducida por la sepsis, el shock o el SDRA. Nuevos estudios deben realizarse en favor de adquirir mejores conocimientos sobre esta temática.
Mortalidad en el paciente con VMA/COVID-19 y en neurocríticos
La VMA es una herramienta de vital importancia en el manejo del paciente con SDRA+COVID-19. Como se comentó, su uso es sugerido por el gremio de intensivistas y anestesiólogos. Sin embargo, la mortalidad asociada al proceder aún hoy es elevada.
Plotnikow y otros17 en una corte multicéntrica y retrospectiva de ventilados con COVID-19 encontraron a la fecha de cierre del estudio una mortalidad del 61,7 % de la población de estudio (n=47).
Sayf y otros18 en una serie multicéntrica de casos y controles ventilados con COVID-19 y sin el virus (192 pacientes en cada grupo), encontraron que la mortalidad del primer grupo fue superior al segundo (62 % vs 49 %, p=0,007). Otro hallazgo de interés fue que ambos grupos presentaron características ventilatorias similares. En el análisis univariado, la presencia de la infección por COVID-19 (p=0,007) y el SDRA (p=0,002) al tercer (p=0,008) y séptimo día (p<0,001), entre otras variables, se comportaron como factores pronóstico de mortalidad. Al análisis multivariado la infección por COVID-19 (OR: 1,9; CI 95 %: 1,105-3,403; p=0,021) fue un predictor de mal pronóstico.
Un punto de interés en este argumento está dado por la función que tiene la gravedad del SDRA en el curso de la COVID-19. Los estudios consultados demuestran que a mayor incremento de la falla respiratoria es mayor la mortalidad.18,19
De igual manera, fuera del ámbito de la COVID-19 la mortalidad en pacientes bajo VMA es elevada. En el paciente neurológico grave, la supervivencia de aquellos que necesitan intubación endotraqueal y VMA es alrededor del 50 % a los 30 días del evento y solo el 30 % sobrevive al año (un tercio de pacientes con ictus que requieren ingreso en la UCI y egresan vivos, quedan con secuelas neurológicas leves o moderadas al año del evento).20,21
Efectos de la VMA sobre el cerebro dañado: de la teoría a la práctica
La mayoría de los protocolos que evalúan al paciente con VMA excluyen a los neurocríticos. El asunto es que la estrategia de protección pulmonar que utiliza la combinación de PEEP y bajo Vt puede tener efectos adversos como el incremento de la presión intracraneal (PIC). Esto es por aumento de la presión venosa central y disminución consecuente de la presión de perfusión cerebral (PPC) por caída del retorno venoso.22,23 Otro mecanismo propuesto considera que la ventilación a presión positiva (con o sin PEEP) puede deprimir el volumen de salida cardiaco y la presión arterial media (PAM), disminuyendo la PPC.23 Debido a estos efectos, en la actualidad, los resultados de pacientes críticos que reciben VMA durante un ictus son limitados.21 Esta estrecha relación bidireccional existente en un paciente que recibe VMA y tiene un daño cerebral agudo (DCA) ha sido comúnmente denominado “interacción pulmón-cerebro” (parte del espectro: “brain-organ crosstalk”).24 Y tiene una importancia vital en el desenlace del enfermo crítico.
A razón de los autores de esta comunicación, este complejo “bucle” pudiera explicar la razón de tan alta mortalidad y pobre recuperación. Como consecuencia, bien puede extrapolarse a los pacientes con COVID-19.
Las consideraciones antes planteadas son admisibles desde una concepción teórica. Sin embargo, estudios recientes demuestran un resultado diferente, dando a la VP la mejor opción.
Asehnoune K y otros25 realizaron un estudio multicéntrico, en el cual involucraron 2 estrategias ventilatorias para pacientes con DCA que requirieron VMA por más de 24 h. Un total de 744 pacientes se involucraron en la investigación. La estrategia consistente en Vt ≤ 7ml/kg Pp, PEEP entre 6-8 cmH2O y extubación temprana, redujo los días de VMA y la mortalidad, frente a una estrategia ventilatoria más liberal.
Borsellino B y otros26 publicaron una revisión sistemática sobre VMA en pacientes neurocríticos. Con una línea temporal de 10 años, incluyeron 16 estudios clínicos en los cuales detallaron el efecto de la VP, el uso de PEEP, entre otros objetivos. Las conclusiones arrojaron que la VP puede ser usada para prevenir el desarrollo de daño pulmonar inducido por la VMA, mejorar la función cerebral y reducir las complicaciones pulmonares.
Por último, con respecto al uso de PEEP, Boone MD y otros23 demostraron que el uso de PEEP puede ser aplicado de forma segura en pacientes con DCA sin que haya significación clínica de efecto sobre la PIC y la PPC. Borsellino B y otros 26 también concluyeron que en presencia de deterioro de la oxigenación el uso de PEEP en enfermedades neurológicas (sobre todo en la hemorragia subaracnoidea o el TCE) bajo estricto neuromonitoreo parece ser segura ante el aumento de la PIC.
Actualmente. se acepta que si la PEEP es menor que la PIC no existe un efecto significativo en esta última.27,28,29,30
Sin embargo, y a pesar de la evidencia disponible, el manejo del paciente con DCA y SDRA es motivo de polémica. Nuevos ensayos clínicos deben realizarse con el objetivo de individualizar cada patología neurológica (ACVi, hemorragia intracraneal, TCE, y otras), poder monitorizar los eventos fisiopatológicos que ocurran, la alteración de biomarcadores cerebrales, pulmonares o sistémicos y la respuesta terapéutica en escenarios individualizados (salas de emergencias, UCI, salón de operaciones, etc.)
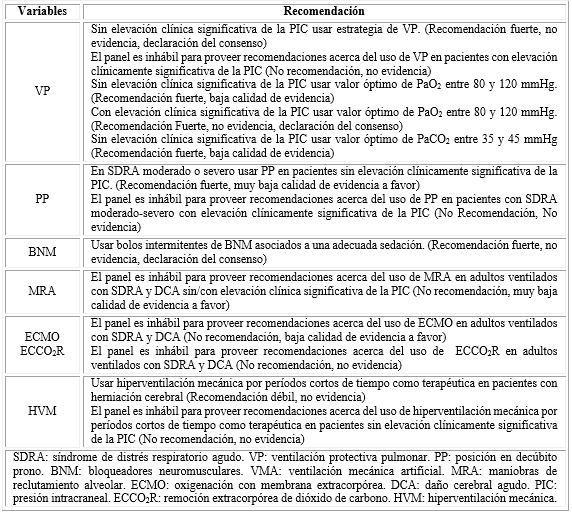
Las Guías para el manejo ventilatorio de pacientes con DCA11 publicadas el pasado 2020 tienen como limitación principal la escasa evidencia disponible. Por lo que la mayoría de las recomendaciones propuestas son opiniones de los expertos del panel (Tabla 1). Una posible explicación está dado porque la mayoría de los estudios publicados no incluyen a pacientes con SDRA. Las investigaciones antes citadas23,25,26 son ejemplo de ello.
Recomendaciones para la VMA/COVID-19+ACVi
La búsqueda de sugerencias para el manejo ventilatorio del paciente con COVID-19+ACVi en los principales consensos publicados hasta la fecha por Sociedades de Neurología o Paneles de expertos solo proporcionan orientaciones generales. El énfasis para recomendar metas en esta subpoblación de pacientes, se limita al uso de oxígeno suplementario o el posible rol de la VMA durante la trombectomía mecánica u otro proceder endovascular (Tabla 2).
Tabla 2 Recomendaciones para el manejo respiratorio de pacientes con ACVi+ COVID-19 según varias Sociedades de Neurología o Paneles de expertos.

Por otra parte, las “campañas sobrevivir a la sepsis (SSC, por sus siglas en inglés) en el paciente con COVID-19”, ofrecen recomendaciones con respecto al manejo ventilatorio, con buena calidad en la evidencia, sin embargo, es imprescindible aclarar que se refieren al paciente con SDRA de forma general y no especifica cómo proceder si aparecen complicaciones neurológicas como el ACVi durante la infección (Tabla 3).
Fenotipos pulmonares en la COVID-19
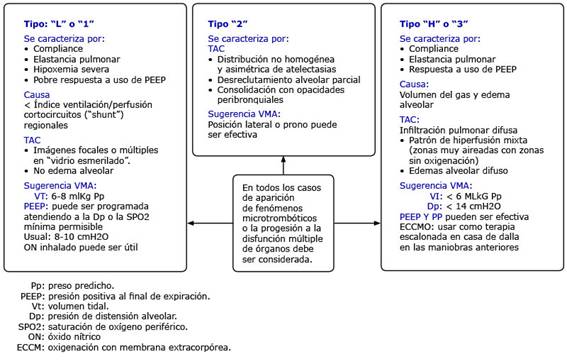
Un elemento a considerar está relacionado con la identificación de fenotipos pulmonares específicos en el paciente con SDRA+COVID-19. El profesor Gattinoni y otros,31 a través de múltiples observaciones clínicas y tomográficas definieron 2 patrones fundamentales que se desarrollan, los cuales caracterizan la falla ventilatoria por SARS-CoV-2.
Se ha definido que el SDRA+COVID-19 se caracteriza por la presencia de edema alveolar e intersticial mínimo, infiltración y necrosis celular con consolidación alveolar y neumólisis. La perfusión regional sigue un patrón no gravitacional (no dependiente de las regiones pulmonares) e “hiperperfusión” de zonas normalmente aireadas y aquellas que reciben menos oxigenación (imagen en “vidrio deslustrado o vidrio esmerilado”). Estas particularidades difieren del clásico SDRA y son las causantes de las alteraciones en el índice ventilación-perfusión.32Gattinoni y otros31 refieren que estas peculiaridades dependen de 3 factores fundamentales y de su interacción se estriban los 2 fenotipos pulmonares: 1) la gravedad de la infección, respuesta del hospedero, reserva fisiológica y presencia de comorbilidades, 2) respuesta ventilatoria del paciente ante la hipoxemia y 3) tiempo entre el inicio de la sintomatología y su observación hospitalaria. Por otro lado, Battaglini y otros32 agregan un tercer fenotipo con rasgos tomadas de los 2 anteriores. Las características y causas de estos elementos así como las sugerencias para el uso de VMA se muestran en la figura 1.10,31,32
Es interesante destacar que con los diferentes fenotipos la terapéutica ventilatoria deja de ser única (tal y como lo establecen las SSC) y se convierte en individualizada.31
Los autores de esta comunicación asumen que el conocimiento del fenotipo pulmonar específico tiene una importancia especial ya que puede establecer la mejor opción terapéutica y evitar otras que pueden repercutir en la dinámica cerebral. Así por ejemplo, en el caso del fenotipo 1 el cual tiene bajo potencial de reclutamiento, la utilización de la estrategia protectora pulmonar con hipercapnia permisiva es la iniciativa a utilizar, aunque pudiera generar daño cerebral secundario. En este caso, la optimización de la hemoglobina y el volumen de salida cardíaco como estrategia para mejorar la entrega de oxígeno, representan propuestas atractivas. En el caso del fenotipo 3, quien necesita de niveles elevados de PEEP, PP y MRA, el conocimiento de la interacción pulmón-cerebro a través de la monitorización de la PIC debe ser usado. Por último, se considera que la presión parcial de oxígeno, la presión parcial de dióxido de carbono, la hemoglobina y el pH arterial deben ser variables consideradas como objetivos-metas junto a la monitorización de la PIC y así proteger al pulmón y cerebro a la vez.32
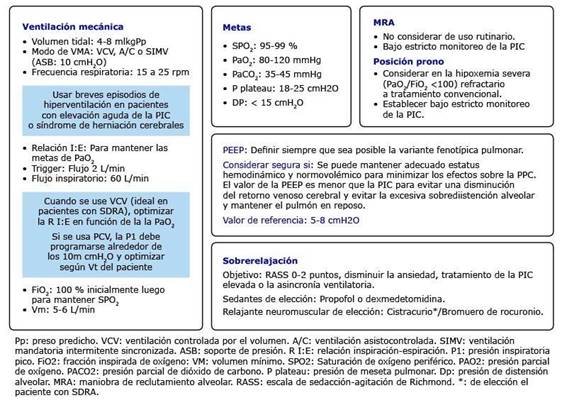
Ante la escasa evidencia propicia para pacientes con VMA/COVID-19+ACVi y la literatura disponible sobre VMA en neurocríticos (la mayoría de pacientes sin SDRA), los autores de esta contribución sugieren tomar en cuenta las siguientes estrategias11,24,27,33,34,35,36 (Fig. 2).
La probabilidad de que el ACVi repercuta en el desenlace del paciente ya sea por una limitada recuperación funcional o la muerte, es alta. Por lo que se sugiere que el establecimiento del marco ventilatorio se base en un modelo neurocéntrico con el objetivo de evitar el daño cerebral secundario.
El ACVi en el curso de la infección por COVID-19 tiene una incidencia baja, ocurre, fundamentalmente, el curso de la enfermedad grave y posee una alta mortalidad. Las guías de manejo del ACVi+COVID-19 no proveen información específica para el manejo ventilatorio en caso de ser necesario.
Según la evidencia sobre la VMA en el paciente con DCA, se pueden extrapolar recomendaciones para este grupo especial, las cuales incluyen: la ventilación protectora pulmonar, el uso de presión positiva al final de la expiración y posición prono.
El establecimiento del protocolo adecuado debe ser individualizado en todo momento y siempre bajo estricta monitorización de la PIC.