Introducción
La dermatitis atópica (DA) es una enfermedad cutánea inflamatoria, crónica y pruriginosa. De etiología multifactorial que se produce con mayor frecuencia durante la lactancia y en la infancia temprana, pudiendo afectar a todas las razas y con una proporción de 1,5/1 para el sexo femenino.1
Su etiopatogenia es el resultado de una combinación de factores genéticos, inmunitarios y ambientales que inducen a una disfunción de la barrera cutánea y una desregulación inmunitaria cutánea y sistémica.2),(3
El componente genético en la DA es bastante expresivo, las mutaciones en el gen filagrina están entre los defectos más frecuentes y comunes como causantes de la enfermedad. Cuando hablamos de mecanismos fisio patogénicos inmunitarios de la DA existe un predominio de las células Th2 con una mayor producción de IL-4 y disminución de IFN-y, lo que nos genera una mayor producción de IgE ya que las células Th2 estimulan los linfocitos B a producir inmunoglobulinas (IgE).1
Adentro de los factores ambientales tenemos la exposición a determinados tipos de Aeroalérgenos, determinado tipos de alimentos y enfermedades infectocontagiosas causadas principalmente por microorganismos como el Staphylococcus aureus y M. furfur debido a esa disfunción de la barrera cutánea de la piel hace con que los pacientes con DA sean más propensos a desarrollarlas.4
Los otros tipos de agravantes están relacionados con las variaciones estacionales del año, como el aumento o disminución de la temperatura, humedad o sequedad excesiva. Que conlleva a la aparición de un prurito intenso en la piel llevando al paciente a rascarse empeorando aún más la alteración de la barrera cutánea de la piel.5
El tratamiento se basa en cuidados rutineros con la piel, corticoesteroides tópicos, inhibidores tópicos de calcineurina, fototerapia, inmunomoduladores orales de acción sistémica y la terapia monoclonal con inhibidores, como en el caso de la familia de tirosincinasas transductoras de señal denominadas janus cinasas (JAK), que actúan bloqueando la vía de señalización de las IL-4 y IL-13, asegurando una alternativa segura y eficaz para ayudar a modificar los casos moderados y graves de la enfermedad.6
Los anticuerpos monoclonales son proteínas del sistema inmunológico producidas artificialmente en laboratorios, que actúan como anticuerpos dentro del organismo humano modulando la acción del sistema inmune. Se utilizan normalmente para combatir enfermedades de difícil tratamiento, como es el caso de la dermatitis atópica.7
Recientemente, la dermatitis atópica está siendo objeto de intensas investigaciones y ensayos clínicos, que están redefiniendo su tratamiento clínico a largo plazo basado en inmunosupresores de amplio espectro. Debido a que la enfermedad está mediada en gran medida por Th2/Th22, los esfuerzos para encontrar terapias dirigidas se han centrado en estos sistemas inmunitarios, lo que llevó al desarrollo del primer anticuerpo monoclonal autorizado para la dermatitis atópica: inhibidores de IL-4/IL-13, dupilumab.8
Los anticuerpos monoclonales que inhiben los efectos de varias IL (es decir, IL-4, IL 13, IL-5, IL-17, IL-22, IL-31, IL-33) se muestran prometedores terapéuticos para el tratamiento de las enfermedades atópicas. La complejidad de la respuesta inmunitaria adaptativa brinda varias oportunidades para la terapia dirigida con fármacos biológicos contra las citocinas y sus respectivos receptores.9
Como las células T son efectoras de la respuesta inflamatoria, influyen en su actividad migratoria desde los ganglios linfáticos mediante la modulación del receptor 1 de fosfato de esfingosina (S1PR) o mediante el receptor de quimiocinas CC4 (CCR4) o mediante receptores de quimiocinas. La migración de CC 4 (CCR4) en la piel es un nuevo método. Además de los productos biológicos, otra estrategia para afectar las vías que impulsan la inflamación es usar inhibidores de la quinasa que son diferencialmente selectivos para la JAK) que está involucrada en la señalización del receptor de citoquinas.10,(2),(3
Las JAK son proteínas tirosina quinasas intracitoplasmáticas que se unen al dominio citoplasmático de los receptores de citoquinas transmembrana y median la señalización a través de los receptores de citoquinas tipo 1 y tipo 2. Tras la interacción receptor-ligando, se activan varias JAK, lo que conduce a la fosforilación de la tirosina del receptor y la subsiguiente activación de STAT (transductores de señales y activadores de la transcripción), que actúan como factores de transcripción.11
La señalización JAK/STAT media las respuestas celulares a varias citocinas y factores de crecimiento. Estas respuestas incluyen proliferación celular, diferenciación, migración, apoptosis y supervivencia dependiendo de las señales celulares y el medio ambiente. Los STAT activados ingresan al núcleo y se unen a secuencias potenciadoras específicas en genes diana, lo que afecta su transcripción.11
Con base en la investigación básica que comenzó en la década de 1990, se identificaron vías para la transducción de señales que condujeron a la producción de citoquinas inflamatorias para las citoquinas tipo I y II [1-3] 1/2. Este es un proceso difícil que condujo al desarrollo de los inhibidores de la JAK, que resultó en la aprobación de los inhibidores de JAK.12
La DA se caracterizada por una respuesta inmune polarizada Th2 en su fase aguda. La vía JAK/STAT juega un papel importante en las respuestas inmunitarias desreguladas en la DA, incluida la regulación de las respuestas Th2, la activación de los eosinófilos, la supresión de las células T reguladoras (Treg) y la maduración y diferenciación de las células B en células plasmáticas y células con mastocitos de la piel asociados, secreta inmunoglobulina E (IgE), provocando la liberación de histamina. Las respuestas Th2 también inducen la liberación de citocinas proinflamatorias y factores proangiogénicos de las células epidérmicas.7),(13
En función de su selectividad dependiente de la dosis para una o más JAK, los inhibidores de JAK (JAKi) ejercen una amplia gama de efectos inmunofarmacológicos al bloquear múltiples vías de transducción de señales del receptor de citoquinas tipo I (familia hematopoyética) y tipo II (interferón).10
Ellos se pueden clasificar en tres categorías principales: los (pan-)JAKi no selectivos (delgocitinib, cerdulatinib, jaktinib, CEE321) los inhibidores duales (baricitinib, ruxolitinib, brepocitinib, ATI-1777); y los inhibidores selectivos de JAK1 (upadacitinib, abrocitinib, SHR0302). El potencial terapéutico de la inhibición ha demostrado una barrera cutánea mejorada , supresión del prurito , elongación del nervio cutáneo y deterioro de IL-4 e IL-13 pro inflamatorias.10
Resulta necesario desarrollar una revisión de la evidencia científica hasta el momento sobre el papel de los inhibidores de JAK en el tratamiento de la dermatitis atópica, proponiéndonos como objetivo describir la evidencia científica sobre el efecto de los inhibidores de JAK sobre la mejoría clínica y la remisión de la DA.
Método
Diseño del Estudio
Teniendo en cuenta que existen abundante literatura científica sobre el tema objeto de estudio, se sintetizaron los resultados de investigación mediante una revisión sistemática. Esta revisión sistemática se rigió de acuerdo con las directrices PRISMA (elementos de informe preferidos para revisiones sistemáticas y metanálisis).14),(15
Población de estudio
Se incluyeron los artículos científicos que aborden el tema de los inhibidores de JAK como tratamiento, específicamente el uso de abrocitinib en pacientes con DA, en el periodo de enero 2013 a octubre 2022.
Criterios de Inclusión
Artículos originales con tipología IMRyD que desarrollen estudios de cohortes, ensayos clínicos, otras revisiones sistemáticas y metaanálisis.
Criterios de Exclusión
Artículos de revisión, Cartas Científicas/ Cartas al Editor, Casos Clínicos, Editoriales, Artículos Originales que correspondan a estudios preclínicos y Estudios Observacionales.
Selección y Tamaño de la Muestra
Se realizó una búsqueda en Pubmed, Scopus, Web of Science desde enero de 2000 hasta octubre de 2022. Seleccionando resúmenes de estudios de cohorte y de casos y controles que evalúen los inhibidores de JAK como tratamiento en pacientes con dermatitis atópica.
Planificación de la recolección de datos
Se realizó una búsqueda bibliográfica en las bases de datos utilizando como descriptores MESH: “Janus Kinase Inhibitors” y “Dermatitis, Atopic”.
Se clasificaron las publicaciones y de acuerdo con los criterios de inclusión y exclusión se seleccionaron aquellas que conformarán el estudio.
Se realizó una lectura crítica de los resúmenes (abstracts) y artículos in extenso, para valorar su inclusión de acuerdo a la pertinencia.
Consideraciones éticas y legales
Este estudio se incluyeron fuentes de datos secundarias por lo que no corresponde un análisis desde el punto de vista ético, dado que no se realizan experimentación o evaluaciones en seres humanos/animales de experimentación.
Resultados
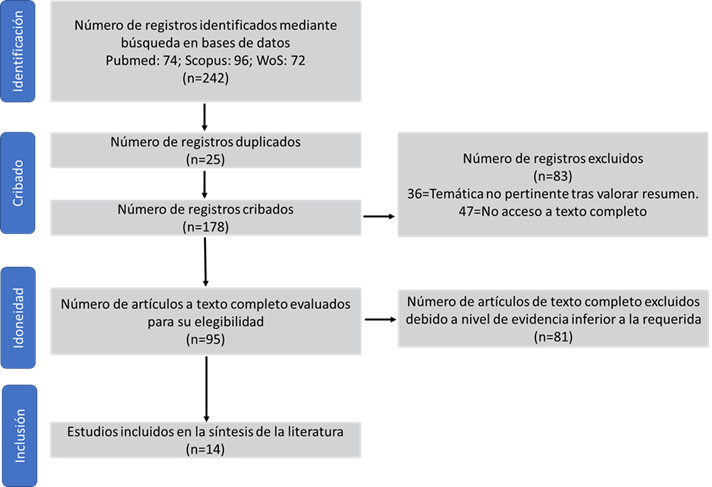
Se encontraron 242 referencias, de las que se eliminaron 228 por no ser artículos empíricos, no abordar el objetivo de la revisión o no contar con el texto completo. Se incluyeron finalmente 14 artículos (Figura 1).
Las principales características de los estudios incluidos en la revisión sistemática se muestran en la Tabla 1.
Tabla 1. Principales características de los estudios incluidos
| Bieber et al., 2021 16 | Estados Unidos | Ensayo Clínico Aleatorizado Fase 3 | 838 pacientes (randomización 2:2:2:1) |
Se asignaron 226 pacientes al grupo de 200 mg de abrocitinib, 238 al grupo de 100 mg de abrocitinib, 243 al grupo de dupilumab y 131 al grupo placebo. Se observó una respuesta IGA en la semana 12 en el 48,4% de los pacientes del grupo de 200 mg de abrocitinib, en el 36,6% del grupo de 100 mg de abrocitinib, en el 36,5% del grupo de dupilumab y en el 14,0% del grupo placebo (p<0,001 para ambos abrocitinib y dupilumab); se observó una respuesta EASI-75 en la semana 12 en el 70,3%, 58,7%, 58,1% y 27,1%, respectivamente (P<0,001 para ambas dosis de abrocitinib frente a placebo). La dosis de abrocitinib de 200 mg, pero no la de 100 mg, fue superior a dupilumab en cuanto a la respuesta al prurito en la semana 2. Ninguna de las dosis de abrocitinib difirió de la de dupilumab en cuanto a la respuesta al prurito. Ninguna de las dosis de abrocitinib difirió significativamente de la de dupilumab en la mayoría de las demás comparaciones de criterios de valoración secundarios clave en la semana 16. Se produjeron náuseas en el 11,1% de los casos. Se produjeron náuseas en el 11,1% de los pacientes del grupo de abrocitinib de 200 mg y en el 4,2% de los del grupo de abrocitinib de 100 mg, y acné en el 6,6% y el 2,9%, respectivamente. |
| Blauvelt et al., 2022 17 | Estados Unidos | Ensayo Clínico Aleatorizado Fase 3 | 798 pacientes (randomización 1:1:1) |
La probabilidad de reagudización durante el mantenimiento fue del 18,9%, 42,6% y 80,9% con abrocitinib 200 mg, abrocitinib 100 mg y placebo, respectivamente. Entre los pacientes con reagudización en los grupos de abrocitinib 200 mg, abrocitinib 100 mg y placebo, el 36,6%, el 58,8% y el 81,6% recuperaron la respuesta 0/1 de la evaluación global del investigador, respectivamente, y el 55,0%, el 74,5% y el 91,8% recuperaron la respuesta del área de eczema y del índice de gravedad, respectivamente, con el tratamiento de rescate. Durante el mantenimiento, el 63,2% y el 54,0% de los pacientes que recibieron abrocitinib 200 y 100 mg, respectivamente, experimentaron acontecimientos adversos. |
| Cork et al., 2022 18 | Reino Unido | Ensayo Clínico Aleatorizado Fase 3 | 267 pacientes (randomización 1:1:1, JADE TEEN; 2:2:1, JADE MONO-1/-2) |
En la semana 12, más adolescentes tratados con abrocitinib (200 o 100 mg) frente a placebo lograron una mejora ≥ 4 puntos desde el inicio en la Medida de Eccema Orientada al Paciente en JADE TEEN (83,9% y 77,0% frente a 60. 2%) y JADE MONO-1/-2 (83,0% y 69,4% frente a 43,5%) y una mejora ≥ 6 puntos desde el inicio en el Índice de Calidad de Vida Dermatológica Infantil en JADE TEEN (73,8% y 67,5% frente a 56,5%) y JADE MONO-1/-2 (70,0% y 57,1% frente a 19,0%). Se demostraron mejoras significativas en las puntuaciones de la Escala Visual Analógica de Dermatitis Atópica SCORing para la pérdida de sueño con abrocitinib frente a placebo en las semanas 2-12 en JADE TEEN y JADE MONO-1/-2. |
| Drucker et al., 2022 19 | Canada | Revisión sistemática y Metaanálisis | 39 estudios |
Hasta las 16 semanas de tratamiento en adultos, abrocitinib, 200 mg al día (diferencia de medias [DM], 2,2; intervalo creíble [IC] del 95%, 0,2-4,0; certeza alta) y upadacitinib, 30 mg al día (DM, 2,7; IC del 95%, 0,6-4,7; certeza alta) se asociaron con una reducción del EASI ligeramente mayor que dupilumab, 600 mg y luego 300 mg cada 2 semanas. Abrocitinib, 100 mg al día (DM, -2,1; ICr del 95%, -4,1 a -0,3; certeza alta), baricitinib, 4 mg al día (DM, -3,2; ICr del 95%, -5,7 a -0,8; certeza alta), baricitinib, 2 mg al día (DM, -5,2; ICr del 95%, -7,5 a -2,9; certeza alta). 5 a -2,9; certeza alta) y tralokinumab, 600 mg y luego 300 mg cada 2 semanas (DM, -3,5; ICr del 95%, -5,8 a -1,3; certeza alta) se asociaron con una reducción del EASI ligeramente menor que dupilumab. Hubo poca o ninguna diferencia entre upadacitinib, 15 mg diarios, y dupilumab (DM, 0,2; ICr del 95%, -1,9 a 2,2; certeza alta). El patrón de resultados fue similar para POEM, DLQI y PP-NRS. |
| Eichenfield et al., 2021 20 | Estados Unidos | Ensayo Clínico Aleatorizado | 285 pacientes (randomización 1:1:1) |
Participaron adolescentes con EA de moderada a grave (145 varones [50,9%] y 140 mujeres [49,1%]), de los cuales 160 (56,1%) eran blancos y 94 (33,0%) asiáticos; la mediana de edad era de 15 años (rango intercuartílico: 13-17 años). Un número sustancialmente mayor de pacientes tratados con abrocitinib (200 mg o 100 mg) frente a placebo alcanzaron una respuesta IGA de 0/1 (46,2%; 41,6% frente a 24,5%; p < 0,05 para ambos), EASI-75 (72,0%; 68,5% frente a 41,5%; p < 0,05 para ambos) y PP-NRS4 (55,4%; 52,6% frente a 29,8%; p < 0,01 para 200 mg frente a placebo) en la semana 12. Se notificaron acontecimientos adversos en 59 (56,1%) pacientes. Se notificaron acontecimientos adversos en 59 (62,8%), 54 (56,8%) y 50 (52,1%) pacientes de los grupos de 200 mg, 100 mg y placebo, respectivamente; las náuseas fueron más frecuentes con abrocitinib, 200 mg (17 [18,1%]) y 100 mg (7 [7,4%]). Los EA relacionados con el herpes fueron infrecuentes; 1 (1,1%), 0 y 2 (2,1%) pacientes tuvieron EA graves. |
| Gooderham et al., 2019 21 | Canadá y Estados Unidos | Ensayo Clínico Aleatorizado Fase 2 | 267 pacientes (randomización 1:1:1:1:1) |
De los participantes, 144 eran mujeres (media [DE] de edad, 40,8 [16,1] años). En la semana 12, 21 de los 48 pacientes que recibieron 200 mg de abrocitinib (43,8%; P < 0,001, a dos caras), 16 de los 54 pacientes que recibieron 100 mg de abrocitinib (29,6%; P < 0,001) y 3 de los 52 pacientes que recibieron placebo (5,8%) alcanzaron grados de claro o casi claro en la escala de Evaluación Global del Investigador, con una mejora de 2,5 mg. El 44,5% (IC del 95%: 26,7%-62,3%) de los que recibieron 200 mg de abrocitinib, el 27,8% (IC del 95%: 14,8%-40,9%) de los que recibieron 100 mg de abrocitinib y el 6,3% (IC del 95%: -0,2%-12,9%) de los que recibieron placebo. Las reducciones en el Índice de Área y Gravedad del Eczema fueron del 82,6% (IC del 90%, 72,4%-92,8%; p < 0,001) para los que recibieron 200 mg de abrocitinib, del 59,0% (IC del 90%, 48,8%-69,3%; p = 0,009) para los que recibieron 100 mg de abrocitinib, y del 35,2% (IC del 90%, 24,4%-46,1%) para los que recibieron placebo. |
| Reich et al., 2022 22 | Alemania | Ensayo Clínico Aleatorizado Fase 3 | 837 pacientes (randomización 2:2:2:1) | En la semana 16, el 48,9%, el 38,0% y el 38,8% de los grupos de abrocitinib 200 mg, 100 mg y dupilumab, respectivamente, lograron una mejoría mayor o igual al 90% desde el inicio en el EASI frente al 11,3% de placebo; el 14,9%, el 12,6% y el 6,5% lograron la Evaluación Global del Investigador 0 (clara) frente al 4,8% de placebo; 29,7%, 21,6% y 24,0% obtuvieron un Índice de Calidad de Vida Dermatológica 0/1 (impacto nulo o mínimo en la calidad de vida) frente a 10,6% con placebo; y 57,1%, 44,5% y 46,1% obtuvieron una Escala de Picor Nocturno de gravedad 0/1 (picor nocturno nulo o mínimo) frente a 31,9% con placebo. La mediana de Kaplan-Meier del tiempo transcurrido hasta una mejoría mayor o igual al 90% respecto al valor basal en el EASI fue de 59, 113 y 114 días en los grupos de abrocitinib 200 mg, 100 mg y dupilumab, respectivamente, y no fue evaluable para el placebo; la mediana del tiempo transcurrido hasta el pico 0/1 de la Escala de Calificación Numérica del Prurito (picor nulo/muy mínimo) fue de 86 y 116 días en los grupos de abrocitinib 200 mg y dupilumab, respectivamente, y no fue evaluable para los grupos de abrocitinib 100 mg y placebo. |
| Shi et al., 2022 23 | Estados Unidos | Ensayo Clínico Aleatorizado Fase 3 | 203 pacientes | Entre los pacientes que habían respondido anteriormente a dupilumab, se logró una mejoría ≥75% en el Índice de Área y Gravedad del Eccema en el 93,5% y el 90,2% de los pacientes que recibieron 12 semanas de abrocitinib 200 mg y 100 mg, respectivamente; se logró una mejoría ≥4 puntos en la Escala de Calificación Numérica del Prurito Máximo en el 89,7% y el 81,6%, respectivamente. Entre los pacientes que anteriormente no respondieron a dupilumab, se logró una mejoría ≥75% en el Índice de Área y Gravedad del Eczema con abrocitinib 200 mg y 100 mg en el 80,0% y el 67,7%, y una mejoría ≥4 puntos en la Escala de Calificación Numérica del Prurito Máximo en el 77,3% y el 37,8%, respectivamente. Los acontecimientos adversos más frecuentes entre los pacientes tratados con abrocitinib fueron nasofaringitis, náuseas, acné y cefalea. La conjuntivitis fue menos frecuente con abrocitinib que con dupilumab. |
| Silverberg et al., 2020 24 | Estados Unidos | Ensayo Clínico Aleatorizado | 301 pacientes (randomización 2:2:1) |
De los pacientes incluidos 229 eran varones [58,6%]; media [DE] de edad, 35,1 [15,1] años); de ellos, 155 recibieron abrocitinib, 200 mg/día; 158, abrocitinib, 100 mg/día; y 78, placebo. Entre los pacientes con datos disponibles en la semana 12, mayores proporciones de pacientes en los grupos de abrocitinib de 200 mg y 100 mg frente al grupo placebo lograron IGA (59 de 155 [38,1%] y 44 de 155 [28,4%] frente a 7 de 77 [9,1%]; P < 0,001) y EASI-75 (94 de 154 [61,0%] y 69 de 155 [44,5%] frente a 8 de 77 [10 . 4%]; p < 0,001), mayores proporciones estimadas de respuestas PP-NRS (55,3% [IC 95%, 47,2%-63,5%] y 45,2% [IC 95%, 37,1%-53,3%] frente a 11,5% [IC 95%, 4,1%-19,0%]; p < 0,001), y/o mayores proporciones de respuestas EASI-90 (58 de 154 [37,7%] y 37 de 155 [23,9%] frente a 3 de 77 [3,9%]). Se notificaron acontecimientos adversos en 102 pacientes (65,8%) del grupo de 200 mg, 99 (62,7%) del grupo de 100 mg y 42 (53,8%) del grupo placebo; se notificaron acontecimientos adversos graves en 2 pacientes (1,3%) del grupo de 200 mg, 5 (3,2%) del grupo de 100 mg y 1 (1,3%) del grupo placebo. Se notificaron descensos en el recuento de plaquetas (2 [1,3%]) y valores de laboratorio indicativos de trombocitopenia (5 [3,2%]) en el grupo de 200 mg. |
| Silverberg et al., 2021 25 | Estados Unidos | Revisión sistemática y Metaanálisis |
36 estudios incluídos (17 ensayos clínicos) |
En los ECA en monoterapia, upadacitinib 30 mg una vez al día (QD) tuvo la eficacia numéricamente más alta (el 83,6% logró una mejora ≥50% en el EASI [respuesta EASI-50]), seguido de abrocitinib 200 mg QD (74,6%), upadacitinib 15 mg QD (70,5%), dupilumab 300 mg cada 2 semanas (Q2W) (63,4%) y abrocitinib 100 mg QD (56,7%). Se observaron tendencias similares en la respuesta EASI-75 y EASI-90. En los ECA de terapia combinada, abrocitinib 200 mg QD tuvo el EASI-50 más alto (86,6%), seguido de dupilumab 300 mg Q2W (82,4%) y abrocitinib 100 mg QD (79,7%). Se observaron resultados similares para la respuesta IGA y los PRO. En los ECA de monoterapia y terapia combinada, la probabilidad de acontecimientos adversos emergentes del tratamiento (AAET) fue mayor entre todos los tratamientos activos que con placebo (excepto para dupilumab 300 mg Q2W [odds ratio [OR], 0,96; intervalo de credibilidad [IC] del 95%, 0,45-2,18] y abrocitinib 100 mg QD [OR, 0,95; IC del 95%, 0,35-2,66] en los ECA de terapia combinada), aunque los tratamientos activos no difirieron significativamente entre sí. Abrocitinib, dupilumab y upadacitinib fueron sistemáticamente los tratamientos sistémicos más eficaces en pacientes adultos y adolescentes con EA, sin diferencias significativas en los ECA a corto plazo. |
| Simpson et al., 2020 26 | Australia | Ensayo Clínico Aleatorizado Fase 3 | 387 pacientes (randomización 2:2:1) |
156 fueron asignados a abrocitinib 100 mg, 154 a abrocitinib 200 mg y 77 a placebo. Todos los pacientes reclutados recibieron al menos una dosis del tratamiento del estudio y, por tanto, se pudo evaluar su eficacia a las 12 semanas. De los pacientes con datos disponibles para los criterios de valoración coprimarios en la semana 12, la proporción de pacientes que habían logrado una respuesta en la Evaluación Global del Investigador fue significativamente mayor en el grupo de abrocitinib 100 mg que en el grupo placebo (37 [24%] de 156 pacientes frente a seis [8%] de 76 pacientes; p=0-0037) y en el grupo de abrocitinib 200 mg en comparación con el grupo placebo (67 [44%] de 153 pacientes frente a seis [8%] de 76 pacientes; p<0-0001). De los pacientes con datos disponibles para los criterios de valoración coprimarios en la semana 12, en comparación con el grupo placebo, la proporción de pacientes que habían logrado una respuesta EASI-75 fue significativamente mayor en el grupo de abrocitinib 100 mg (62 [40%] de 156 pacientes frente a nueve [12%] de 76 pacientes; p<0-0001) y en el grupo de abrocitinib 200 mg (96 [63%] de 153 pacientes frente a nueve [12%] de 76 pacientes; p<0-0001). Se notificaron acontecimientos adversos en 108 (69%) de 156 pacientes del grupo de abrocitinib 100 mg, 120 (78%) de 154 pacientes del grupo de abrocitinib 200 mg y 44 (57%) de 77 pacientes del grupo placebo. Se notificaron acontecimientos adversos graves en cinco (3%) de 156 pacientes del grupo de abrocitinib 100 mg, cinco (3%) de 154 pacientes del grupo de abrocitinib 200 mg y tres (4%) de 77 pacientes del grupo placebo. No se notificaron muertes relacionadas con el tratamiento. |
| Simpson et al., 2021 27 | Estados Unidos | Ensayo Clínico Aleatorizado Fase 3 | 4396 pacientes |
El recuento plaquetario se redujo transitoriamente de forma dependiente de la dosis; 2/2718 pacientes (grupo de 200 mg) presentaron recuentos plaquetarios confirmados < 50 × 103/mm3 en la semana 4. Las tasas de incidencia (IR) fueron de 2,33/100PY y 2,65/100 PY para infección grave, 4,34/100PY y 2,04/100PY para herpes zoster, y 11,83/100PY y 8,73/100PY para herpes simple en los grupos de 200 mg y 100 mg, respectivamente. Las IR de cáncer de piel no melanoma, otras neoplasias malignas y acontecimientos adversos cardiovasculares graves fueron < 0,5/100PY para ambas dosis. Se produjeron cinco tromboembolias venosas (IR 0,30/100PY), todas en el grupo de 200 mg. Hubo tres fallecimientos debidos a carcinoma gástrico (diagnosticado el día 43), muerte súbita y COVID-19. |
| Ständer et al., 2023 28 | Alemania | Ensayo Clínico Aleatorizado Fase 3 | 837 pacientes (randomización 2:2:2:1) | Ya en el día 4 tras el tratamiento, una proporción significativamente mayor de pacientes alcanzó la respuesta PP-NRS4 con abrocitinib 200 mg (18,6%) frente a dupilumab (5,6%; p < 0,001) y placebo (6,0%; p < 0,003). Se observó una tendencia similar con abrocitinib en la dosis de 100 mg, con tasas de respuesta PP-NRS4 significativamente mayores frente a placebo ya en el día 9. Con ambas dosis de abrocitinib, las tasas de respuesta IGA 0/1, EASI-75, EASI-90 y DLQI 0/1 en la semana 12 fueron mayores en los pacientes que respondieron a la PP-NRS4 en la semana 2 que en los que no respondieron; no se observaron diferencias entre los pacientes que respondieron a la PP-NRS4 en la semana 2 y los que no respondieron en los grupos de dupilumab y placebo. La mejoría temprana de la PP-NRS en la semana 2 se asoció con la desaparición de la piel en la semana 12 en los pacientes tratados con abrocitinib. |
| Thyssen et al., 2022 29 | Dinamarca | Ensayo Clínico Aleatorizado Fase 3 | 267 pacientes (randomización 2:2:2:1) |
En la semana 16, la proporción de pacientes que alcanzaron puntuaciones POEM <3 fue del 21,3% y del 11,7% para 200 y 100 mg de abrocitinib, del 12,4% para dupilumab y del 4,8% para placebo (frente a abrocitinib, P < 0,0001 y P = 0,04). La proporción que logró una mejoría ≥4 puntos desde el inicio en la gravedad de la NTIS fue del 64,3% y del 52,4% para 200 y 100 mg de abrocitinib, del 54,0% para dupilumab y del 34,4% para placebo (frente a abrocitinib, p < 0,0001 y p = 0,007). La proporción que logró una mejoría ≥4 puntos en el DLQI con respecto al valor inicial fue del 85,0% y el 74,4% con 200 y 100 mg de abrocitinib, el 83,4% con dupilumab y el 59,7% con placebo (frente a abrocitinib, p < 0,0001 y p = 0,005). |
Discusión
El abrocitinib es un inhibidor de la cinasa JAK1 que fue aprobado por la FDA en enero de 2020 para el tratamiento de la dermatitis atópica refractaria de moderada a grave.30
El abrocitinib combinado con terapia tópica mostró una mayor eficacia en el tratamiento de la dermatitis atópica en comparación con el placebo; el abrocitinib mostró mayores beneficios terapéuticos con respecto a los síntomas de la dermatitis atópica en comparación con el placebo.16
En relación con las escalas de evaluación clínica, los estudios clínicos han demostrado que el abrocitinib puede producir una reducción significativa en la puntuación del POEM en comparación con el placebo. La magnitud de la mejora depende de varios factores, como la gravedad de la enfermedad, la duración del tratamiento y la respuesta individual del paciente. Se debe tener en cuenta que la puntuación del POEM es solo una medida de la actividad de la enfermedad y no refleja necesariamente la mejora en otros aspectos de la calidad de vida, como el dolor o la capacidad física.
Respecto al índice EASI (índice eczema área y gravedad), que es una medida utilizada para evaluar la gravedad de la eccema atópica, los estudios tuvieron como punto de corte la puntuación EASI-75 y EASI-90 que refieren a la mejoría del 75 % y del 90 %, respectivamente, en la puntuación EASI en comparación con la puntuación basal. En los estudios clínicos, como Silverberg et al., 2021,25 y Simpson et al., 2020,26 se demostró que el abrocitinib es eficaz en el tratamiento de la eccema atópica, con una mejora significativa en la puntuación EASI en pacientes tratados con abrocitinib en comparación con el placebo. La magnitud de la mejora dependió de varios factores, como la gravedad de la enfermedad y la duración del tratamiento.
Según los resultados de los estudios clínicos, la puntuación EASI-75 se alcanzó en un porcentaje significativo de pacientes tratados con abrocitinib. La puntuación EASI-90 también se logró en un porcentaje significativo de pacientes, pero la tasa fue ligeramente menor.
En los estudios analizados destacan algunas las ventajas de su uso, entre la que destacan aspectos como la eficacia clínica, donde los estudios clínicos como Simpson et al., 2021,27Ständer et al., 2023,28Bieber et al., 202116, y la revisión de Drucker et al., 202219 han demostrado que el abrocitinib es eficaz en el tratamiento de la dermatitis atópica, con mejorías significativas en los síntomas como picazón, eritema y descamación. Otro elemento destacable, tal como evidencia Blauvelt et al., 2022,17 el abrocitinib tiene una vida media corta, lo que significa que su efecto es rápido y puede ser útil para el manejo agudo de los brotes de dermatitis atópica.
El abrocitinib se administra por vía oral, lo que puede ser más conveniente que las aplicaciones tópicas o inyecciones para algunos pacientes.18),(21 Sin embargo, se reportan efectos secundarios como dolores de cabeza, diarrea, infecciones y dolor abdominal. Es importante tener en cuenta que, dado que este medicamento tiene una aprobación reciente, es posible que puedan surgir otros efectos secundarios a medida que se realice más investigación en humanos.31
Conclusiones
El tratamiento con inhibidores del JAK, como el abrocitinib, está siendo investigado como una opción potencial para el tratamiento de la dermatitis atópica y los artículos incluidos en esta revisión han demostrado resultados prometedores. El abrocitinib mostró una mejora sostenible de los síntomas de la dermatitis atópica, ha demostrado ser bien tolerado en los ensayos clínicos, con menor cantidad e intensidad de efectos secundarios, respeto a otros fármacos como cremas o corticoides sistémicos, y hasta el momento sugieren que los inhibidores de la JAK son bien tolerados por la mayoría de los pacientes. Es importante destacar que el abrocitinib aún es una terapia relativamente nueva y su uso a largo plazo en el tratamiento de la dermatitis atópica requiere más investigación.