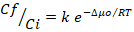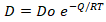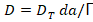INTRODUCCIÓN
Existen diversas fuentes de contaminación por níquel de aguas naturales, siendo la principal la descarga de efluentes industriales directamente a fuentes naturales sin ningún tratamiento previo. Este problema se debe tanto a los altos costos como a la baja eficiencia de muchos de los métodos empleados para la remoción de los metales pesados. En la actualidad se ha desarrollado una diversa gama de tecnologías que apuntan a ser soluciones de bajo costo y ambientalmente amigables (Prieto y col., 2020). Una de estas técnicas es la llamada biosorción, en la cual se hace uso de materia orgánica -viva, muerta o inmovilizada- para la remoción de metales pesados y su posterior recuperación (Duygu y Kumbur 2006), (Larenas y col., 2008).
El presente trabajo tiene por objetivo evaluar la capacidad de biosorción, mediante un estudio cinético de material procedente de residuos de cedro tomando en consideración el tiempo de contacto entre el biosorbente y soluciones modelos.
1.1. Características de Níquel
El níquel es un metal de transición de número atómico 28 y símbolo Ni, cuya configuración electrónica es [Ar]3d84s² y presenta una estructura cristalina cúbica centrada en las caras (Ponjuan y col., 1979). Es de color blanco plateado, conductor de la electricidad y del calor, dúctil y maleable por lo que se puede laminar, pulir y forjar fácilmente. Se encuentra en distintos minerales, en meteoritos (aleado con hierro) y en principio, hay níquel en el interior de la Tierra.
Es resistente a la corrosión y se suele utilizar como recubrimiento, mediante electrodeposición. El metal y alguna de sus aleaciones, como el monel, se utilizan para manejar el flúor y algunos fluoruros debido a que reacciona con dificultad con estos productos.
Su estado de oxidación más estable es 2+. Puede presentar otros, se han observado estados de oxidación 1+ y 3+ en complejos, pero son muy poco frecuentes. Se encuentra en distintos minerales, en meteoritos (aleado con hierro) y en principio, hay níquel en el interior de la Tierra.
1.2. Contaminación con Níquel
El níquel es un elemento natural muy abundante. Puro, es un metal duro, blanco-plateado que puede combinarse con otros metales, tales como el hierro, cobre, cromo y zinc para formar aleaciones (Ponjuan y col., 1979). Estas aleaciones se usan para fabricar monedas, joyas y artículos tales como válvulas e intercambiadores de calor. La mayor parte del níquel se usa para fabricar acero inoxidable.
El níquel es liberado a la atmósfera por industrias que manufacturan o usan níquel, sus aleaciones o compuestos. También lo liberan plantas que queman petróleo o carbón y por incineradores de basura. En el aire, se adhiere a pequeñas partículas de polvo que se depositan en el suelo o son removidas del aire en la lluvia o la nieve; esto generalmente toma varios días.
El níquel liberado en desagües industriales termina en el suelo o en el sedimento, en donde se adhiere fuertemente a partículas que contienen hierro o manganeso.
Se puede estar expuesto al níquel al ingerir alimentos contaminados con el mismo, lo que representa la fuente de exposición más importante para la mayoría de las personas (ATSDR, 2005). También si la piel está en contacto con el suelo, agua de baño o ducha, o metales que contienen níquel, como también al tocar monedas o joyas que lo contienen. Además, al beber agua que contiene pequeñas cantidades, al respirar aire o usar tabaco que lo contenga.
El efecto adverso más común de la exposición al níquel en seres humanos es una reacción alérgica. Las personas pueden sensibilizarse al metal cuando hay contacto directo prolongado de la piel con artículos que lo contienen. Una vez que la persona se ha sensibilizado al níquel, el contacto adicional con el metal producirá una reacción. La reacción más común es un salpullido en el área de contacto. El salpullido también puede aparecer en un área lejos del sitio de contacto. Con menor frecuencia, algunas personas que son sensibles al níquel sufren ataques de asma luego de exposición al mismo. Algunas personas sensibilizadas reaccionan cuando ingieren níquel en los alimentos o el agua o cuando respiran polvo que lo contiene.
El níquel puede producir bronquitis crónica y alteraciones del pulmón al ser inhaladas cantidades mucho más altas que los niveles que se encuentran normalmente en el ambiente. También puede producir dolores de estómago y efectos adversos en la sangre y los riñones (Resumen de Salud Pública, 2005).
La contaminación de iones Ni2+ en los afluentes acuosos está condicionado por la descarga de de las aguas residuales de la industria sin tratamiento que atenúe las altas concentraciones del metal. Esta situación se debe a los altos costos y no adecuada eficiencia de los métodos empleados para la remoción de los metales pesados. En la actualidad se han desarrollado tecnologías dirigidas a solucionar el problema con costos bajos. Una de estas técnicas es la llamada biosorción, en la cual se hace uso de materia orgánica para la remoción de metales pesados y su posterior recuperación (Larenas y col., 2008).
El presente trabajo tiene por objetivo evaluar la capacidad de biosorción, mediante un estudio cinético del serrín de cedro, tomando en consideración el tiempo de contacto entre el biosorbente y soluciones modelos.
MATERIALES Y MÉTODOS
2.1. Técnicas empleadas en la caracterización parcial del adsorbente
Se determinan para la fracción de 0,2 mm de diámetro una serie de parámetros físicos como densidad picnométrica, aparente, aparente por aprisionamiento, compresibilidad, porosidad, velocidad de flujo, tortuosidad, factor de forma, pH y superficie específica.
El análisis inmediato caracteriza a las muestras en términos de sus contenidos de humedad, volátiles, carbono fijo y cenizas. En este trabajo, se llevó a cabo el análisis inmediato de los residuos de cedro, siguiendo las normas ASTM que se detallan a continuación.
2.1.1. Procedimiento según Normas ASTM
Humedad (ASTM D-3175-73)
Se calienta la muestra en estufa a 120°C hasta llegar a peso constante. Los resultados obtenidos se informan sobre la muestra original.
Volátiles (ASTM D-3175-77)
La muestra contenida en un crisol tapado, para simular atmósfera inerte, se calienta durante siete minutos a 850 ± 10°C. Los resultados obtenidos se informan en base seca.
Cenizas (ASTM D-3174-73)
Se coloca la muestra en una mufla a temperatura ambiente y se calienta hasta llegar a una temperatura de 900°C en 4 horas, procurando una atmósfera oxidante durante toda la experiencia. El calentamiento se realiza gradualmente con el objeto de evitar pérdidas de muestra debido a una rápida expulsión de volátiles. Los resultados obtenidos se informan en base seca.
Carbono fijo
El mismo se obtiene por diferencia según la Ecuación 1:
Estos resultados se informan en base seca.
Por último, la muestra del adsorbente se digiere en agua regia y se determina mediante las técnicas de Espectroscopía de Absorción Atómica (EAA) los contenidos de calcio, potasio, sodio y magnesio.
2.2. Estudio cinético
Se prepara una disolución acuosa de 0,042 mol/L del ion Ni2+. Se toman 250 mL y se le añaden 2g de serrín de cedro. Posteriormente, se toman alícuotas de 2 mL en intervalos de 5, 10, 15, 20, 25 y 30 minutos a las temperaturas de 25, 35 y 45oC y se determina la concentración de iones Ni2+ mediante EAA en un equipo Pye Unicam SP 9. Se realizan cinco réplicas por cada punto cinético obtenido. A ese conjunto de puntos se le determinan algunos parámetros estadísticos que describen las características de las curvas cinéticas como media, mediana, desviación estándar del gráfico inclusiva, asimetría gráfica inclusiva y la curtosis (Ostle, 1974).
2.3. Modelos cinéticos y difusivos empleados
Los modelos cinéticos y difusivos considerados son los modelos de seudoprimer orden (SPO), seudosegundo orden (SSO), Elovich (ME), difusión intrapartícula (DPL), difusión en los poros según Bangham (MB), difusión en la película líquida (DPL), (Prieto y col., 2019a), (Prieto y col., 2019b), (Prieto y col., 2019c), (Prieto y col., 2020). Además, se determina la energía de activación del sistema heterogéneo, la variación de entropía y entalpía "aparente" del complejo activado de adsorción y el calor isostérico involucrado en el proceso adsortivo (Ejikeme et al., 2011), (Eyring et al., 1949), (Azmier y Khabibor, 2011), (Fonseca y col., 2014), (Fu y Wang, 2011), (Taha et al., 2016).
RESULTADOS Y DISCUSIÓN
A continuación, en la Tabla 1, se muestran las características físicas del adsorbente, aspecto importante en cuanto a las propiedades físicas, que influyen en el comportamiento químico:
Tabla 1 Parámetros físicos del adsorbente
| Tamaño de partícula (mm) | 0,2 |
| Densidad aparente (g/cm3) | 0,17± 0,070 |
| Densidad aparente por aprisionamiento (g/cm3) | 0,24± 0,046 |
| Densidad picnométrica (g/cm3) | 0,43± 0,028 |
| Velocidad de flujo (mg/s) | 0 |
| Porosidad (%) | 61± 0,75 |
| Compresibilidad (%) | 50 ± 0,030 |
| Superficie específica(m2/g) | 289 ± 0,52 |
Además la tortuosidad del polvo es de 1,8, el factor de forma es de 0,5. La muestra de cedro tiene un pH de 6,9.
Desde el punto de vista físico, es un material de origen vegetal de baja densidad, gran porosidad, lo que justifica su nula velocidad de flujo. Su compresibilidad es elevada. Presenta una superficie específica baja en comparación con algunos carbones, pero alta con respecto a arcillas, zeolitas y sólidos amorfos.
Las partículas presentan una elevada tortuosidad, lo cual condiciona la superficie específica que presenta. El factor de forma brinda una idea de lo alejada que esta la morfología de grano de una esfera. El pH de la muestra puede estar condicionado por los derivados orgánicos presentes en la estructura.
Los bioadsorbentes son materiales porosos constituidos principalmente por carbono, sin embargo invariablemente junto a esta presencia mayoritaria de carbono, siempre está presente un importante contenido de oxígeno e hidrógeno, a la forma de diferentes tipos de grupos funcionales superficiales. Además de los elementos anteriores, se presenta aunque en menores cantidades, nitrógeno, hidrógeno y una variable composición en contenido de metales (cenizas). Por lo anterior es que la caracterización química de un bioadsorbente debe necesariamente considerar el análisis elemental y además de un análisis de sus cenizas con el fin de detectar la presencia de los metales más abundantes en el material. En la Tabla 2 se muestran algunos parámetros químicos del adsorbente.
Tabla 2 Parámetros químicos del adsorbente
| Carbón fijo (%) | 15,38 ± 0,080 |
| Humedad (%) | 11,3± 0,038 |
| Volátiles (%) | 72,3± 0,054 |
| Cenizas (%) | 1,02± 0,021 |
| Sodio (mg/g) | 0,08± 0,010 |
| Potasio (mg/g) | 1,7± 0,18 |
| Calcio (mg/g) | 0,9± 0,016 |
| Magnesio(mg/g) | 0,2± 0,018 |
3.1. Resultados del estudio cinético
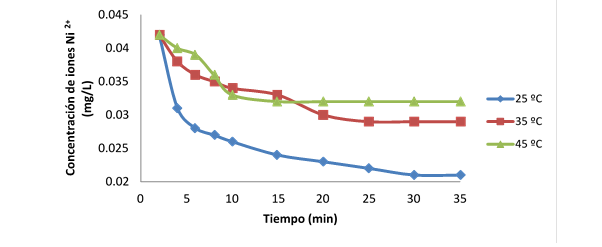
A continuación se muestra la Fig. 1 donde se establece la dependencia de la concentración de iones Ni 2+ (mg/L) vs. tiempo (min).
Se puede apreciar en el gráfico que las mejores condiciones para la adsorción son a 25oC y que se hace mínima a los 45oC. En la Tabla 3 se expresan los coeficientes de determinación para los modelos cinéticos y difusivos empleados.
Tabla 3 Coeficientes de determinación de los modelos cinéticos empleados
|
|
||||||
|---|---|---|---|---|---|---|
| 25 | 0,939 | 0,875 | 0.895 | 0,946 | 0,844 | 0,922 |
| 35 | 0,980 | 0,914 | 0,896 | 0,945 | 0,879 | 0.922 |
| 45 | 0,947 | 0.151 | 0,936 | 0,977 | 0,992 | 0,994 |
Donde:
SPO: Seudoprimer orden, SO: Seudosegundo orden, ME: Mecanismo de Elovich, DIP: Difusión intrapartícula, DPL: Difusión en la película de liquido, MB: Mecanismo de Bangham
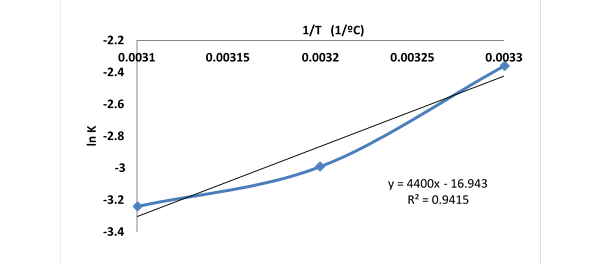
Se aprecia que el modelo cinético que mejor se ajusta es el de seudoprimer orden. Esto se puede considera como si el ion Ni2+ interactuara con un punto del adsorbente. A partir de los valores de la constante "aparente" específica de velocidad de adsorción (kads) para las temperaturas de 25, 35 y 45oC respectivamente: 0,276, 0,118 y 0,104 min-1 se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 38,4 kJ/mol, con un valor del factor preexponencial de 1,1•107 min -1. Este valor bajo de la energía de activación refleja un proceso de adsorción de naturaleza física.
Al establecer la dependencia ln Ce vs 1/T se determina el calor isostérico cuyo valor de 8,2 kJ/mol, demuestra su poca relevancia, lo cual responde a la baja heterogeneidad energética superficial. Los valores de los tiempos de vida media para los procesos a 45, 35 y 25oC son 6,66, 5,87 y 2,51 minutos. Todo ello refleja cómo el proceso de adsorción está favorecido a 25oC.
Es de destacar que a 45oC el modelo de Elovich presenta un coeficiente de determinación elevado en comparación con los procesos a menor temperatura, lo cual puede estar condicionado por procesos químicos de adsorción condicionados por la alta temperatura. La difusión intrapartícula presenta elevados valores de los coeficientes de determinación a las tres temperaturas. Como mecanismo difusivo del proceso permitirá obtener los coeficientes de difusión a las diferentes temperaturas, el valor del factor preexponencial del proceso difusivo y su energía de activación.
La difusión en la película de líquido no es de consideración para las temperaturas de 25 y 35oC pero no es despreciable a 45oC, donde el aumento de temperatura condiciona una mayor movilidad de los iones y por tanto una mayor influencia en la película de líquido que cubre el grano de adsorbente. Por último, llama la atención los coeficientes de determinación del mecanismo de Bangham por sus valores apreciables, lo cual permite especular sobre el papel de los microporos en el proceso difusivo de los iones Ni 2+ en la matriz sólida del grano del adsorbente. A partir de la Ecuación 2 es posible obtener la variación de entalpía y entropía de adsorción.
Donde:
K: constante de equilibrio (adimensional), ∆𝐻𝑎𝑑𝑠: Variación de entalpía (J/mol), ∆𝑆𝑎𝑑𝑠: Variación de entropía (J/(mol.K)), R: Constante universal de los gases (8,3144 J/(mol. K)), T: Temperatura (K).
Es preciso conocer la relación K= qe/Ce donde K es la constante de equilibrio, qe la capacidad de adsorción (mg/g) y Ce la concentración de equilibrio (mg/L) para cada temperatura, lo cual se muestra en la Tabla 4. Ver Fig. 2.
Tabla 4 Constantes de equilibrio a diferentes temperaturas
|
|
|
|
|
|---|---|---|---|
| 25 | 2,25 • 10-3 | 0,024 | 0,094 |
| 35 | 1,50 • 10-3 | 0,030 | 0,050 |
| 45 | 1,25 • 10-3 | 0,032 | 0,039 |
El empleo de la Ecuación 2 permite obtener los valores:
ΔHads = -36,6 kJ/mol
ΔSads = -0,14 kJ/(mol• K)
El proceso de adsorción trae aparejado una liberación de energía y a una disminución de la aleatoriedad del sistema adsorbente/adsorbato. Al establecer la Ecuación 3:
Donde:
R: Constante universal de los gases 8,314 J/(mol•K), T: Temperatura (K).
Se obtienen los valores mostrados en la Tabla 5 para la variación de energía libre de adsorción.
Tabla 5 Valores de ΔGads a diferentes temperaturas
|
|
|
|---|---|
| 25 | 5,8 |
| 35 | 7,7 |
| 45 | 8,6 |
A partir de los valores de variación de entalpía, entropía y energía libre de adsorción se puede afirmar que el proceso es posible a bajas temperaturas.
Al aplicar el modelo rotacional es posible obtener el coeficiente de difusión del proceso a las tres temperaturas estudiadas.
El proceso difusivo está regido por la diferencia de los potenciales químicos. Lo anterior puede ser hallado por la Ecuación 4:
donde:
Cf/Ci: Relación de la concentración final e inicial a cada temperatura, K: Constante de proporcionalidad (adimensional), Δμo: Diferencia de potenciales químicos (J/mol), R: Constante de los gases 8,314 J/(mol. K), T: Temperatura (K). Ver Tabla 6.
Tabla 6 Relación entre ln Cf/Ci vs 1/T
|
|
|
|---|---|
| -0,56 | 3,35 • 10-3 |
| -0,34 | 3,25 • 10-3 |
| -0,27 | 3,14 • 10-3 |
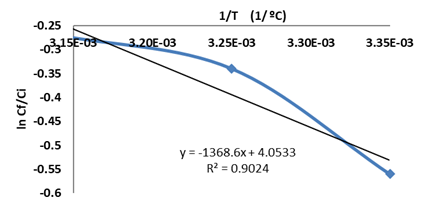
A continuación en la Fig. 3 se muestra la dependencia de ln Cf/Ci vs 1/T. A partir de la pendiente se establece el valor de Δμo = 11,37 kJ/mol, el cual demuestra que el proceso de difusión está favorecido.
Otro aspecto a considerar es la determinación del coeficiente de difusión efectivo, como se muestra en la Tabla 7, muy vinculado a la morfología de grano del bioadsorbente.
Tabla 7 Coeficientes de difusión a las temperaturas de estudio
|
|
|
|---|---|
| 25 | 1,1•10-16 |
| 35 | 9,0•10-17 |
| 45 | 5,2•10-17 |
Es apreciable como un aumento de temperatura provoca una disminución de la difusión en el grano. Lo anterior está relacionado con el aumento de la temperatura en el sistema heterogéneo que provoca dificultades en el traslado de los iones a través de la matriz sólida del adsorbente. A partir de la Ecuación 5:
Donde:
D: Coeficiente de difusión efectivo (m2/s), Do= Factor pre-exponencial (m2/s), Q: Energía de activación del proceso de difusión (kJ/mol), R: 8,314 J/(mol•K), T: Temperatura (K), Es posible obtener:
Do= 2,6•10-21 m2/s
Q= 26,4 kJ/mol
Lo anterior permite afirmar que se invierte 66,8 % de la energía de activación en el proceso difusivo. Conociendo que la tortuosidad es 1,76 es posible obtener la difusividad teórica o coeficiente de difusión teórico para cada temperatura a través de la Ecuación 6. Los resultados se muestran en la Tabla 8.
Donde:
DT: Coeficiente de difusión teórico (m2/s), da: densidad aparente por aprisionamiento (g/mL), Γ: Tortuosidad (adimensional).
Tabla 8: Coeficientes de difusión teóricos a las temperaturas de estudio
|
|
|
|---|---|
| 25 | 1,1•10-15 |
| 35 | 9,3•10-16 |
| 45 | 5,4•10-16 |
Se aprecia como la difusión teórica es mayor que la efectiva a las temperaturas de trabajo. Las diferencias entre las difusividad teóricas y efectivas son de 9,9·10-16, 8,4·10-16 y 4,9·10-16 m2/s a las tres temperaturas de estudio.
CONCLUSIONES
Desde el punto de vista físico el serrín de cedro es un material de origen vegetal de baja densidad, gran porosidad, lo que justifica su nula velocidad de flujo. Su compresibilidad es elevada. Presenta una superficie específica baja.
A partir de los valores de kads para las temperaturas de 25, 35 y 45oC respectivamente: 0,276, 0,118 y 0,104 min-1 se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 38,4 kJ/mol, con un valor del factor preexponencial de 1,1•107 min-1, refrendando un proceso de naturaleza física.
El proceso de adsorción de iones Ni2+ presenta valores negativos de variación de entropía y entalpía, no así de energía libre, lo que condiciona que el mismo pueda ocurrir a bajas temperaturas.
El proceso de adsorción de iones Ni2+ posee bajo calor isostérico (8,2 kJ/mol) involucrado.
El proceso difusivo consume el 66,8% de la energía de activación del proceso.