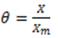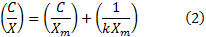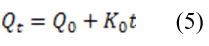Introducción
Las partículas poliméricas biodegradables son empleadas para mejorar el valor terapéutico de disímiles fármacos,1 tanto solubles como insolubles en agua, así como de moléculas bioactivas, mediante el mejoramiento de su biodisponibilidad, solubilidad y tiempo de permanencia, a la vez que reducen los riesgos de toxicidad.2,3 Pueden afectar radicalmente la biodistribución de un citostático,4 por tanto, aumentar su concentración y la especificidad de ataque en tejidos malignos. En el caso de tratamientos locales, dichos sistemas de liberación para citostáticos pueden aumentar el índice terapéutico, debido a la reducción de la adsorción sistémica y/o los efectos secundarios, los cuales se presentan cuando este actúa en sitios no específicos.5
Son variadas las estructuras poliméricas que han sido estudiadas para incrementar el índice terapéutico y reducir los efectos colaterales.6 Dentro de estos, los policianoacrilatos de alquilos (PACA, por sus siglas en inglés) presentan propiedades que los hacen excelentes bloques de construcción para la elaboración de sistemas de liberación controlada como nanocápsulas y nanoesferas.7,8,9,10 El policianoacrilato de n-butilo (PBCA, por sus siglas en inglés) resulta de particular interés para portar fármacos citotóxicos como el 5-FU dadas las bondades que presenta su monómero precursor, el cianoacrilato de n-butilo (BCA, en inglés), que posee baja toxicidad y buena biodegradabilidad.11
Para estudiar el fenómeno de adsorción se evalúan los datos obtenidos mediante isotermas.12 De estas, existen cinco tipos o perfiles.12 El caso de la adsorción del 5-FU en partículas de policianoacrilatos de alquilo, puede ser adecuadamente descrito mediante el Modelo de Langmuir:13,14,15
donde:
k: constante de equilibrio (empírica), expresa la fortaleza de las interacciones adsorbato-adsorbente
C: concentración másica en el equilibrio
X: cantidad de adsorbato adsorbido (mg/g)
Xm: máxima adsorción del adsorbato en la superficie (mg/g).
Esta expresión puede ser linealizada según:
Correspondiéndose:
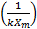 con el intercepto, y
con el intercepto, y 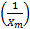 con la pendiente.
con la pendiente.
Estos mecanismos de liberación de una sustancia o principio activo de una matriz polimérica, dependen de varios factores como la difusión, el contacto con disolventes y procesos químicos.16,17,18 Los modelos cinéticos que pueden seguir los fármacos para ser liberados de una matriz son variados, y se pueden dividir en dos grupos: los que liberan el fármaco lentamente desde el inicio cumpliendo una cinética de orden cero o de primer orden, y los que liberan rápidamente al inicio una primera dosis y luego; le sigue una segunda fase más lenta y sostenida con un comportamiento cinético de orden cero o primer orden a partir de ese momento inicial.19,20
Los trabajos revisados en su mayoría emplean métodos basados en funciones matemáticas que describen perfiles de disoluciones. Para proceder, se selecciona una función adecuada y se evalúan los parámetros. El modelo que describe el orden cero,20 puede ser utilizado para diversos sistemas de liberación como parches transdermales, tabletas con composición matricial cargadas con fármacos poco solubles, etc. La expresión matemática que lo define es:
donde:
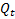 : cantidad de fármaco disuelta en el tiempo t
: cantidad de fármaco disuelta en el tiempo t
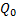 : la cantidad inicial de fármaco en la disolución
: la cantidad inicial de fármaco en la disolución
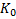 : constante de liberación de orden cero.
: constante de liberación de orden cero.
Varios autores han abordado la temática de la liberación del 5- FU desde liposomas,21,22 nanopartículas poliméricas,23,24) niosomas,25 trasfersomas,26 nanogeles27 y desde microesferas de quitosana.28) Estos trabajos logran liberación controlada del medicamento, pero en periodos cortos de tiempo. En esta investigación se realiza la preparación de nanopartículas cargadas con 5-fluorouracilo para la liberación controlada durante un tiempo prolongado estimado de 6-8 h y su posible utilización en el tratamiento del cáncer de piel.
Materiales y métodos
Obtención de las partículas de policianoacrilato de n-butilo cargadas con 5-fluorouracilo
La metodología seguida para la obtención y caracterización de las partículas libres y luego cargadas con el fármaco en la superficie, así como los reactivos, disoluciones e instrumentación empleados, están descritos por Ferrer y colaboradores. De igual manera, durante la técnica de obtención de las partículas con el fármaco encapsulado se siguió el criterio de Ferrer.29 De forma resumida, durante la polimerización en emulsión, al medio acuoso ácido que contenía surfactante (y el citostático, en el caso de la encapsulación), se le goteó cuidadosamente el monómero disuelto en acetona y se mantuvo en agitación durante 4 h. Luego se aseguró el fin de la polimerización mediante la neutralización del medio con KOH (0,1 mol/L). Al finalizar, se rotoevaporó la emulsión para eliminar los restos de acetona, y las partículas se lavaron hasta igualar el pH del agua sobrenadante al del agua bidestilada empleada, y se almacenaron hasta su uso.
Estudios de sorción superficial del 5-FU a las nanoesferas
Comparando la concentración inicial y la final luego del tiempo de contacto con las nanopartículas mediante HPLC 29 se comprobó la adsorción del fármaco. Los estudios mediante isotermas de adsorción, indicaron como las moléculas adsorbidas se distribuyen en la fase sólida cuando el proceso de adsorción alcanza un estado de equilibrio. Los experimentos consistieron en: preparar disoluciones de 5-FU a concentraciones de 0,0010; 0,0015; 0,0020; 0,0025; 0,0030 y 0,0035 mg/mL, y a cada disolución se le añadió una masa constante (5,0 mg) de las partículas, manteniendo en agitación (Zaranda HDL, China, 160 rpm) a temperatura de 20 °C durante cuatro horas. Con los datos obtenidos se graficó la isoterma de adsorción y su correspondiente función lineal empleando el modelo de Langmuir.
Estudios de liberación in-vitro del 5-fluorouracilo
Los experimentos de liberación fueron realizados empleando las partículas cargadas por ambas metodologías descritas por Ferrer y col.22) Las determinaciones del 5-FU liberado se llevaron a cabo utilizando como medio de liberación una disolución buffer a pH= 7,4 que fue preparada con una mezcla de 3,4 g de dihidrógenofosfato de potasio (KH2PO4) y 4,35 g de hidrógenofosfato de potasio (K2HPO4) en 0,5 L.
El procedimiento seguido se describe a continuación: en unos tubos Corning para reacción, se añadieron 20 mL de la disolución buffer de fosfato y una masa correspondiente a 0,075 g de partículas cargadas con el citostático. Ambos fueron colocados en una zaranda termostatada con baño de agua bajo una agitación de 160 rpm a 37 ºC, y se tomaron muestras de 50 µL en intervalos de tiempo determinados durante un periodo de siete horas. El proceso fue seguido mediante cromatografía líquida de alta resolución (HPLC Shimadzu Prominence LC-2010 con detector Ultravioleta SPD-M20A) y fueron realizados experimentos por cuadruplicado, alcanzándose resultados similares entre ellos.
Resultados y discusión
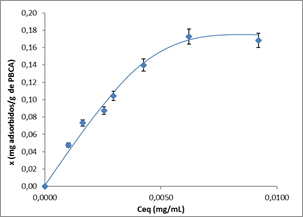
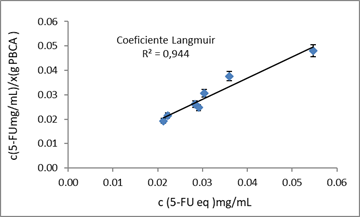
La data obtenida por HPLC permitió calcular la capacidad de adsorción de las partículas en el equilibrio para cada punto (concentración de 5-FU por g de polímero) y las concentraciones de 5-FU en el equilibrio (Ce), en la disolución. Partiendo de estos datos, se construyó la isoterma (figura 1).
Para una mejor interpretación de los resultados, se obtuvieron las representaciones lineales de ambos modelos matemáticos y se presenta en la figura 2, el modelo que mejor se ajusta.
Como se aprecia en la figura 2, los datos muestran un buen ajuste al modelo empleado con valores de coeficiente de determinación (R2) de 0,94. Este resultado indica, que el 5-FU en las condiciones trabajadas se adsorbe en forma de monocapa sobre las partículas de PBCA.
El análisis mediante el modelo de Langmuir permitió conocer la máxima adsorción del 5-FU en las partículas (xm). Con un valor de 0,284 8 g 5-FU/g polímero, indica que el máximo porcentaje de 5-FU que son capaces de adsorber las partículas, se halla alrededor de un 28 %.29
Experimentos de liberación del fármaco
La figura 3 muestra la liberación del 5-FU expresada como concentración másica en función del tiempo. En esta se observa que el citostático es liberado con mayor facilidad de las partículas que presentan el 5-FU encapsulado. En este caso, el 5-FU parte de una concentración inicial de 0,023 6 mg/mL hasta una concentración final de 0,043 7 mg/mL. La concentración máxima a liberar del citostático a partir de 86,1 mg de polímero fue de 0,032 7 mg/mL estimado a partir de un estudio previo.19) Durante el experimento se liberaron 0,013 08 mg/mL (61,4 %) del 5-FU esperado). Este valor indica que se encuentran disponibles para uso como fármaco 5,5mg (5-FU)/g (polímero), al utilizar una concentración inicial de 3,0 x 10-4 mol/L durante la obtención de las nanoesferas con el fármaco encapsulado.
En el caso del polímero con el 5-FU adsorbido, este es liberado desde una concentración inicial de 0,011 5 mg/mL hasta una concentración final de 0,014 8 mg/ml. La concentración máxima a liberar del citostático a partir de 76,8 mg de polímero, fue de 0,043 9 mg/mL. Durante este experimento, se liberaron 0,003 4 mg/mL (7,7 % del valor teórico de 5-FU esperado). Este valor indica que se encuentran disponibles para uso como fármaco 3,0 mg (5-FU)/g (polímero), al utilizar una concentración inicial de 1,5 x 10-4 mol/L durante el proceso de carga por adsorción.
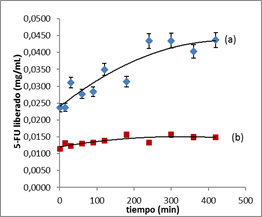
Fig. 3 Representación gráfica de la liberación del 5-FU de las partículas de PBCA. (a) 5-FU encapsulado; (b) 5-FU adsorbido
La concentración inicial reportada en cada caso corresponde a la suma del 5-FU contenido en el polímero y al retenido en el papel del filtro de membrana empleado para separar las partículas. La contribución de este último, está relacionada con la propia adsorción del papel, el que fue cortado en pequeños trozos y sumergido en la disolución para los estudios de liberación.
Para producir las nanoesferas con el fármaco encapsulado, este es añadido al medio de polimerización, y es posible que la presencia del mismo conlleve a la obtención de una estructura más porosa, donde las cadenas poliméricas están más relajadas y las cavidades se encuentran interconectadas, formando canales continuos en una superficie heterogénea, lo que permite que el 5-FU atrapado en la matriz, escape con mayor facilidad. Esto está comprobado que ocurre en otros casos como en polímeros de impresión molecular, cuyo método de obtención es semejante al descrito en este trabajo, para la elaboración de las nanoesferas con el citostático encapsulado.30
En el caso de los experimentos de adsorción, la baja cantidad liberada pudiera ser explicada considerando que el 5-FU se encontrara quimisorbido a la superficie de las partículas. Otra alternativa, es considerar que durante la síntesis de estas partículas, los poros superficiales que se crean, son lo suficientemente profundos y no están interconectados. Así que, durante el proceso de carga del medicamento, este entra en los poros, pero luego difunde con dificultad y de forma incompleta. Una combinación de ambos factores permite explicar el comportamiento observado.
El modelo cinético de liberación del citostático desde las partículas fue evaluado considerando orden cero de acuerdo con la ecuación 5.
Los gráficos obtenidos se muestran en la figura 4. De ellos se obtienen los valores del intercepto (Qo, cantidad inicial de fármaco) y la pendiente (constante de orden cero, Ko).
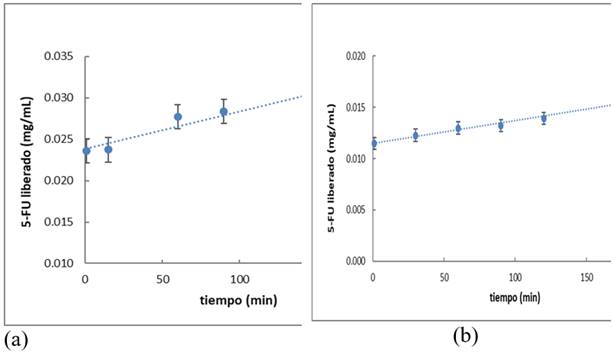
Fig. 4 Modelo cinético de liberación de orden cero para las partículas con el 5-FU (a) encapsulado y (b) adsorbido
Los valores obtenidos para ambos casos fueron los siguientes: Qo= 0,023 9 y Ko= 4,49*10-5 con R2= 0,94 para las partículas con el 5-FU encapsulado y Qo= 0,011 5 y Ko=2,22*10-5 con R2= 0,98 para las partículas con el 5-FU adsorbido. Se puede concluir, que el modelo cinético estudiado presenta un buen ajuste a los datos experimentales, por tanto, la liberación del citostático tanto encapsulado, como adsorbido en las partículas de PBCA, sigue una cinética de orden cero, donde la cantidad de 5-FU liberado presenta una relación directa con el tiempo. Este comportamiento es el deseable en los sistemas de liberación controlada.17,18,31
La liberación del citostático desde las partículas fue realizada en buffer fosfato a pH 7,4. De 11,7 mg/g polímero de 5-FU adsorbido, se liberaron 3,0 mg/g polímero, mientras que del encapsulado de 7,4 mg/g polímero se liberaron 5,5 mg/g polímero, en un periodo de tiempo de siete horas para ambos casos, que resultan superiores al comportamiento que obtienen otros autores.
Con una carga cercana al 30 % del fármaco total empleado por gramo de polímero, en este trabajo se adsorbió una cantidad de 7,4 mg de 5-FU g polímero. En el estudio de isotermas de adsorción, el valor hallado de constante de adsorción/desorción (K= 223 L/mol) se encuentra en un rango similar a lo reportado en literatura. Arias y col. reportan valores de 214 y 200 L/mol,14 siendo indicativa de que la cantidad de fármaco liberado a partir de lo adsorbido es similar a otros trabajos. La capacidad de adsorción máxima (Xm) produjo un valor de 0,284 8 mg/g polímero (2,19 µmol/g polímero). Arias y col.15) reportan la liberación de casi la totalidad del fármaco adsorbido (12,2 mg/g en 40 min y 3,40 mg/g en 2 h). En cuanto al encapsulado (1,18 mg/g) liberó un 65 % en 1 h y el 35 % restante en las próximas 2 h, y para 0,77 mg/g cargados; el 75 % en 30 min y el 25 % restante durante las siguientes 20 h con concentraciones de partida del fármaco diferentes. Por otra parte, Semionova y col.,32) obtienen partículas con diámetros entre 148-160 nm empleando un tiempo de polimerización de 3h, pH de 2-3, dextrana 40 (0,8 % m/v) y 10 mg/mL de 5-FU, mientras consigue una eficiencia de encapsulación de 85 %, cuya liberación se estudió por un lapso de 6 h.