Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.32 no.2 Santiago de Cuba may.ago. 2012
ARTICULO ORIGINAL
Estudio de un inhibidor de corrosión en medio ácido
Study of a Corrosion Inhibitor in Acid Medium
M.Sc. Bibiana Sandianes-VegaI, Dr. Jorge Uruchurtu-ChavarínII, Dr. Osmar Calderón-SecadaIII, Dr. Osmar Calderón-SánchezIV
I: Centro de Investigación y Desarrollo del Comercio Interior (CID-CI), La Habana, Cuba. bibiana@cidci.cu
II: Universidad Autónoma del Estado de Morelos (UAEM), Cuernavaca, Morelos, México. juch25@uaem.mx
III: Empresa Gestión del Conocimiento y la Tecnología (GECYT), La Habana, Cuba
IV: Facultad de Química de la Universidad de La Habana, Cuba
RESUMEN
El tratamiento ácido a pozos de petróleo es uno de los procesos tecnológicos más corrosivos para instalacione s metálicas, pues involucra ácidos concentrados, elevada temperatura y tiempo prolongado, entre otros, siendo imprescindibl e el uso de métodos de protección contra la corrosión, donde el más adecuado y difundido en la práctica mundial es la adición de inhibidores de corrosión a la receta ácida. Sin embargo, gran parte de estos productos disminuye su acción protectora en el sistema mencionado, por lo que son escasos aquellos que satisfacen las exigencias para poder ser utilizados en estos tratamientos, lo cual además eleva su precio en el mercado internacional. Cuba no cuenta con productos aptos para esta aplicación y la composición de los comercia les importados es generalmente desconocida, por lo que el objetivo de este trabajo fue estudiar un inhibidor comercial para tratamientos ácidos a pozos de petróleo, que posee reconocido prestigio y probada eficiencia, cuyos resultados sustentaran el desarrollo de productos nacionales de similar eficiencia y menor costo. Se emplearon técnicas de análisis para identificar elementos de la composición y estructura delos componentes, previamente separados enfracciones, así como métodos electroquímicos para el estudio de su comportamiento inhibidor, demostrando estos últimos que el principio activo radica en el residuo, el cual se comporta similar al producto original, con una conducta típica de inhibidores mixtos de adsorción, recomendados para medio ácido. Parte del trabajo se realizó en el Instituto de Investigaciones Eléctricas de México, por una beca de investigación, otorgada por su Secretaría de Relaciones Exteriores.
Palabras clave: corrosión, inhibidores de corrosión, medio ácido, tratamiento ácido a pozos de petróleo.
ABSTRACT
Acid treatment in oil wells is one of the most corrosive technologic process for metallic installations, since it involves concentrated acid solutions, high temperature under long exposure periods amongst others. It is imperative the use of corrosion control methods, being the most adequate and common the use and addition of inhibitors in the acid environment, the world over. Nevertheless, in most of these products the corrosion protection diminishes as a function of time, therefore there are just a few that satisfy the action conditions needed to be used under these corrosion conditions and its cost are increased in the world market. Cuba has no products that satisfy this composition and application standards and the chemical composition of the imported international products is unknown. The objective of the present work was to study a commercial inhibitor a highly used oil well acid treatment inhibitor, which enabled to compare with a further development of a national inhibitor product development of a similar efficiency but with a lower cost. Analytical techniques were used to identify structure and composition previously fractionally separated, as well as electrochemical evaluation for the inhibitor performance and efficiency. It was demonstrated that the active component rest in the residual by-product obtained, behaving in a similar way to the original product, a typical behaviour observed for the mix adsorption reaction inhibitors, recommended for acid media. Part of his work was made in the Electric Research Institute in Mexico with a research scholarship given by the Mexican Foreign Relations Secretary.
Keywords: corrosion, inhibitor, acid media, oil well acid treatment.
INTRODUCCION
El tratamiento ácido a pozos de petróleo consiste en inyectarles grandes volúmenes de fluidos ácidos, forzándolos a entrar a presiónen la formación par a disolver parte de la s rocas, aumentando su permeabilidad y la fluencia del petróleo [1-5].Se efectúa enpozos en ensayo, que sonpunzados buscando la capa productiva, opara estimular pozos en explotación, que por causas diferentes, han disminuido su producción, afectando esto sensiblemente la economía de cualquier país [1].
Los fluidos o recetas empleadas están compuestas usualmente por uno o más ácidos a altas concentraciones con otros aditivos, pudiendo alcanzar temperaturas elevadas según la profundidad del pozo, durante un tiempo que suele prolongarse varias horas y además pueden existir diferentes contaminantes. Estas condiciones definen la alta corrosividad del proceso hacia los materiales metálicos, siendo ineludible aplicar medidas de protección anticorrosivas, donde la adición de inhibidores de corrosión al medio ácido es el método más adecuado y difundido en la práctica mundial [1-3, 6-9], aunque no existen inhibidores de uso universal, para su desarrollo y selección hay que considerar la interrelación metal-medio corrosivoparámetros tecnológicos.
Las agresivas condiciones de estos tratamientos disminuyen la acción protectora de gran cantidad de inhibidores de corrosión, siendo escasos en el mercado internacional los que logran satisfacer las exigencias para poder ser usados en los mismos, y además poseen precios muy elevados.Usualmente estos productos se encuentran con nombres o marcas registradas, estando formados por varios compuestos, entre los que se halla el principio activo, donde radica la cualidad inhibidora, cuya composición química habitualmente es protegida, ofreciéndose una pequeña o a veces nula información sobre la misma [2, 4].
En Cuba se han realizado múltiples trabajos para obtener inhibidores de corrosión, pero aún no se dispone en el mercado interno de productos aptos para la aplicación referida. El objetivo de este trabajo fue estudiar un inhibidor comercial importado, de reconocido prestigio y probada eficiencia en tratamientos ácidos a pozos de petróleo, cuyos resultados sustentaran el desarrollo de inhibidores de similar desempeño y menor costo.
FUNDAMENTACION TEORICA
En Cuba los pozos de petróleo se hallan en general en formaciones calizas y dolomitas, utilizándose en los tratamientos ácidos usualmente el ácido clorhídrico por su alta velocidad de reacción con las mismas [2], es fácil de obtener comercialmente a un costo relativo bajo y su manipulación no es muy compleja [1]; su principal desventaja por su alta fortaleza iónica es su corrosividad hacia los materiales metálicos, costosa y difícil de controlar [6, 10], pues la velocidad de corrosión de estos aumenta sin límite con la concentración de clorhídrico [4, 6, 11], que varía de 10-30 % [2, 3, 6, 7, 9], siendo la más usada para pozos en formaciones calizas la de 15 %.
La temperatura es factor perjudicial para la corrosión, que depende de la profundidad, puede superar los 100 0C en pozos ultra-profundos [3, 6-7, 8-9]; en nuestro país usualmente no se alcanza ese valor. La relación velocidad de corrosión-temperatura en medio ácido es una función exponencial tipo Arrehnius, donde la corrosión ocurre con despolarización por hidrógeno, reduciendo el sobrevoltaje de este sobre la superficie metálica [10, 12-14], provocando que [6]:
- la velocidad de la reacción metal-ácido (no inhibido) se incremente notablemente
- el área efectiva de la superficie metálica aumente por el rápido ataque del ácido.
El tiempo de tratamiento puede ser de 2-12 h o más, según las condiciones reales de operación, durante el cual la pérdida de metal crece continuamente estando expuesto al ácido, agravado por la acción unísona de la alta concentración y elevada temperatura del clorhídrico, por tanto el proceso debe realizarse en el menor tiempo tecnológicamente posible, usando medidas de protección anticorrosiva, donde la adición de inhibidor de corrosión al medio es la más adecuada y difundida [1-3, 6-9].
Los inhibidores de corrosión son sustancias químicas que, añadidas en concentraciones pequeñas al medio corrosivo, actúan en la interfase metal-solución, disminuyendo sensiblemente la velocidad de corrosión del material metálico, expuesto al mismo [13].
El parámetro fundamental que caracteriza a los inhibidores de corrosión, aunque no el único que define su uso, es su efectividad, en la que incide la estructura química de la molécula. En ácido clorhídrico son efectivos los compuestos orgánicos que posean grupos funcionales con al menos un heteroátomo de nitrógeno, azufre, oxígeno, fósforo y/o enlaces múltiples, preferible triples [9]; además si son suficientemente solubles en el medio pueden ser altamente efectivos a muy bajas concentraciones, con mínima saturación de la superficie metálica [6]; pues se adsorben sobre los centros activos del metal y retardan el paso controlador de la velocidad de corrosión, que es la transferencia electrónica [6, 13, 15], comportándose usualmente como inhibidores mixtos, que pueden tener cierta tendencia catódica o anódica.
La efectividad del inhibidor puede afectarse por el aumento de temperatura del sistema, lo que en general, puede hacer que [6]:
- la parte de superficie cubierta por inhibidor adsorbido varíe, en general disminuye
- algunos inhibidores a altas temperaturas pueden descomponerse
Por otra parte, en dependencia de la duración del proceso, puede ocurrir que [6]:
- el inhibidor cambie químicamente o precipite de la solución
- la superficie de metal aumenta, por efecto "panal de abeja" o formación de picaduras, o varía la relación de áreas anódica/catódica por deposición de alguna sustancia Usualmente sobre los inhibidores de corrosión comerciales únicamente se ofrece una pequeña o nula información de su composición química, que es habitualmente protegida [2, 4], no solo por no divulgar el principio activo inhibidor, que es de por sí importante, a veces es porque este no es mayoritario entre los componentes de la formulación y se encuentra en muy pequeña proporción, que podría llamar la atención de los compradores del producto.
En general los inhibidores comerciales incluyen en su formulación [2]:
- compuestos inhibidores o principio activo
- mejoradores de propiedades protectoras
- mejoradores de solubilidad o dispersabilidad
- solventes, biocidas demulsificantes
- sustancias inactivas de relleno
- otros aditivos según aplicación para obtener inhibidores de corrosión, lográndose uno aceptable para la aplicación referida [16], el cual aún no se dispone en el mercado interno por diferentes razones, continuándose la búsqueda de otros productos.
MATERIALES Y METODOS
Se estudió un inhibidor de corrosión de composición química desconocida, que se recomienda para ser empleado en tratamientos ácidos a pozos de petróleo por una firma europea de reconocido prestigio mundial, que no se menciona por razones obvias.
El producto original, un líquido color naranjacarmelitoso, se destiló en baño de agua a presión atmosférica y al vacío, determinándosele a este y a sus fracciones, varias propiedades físicas: punto de ebullición por destilación y el método Sibolowov, [17] índice de refracción y tensión superficial a 25 0C. Se
efectuaron pruebas de solubilidad en diferentes solventes orgánicos, agua destilada, HCl 5 % y NaOH 5 %.
Se determinaron espectros infrarrojo, en dependencia del compuesto, en ventana de NaCl, entre ventanas de NaCl y de KBr, o en ventana de KBr. Se realizaron cromatogramas de gases y de capa delgada. Se tomaron espectros de RMN IH a 80 MHz, 13C y IH a 200 MHz. Se realizó análisis cualitativo elemental, por la técnica de fusión con sodio metálico y pruebas cualitativas para halógenos, azufre y nitrógeno [17]. Las pruebas químicas de insaturación se realizaron usando solución de bromo en tetracloruro de carbono y reactivo Bayer, solución al 2 % de permanganato de potasio.
Se realizaron ensayos para determinar el comportamiento del producto y algunas de sus fracciones, desde el punto de vista de la protección que brindan contra la corrosión, en condiciones que simulan en cierta medida las reales de operación.
Como material metálico para los electrodos de trabajo se utilizó acero D, que es un acero de medio carbono, bajo aleado al manganeso, utilizado en las tuberías de los pozos de petróleo. Como electrodo de referencia se empleó el de calomel saturado y platino como electrodo auxiliar, en la técnica que lo requería. Como medio corrosivo se empleó solución de ácido clorhídrico 15 %. La temperatura de ensayo fue 70 0C.
Se trazaron las curvas de polarización potenciodinámicas del acero en la solución no inhibida, y con el inhibidor y las fracciones F-2 y F-4, así como las de ruido electroquímico con el inhibidor y con F-4 a la concentración de 0,1 % del volumen de solución, valor dentro del rango recomendado para el empleo del inhibidor comercial.
Al conectar a los 120 0C el vacío al equipo de destilación fraccionada se obtuvieron, a la presión 2-3 mm de Hg, las fracciones nombradas como F-2 y F-3, en cantidades relativas aproximadas de 10,3 % y 1,03 % del total, respectivamente.
La fracción F-2 destiló de 60-64 0C a la presión fijada. El cromatograma de gases indicó la presencia de tres componentes al revelar picos en tiempos de retención 3, 4 y 9 min, cuya composición relativa aproximada fue 15 %, 40 % y 45 %, en ese orden. En placa de capa delgada aparecieron dos manchas significativas con valores de Rfde 0 y 0,7, lógico si se tiene en cuenta la cercanía en los tiempos de retención de los primeros picos en el cromatograma de gases, a pesar del estrecho rango de ebullición en que se obtuvo la fracción, que indica la posible existencia de un isómero estructural en su composición.
La fracción F-2 tiene un índice de refracción de 1,442 8 y temperatura de ebullición entre 195-200 0C. Las pruebas de solubilidad mostraron que es insoluble en agua, poco soluble en éter etílico, HCl 5 % y NaOH 5 % y muy soluble en cloroformo y etanol. Las pruebas químicas del bromo en tetracloruro de carbono y el permanganato de potasio, fueron positivas, por lo que existe insaturación en al menos uno de los componentes.
El espectro infrarrojo presenta una banda ancha e intensa en 3 315,9 cm-1, que se asigna a la vibración de valencia del grupo OH asociado, las bandas en 2 932,6 cm-1 y en 2 874,5 cm-1 indican la presencia de grupos CH3y CH2, lo que se corrobora al analizar la banda en 1411,3 cm-1 dentro de un conjunto. La ausencia de bandas en la región de 2100 cm-1 y la existencia de una débil banda en 1640 cm-1 evidencia la presencia de doble enlace en uno de los componentes, lo que se reafirma con la banda 858,2 cm-1 que se asigna a una vibración fuera del plano del grupo CH unido a un doble enlace. La banda en 1 082,5 cm-1 se puede asignar a un alcohol secundario alfainsaturado o primario saturado; de igual forma las bandas situadas en la región entre 1150 cm-1 y 1085 cm-1 indican la presencia de un enlace C-OC, correspondiendo a un éter.
Los espectros de RMN 1H y 13C indican la presencia de protones alcohólicos, grupos etilo y múltiples enlaces C-O en la estructura de los compuestos, lo que sugiere la existencia de un alcohol graso insaturado polioxietilado, que junto al valor de tensión superficial 28.9 mN/m, refuerza el criterio que el producto es un tensioactivo no iónico.
La fracción F-3 por su proporción puede considerarse una impureza, esta contiene el mismo par de isómeros que aparecen en el cromatograma de gases de la fracción F-2 a un tiempo de retención de 3 min, apareciendo también un pico en tiempo de retención de 6 min, que aparentemente es el causante de las diferencias en las propiedades físicas de ambas: índice de refracción 1,4710 y temperatura de ebullición 235-240 0C.
Los espectros infrarrojo y RMN 1H y 13C de manera análoga a la fracción F-2 indican la presencia de alcoholes grasos polioxietilados, con posible función tensoactiva.
En capa delgada aparecen, coincidiendo con el cromatograma de gases, manchas que corresponden cada una con sendos productos, que forman la composición de la fracción.
Por encima de la temperatura del baño entre 300-310 0C a presión de 2-3 mm de Hg no se siguió calentando el producto resultante por temor a su descomposición. No dieron resultado las determinaciones de la temperatura de ebullición por encima de 260 0C.
A este residuo se le denominó F-4, obteniéndose aproximadamente 38,5 % del total de muestra, siendo un compuesto pastoso con olor característico de alcoholes grasos. Dada su poca volatilidad no se pudo hacer cromatograma de gases, pero por capa delgada se distinguen dos manchas con valores de Rfa 0 y 0,41, que presentan gran semejanza con los valores de la mezcla original que se corrió en paralelo.
Las bandas en el espectro infrarrojo se comportan de manera análoga a las fracciones anteriores, por lo que se deduce la existencia de un alcohol insaturado polioxietilado, coincidiendo con lo encontrado por vía química al presentar resultados positivos frente al ensayo de bromo en tetracloruro de carbono y solución de permanganato de potasio.
La alta proporción de F-4 en comparación con el total de la muestra y en relación, mucho mayor, a la muestra sin solvente, así como sus características físico-químicas, sugieren que este debe ser el principio activo inhibidor dentro del producto original.
Para comprobar esta hipótesis se realizaron los ensayos electroquímicos que permitieran observar el comportamiento de F-4 en comparación con el inhibidor comercial original, lo que se expone a continuación.
La corrosión electroquímica se produce como el resultado de un flujo de corriente a través de un medio electrolítico, en este caso el ácido clorhídrico, entre las áreas anódicas y catódicas que se originan en la superficie metálica que se encuentra en contacto con el mismo.
El producto que se añada a la solución ácida con el objetivo de inhibir la corrosión debe ser capaz de reducir el mencionado flujo de corriente, efecto que puede ser detectado mediante el trazado de las curvas de polarización, que permiten visualizar las disminuciones de corriente en ambas ramas de la curva, anódica y catódica, y valorar el efecto del inhibidor. La desventaja de esta técnica es que produce alteraciones en el medio y en la probeta metálica, debido a las altas polarizaciones de trabajo.
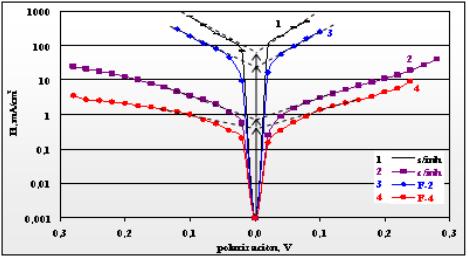
En la figura 1 se muestran las curvas de polarización del acero en HCl 15 % no inhibido y con la adición de inhibidor y de las fracciones F-2 y F-4, obtenidas de su destilación.
Fig. 1 Curvas de polarización de acero D en HCl 15 % a 70 0C.
Puede observarse de la figura 1 que, como es lógico, los mayores valores de corriente se presentan en la curva 1 en ausencia del inhibidor, mientras que en presencia de este, curva 2, son mucho menores, destacándose que el inhibidor comercial en estudio es capaz de reducir la densidad de corriente de corrosión en 2 órdenes, desde aproximadamente 60 mA/cm2 en la curva 1 hasta 0,7 mA/cm2 en la curva 2, lo que demuestra la alta efectividad del producto.
Sin embargo, en la curva 3 con la fracción F-2 no se observa una influencia marcada en la disminución del valor de densidad de corriente de corrosión, cercano a 30 mA/cm2, respecto al valor de la curva 1 sin inhibidor, 60 mA/cm2, como para suponer que este pudiera ser el principio activo del inhibidor estudiado, el cual sí es altamente efectivo según demuestra la curva 2, como ya se observó antes.
En las pruebas de solubilidad se había establecido que la fracción F-2 es poco soluble en solución de ácido clorhídrico, lo que hace que su efectividad no sea alta en el medio de ensayo, además el hecho de se haya determinado que es un tensoactivo, sustancias capaces de adsorberse sobre la superficie metálica en mayor o menor grado, no quiere decir que posea propiedades inhibidoras de la corrosión, aunque siempre que no sean aceleradores de la misma, pueden estar
presentes en la formulación inhibidora con otros fines, como debe ser el caso de esta fracción F-2 y de la F-3. Con esta última no se realizaron ensayos electroquímicos por tener iguales características en cuanto a la poca solubilidad y además su proporción en la mezcla inhibidora es bastante pequeña.
Por otra parte, se aprecia de la figura 1 que existe gran similitud entre las curvas 2 y 4 con inhibidor y con F-4 respectivamente, en las que los valores de densidad de corriente de corrosión están muy próximos, 0,7 mA/cm2 y 0,4 mA/cm2 en ese orden. Las menores densidades de corriente en ambas ramas de la curva, catódica y anódica, con la fracción F-4 se atribuye a que este se encuentra en mayor concentración en la solución ácida respecto a la parte de él que se encuentra en el inhibidor comercial, que es solo el 38,5 % como fue determinado, pues los dos fueron agregados a la solución de ensayo a igual concentración de 0,1 % del volumen total.
Los inhibidores orgánicos de adsorción pueden tener cierta tendencia a ser catódicos o anódicos, pero generalmente son mixtos, capaces de modificar ambas ramas de las curvas de polarización, comportamiento este que coincide con el mostrado por el inhibidor y por su fracción F-4, como se observa en la figura 1, curvas 2 y 4, al compararlas con la curva 1 sin inhibidor, por lo que ambos pueden clasificarse precisamente como inhibidores mixtos en estas condiciones.
Para corroborar los resultados del estudio por más de una técnica y tener una valoración más amplia del comportamiento inhibidor, se realizaron también ensayos de ruido electroquímico, que ya en trabajos anteriores han mostrado una buena correlación con las curvas de polarización, y con otros ensayos [16, 18].
La técnica de ruido electroquímico permite adquirir información complementaria a la lograda por otras vías; recoge las fluctuaciones espontáneas de potencial y/o corriente en un sistema electroquímico con la ventaja de no perturbarlo, ya que se obtienen datos a partir de la simple escucha de la señal recogida del medio.
Además se puede tener referencia acerca del tipo de corrosión, generalizada o localizada, que está ocurriendo.
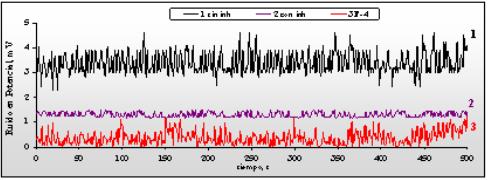
En la figura 2 se presentan las gráficas de las señales de ruido en potencial del acero D en HCl 15 % sin inhibir, con adición de inhibidor y con la fracción F-4 a 70 0C.
Fig. 2 Ruido en Potencial de acero D en HCl 15 %.
En la solución ácida no inhibida, curva 1 de la figura 2, se presenta una señal de ruido en potencial con muchas oscilaciones durante todo el tiempo de ensayo, con alta frecuencia y amplitud moderada, lo que manifiesta los constantes cambios de la superficie sometida a un medio y condiciones tan agresivas como las de este ensayo.
En presencia del inhibidor estudiado, curva 2 de la figura 2, la señal de ruido en potencial presenta oscilaciones aleatorias de bajísima amplitud, que contrasta con lo obtenido en la curva 1 de la misma figura, reflejando una buena actuación del inhibidor, capaz de adsorberse en la superficie metálica y modificar el comportamiento de esta. La curva 3 de la figura 2 muestra las señales de ruido en potencial con la fracción F-4, que también presenta oscilaciones aleatorias, ahora de mayor amplitud que las de la curva 2 con el inhibidor, pero las variaciones apenas llegan a un mV, lo que puede considerarse un satisfactorio comportamiento inhibidor de la fracción evaluada.
También fueron registradas las señales de ruido en corriente, totalmente acordes con el comportamiento observado en el ruido en potencial. En la solución sin inhibidor la señal fue aleatoria con regular amplitud y alta frecuencia a valores elevados de corriente, típico de sistemas no inhibidos altamente corrosivos. Con el inhibidor se obtuvo una señal casi plana con valor cercano a cero, lo que evidencia su excelente acción protectora. Con F-4, aunque las oscilaciones fueron de amplitud un poco mayor, su comportamiento fue similar al del inhibidor, con valor de la señal próxima a cero.
CONCLUSIONES
1. El inhibidor en estudio fue separado en cuatro fracciones, identificadas como:
- F-1: fracción más volátil, es el solvente de la formulación inhibidora, está en mayoría respecto al resto de los componentes.
- F-2 y F-3: fracciones intermedias, en menor proporción, la segunda casi como impureza, ambas con carácter tensioactivo para desempeñar distintas funciones, no inhibidoras, dentro de la formulación inhibidora.
- F-4: residuo, más de la tercera parte del inhibidor, aunque no es el compuesto mayoritario dentro del formulado.
2. Se demostró mediante ensayos electroquímicos que en el residuo F-4 radica el principio activo inhibidor dentro de la composición del producto.
3. Tanto el inhibidor estudiado como la fracción F-4 se comportaron como inhibidores mixtos, típico de los inhibidores orgánicos de adsorción en medio ácido.
4. Se reafirma que las diferentes técnicas electroquímicas empleadas se complementan y contribuyen a la más amplia valoración de productos inhibidores de la corrosión.
RECOMENDACIONES
Se deben tener en cuenta los resultados de este trabajo para la posterior formulación nacional de inhibidores de corrosión que puedan ser empleados en los tratamientos ácidos a pozos de petróleo.
AGRADECIMIENTOS
Se agradece a la Secretaría de Relaciones Exteriores de México y al Ministerio del Comercio Interior de la República de Cuba, que bajo el convenio bilateral entre ambos países hicieron posible la realización de parte de este trabajo, mediante una beca de investigación en el Instituto de Investigaciones Eléctricas de México, agradeciendo de igual forma a los investigadores del Departamento de Corrosión de dicho Instituto y en especial al asesor y coautor del trabajo, el Dr. Jorge Uruchurtu Chavarín.
BIBLIOGRAFIA
1. SCHECHTER, R., "Oil Well Stimulation", Prentice Hall, New Jersey, USA, 1992.
2. LAHODNY-SARC, O., "Corrosion Inhibition in Oil and Gas Drilling and Productions Operations", Fed. Europea de Corrosión, 1994. Págs. 104-120.
3. SCHMITT, G., "Inhibition in Acid Media", Fed. Europea de Corrosión, 1994. Págs. 64-91.
4. HUNT, L. R., "Aspects of the Use of Acid Inhibitors in Acid Cleaning and Pickling", Corrosion Week, 1968. Págs. 190-207.
5. HAUSLER, R. H., "On the Use of Linear Polarization Measurements for the Evaluation of Corrosion Inhibitors in Concentrated HCl at 200 F (93 0C)". Corrosion, Vol. 42, No. 12, 1986. Págs. 729-739.
6. NATHAN, C. C., "Corrosion Inhibitors", NACE, 1973.
7. ANTROPOV, L. I.; MAKUCHIN, E. M.; PANACENKO, B. F., "Inguibitory korrozii metallov", Kiev Tejnica, 1981.
8. VICENTINI, B. et al."Corrosion Behavior in Acidizing Conditions of Different High Alloy Stainless Steels for Oil Wells", 3er Cong. Iberoamericano de Corrosión y Protección, Vol. II, Brasil, 1989. Págs. 627-637.
9. RESHETNIKOV, S. M., "Inguibitory kislotnoi korrozii metallov", 1986.
10. Fontana, M. G., "Corrosion Engineering", Mc Graw-Hill, 3er Edition, 1986.
11. WIDYANTO, B.; SURATMAN, R.; ASHRUL, A., "The Effect of Hydrochloric Acid Concentration and Cyclic Immersion Speed on the Corrosion Behavior of Austenitic Stainless Steels and Plain Carbon Steel". Australia, 1996.
12. TOMASHOV, N. D., "Theory of Corrosion and Protection of Metals", Cuba, 1971.
13. DOMÍNGUEZ, J. A.; CASTRO, D. M.; MATOS, R.; HING, R., "Introducción a la corrosión y protección de metales", Edit. MES, La Habana, Cuba, 1987.
14. ZHUK, N. P., "Kurs teorii korrozii i zashita metallov", Moscú, 1976.
15. MAINIER, F., "Influência dos ions férricos em inhibidores de corrosão para sistemas ácidos", 3er Cong. Iberoamericano de Corrosión y Protección, Vol. II, Brasil, 1989. Págs. 1027-1036.
16. SANDIANES, B.; URUCHURTU, J; MARRERO, M., "Composición inhibidora de la corrosión del acero en medio ácido", Tecnología Química, Vol.29, No. 2, 2009.
17. PASTO, Daniel J.; JOHNSON C. R., "Determinación de estructuras orgánicas", Edit. Pueblo y Educ., La Habana, 1980.
18. SANDIANES, B.; URUCHURTU, J., "Estudio electroquímico de inhibidores de corrosión", Mexico, 2003.
Recibido: Abril 2012
Aprobado: Agosto 2012
M.Sc. Bibiana Sandianes-VegaI. Centro de Investigación y Desarrollo del Comercio Interior (CID-CI), La Habana, Cuba. bibiana@cidci.cu