Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.36 no.1 Santiago de Cuba ene.-abr. 2016
ARTICULO ORIGINAL
Activación de cultivos probióticos tratados con campo magnético de frecuencia extremadamente baja
Activation of Probiotic Cultures Treated with Extremely low Fequency Magnetic Field
MSc. Tania María Guzmán-ArmenteroI, MSc. Matilde Anaya-VillalpandaII, MSc. Yarindra Mesa-MariñoIII
I: Universidad Tecnológica Equinoccial, Ecuador. taniamariaguzman@gmail.com
II: Instituto de Investigaciones para la Industria Alimentaria (IIIA), La Habana, Cuba
III: Centro Nacional de Electromagnetismo Aplicado (CNEA), Santiago de Cuba. Cuba
RESUMEN
Se evaluó el efecto del campo magnético oscilante de frecuencia extremadamente baja (CMO-FEB) sobre la viabilidad de tres cultivos probióticos para yogurt: Lactobacillus acidophilus, Lactobacillus casei y Bioyogurt. Los cultivos inoculados en 50 mL de leche descremada al 9 % se trataron CMO-FEB de 60 Hz y densidad de 1 a 20 Gauss (G) durante 10 a 60 min, según diseño de experimento D-óptimo. Las variables de respuesta fueron la viabilidad (Log ufc/mL) y la morfología de cada microorganismo. El tratamiento aplicado tuvo mayor efecto estimulante sobre L. acidophilus y L. casei (incremento de 1,8 y 1,4 Log ufc/mL, respectivamente) mientras que la viabilidad del cultivo de Bioyogurt después de tratado (1,3 a 8,2 Log ufc/mL) nunca superó al valor control (9,5 log ufc/mL). La viabilidad del L. acidophilus (10,71 Log ufc/mL) fue mayor que la de L. casei (8,97 Log ufc/mL) y observándose disminución de esta variable (ventana) entre 9 y 11 G para ambos cultivos. En este rango se observó un engrosamiento de la pared celular de los lactobacilos que no afectó su forma bacilar y se deformaron con 20 G mientras los cocos del cultivo de Bioyogurt conservaron su morfología típica en todo momento. La optimización numérica del diseño indicó 35 min y 10 G como el régimen adecuado para alcanzar la máxima viabilidad. Se concluye que el CMO-FEB aplicado tiene mayor efecto sobre la morfología bacilar y estimula más la viabilidad de los lactobacilos como cultivos puros que sobre los cocos cuando forman un cultivo mixto.
Palabras clave: bacterias ácido lácticas, liofilización, viabilidad.
ABSTRACT
The effect of the extremely low frequency oscillate magnetic field (LEF-OMF) was evaluated on the viability of three probiotics cultures for yogurt: Lactobacillus acidophilus, Lactobacillus casei and Bioyogurt. The cultures inoculated in 50 mL of 9% not fatty milk were treated CMO-FEB of 60 Hz and density from 1 to 20 Gauss (G) during 10 to 60 min, according to of D-optimum experiment design. Response variables were the viability (Log ufc/mL) and the morphology of each microorganism. The applied treatment had bigger stimulated effect on L. acidophilus and L. casei (increasing 1,8 and 1,4 Log ufc/mL, respectively) while the viability of the cultivation of Bioyogurt after treated (1,3 to 8,2 Log ufc/mL) never overcame to the value control (9,5 Log ufc/mL). The viability of the L. acidophilus (10.71 Log ufc/mL) was bigger than L. casei (8,97 Log ufc/mL) and decreasing of this variable (window) between 9 and 11 G for both cultures was observed. In this range a thickness of the lactobacillus cellular wall was observed that didn't affect its bacillary form and with 20 G bacilli were deformed while the cocci of Bioyogurt culture conserved typical morphology in all time. The numeric optimization of design indicated 35 min and 10 G like the appropriate regime to reach the maximum viability. Was conclude the applied CMO-FEB has bigger effect on the bacillary morphology and stimulates more the viability of the lactobacillus like pure culture that cocci when they form a mixed culture.
Keywords: lactic acidity bacteria, liofilization, viability.
INTRODUCCION
Investigaciones actuales demuestran que el campo magnético oscilante de frecuencia extremadamente baja (CMO-FEB) estimula el crecimiento de diversos microorganismos. Sus mecanismos de acción están sin esclarecer, aunque se explican esencialmente por su efecto directo sobre los iones que intervienen en el transporte de sustancias a través de la membrana plasmática, y en procesos donde intervienen las macromoléculas como el ADN y las proteínas. Este hecho involucra repercusiones metabólicas importantes que puede incidir en el crecimiento microbiano. [1,2]
Se plantea que el metabolismo de diversas bacterias ácido lácticas se afecta por la acción del CMO-FEB [3-5]. Varios autores observaron que el CMO-FEB puede acelerar su crecimiento y su actividad fermentativa [6-9]. Se ha visto que en presencia del CMO, los microorganismos estresados por diferentes procesos (liofilización, pasterización, centrifugación) pueden adaptarse y activarse más rápidamente adecuando su metabolismo a un rápido crecimiento [10-13].
En consecuencia, estos estudios tienen una importancia medular para la industria alimentaria, ya que la mayoría de los metabolitos de interés industrial están asociados al crecimiento de los microorganismos que los producen. Por otra parte, la viabilidad del cultivo incrementa la efectividad del empleo de los microorganismos probióticos como agentes nutracéuticos [1]. En tal sentido, resulta importante estudiar el efecto del CMO-FEB sobre microorganismos que se emplean en la industria alimentaria para elaborar diferentes productos.
Por tal motivo el objetivo de este trabajo es valorar el efecto del CMO-FEB en la viabilidad de tres cultivos probióticos para yogurt.
MATERIALES Y METODOS
Se emplearon tres cultivos probióticos liofilizados: Bioyogurt (compuesto por Lactobacillus. acidophilus y Streptococus. thermophilus), L. acidophilus y L. casei, los cuales se activaron en erlenmeyrs de 100 mL conteniendo 10 mL de leche descremada en polvo al 9 %, según procedimiento normativo establecido [14].
En una primera etapa experimental con cada cultivo se aplicó tratamiento con CMO-FEB en valores máximo (20 Gauss) y mínimo (10 Gauss) durante 60 min para evaluar el efecto sobre su viabilidad. Los mismos se seleccionaron según los valores informados en la literatura con los que se encontraron efectos estimulantes en los microorganismos [4-7].
Posteriormente se realizó un diseño de experimento D-óptimo de superficie respuesta por el programa Desing Expert (versión 6.0.1). Para los niveles de los factores densidad del CMO-FEB (G) y tiempo de exposición (min) se tuvo en cuenta los resultados de la etapa anterior (tabla 1). Se obtuvieron doce variantes experimentales, que se aplicó a cada cultivo para un total de 36 corridas.
Tabla 1
Factores y niveles del diseño experimental
| Factor | Nivel bajo | Nivel alto |
| Densidad del CMO-FEB (G) | 1 | 20 |
| Tiempo de exposición (min) | 10 | 60 |
El tratamiento con CMO-FEB de 60 Hz se aplicó en la segunda activación de los cultivos, en su fase logarítmica y bajo condiciones de incubación (T = 43 ºC y t = 4 h). Las muestras controles no recibieron tratamiento magnético. Las variables de respuesta fueron la viabilidad y morfología celular (cocos y bacilos).
La determinación microbiológica de la viabilidad de cada cultivo se realizó después del periodo de incubación, considerando el total de microorganismos viables mediante siembra en placa según las normas establecidas en el banco de cepas [14]. Se expresó como Logaritmo de unidades formadoras de colonias por mililitro (Log ufc/mL). Las características morfológicas de las bacterias se determinaron por tinción de Levine de Black [14]. Se observaron bajo microscopio óptico marca Olimpus con lente de inmersión y aumento de 1000X.
El CMO-FEB se obtuvo con una bobina tipo solenoide, con núcleo de aire, por el paso de una corriente de 60 Hz/220 V a través de un alambre de cobre de 2 mm de diámetro enrollado en un cartón de 30 cm de diámetro y 29 cm de altura y resistencia de 6,1  . Dicha bobina está caracterizada por el Centro Nacional de Electromagnetismo Aplicado (CNEA) de Santiago de Cuba.
. Dicha bobina está caracterizada por el Centro Nacional de Electromagnetismo Aplicado (CNEA) de Santiago de Cuba.
Todos los análisis se realizaron por triplicado. Los resultados obtenidos de la viabilidad en cada corrida experimental se procesaron con el programa estadístico Statgraphics Centurion (versión 15 1.0.2). Se determinó la distribución de probabilidad mediante prueba de t-student para 95 % de confianza (p<0,05) y las diferencias significativas por el método de Rangos Múltiples de Duncan. Con los valores promedios se corrió el diseño experimental antes mencionado.
DISCUSION DE LOS RESULTADOS
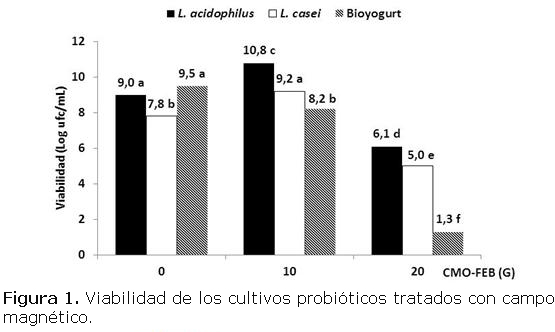
La figura 1 muestra los resultados de la viabilidad de los cultivos tratados y sus controles en la primera etapa del experimento en las condiciones de (60 Hz por 60 min) en la segunda fase de activación e incubados 4 h a 43 ºC. Las letras distintas indican diferencia estadísticamente significativa (p<0,05). Nótese que L. acidophilus y Bioyogurt tuvieron valores de viabilidad similares (9 y 9,5 Log ufc/mL, respectivamente) y significativamente superiores a los de L. casei (7,8 Log ufc/mL), lo cual indica que el crecimiento de L. acidophilus beneficia al del S. thermophilus en el Bioyogurt ya se establecen relaciones simbióticas favorables para el desarrollo de ambas especies [14].
Al aplicar CMO-FEB de 10 G las cepas puras L. acidophilus y L. casei incrementaron su viabilidad en relación con los controles (aumento de 1,8 y 1,4 Log ufc/mL, respectivamente). Sin embargo, con 20 G la viabilidad de ambos cultivos decreció cerca de 3 Log ufc/mL por debajo del control. Este resultado sugiere que valores superiores de densidad de CMO pudieran inhibir el crecimiento indicando que debe aplicarse en tiempos menores, lo cual es favorable para su aplicación en la industria. Se plantea que debido al CMO-FEB las bacterias podrían generar diferentes respuestas metabólicas en el cultivo y perjudicar la simbiosis [5, 6].
En tal sentido, nótese que el cultivo mixto mostró la menor viabilidad para los dos valores de densidad aplicados, siendo más afectado por 20 G alcanzándose casi la inhibición total (1,3 Log ufc/mL). Este resultado contrasta con los obtenidos para el L. acidophilus que fue significativamente superior (6,1 Log ufc/mL).
Este resultado permite inferir que el CMO aplicado tiene mayor efecto estimulante sobre los lactobacilos que sobre los cocos, dado el comportamiento de ambos bacilos (L. acidophilus y L. casei) al compararlo con el Bioyogurt que está formado también por cocos (en este caso Streptococus. thermophilus que no fue objeto de estudio). Esto puede deberse a la complejidad de este cultivo mixto, ya que contiene dos microorganismos de diferentes géneros que exhiben un metabolismo distinto [3]. Ver a continuación la tabla 2.
Tabla 2
Morfología de los cultivos tratados con CMO-FEB
| L. acidophilus | L. casei | Bioyogurt | |||
| 10 G | 20 G | 10 G | 20 G | 10 G | 20 G |
| Bacilos típicos; paredes engrosadas | Bacilos escasos; deformados | Bacilos típicos; paredes engrosadas | Bacilos escasos; deformados | Bacilos paredes engrosadas y cocos típicos (1:2) | Bacilos y cocos típicos (1:1) |
Lo anterior se evidencia al analizar la morfología de cada cultivo después de tratados (tabla 2). En los cultivos controles, la morfología fue típica, mientras que en los tratados con CMO se observó variaciones. Con 10 G hubo mayor viabilidad pero se observó un engrosamiento de la pared en los lactobacilos que no afectó su forma bacilar. En los rangos de densidad donde la viabilidad decreció (20 G) las formas bacilares se deformaron, mientras que los cocos del cultivo de Bioyogurt conservaron su morfología típica en todo momento.
En estudios similares se observó que los bacilos son más propensos a la deformación, mientras que los cocos tienen mayor sensibilidad a los efectos del CMO [15]. En este sentido, la relación simbiótica de 1 bacilo por cada 2 cocos (1:2) se afectó en un bacilo por cada coco (1:1). Es decir, el crecimiento de los cocos disminuye al aumentar la densidad del CMO. Se plantea que ante diferentes factores estresantes las bacterias pueden producir varios metabolitos tóxicos que afectan el crecimiento de otras especies [16].
El engrosamiento en la pared celular de los lactobacilos podría deberse a que el CMO estimula la actividad de transporte a ambos lados de la membrana incrementando el metabolismo celular y la conformación tridimensional de las proteínas de la pared [17, 18]. De acuerdo a los resultados morfológicos obtenidos en función de la densidad del CMO se plantea que al aumentar esta, la morfología de las bacterias puede afectarse por cambios directos en los microfilamentos del citoesqueleto [19]. Ver a continuación la tabla 3.
Tabla 3
Resultados obtenidos del diseño de experimentos
| Cultivo | R2 | Expresión del modelo matemático ajustado |
| L. acidophilus | 0,96 | V =10,71 – 0,87 A – 0,032 B – 3,40 A2 – 0,22 B2 – 0,073 AB |
| L. casei | 0,97 | V = 8,97 – 0,93 A – 0,069 B – 2,90 A2 – 0,062 B2 – 0,12 AB |
| Bioyogurt | 0,99 | V = 4,79 – 3,35 A – 0,074 B |
Nota: El tiempo de exposición (B) no tuvo significación (p>0,05)
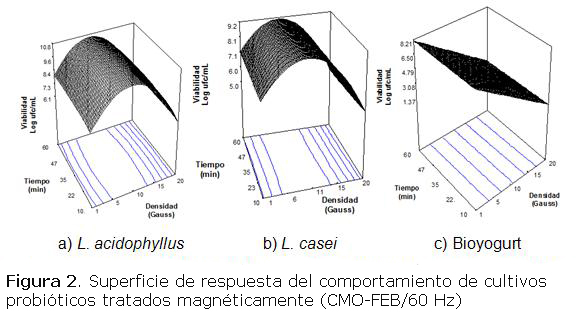
La tabla 3 muestra el comportamiento de la viabilidad para los tres cultivos prebióticos en la segunda parte del experimento. En todos los casos el comportamiento microbiano se ajustó a ecuaciones matemáticas que explican más del 96 % de su comportamiento (R2 = 0,96 a 0,99). La viabilidad del cultivo de L. acidophilus y L. casei se ajustó a ecuaciones cuadráticas y la del Bioyogurt a una ecuación lineal. De forma general se destaca que en los tres modelos matemáticos existen diferencias significativas (p ≤ 0,05) de la viabilidad con respecto a la densidad de CMO (A), pero no significativas (p ≥ 0,05) con relación al tiempo de exposición (B).
No obstante, en todas las ecuaciones los coeficientes del término A fueron negativos y de mayor módulo que el término (B), por lo que prolongar el tiempo de exposición al CMO no provocaría aumento de la viabilidad. Esto se reafirma al analizar los coeficientes negativos del término cuadrático (B2) y la interacción de ambos términos (AB), que si fueron significativos. Este resultado concuerda con lo informado en la literatura donde se aprecia que el crecimiento de algunas especies microbianas bajo un CMO se afecta más notablemente por la densidad de campo que por el tiempo de exposición [6, 7; 15]. Sobre este hecho singular se informa que al retirarse el campo, la respuesta se mantiene por varias generaciones, debido a afectaciones permanentes del metabolismo celular y en las propiedades del medio de cultivo [7].
En la tabla 3 se observa que al aumentar la densidad del CMO disminuye la viabilidad, lo cual se verifica por el signo negativo de los coeficientes de dicho término en los tres modelos obtenidos. Inicialmente la viabilidad de ambos cultivos aumenta paulatinamente hasta alcanzar valores máximos en un rango específico de densidad, y luego empieza a decrecer suavemente hasta obtenerse su valor mínimo. Nótese que la viabilidad (Log ufc/mL) del L. acidophilus (10,71) fue mayor que la de L. casei (8,97) que a su vez, fue más sensible que el primero al tratamiento aplicado dado por los mayores módulos de sus coeficientes (-0,93 A y -0,069 B). Por tanto, el crecimiento del L. acidophilus resultó más estimulado. La mayor disminución del crecimiento (-3,35 A y -0,074 B) se manifestó en el Bioyogurt y pudiera explicarse porque los cocos (S. thermophilus) fueron más sensible que los bacilos (L. acidophilus) (tabla 2). Ver a continuación la figura 2.
Este comportamiento de cada microorganismo puede observarse en la figura 2. En las figuras 2a y 2b puede apreciarse la similitud en los perfiles de L. acidophilus y L. casei lo cual indica que ambos cultivos responden de forma análoga ante el CMO. Este hecho puede obedecer a que ambas bacterias son del mismo género y con muchas características morfofuncionales similares, porque comparten la mayoría de las reacciones enzimáticas asociadas al metabolismo primario [2]. La figura 2c muestra el comportamiento del cultivo de Bioyogurt y se observa que la viabilidad de este cultivo exhibe una función lineal decreciente en la medida que aumenta la densidad del CMO.
De forma general en las dos primeras figuras se observa que la viabilidad decrece en rangos de densidad de 15 a 20 G. Se ha verificado que en diversos rangos las variables de respuestas asociadas al metabolismo pueden aumentar o disminuir en función de la densidad del CMO, hasta un punto denominado “ventana” a partir del cual se produce un efecto contrario al inicial, o no se produce efecto [4-7; 20].
Este resultado ha sido observado de forma repetida en varias investigaciones y está demostrado que cualquier variación en las condiciones experimentales (microorganismo, sustrato, tipo de campo, polaridad, conductividad eléctrica del fluido, etcétera) puede mover la “ventana” de un lado a otro del rango de densidad, o experimentar “saltos” en rangos de densidad muy alejados del inicial [6; 10-12; 20]. En ese sentido el microorganismo más estudiado es E. coli que en un medio concentrado muestra una ventana típica a 40 G con un pico de crecimiento de 12 ciclos Log, mientras que en ese mismo medio más diluido la ventana se desplaza hacia atrás, hasta 1 G con un pico de 14 ciclos Log [21].
Considerando los resultados mostrados en la figura 2 y en correspondencia con lo planteado por las fuentes antes mencionadas, en las condiciones experimentales trabajadas a 10 G podría existir una ventana para los cultivos de L. acidophilus y L. casei. La optimización numérica del diseño indicó que 35 min y 10 G es el régimen de tratamiento magnético adecuado para alcanzar la máxima viabilidad en los tres cultivos probióticos estudiados.
En sentido general la optimización numérica del diseño indicó que 35 min y 10 G es el régimen de tratamiento magnético óptimo para alcanzar la máxima viabilidad. En cuanto el efecto estimulante del L. acidophilus y L. casei fue superior (incremento de 1,8 y 1,4 Log ufc/mL, respectivamente) al cultivo de Bioyogurt (1,3 a 8,2 Log ufc/mL) siendo que este último nunca superó al valor control (9,5 log ufc/mL).
CONCLUSIONES
Se concluye que la viabilidad de los cultivos probióticos puede incrementarse significativamente (p ≤ 0,05) de 9 a 11 G de densidad de CMO, durante 10 min. El CMO-FEB aplicado tiene mayor efecto sobre la morfología bacilar y ejerce mayor estímulo sobre la viabilidad de cultivos puros de lactobacilos, que en cultivos mixtos de lactobacilos y cocos.
BIBLIOGRAFIA
1. SAAVEDRA, Jose M. Clinical applications of probiotic agents. The American journal of clinical nutrition, 2001, vol. 73, núm. 6, p. 1147-1151. USA
2. CAMPOS, J. A., "Cultivos probióticos y protectores, propiedades funcionales (nutracéuticas) de valor agregado en los derivados lácteos". Lácteos y Cárnicos Mexicanos, 2002, p. 26-37. México.
3. VINDEROLA, C. G., et al., "Viability of probiotic (Bifidobacterium, Lactobacillus acidophilus and Lactobacillus casei) and nonprobiotic microflora in Argentinian fresco cheese". Journal of Dairy Science, 2000, vol. 83, núm 9, p. 1905-1911. USA
4. NAMBA, K.; MOHRI, K. S., "Effect of electromagnetic field on lactic acid bacteria proliferation", Nippon Shokubutsu Kojo Gakkai Taikai Gakujutsu Koen Yoshishu, 2000, vol. 2000, p. 68-69.
5. STRASAK, Ludek; VETTERL, Vladimir; FOJT, Lukas, "Effects of 50 Hz magnetic fields on the viability of different bacterial strains", Electromagnetic Biology and Medicine, 2005, vol. 24, núm. 3, p. 293-300. USA
6. BEGLARIAN, R. A., et al., "The use of magnetic field in the dairy industry". vol. II. International Dairy Federation, 1990. Canadá
7. LÁSZLÓ, János; KUTASI, József, "Static magnetic field exposure fails to affect the viability of different bacteria strains", Bioelectromagnetics, 2010, vol. 31, núm. 3, p. 220-225. USA
8. GUZMÁN, Tania María., "Células en cultivo de Lactobacillus. acidophilus bajo la acción un campo electromagnético de frecuencia extremadamente baja". Investigación y Saberes, vol. 2, núm. 3, 2013, p. 13-17. Ecuador
9. BLICQ, D. M.; MURRAY, E. D., "Manipulation of growth characteristics of yogurt culture through the application of an electromagnetic field", Cultured dairy products journal, vol. 77, 1994. USA
10. PICHKO, V. B.; POVALYAEVA, I. V., "Electromagnetic stimulation of microorganism productivity: possible mechanisms". Applied Biochemistry and Microbiology, 1996, vol. 32, núm. 4, p. 425-428. USA
11. BARBOSA CÁNOVAS, G. V. "No thermal electrical methods in food preservation". Food Science; 1998, vol 4, núm. 5, p 363-370. USA
12. OKUNO, Kazumasa, et al. Effect of super high magnetic field on the growth of Escherichia coli under various medium compositions and temperatures. Journal of fermentation and bioengineering, 1993, vol. 75, núm.2, p. 103-106. USA
13. HOFMANN, G. A. Deactivation of microorganisms by an oscillating magnetic field. 1985. USA
14. Oficina Nacional de Normalización. NRIAL 065:08- Iniciadores lácticos. Métodos de ensayo. 2008. USA
15. FOJT, Lukas, et al., "50Hz magnetic field effect on the morphology of bacteria". Micron, 2009, vol. 40, núm. 8, p. 918-922. USA
16. ABEE, Tjakko; WOUTERS, Jeroen A., "Microbial stress response in minimal processing". International journal of food microbiology, 1999, vol. 50, núm. 1, p. 65-91. USA
17. ISHISAKA, Rumi, et al., "Effects of a magnetic fields on the various functions of subcellular organelles and cells". Pathophysiology, 2000, vol. 7, núm. 2, p. 149-152. USA
18. HE, Zichao, et al., FTIR investigation of the effects of ultra-strong static magnetic field on the secondary structures of protein in bacteria. Infrared Physics & Technology, 2009, vol. 52, núm. 4, p. 138-142. UK
19. KROUPOVÁ, Jana, et al., "Low-frequency magnetic field effect on cytoskeleton and chromatin". Bioelectrochemistry, 2007, vol. 70, núm. 1, p. 96-100. USA
20. GUZMÁN, Tania María, "Eficiencia fermentativa de cepas de levadura para el proceso de cervezas de alta gravedad". La Alimentación Latinoamerican, 2014, núm 10, p. 68-75. Argentina
21. STRASAK, Ludek; VETTERL, Vladimir; SMARDA, Jan. Effects of low-frequency magnetic fields on bacteria Escherichia coli. Bioelectrochemistry, 2002, vol. 55, Nº 1, p. 161-164. USA
Recibido: Septiembre 2015
Aprobado: Diciembre 2015
MSc. Tania María Guzmán-ArmenteroI. Universidad Tecnológica Equinoccial, Ecuador. taniamariaguzman@gmail.com