Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.38 no.3 Santiago de Cuba set.-dic. 2018
ARTICULO ORIGINAL
Introducción y consistencia de la producción del HeberFERON en la Planta de Productos Parenterales 3
Introduction and consistency of HeberFERON production in the Parenteral Products Plant 3
MSc. Leisy Fuentes Mederos 1,2 , Dr. Orestes Mayo Abad 2 , Ing. Luis C. Hidalgo Guerrero 1 , MSc. Zenaida Paz Pérez 1 , Ing. Daniel Márquez Bravo 1
1 Centro Nacional de Biopreparados, Mayabeque, Cuba. 2 Universidad Tecnológica de La Habana José Antonio Echeverría, CUJAE. Cuba. leisy.fuentes@biocen.cu
Resumen
El Centro Nacional de Biopreparados es una instalación que se dedica fundamentalmente a la producción de productos parenterales líquidos y liofilizados de bajo volumen, como parte del proceso de mejora continua, se construyó una nueva planta de productos parenterales (PPP3). El proceso aséptico de formulación, llenado y liofilización debe estar validado, ya que esta es la forma de demostrar que se puede obtener un producto estéril de manera consistente. Por lo tanto, este trabajo se realiza con el objetivo de obtener una evidencia documentada de que todas las operaciones se lleven a cabo según las regulaciones de Buenas Prácticas de Producción de productos estériles en la Planta de Productos Parenterales 3. La simulación del proceso productivo no mostró crecimiento de microorganismos en ninguna de las muestras incubadas de las corridas ejecutadas, lo cual permitió la formulación de los lotes de producción. Tanto los lotes de introducción como los demás lotes producidos hasta la realización de este trabajo, han tenido resultados conformes de acuerdo a las especificaciones establecidas. Finalmente, la producción de HeberFERON en PPP3 obtuvo la licencia de fabricación y están dadas todas las condiciones para cumplir con los planes previstos.
Palabras clave: Introducción, consistencia, validación, proceso aséptico, HeberFERON.
Abstract
The National Center for Bioproducts is an installation that is mainly dedicated to the production of low-volume liquid and lyophilized parenteral products. As part of the continuous improvement process, a new parenteral product plant (PPP3) was built. The aseptic process of formulation, filling and lyophilization must be validated, since this is the way to demonstrate that a sterile product can be obtained consistently. Therefore, this work is carried out with the objective of obtaining documented evidence that all the operations are carried out according to the regulations of Good Production Practices of sterile products in the Parenteral Products Plant 3. The simulation of the productive process showed no growth of microorganisms in any of the samples incubated from the executed runs, which allowed the formulation of the production lots. Both the introductory batches and the other batches produced up to the completion of this work have had conforming results according to the established specifications. Finally, the production of HeberFERON in PPP3 obtained the manufacturing license and all the conditions are fulfilled to accomplish the planned plans.
Keywords: Introduction, consistency, validation, aseptic process, HeberFERON.
INTRODUCCION
El Centro de Ingeniería Genética y Biotecnología (CIGB) de Cuba, desarrolló un nuevo producto pensado en el tratamiento del cáncer de piel. Su objetivo principalmente es: eliminar y reducir los tumores de la piel que sean no melanomas. El nombre comercial del medicamento es el HeberFERON, el cual está constituido químicamente por la combinación de Interferón Alfa y Gamma de tipo humanos recombinantes. La combinación de los productos químicos que tiene el medicamento cubano, es mucho más potente que el que se obtiene utilizando algunos de sus compuestos por separado [1, 2].
Dado su crecimiento, las producciones biotecnológicas se colocaron en la avanzada científica del país, y también esa rama sobresale por sus apreciables aportes a la economía nacional y a la sociedad. Resulta bastante conocido, el desarrollo iniciado desde la década de 1980, y también los avances y exitosas aplicaciones en la salud pública para el diagnóstico, prevención y tratamiento de enfermedades, tanto en el territorio nacional, como en otras naciones del mundo [3] . Como parte de esta política se creó el Centro Nacional de Biopreparados (BioCen).
En la industria farmacéutica, el procesamiento aséptico se refiere al aseguramiento de la esterilidad. Esto se traduce en la prevención de la contaminación microbiológica durante toda la producción [4]. Las etapas de formulación, llenado aséptico y liofilización del HeberFERON se producen en la Planta de Productos Parenterales 3 (PPP3) del BioCen; con procesos debidamente validados según los requisitos regulatorios aplicables, por lo que estas instalaciones han brindado productos que satisfacen las necesidades y expectativas de los clientes.
Además, se hace imprescindible contar con diferentes vías para combatir los diversos tipos de cáncer de piel en el país. Esto aumentaría la fuente de ingresos de la organización y por tanto al país, además de mejorar la calidad de vida de los pacientes. Por lo que el objetivo de este trabajo es introducir y validar, según las regulaciones de Buenas Prácticas de Fabricación de Productos Estériles, el proceso de producción aséptica del HeberFERON, en la Planta de Productos Parenterales 3 del BioCen.
MATERIALES Y MÉTODOS
La industria farmacéutica se encuentra en el sector de la industria química y es parte de la industria que se dedica al desarrollo de productos químicos con fines medicinales. Este tipo de industria dedica gran parte de su presupuesto a la investigación y al desarrollo de nuevos productos, que satisfagan la creciente demanda de más y mejores productos [5]. Ante esta política se realiza la producción de HeberFERON en BioCen, en PPP3, donde se formula, llena y liofiliza, procesos debidamente validados según los requisitos regulatorios aplicables, ya que estas instalaciones han brindado anteriormente productos que satisfacen las necesidades y expectativas de los clientes.
Para obtener la licencia de producción del HeberFERON en PPP3, se tuvieron en cuenta diferentes variables del proceso, las cuales se describen a continuación.
Descripción del producto.
El HeberFERON, como se le conoce comercialmente, surgió en sus inicios con el nombre genérico de CIGB128-A. Es un producto liofilizado de color blanco sin partículas visibles, que se disuelve fácilmente en agua para inyección dando lugar a una solución transparente. Este producto se presenta en forma de polvo liofilizado para inyección parenteral. Además de Interferón Alfa Humano Recombinante e Interferón Gamma Humano, contiene una mezcla de albúmina humana en la solución compuesta por trehalosa dihidratada y ácido succínico [6].
Descripción de las instalaciones de producción.
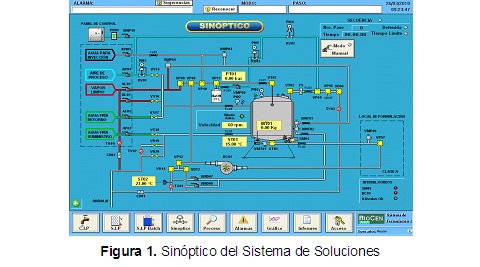
El sistema de formulación está integrado por un tanque estacionario de 150 litros de capacidad, tuberías, válvulas (diseño aséptico y no aséptico), instrumentos interconectados (para indicación, control y registro), una bomba centrífuga de diseño aséptico para la limpieza del sistema y un panel de control. El sistema realiza las operaciones de limpieza y esterilización en el lugar (CIP/SIP) del tanque y la esterilización del líquido dentro de él, todas completamente automáticas, teniendo en cuenta que son las operaciones críticas dentro del procesamiento aséptico. La interacción entre el operario y el sistema de formulación se realiza desde un SCADA que trabaja en ambiente Windows, la cual está conectada a un autómata, donde están programadas todas las secuencias automáticas. El monitor de la computadora muestra como pantalla principal un esquema sinóptico del sistema representado en la Figura 1, en el cual se observa el estado de los componentes del mismo según el color: verde en funcionamiento o abierta, amarillo apagado o cerrada, dependiendo de si es una bomba, agitador o válvula [7].
La línea de llenado c onsiste en un tren continuo, compuesto por una máquina lavadora de bulbos, un túnel de esterilización-despirogenización y una máquina llenadora-selladora. Estos equipos poseen una capacidad de 12 000 unidades por hora con cuatro bombas dosificadoras, son completamente automatizados. La operación de llenado aséptico se realiza bajo flujo laminar Clase A y un entorno Clase B [8].
La liofilización funciona congelando el producto y luego reduciendo la presión circundante para permitir que el agua congelada se sublime directamente desde la fase sólida a la fase gaseosa, sin pasar por el estado líquido. Este proceso se lleva a cabo en una liofilizadora que está diseñada y construida para producir de acuerdo a las Buenas Prácticas de Producción (BPP); ya que permite efectuar ciclos completos de liofilización, de limpieza (CIP) y de esterilización (SIP) por vapor de la cámara y el condensador, prueba de fugas y prueba de integridad al filtro de venteo, incorporando la instrumentación y los sistemas de control necesarios para optimizar los tiempos de ciclo y mejorar la eficiencia del proceso [9] .
Para los inyectables, la calidad del agua mínima aceptable es agua para inyección, la cual se produce a partir de agua potable a través de destilación y su punto crítico es la eliminación de bacterias y endotoxinas bacterianas; un destilador de múltiple efecto garantiza la producción de agua para inyección libre de pirógenos y de alta pureza. El vapor limpio se produce a partir de agua tratada y se utiliza cuando el vapor entra en contacto directo tanto con el producto como con los materiales de uso parenteral; un generador Stilmas para uso de la industria farmacéutica se encarga de la generación de este vapor limpio, la calidad del condensado del vapor producido cumple con las especificaciones descritas por la farmacopea de los EEUU (USP) vigente para el agua para inyección. El aire comprimido de proceso es suministrado a través de un compresor de aire limpio y libre de aceite, que incluye un secador frigorífico, un tanque de almacenamiento y un sistema de filtración escalonado; cumpliendo con los estrictos controles de aire en el ambiente interior de las áreas de producción asépticas [6, 10] .
Procedimiento para la simulación con medio.
Las principales fuentes de contaminación son el aire, el personal, los materiales y el equipo, que participan en el proceso [11] . Para asegurar la esterilidad de productos parenterales, las etapas de formulación, llenado aséptico y liofilización deben ser adecuadamente validadas. Una operación de procesamiento aséptico debe validarse utilizando un medio de cultivo microbiológico en lugar del producto. Los resultados son interpretados para evaluar el potencial de una unidad de producto farmacéutico para contaminarse durante las operaciones reales. El monitoreo de los datos de la simulación del proceso también puede proporcionar información útil para la evaluación de la línea de procesamiento [12] .
DISCUSIÓN DE LOS RESULTADOS
En la Planta de Productos Parenterales 3 de BioCen se realizó el proceso de Introducción del HeberFERON solicitado por el CIGB, que abarcó las etapas de formulación (en bolsas apirogénicas y estériles), llenado aséptico, liofilización y la inspección visual. La validación del proceso de formulación y llenado aséptico se realizó mediante Pruebas de Simulación de Procesos con medio de cultivo Caldo Triptona Soya. En el estudio de consistencia de producción se analizó el cumplimiento de las especificaciones de calidad en seis lotes producidos a nivel industrial en las instalaciones de PPP3.
Simulación del proceso de formulación.
Los días 17, 18 y 19 de diciembre del año 2013 se efectuaron los tres procesos de formulación simulado de la vacuna Heberpenta-L en bolsas plásticas, considerando la formulación de este producto como el peor caso, el cual valida la formulación de los demás productos realizados en esta planta; dichos lotes se denominaron de la manera siguiente: MCF(17/12/13), MCF(18/12/13) y MCF(19/12/13) respectivamente. Concluida la formulación se tomaron muestras para determinar las propiedades de crecimiento y verificar la esterilidad del medio utilizado y después de 12 horas de formulación fue simulada la ejecución de 4 conexiones de la bolsa a la línea de llenado. Todas las muestras fueron incubadas durante 14 días a una temperatura de 31 ± 1 ° C y examinadas para detectar cualquier contaminación el séptimo y décimo cuarto día. Al cabo de este tiempo se realizó la prueba de Promoción de Crecimiento a la muestra seleccionada. El Monitoreo Ambiental del aire, superficies y el personal en condiciones de reposo y operación se efectuó según los procedimientos establecidos para la producción [13].
En la tabla 1 se muestran los resultados obtenidos en el control de la esterilidad de las muestras de simulación que fueron incubadas.
Tabla 1. Resultados de la primera corrida
| Código de la muestra | Identificación de los códigos | Verificación de la esterilidad | |
| 7 días | 14 días | ||
| MCF(17/12/13)-BP | Lote formulado en la bolsa | Conforme | Conforme |
| MCF(17/12/13)-For | Muestra para esterilidad | Conforme | Conforme |
| MCF(17/12/13)-pc | Muestra para promoción de crecimiento | Conforme | Conforme |
| MCF(17/12/13)-TD | Residuo de la simulación del IFA de TD | Conforme | Conforme |
| MCF(17/12/13)-TT | Residuo de la simulación del IFA de TT | Conforme | Conforme |
| MCF(17/12/13)-P | Residuo de la simulación del IFA de P | Conforme | Conforme |
| MCF(17/12/13)-HB | Residuo de la simulación del IFA de HB | Conforme | Conforme |
| MCF(17/12/13)-G | Residuo de la simulación del IFA de HB adsorbido | Conforme | Conforme |
| MCF(17/12/13)-Hib | Residuo de la simulación de Hib adsorbido | Conforme | Conforme |
| MCF(17/12/13)-Tio | Residuo de la simulación del Tiomersal | Conforme | Conforme |
| MCF(17/12/13)-Lle1 | Muestra de la conexión 1 al llenado | Conforme | Conforme |
| MCF(17/12/13)-Lle2 | Muestra de la conexión 2 al llenado | Conforme | Conforme |
| MCF(17/12/13)-Lle3 | Muestra de la conexión 3 al llenado | Conforme | Conforme |
| MCF(17/12/13)-Lle4 | Muestra de la conexión 4 al llenado | Conforme | Conforme |
Como se observa en la tabla anterior, no se aprecia crecimiento de microorganismos en ninguna de las muestras, por lo que cumplieron con la condición de esterilidad después del tiempo de incubación previsto. Este comportamiento fue similar para la segunda y tercera corrida. Se comprobó que el Medio de Cultivo utilizado en la simulación promueve el crecimiento de un grupo de cepas patrón y de una selección de cepas procedentes del ambiente de fabricación, por lo tanto, hay seguridad y confianza en los resultados obtenidos.
Se les realizó monitoreo del aire a los locales de Formulación 2 y Llenado, en condiciones de reposo y operación, utilizando el contador volumétrico (SAS) y el método de Placa Expuesta. Este último se efectúa desde la hora de comienzo de los procesos hasta el final de los mismos, cambiando las placas cada una hora. Teniendo en cuenta los límites establecidos en la regulación para las diferentes clases de área, se puede decir que los resultados obtenidos son satisfactorios pues cumplen los criterios establecidos.
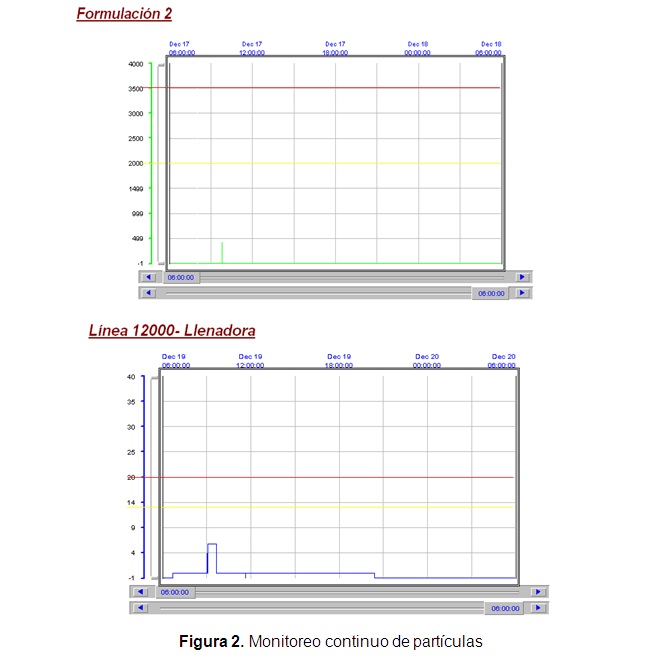
El sistema de monitorización de partículas en continuo permite realizar estudios de la evolución de la calidad ambiental en una sala limpia. En la Figura 2 los gráficos muestran el conteo continuo de partículas permitidas por m 3 en Clase A, para 0,5 µm en Formulación 2 y 5,0 µm en la Línea 12 000 respectivamente.
Los resultados que se muestran en la Tabla 2 corresponden a la presencia de partículas en Clase B, con límite establecido para partículas de 0,5 µm en reposo = 3520 partículas/m 3 y en operación = 352 000 partículas/m 3 .
Tabla 2. Características del aire en concentración de partículas por punto de muestreo. Formulación 2
| Lote | Punto/ operación | Partículas/m 3 | |||
| Reposo | Operación | ||||
| 0,5µm | 5,0µm | 0,5µm | 5,0µm | ||
| MCF(17/12/13)-BP | 1 | 0 | 0 | 706 | 0 |
| MCF(18/12/13)-BP | 1 | 106 | 0 | 2755 | 0 |
| MCF(19/12/13)-BP | 1 | 106 | 0 | 1059 | 0 |
En el monitoreo de partículas no viables, tanto en Clase A emitida por los gráficos del monitoreo continuo, como en Clase B y C reportados por el contador MetOne, se muestran valores que se encuentran dentro de los límites establecidos, obtenidos durante las operaciones para los tres lotes procesados. Solo en casos muy puntuales se observan puntos fuera de especificación que se corresponden con intervenciones realizadas por el personal. Estos resultados corroboran que los sistemas de manejo y acondicionamiento del aire funcionan adecuadamente y que los operarios cumplen con las BPP de productos estériles.
En todas las superficies muestreadas se obtuvieron resultados satisfactorios, pues las unidades formadoras de colonias detectadas estuvieron por debajo de los límites establecidos según la especificación, esto se relacionan con las técnicas de limpieza e higienización adecuadas y un desempeño satisfactorio por parte del personal durante las operaciones.
El personal es una de las mayores fuentes de contaminación dentro de una sala limpia, por lo tanto, el monitoreo de las manos del personal (los guantes) y otras partes de la vestimenta para la sala limpia es una herramienta imprescindible para evaluar los riesgos de contaminación. El control microbiológico realizado al personal durante las operaciones de formulación y las conexiones al llenado, demostró que los resultados cumplen con los límites de aceptación establecidos, por lo que el desempeño de estos operadores se encuentra de acuerdo con las buenas prácticas y principios de fabricación aséptica.
Simulación del proceso de llenado y Liofilización.
La revalidación de los procesos de llenado, liofilización y retape asépticos se realizó el 3 de octubre del 2013 mediante una Prueba de Simulación de Procesos con el medio de cultivo Caldo Triptona Soya. La prueba de Promoción de Crecimiento se realizó a una selección de 25 bulbos estériles del lote llenado al concluir el período de incubación. El Monitoreo Ambiental del aire, superficies y el personal se efectuó en condiciones de reposo y operación. Los bulbos llenados, así como un resto en la bolsa llenada fueron incubados durante 14 días a una temperatura de 31 ± 1 ° C y examinados (revisados) para detectar cualquier contaminación al séptimo y décimo cuarto día [14].
Como se observa en la tabla 3 en el lote llenado MCliof(03/10/13) no se detectó contaminación en más de 10 000 unidades llenadas, cumpliéndose el criterio de aceptación establecido en el protocolo de validación. Este resultado demuestra el alto nivel de aseguramiento de la esterilidad de los procesos de llenado asépticos.
Tabla 3. Unidades contaminadas
| Totales | Lote Llenado |
| MCliof (03/10/13) | |
| Número de unidades retapadas | 15979 |
| Número de unidades incubadas | 15979 |
| Número de unidades contaminadas | 0 |
Al examinar los resultados de la esterilidad de las agujas de dispensación, tapones, bulbos y el resto del medio de cultivo en la bolsa llenada, no se observó crecimiento de microorganismos, por lo que cumplió con la condición de esterilidad después del tiempo de incubación previsto. Con este resultado puede concluirse que las condiciones ambientales y el procedimiento de llenado no afectan la esterilidad de las agujas, bulbos y tapones y que, además, la operación de conexión con la bolsa en el área de llenado se realizó satisfactoriamente de acuerdo con las Buenas Prácticas de Fabricación para productos estériles, demostrándose el entrenamiento y las habilidades de los operadores en la ejecución de esta operación.
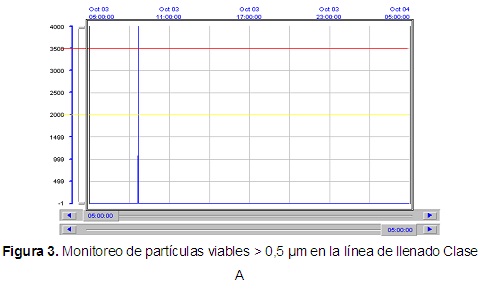
Se analizaron las condiciones ambientales en los diferentes locales y los resultados se compararon con los límites establecidos en el Anexo 4 de la regulación 16-2012 del CECMED [15]. La m onitorización del aire por el método de placa expuesta y el SAS, tanto en condiciones de reposo como en operación, reportó valores dentro de los límites establecidos. Los resultados de los muestreos realizados a las superficies en las áreas de llenado, liofilización y retape (en ambas condiciones) por los métodos de placa RODAC e Hisopado, se relacionan con las técnicas de limpieza e higienización adecuadas y un desempeño satisfactorio por parte del personal durante las operaciones. Los resultados que se muestran en los gráficos del monitoreo continuo de partículas no viables en Clase A para el área de llenado y liofilización muestran resultados dentro de los límites de especificación en condiciones de reposo. En condiciones de operación durante la liofilización todos los valores se encuentran dentro de los límites establecidos. Sin embargo, la figura que aparece a continuación muestra que en el llenado se evidencia la existencia de dos puntos fuera de los límites para partículas mayores de 0,5 µm debido a intervenciones realizadas durante el montaje del sistema de dispensación y durante un suministro de tapones. Estas operaciones fueron detenidas hasta el cese de la alarma, las zonas de trabajo fueron higienizadas y los materiales expuestos retirados.
Los resultados de los muestreos realizados al personal durante las operaciones de llenado, liofilización y retape en el lote procesado muestran resultados satisfactorios, por lo que el desempeño de los operadores se realiza de acuerdo con las Buenas Prácticas y principios de fabricación aséptica. En este monitoreo se incluyó, además, el muestreo del desempeño del mecánico durante su intervención en la operación de llenado, siendo este satisfactorio, lo que demuestra que al igual que los operadores, cumple también las buenas prácticas de fabricación aséptica.
Producción de los lotes de introducción.
Entre los días 10 y 23 de enero del año 2014 se realizaron como un primer paso, un lote de placebo y tres lotes de productos, todos formulados en la PPP3 y se obtuvieron resultados satisfactorios, los cuales se muestran a continuación.
La formulación se realiza en bolsas plásticas de 5 y 10 Litros de capacidad de acuerdo al volumen a formular. En la tabla 4 se muestran los datos principales de cada lote.
Tabla 4. Datos generales de la formulación
| Lote | Fecha | Lote de IFA | Volumen Teórico (L) | Volumen Real (L) |
| PF401LL | 10/01/2014 | - | 2,5 | 2,4 |
| F401LL | 15/01/2014 | 01IFA1307 / 05IFAG301 | 2,7 | 2,48 |
| F402LL | 19/01/2014 | 01IFA1308 / 05IFAG302 | 6,8 | 5,62 |
| F403LL | 23/01/2014 | 01IFA1309 / 05IFAG303 | 3,6 | 2,71 |
Todos los ensayos realizados al producto cumplen con los requerimientos de la Especificación [16], por lo tanto, los lotes están Conforme y se declara que el producto está introducido en las instalaciones de la Planta de Productos Parenterales 3 en BioCen.
Consistencia de la producción.
La producción en BioCen se organiza en campañas y en el año 2015, la fabricación de HeberFERON se dividió en dos etapas, una en el mes de marzo y la otra en agosto, con tres lotes consecutivos cada una. El monitoreo ambiental en reposo y operación de los procesos de formulación y llenado se ejecutó según las regulaciones establecidas. El historial gráfico de conteo continuo de partículas permitidas por m 3 , para 0,5 µm y 5,0 µm en Clase A, para los diferentes locales que intervienen en la producción, tiene un comportamiento estable y conforme según especificaciones.
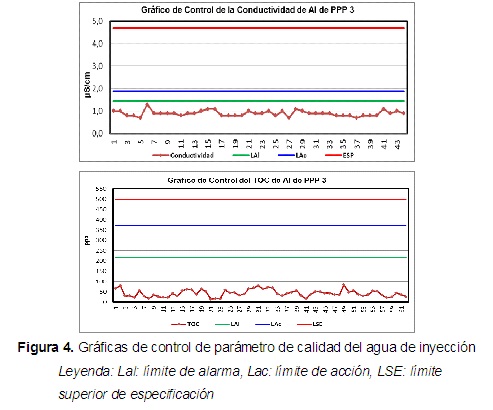
El comportamiento de los suministros auxiliares para las dos campañas, el cual reporta valores que se mueven alrededor del límite de aceptación, esto demuestra que los datos se encuentran en control estadístico. En los gráficos que aparecen a continuación se observa el control del agua para inyección del mes de marzo y de agosto respectivamente.
Los datos principales de la formulación de cada lote se muestran en la Tabla 5.
Tabla 5. Datos generales de la formulación
| Lote | Fecha | Lote de IFA | Volumen Teórico (L) | Volumen Real (L) |
| F501LL | 04/03/2015 | 01IFAG403 / 05IFAG501 | 8,30 | 7,79 |
| F502LL | 04/03/2015 | 01IFAG404 / 05IFAG502 | 8,50 | 7,46 |
| F503LL | 06/03/2015 | 01IFAG405 / 05IFAG503 | 9,00 | 5,79 |
| F504LL | 24/08/2015 | 01IFAG403 / 05IFAG502 | 8,85 | 8,35 |
| F505LL | 25/08/2015 | 01IFAG405 / 05IFAG502 | 8,86 | 8,18 |
| F506LL | 28/08/2015 | 01IFAG404 / 05IFAG503 | 9,95 | 8,14 |
Debido a que con el procedimiento de descongelación rápida que se emplea para el IFA de Interferón Gamma ocurrió la ruptura de algunos frascos, se evaluó ajustar los parámetros de este proceso utilizando una alternativa de descongelación lenta escalonada, para validar este cambio se analizaron los lotes producidos en el mes de marzo.
Los rendimientos en los lotes formulados estuvieron por encima del 90%, las incidencias están relacionadas con los muestreos realizados. En la formulación del lote F503LL se tomaron 1,4 litros de producto para realizar estudios de estabilidad y validación, de ahí que el rendimiento operacional en esta etapa fuera tan bajo. Se realizaron como parte del control de proceso de la formulación el análisis de la Biocarga, la cual resultó conforme en los lotes fabricados, cumpliendo con el criterio de menor de 10 UFC/100mL.
Los lotes de consistencia se llenaron en la línea de 12 000 bulbos/hora con un comportamiento estable no reportándose incidencias. Los rendimientos operacionales están por encima del 99%, los cuales indican con la eficiencia que se trabajó en el proceso de llenado. El proceso de liofilización de estos lotes se efectuó en las dos liofilizadoras instaladas en la planta y transcurrió sin incidencias. Se cumplieron los parámetros establecidos en la receta del producto.
Los ensayos realizados al producto final según especificación demostraron que la actividad biológica del Interferón Gamma no cumplió con los límites establecidos en los tres primeros lotes de HeberFERON, producidos empleando el procedimiento de descongelación lenta escalonada. Por dicha razón el cambio propuesto no fue aprobado y se continuó realizando la descongelación como antes, es decir por el procedimiento de descongelación rápida. El resto de los ensayos están Conforme [17] . A partir de los resultados que se muestran en la tabla 6, se puede concluir que el proceso de producción del HeberFERON es consistente y permite obtener un producto que cumple con las especificaciones de calidad.
Análisis económico.
La producción del HeberFERON en PPP3 tiene grandes ventajas económicas, el aumento de los estándares de calidad del producto, junto con los resultados alcanzados en la corta experiencia en su producción, elevan el valor agregado del producto, su cotización y de su demanda.
Para este análisis, es necesario cuantificar los costos del proyecto, en los cuales se incluye el lote de simulación con medio de cultivo MCliof (03/10/13) y el lote de placebo P401LL01. Los costos de los lotes de introducción no se incluyen dentro de los costos del proyecto porque sus ingresos serán facturados como el resto de la producción. El costo total de la producción de los lotes de introducción y consistencia del HeberFERON, se calculó teniendo en cuenta los gastos directos e indirectos en todas sus etapas. Los precios se expresan en Moneda Nacional (MN) y en Moneda Libremente Convertible (MLC). La conversión que se utiliza entre las dos monedas es de 1 a 1.
La valoración económica demuestra que el costo del proyecto, que no obtiene ganancias económicas, sumado al costo de producción de los lotes involucrados en la introducción y consistencia del producto, es superior al valor que aportan las ventas de dicho producto. Esto se debe en gran medida a que los tres lotes destinados al ajuste en condiciones de descongelación del IFA de Interferón Gamma no cumplieron con la especificación de actividad biológica del IFA en cuestión, por lo tanto, no aportaron unidades liberadas para obtener beneficios y sí representan gastos en su producción.
Tabla 6. Resultado de los ensayos del producto final
| Ensayos | Resultados/Lotes | ESP 4502 | |||||
| F501LL | F502LL | F503LL | F504LL | F505LL | F506LL | ||
| Características Organolépticas del liofilizado | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Masa liofilizada de color blanco, sin partículas visibles |
| Características Organolépticas del reconstituido | Cumple | Cumple | Cumple | Cumple | Cumple | Cumple | Líquido transparente, homogéneo, libre de partículas en suspensión |
| Actividad biológica Interferón Gamma | 1,82 | 1,79 | 1,83 | 2,79 | 3,27 | 3,40 | De 2,7 a 8,3 x 10 5 UI/mL |
| Actividad biológica Interferón Alfa 2b | 3,22 | 3,11 | 3,46 | 2,65 | 2,88 | 2,27 | De 1,62 a 4,98 x 10 6 UI/mL |
| Identificación de Interferón Gamma | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identificado |
| Identificación de Interferón Alfa 2b | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identifi-cado | Identificado |
| Concentración de proteínas totales | 1,08 | 1,08 | 1,25 | 1,08 | 1,07 | 1,05 | De 0,96 a 1,44 mg/mL |
| Concentración de carbohidratos totales | 52,6 | 45,5 | 50,5 | 55,3 | 56,4 | 57,2 | De 40,0 a 60,0 mg/mL |
| Esterilidad | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Pasa la prueba |
| Pirógenos | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Conforme |
| Seguridad general | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Respon-de | Conforme |
| pH | 6,67 | 6,69 | 6,80 | 6,78 | 6,78 | 6,68 | De 6,25 a 7,25 |
| Humedad residual | 4,0 | 4,17 | 3,14 | 4,4 | 3,1 | 2,9 | = 5% |
En la medida que la producción continúa, la diferencia entre los costos productivos y las ventas se hace menor, lográndose que estas últimas tengan un valor mayor y así poder obtener ganancias. Si se fuera a analizar los beneficios que aporta el HeberFERON al país, además de los ingresos monetarios, este novedoso producto se hace imprescindible para combatir los diversos tipos de cáncer de la piel, que cada día se hacen más recurrentes por la elevada incidencia de las condiciones de eterno verano en nuestra Isla [17].
CONCLUSIONES
• La Planta de Productos Parenterales 3 operó con niveles de contaminación no mayores de una unidad contaminada en más de 10 000 unidades, llenadas bajo las condiciones ambientales, los procedimientos, el equipamiento y el personal involucrados en la prueba de simulación con medio.
• Se realizó, con resultado satisfactorio, la simulación de un proceso evaluado como peor caso, el cual avala el proceso de interés en este trabajo.
• Se demostró que los niveles de higiene en el área de llenado aséptico, en condiciones de reposo y operación, cumplen con los límites de aceptación según la regulación.
• Se comprobó que la PPP3 cuenta con un personal entrenado en las técnicas de fabricación asépticas, cumpliendo con las exigencias relacionadas con las Buenas Prácticas de Producción.
• Se otorgó la licencia de producción del HeberFERON en PPP3a partir de la formulación de tres lotes para su introducción .
• Se cumplieron las especificaciones establecidas en tres lotes consecutivos para demostrar la consistencia de la producción.
• Se demostró la factibilidad económica de la producción del HeberFERON en PPP3.
RERERENCIAS BIBLIOGRÁFICAS
1. Todo de Cuba [en línea]. La Habana: 2016 [4 de diciembre de 2017]. Disponible en internet: http://www.todocuba.org/nuevo-medicamento-cubano-para-tratar-el-cancer-de-piel/ .
2. The Yucatan Times [en línea]. México: Septiembre 2016 [6 de diciembre de 2017] Disponible en internet: http://www.theyucatantimes.com/2016/09/new-skin-cancer-medicine-developed-by-cuban-scientists/ .
3. HERNÁNDEZ BASSO, Minerva. Aplicaciones Médicas de la Biotecnología. En Semanario Económico y Financiero de Cuba . La Habana, 5-8 de marzo de 2012. Disponible en: http://www.opciones.cu/cuba/2012-01-12/mostrara-avances-de-aplicaciones-medicas/ .
4. FRAGA GÓMEZ, José Carlos, Validación y puesta en marcha del sistema de formulación de Heberprot-P. Tesis de Maestría. Instituto Superior Politécnico José Antonio Echeverría, La Habana, 2014.
5. CECMED. Buenas Prácticas Farmacéuticas Sistema Regulador en Cuba . La Habana: Centro para el Control Estatal de Medicamentos, 2017.
6. OMS. Prácticas adecuadas de fabricación: directrices sobre la validación de los procesos de fabricación . Anexo 6 del informe 34, 1998.
7. HIDALGO GUERRERO, Luis Carlos. Specifications of equipment and system. Formulation system of PPP-3 . Mayabeque: Centro Nacional de Biopreparados, 2010.
8. ÁLVAREZ GONZÁLEZ, Marisol, et al. Validación del llenado aséptico en la Planta de Productos Parenterales 3 de BioCen. Revista Tecnología Química, vol. XXXVI, No.3, p.379-391.
9. BIOCEN. Expediente Maestro de la Organización. Planta de Productos Parenterales 3. EMO 05B. Edición 01. Mayabeque: Centro Nacional de Biopreparados, 2016.
10. CECMED. Buenas Prácticas Farmacéuticas Sistema Regulador en Cuba . Anexo 6 Buenas Prácticas Ingenieras para la producción de aguas de uso farmacéutico y vapor limpio. La Habana: Centro para el Control Estatal de Medicamentos, 2012.
11. FIGUEROA PÉREZ, Roberto. Control de la contaminación una visión integradora. En: Taller Internacional Procesamiento Aséptico en la Industria Biofarmacéutica , La Habana, 15-17 de abril de 2015.
12. FDA. Sterile Drug Products Produced by Aseptic Processing - cGMP, Guidance for Industry . 2004.
13. SIMIL RODRÍGUEZ, María Teresa. Protocolo para la Validación del proceso aséptico de formulación de la vacuna Heberpenta-L en bolsa en la PPP3. PRO 12.11.009.4. Edición 02. Mayabeque: Centro Nacional de Biopreparados, 2013.
14. SIMIL RODRÍGUEZ, María Teresa. Protocolo para la validación de los procesos asépticos de llenado, liofilización y retape en la línea de 12 000 bb/h de la Planta de Productos Parenterales 3 . PRO 12.11.007.4. Edición 03. Mayabeque: Centro Nacional de Biopreparados, 2013.
15. CECMED. Directrices sobre buenas prácticas para la fabricación de productos farmacéuticos . Anexo 4 Buenas prácticas para la fabricación de productos estériles. La Habana: Centro para el Control Estatal de la Calidad de los Medicamentos, 2006.
16. BIOCEN. HeberFERON (Interferón alfa 2b humano recombinante 3,0 M + Interferón gamma humano recombinante 0,5 M . ESP 4502. Edición 04. Mayabeque: Centro Nacional de Biopreparados, 2017.
17. FUENTES MEDEROS, Leisy. Introducción y consistencia de la producción de HeberFERON en la Planta de Productos Parenterales 3. Tesis de Maestría. Universidad Tecnológica de La Habana José Antonio Echeverría, La Habana, 2018.
Recibido: Marzo 2018
Aprobado:Julio 2018
MSc. Leisy Fuentes Mederos. Centro Nacional de Biopreparados, Mayabeque