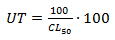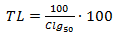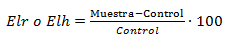Introducción
En el mundo actual, presenta una elevada importancia dentro del campo de la Toxicología, el estudio de los efectos tóxicos de compuestos químicos sobre el organismo humano y otros organismos vivos, donde el grado de intoxicación va a estar dado por el nivel de exposición frente a una determinada sustancia. Esta exposición a bajos niveles muchas veces está relacionada con la aparición de efectos crónicos y con la proliferación de enfermedades aparentemente no vinculadas a factores tóxicos. 1
En la legislación de varios países como Estados Unidos, Canadá y los de la Comunidad Europea, entre otros, se han incluido los ensayos con organismos vivos para cuantificar el grado de toxicidad de efluentes industriales, aguas residuales y/o residuos sólidos, para determinar los límites de descarga y los efectos tóxicos sobre la biota. 2,3
Los ensayos ecotoxicológicos ayudan a evaluar la calidad de los efluentes y de esta forma prevenir o alertar sobre riesgos en el ecosistema. 3 Actualmente se utilizan diferentes especies de organismos acuáticos y terrestre de varios niveles filogenéticos como “indicadores” para determinar los efectos tóxicos de contaminantes vertidos o liberados en el ecosistema. 4
Los residuos generados por el Laboratorio de Química Analítica del Centro de Toxicología y Biomedicina (TOXIMED) son vertidos al medio ambiente, sin tratamiento. En este artículo se realizan ensayos ecotoxicológicos con el objetivo de inferir el efecto que estos residuales pueden tener sobre el ecosistema a partir de las consecuencias que produzca sobre una población de organismos que forme parte fundamental de la cadena trófica (bacterias, algas, invertebrados, peces).
Los efectos biológicos que se producen en los ensayos se pueden definir de varias formas, los cuales van a ser los parámetros que se utilicen para determinar la toxicidad. A continuación se definen dos de los parámetros más usados. 5
Concentración efectiva (CEx): concentración del efluente que produce efectos negativos apreciables en un porcentaje "x" de la población de ensayo. Se usa el CE50 o EC50, que sería la concentración efectiva que afecta al 50 % de la población.
Concentración letal (CLx): concentración del efluente que produce la muerte de un porcentaje "x" de la población de ensayo. Se usa el CL50 o LC50, que sería la concentración letal que elimina al 50 % de la población. Para emplear los resultados de los ensayos de toxicidad se emplean las unidades de toxicidad (UT), que se utilizan como criterio base de la normativa.
El objetivo del trabajo es evaluar los residuales generados en el laboratorio medioambiental mediante el empleo de ensayos ecotoxicológicos.
El objetivo del trabajo es realizar ensayos ecotoxicológicos con el propósito de estudiar el efecto que los residuales del laboratorio de Química Analítica pueden tener sobre el ecosistema.
Materiales y métodos
Al residual líquido procedente del laboratorio de Química Analítica, se le realizó la evaluación de la toxicidad aguda mediante los siguientes bioensayos ecotoxicológicos:
Toxicidad Aguda en Artemia sp
Bioensayo de Toxicidad Aguda con semillas de lechuga (Lactuca sativa L)
Toxicidad aguda en Artemia sp
Esta prueba está basada en la determinación de la concentración de la sustancia en estudio que provoca la muerte al 50 % de las nauplius (Larvas) de Artemia sp, después de 24 h de exposición (CL50) además de efectos subletales. Es un ensayo rápido que se realiza en una o dos etapas según sea necesario; una preliminar que proporciona un valor aproximado de CL50 y determina el rango de concentraciones a probar en el ensayo definitivo y una final la cual se realiza en los casos donde el valor aproximado proporcionado por el preliminar no es suficiente. Esta permite calcular la CL50 y determinar el 0 % y el 100 % de mortalidad.
Justificación del método a emplear: En la actualidad existe una tendencia a reemplazar, reducir y/o refinar los métodos que utilizan vertebrados superiores por lo que han surgido una serie de ensayos que emplean otros sistemas biológicos e informáticos, estos son conocidos como los métodos alternativos a la experimentación animal, muchos de estos métodos, como los que emplean invertebrados, han sido utilizados además desde el punto de vista ecotoxicológico para detectar el impacto de sustancias químicas, residuales y contaminantes en general, en ecosistemas acuáticos, ya que son organismos representativos por ocupar eslabones inferiores de la cadena trófica y cualquier alteración originada por la presencia de un contaminante, tendría repercusión en los organismos superiores. En este grupo de métodos se encuentra el Ensayo de Toxicidad Aguda en Artemia sp, excelente para evaluar los efectos de productos químicos y residuales sobre ecosistemas marinos. 6
Justificación para la selección del sistema de estudio: La Artemia sp es un crustáceo que normalmente constituye un excelente alimento para la cría de peces en los sistemas de acuicultura y los ecosistemas marinos naturales. Al ser un organismo representativo de las cadenas tróficas de estos últimos constituye un elemento básico que puede ser empleado con éxito en los bioensayos de ecotoxicidad para conocer los efectos de los productos químicos. La selección del sistema de estudio animal se sugiere entonces sobre la base de criterios prácticos de disponibilidad durante todo el año, fácil manutención, conveniencia para la prueba, entre otros factores relevantes de tipo económico, biológico y ecológico.
Caracterización del sistema de estudio: En este estudio serán utilizados quistes viables de Artemia sp suministrados por el Centro de Investigaciones Pesqueras de La Habana.
Condiciones previstas de alojamiento: los quistes son mantenidos en refrigeración (4°C) y humedad relativa apropiada para su conservación.
El método de administración de la sustancia a probar es por aplicación al agua de dilución de diferentes concentraciones del residual.
Niveles de concentración: Se probaron cuatro concentraciones (5, 25, 50, 100 %) aplicadas de manera única, al comienzo del ensayo de toxicidad, cuyo tiempo de duración es de 24 h. Se realizó el siguiente procedimiento experimental:
Incubación de los quistes de Artemia sp para la eclosión. 6
Para lograr la eclosión de los quistes de Artemia sp se utilizó una cámara de vidrio dividida en dos compartimentos por una lámina con pequeños orificios, garantizando oscuridad en uno de ellos. Se le adicionó agua de mar artificial, aireando a saturación aproximadamente durante 15 min antes de comenzar el experimento, aireación que se mantuvo durante todo el tiempo que duró la incubación. La temperatura se mantuvo en un rango de 27ºC a 30ºC. Se pesaron 25 mg de huevos y se le adicionaron al compartimento oscuro de la cámara de eclosión.
El otro se ilumino por una lámpara a una distancia de 30 cm de forma paralela a la cámara, con el objetivo de atraer las larvas. Estas, al eclosionar, pasan a través de los orificios por fototaxia positiva. Alrededor de las 24 h de haber puesto los huevos en el agua debe ocurrir la eclosión dando lugar a larvas nauplius y la migración de estas hacia la recámara iluminada donde se colectan, extraen y cuentan.
Ejecución del ensayo. Prueba de toxicidad.
Se depositaron 10 nauplius en cada recipiente (vasos de precipitado). El volumen de agua transferido con las nauplius no debe ser superior a 50 µL. Se valuaron cuatro concentraciones de la sustancia de estudio (5, 25, 50, 100 %) con tres réplicas cada una, incluyendo un grupo control. Cada recipiente se completa con un volumen de 10 mL de las concentraciones respectivas del tóxico en estudio y se incuban en oscuridad a temperatura de 25 °C por 24 h.
Tratamiento de los resultados
Culminado el período de exposición se cuentan en el estereoscopio las larvas supervivientes y se anota cualquier comportamiento anormal. Los efectos sobre la mortalidad se expresan como CL5024h, parámetro que se determina por el programa profesional EPA PROBIT. Se realizó además como índice para evaluar la toxicidad del vertido, la determinación de las UT (Unidades de Toxicidad). Estas se calculan mediante la siguiente ecuación:
Siendo más tóxico cuanto más UT presente.
Bioensayo de Toxicidad Aguda con semillas de lechuga (Lactuca sativa L)
El bioensayo con semillas de lechuga ha sido recomendado y aplicado por diferentes organismos de protección ambiental para la evaluación ecotoxicológica de muestras ambientales, ya que mide los procesos fisiológicos que ocurren durante el periodo de germinación y los primeros días de desarrollo de la plántula, siendo estos generales para la gran mayoría de las semillas. De igual modo existen múltiples estudios realizados que apoyan esta hipótesis,7,8,9 demostrando la sensibilidad que presenta esta especie comparada con otras especies de plantas frente a los contaminantes ambientales, así como su importancia desde el punto de vista hortícola, su rápida germinación, su fácil manutención en el laboratorio, su amplia aplicación en muestras de diferentes características y orígenes, la sencillez, corta duración del bioensayo, así como su buena correlación con otros sistemas de prueba.8,9
Es un ensayo estático de toxicidad aguda (120 h de exposición) en el que se evaluaron los efectos fitotóxicos de una muestra residual líquido en el proceso de germinación de semillas de lechuga (Lactuca sativa L.) y en el desarrollo de las plántulas durante los primeros días de crecimiento.
Las semillas de lechuga variedad BSS utilizadas, fueron suministradas por la Empresa de Semillas de Santiago de Cuba, y almacenadas previamente en ambiente seco y a 4°C. Para la ejecución del ensayo se seleccionaron cuidadosamente por su forma y tamaño más frecuente. Se sembraron un total de 20 semillas en placas de petri de 90 mm de diámetro cubiertas con un papel de filtro Whatman de igual diámetro, dejando suficiente espacio entre ellas para su adecuado crecimiento. Se probaron un control (agua destilada) y 4 concentraciones del residual: 5, 25, 50, 100 %, usando como disolvente agua destilada, con 3 réplicas cada uno, 3 mL de volumen de aplicación, y una temperatura mantenida de 22 ± 2°C en la oscuridad. Como puntos finales para la evaluación de los efectos, se determinó la CIg50 (concentración efectiva a la cual se produjo inhibición de la germinación al 50 %, respecto al grupo control); la CIr50 (concentración efectiva a la cual se produjo inhibición en la elongación de la radícula al 50 %, respecto al grupo control) y la CIh50 (concentración a la cual se produjo inhibición en la elongación del hipocótilo al 50 %, respecto al grupo control).
Cada punto final se evaluó comparando el efecto generado en los organismos expuestos a las muestras con respecto a la respuesta en los organismos del control negativo sujetos a las mismas condiciones de ensayo, excepto por la ausencia de muestra.
Terminado el período de exposición, se cuantificó el efecto en la germinación, en la elongación de la radícula y del hipocótilo. Como criterio de germinación se consideró la aparición visible de la radícula.
Para el análisis de la presencia de anomalías en las plántulas tratadas, se siguió la metodología referida en el Manual para la Evaluación de Plántulas en los Ensayos de Germinación. 4
Se determinó la unidad de toxicidad letal (UTL) para el parámetro de germinación, obtenida por el cociente entre la concentración verdadera medida de un tóxico o sustancia en particular, dividida por la Clg50 de dicha sustancia, en este caso esta relación se calcula con referencia a la concentración inicial del efluente (la concentración real equivale al 100% del mismo), y se calculó mediante la siguiente expresión:
Se tuvo en cuenta que las relaciones menores que uno indican niveles no letales y mayores que uno muy letales. Además, se determinaron otros indicadores que aportan elementos para la clasificación de los residuales, en cuanto a la germinación se consideraron no tóxicas a las muestras en las cuales germinaron más del 90 % respecto del control con agua destilada; tóxicas a las que presentaban valores comprendidos entre 75 % y 90 %, y muy tóxicas a las que tenían menos del 75 % de germinación respecto del control.
De igual modo para los parámetros de crecimiento se determinó la inhibición de la elongación de la raíz e hipocótilo (Elr o EIh) mediante la fórmula:
donde:
Muestra: Promedio de la longitud de la raíz o hipocótilo, según sea en cada caso, teniendo en cuenta que n= 20 para cada concentración donde se presente crecimiento, expresada en mm.
Control: Promedio de la longitud de la raíz o hipocótilo, según sea en cada caso, teniendo en cuenta que n= 20 para el grupo control, expresada en mm.
Los resultados de la inhibición (El) se clasifican de la siguiente forma:
El < 0: Tóxica (inhibición de la prolongación de la raíz o hipocótilo según el parámetro medido);
El > 0: Se consideró estimulación del crecimiento;
El = 0: No tóxica.
Para el cálculo de los valores medios, porcentuales y las concentraciones efectivas CIg50, CIr50, y CIh50 para cada punto final medido se empleó el programa Microsoft Excel 2003. Estas últimas se calcularon a partir del estadígrafo Pronóstico, el cual calcula o predice un valor futuro en una tendencia lineal usando valores existentes.
Resultados y discusión
Toxicidad aguda en Artemia sp
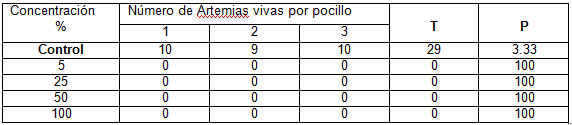
Culminado el tiempo de exposición de la Artemia sp frente al residual líquido del laboratorio de Química Analítica se observa que el porcentaje de mortalidad en los controles fue menor del 10 % (3,33 %), por lo que se considera válida la prueba. 6.
Se muestran en la tabla 1 los resultados obtenidos al final de las pruebas, donde se puede apreciar la existencia de una relación directamente proporcional entre el efecto adverso medido (mortalidad) y los niveles de concentraciones probados.
Se evidencia que el máximo efecto ocurre a partir de la concentración del 5 % con un 100 % de mortalidad luego de 24 h y es válido referir que para la concentración del 50 % la muerte es de manera instantánea para el 100 % de los organismos expuestos, lo que se corresponde con la alta toxicidad del residual líquido del laboratorio
donde:
T: Número total de Artemias vivas al final del ensayo
P: % de mortalidad al final del ensayo
El residual del laboratorio de Química Analítica en sus tres diluciones resultó letal en un 100 % para las larvas de Artemia sp.
Evaluación de la fitotoxicidad en semillas de lechuga (Lactuca sativa)
Al finalizar el ensayo, en la totalidad de los controles se obtuvo un porciento de germinación mayor del 90 % del total de las semillas plantadas, con crecimiento normal y libre de malformaciones, por lo que se considera válido el ensayo. En la tabla 2 y en la figura 1, se muestran los resultados obtenidos en el estudio toxicológico del residual observándose que al 50 % y 100%, no existió germinación y los porcientos de germinación al 5% y 25% de concentración del residual fueron muy bajos (41,6 y 26,6 % respectivamente).
Tabla 2 Resultados del % de inhibición de la germinación de las semillas de Lactuca sativa (lechuga)
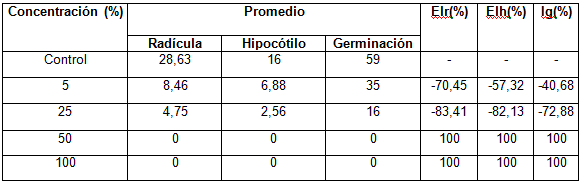
donde:
Ig: Porciento de inhibición de la germinación de las semillas
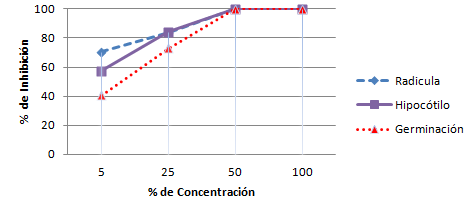
Fig. 1 Comportamiento del porciento de inhibición de la germinación en lechuga con respecto a la concentración de la Mezcla del Residual.
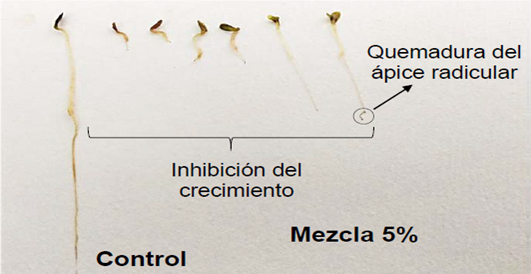
Además, se encontraron anomalías en los órganos del crecimiento en las concentraciones donde hubo crecimiento (5 y 25%), siendo más notorias directamente proporcionales con la concentración probada del residual. Las más significativas en la radícula fueron: quemaduras en ápice radicular por la exposición a los tóxicos que componen el residual (figura 2), raíz atrofiada y/o raquítica (figura 3), mostrando afectaciones considerables y que enuncian la importancia de las mismas en cuanto a la supervivencia y desarrollo normal de la planta, siendo el parámetro más sensible en este estudio coincidiendo con lo reportado por otros autores. (5)

Fig. 3 Anomalías en la raíz de las semillas de lechugas por la exposición al residual objeto de estudio.
Asimismo, en cuanto a las alteraciones en el crecimiento del hipocótilo las más notables fueron: hipocótilo curvado, corto y engrosado (figura 4 ).
La toxicidad de una muestra residual, no solamente depende de los efectos adversos de uno de sus componentes sino también de las posibles interacciones entre ellos, aún cuando originalmente no sean potencialmente tóxicos. Es por ello, que los efectos letales y subletales (incluyendo las anomalías) encontrados, pudieran estar dados por la acción de las diferentes sustancias químicas que componen el efluente evaluado y sus interacciones, partiendo de sus propiedades físico-químicas, y analizando los posibles efectos que pueden ser aditivos o sinérgicos; antagónicos; de potenciación o inhibición. 10
Conclusiones
Después de haber realizado los estudios toxicológicos a los residuales obtenidos en el laboratorio de química de TOXIMED hemos arribado a las siguientes conclusiones:
Con el biomodelo de experimentación de Artemia sp el residual del laboratorio en sus tres diluciones resultó letal en un 100%.
Al evaluar la fitotoxicidad en semillas de lechuga para las cuatro concentraciones, se demostró que al 50 % y 100%, no existió germinación y los porcientos de germinación al 5% y 25% de concentración del residual del laboratorio de química Analítica fueron muy bajos (41,6 y 26,6 % respectivamente).
En las concentraciones donde hubo crecimiento de las plantas de lechugas (5%,25%) se encontraron anomalías en los órganos del crecimiento tales como: raíz raquítica y atrofiada, quemaduras en el ápice radicular e hipocótilo curvado.
Quedó demostrado que el residual del laboratorio de Química tiene efectos tóxicos tanto para los medios acuáticos, como para los terrestres.