Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop v.29 n.4 La Habana oct.-dic. 2008
Obtención de un nuevo método de desinfección de semillas de arroz
J. C. GarcíaI, Dr.C. Annia HernándezII , Yanelis AceboIII, Narovis RivesIV
I Reserva Científica del Laboratorio de Ecología Microbiana
II Profesora Asistente
III Especialista del departamento de Microbiología, facultad de Biología, Universidad de La Habana
IV Investigadora del Laboratorio de Protección de Plantas, Instituto de Investigaciones del Arroz (IIA), km. 16 ½, autopista Novia del Mediodía, Bauta, La Habana, Cuba. Email: narovis@fbio.uh.cu
ABSTRACT
Removing bacteria from seed surface is one of the main issues when identifying endophytic bacteria as well as with microorganism-inoculating trials. Disinfection by chemical methods has been a commonly used strategy with this goal. However, it is very hard to fully disinfect rice seeds, due to its particular characteristics (rough and velvety surface), so that most disinfection methods described by literature are often useless. Therefore, this investigation was aimed at searching an efficient rice seed disinfection methodology. Then, seeds from cv. J-104 were used and four disinfection protocols were assessed by employing different disinfecting solutions (chloramine T, calcium hypochlorite and alcohol, among others), exposure times and solution combination. Results showed that by disinfection protocol 4, using calcium hypochlorite in two plant growth stages, the best germination and disinfection rates were achieved, obtaining an efficient disinfection method, which could be applied to plant-microorganism interaction studies, from the practical point of view.
Key words: rice, seed, methods, disinfection
RESUMEN
Uno de los problemas principales con la identificación de bacterias endófitas así como con los experimentos de inoculación de microorganismos, es la eliminación de bacterias de la superficie. La desinfección por métodos químicos ha sido una estrategia usualmente utilizada para estos fines. Debido a las características peculiares (superficie rugosa y aterciopelada) que presentan las semillas de arroz, resulta muy difícil lograr la total desinfección de estas y poco efectivos la mayoría de los métodos de desinfección descritos en la literatura. En este sentido, el trabajo se desarrolló con el objetivo de buscar una metodología eficiente de desinfección de semillas de arroz. Para ello se emplearon semillas de la variedad J-104 y se ensayaron cuatro protocolos de desinfección, que se basan en la utilización de diferentes soluciones de desinfección (cloramina T, hipoclorito de calcio y alcohol, entre otras), tiempos de exposición y combinaciones de las soluciones. Los resultados demuestran que con el protocolo de desinfección 4, utilizando hipoclorito de calcio en dos fases de desarrollo del cultivo, se logran los mejores resultados con elevados porcentajes de germinación y desinfección de las semillas, obteniéndose un método de desinfección eficiente, que podría ser utilizado desde el punto de vista práctico en estudios de interacción planta-microorganismos.
Palabras clave: arroz, semillas, métodos, desinfección
INTRODUCCIÓN
El arroz es cultivado por el hombre desde hace más de 7000 años. Dentro del género Oryza, oriundo del continente asiático, se encuentran aproximadamente 19 especies de plantas, siendo el arroz común (Oryza sativa L.) la especie más importante para la alimentación humana, aunque también se utiliza O. glaberrima (1).
El consumo anual de arroz a nivel internacional alcanza los 410 millones de toneladas. En el 2003 se produjeron en el mundo 354 millones de toneladas de arroz para el consumo humano y, en el caso de Cuba, se obtuvo 300 000 toneladas, lo que constituyó una producción récord (2). Por la importancia que tiene la producción de alimentos a nivel mundial, para satisfacer las necesidades de una población en crecimiento acelerado, se reclama la acción conjunta de agricultores e investigadores, para buscar alternativas que beneficien el desarrollo del cultivo y su productividad, sin afectaciones para el medio ambiente. La aplicación de inoculantes microbianos podría constituir una de estas alternativas por sus efectos beneficiosos para las plantas y los ecosistemas (3, 4).
Se han encontrado diferentes géneros bacterianos asociados al cultivo del arroz y numerosos autores han dedicado sus estudios al respecto. Dentro de los principales se encuentran Azospirillum (4, 5), Herbaspirillum (6, 7), Pseudomonas, Burkholderia, Azotobacter y Bacillus (8, 9). Sin embargo, los estudios de interacción planta-microorganismos así como los resultados de la aplicación de productos biológicos en la agricultura han sido variables, lo que podría estar relacionado con poblaciones microbianas asociadas a la semilla que interfieran en los resultados.
La semilla de arroz es muy rugosa y aterciopelada (1), características peculiares que la diferencian de otras semillas lisas como las del maíz, por lo que resulta muy difícil lograr una desinfección eficiente de ellas.
La desinfección por métodos químicos ha sido una estrategia usualmente utilizada, empleándose disímiles compuestos, ensayados a diferentes concentraciones y en ocasiones combinados unos con otros, entre los que se pueden citar al hipoclorito de sodio, hipoclorito de calcio, cloruro de mercurio y cloramina T (10, 11, 12).
Sin embargo, los microorganismos que viven endófitos en la raíz no pueden ser eliminados por estas metodologías y son pocos los estudios relacionados con este aspecto. Debido a los resultados tan variables que se han obtenido con la utilización de los diferentes métodos de desinfección y que en muchas investigaciones este proceso constituye un paso inicial del que depende, en ocasiones, el éxito de los experimentos, se hace necesario obtener una metodología eficaz para la desinfección de las semillas que permita garantizar la obtención de resultados confiables.
En este sentido, este trabajo tiene como objetivo la búsqueda de una metodología eficiente de desinfección de semillas de arroz.
MATERIALES Y MÉTODOS
Material vegetal. En este estudio se utilizaron semillas de arroz (Oryza sativa L.) de la variedad J-104, que es una de las variedades comerciales que se emplean actualmente en el país, tanto en el sector especializado como en el no especializado o popular; además, ha constituido un patrón a partir de la que se han obtenido nuevas variedades de arroz (13). Estas fueron suministradas por el Instituto de Investigaciones del Arroz (IIA) y conservadas a 4°C hasta su posterior utilización.
Métodos de desinfección de semillas de arroz. A partir de semillas de arroz de la variedad en estudio, se utilizaron diferentes métodos de desinfección, con vistas a seleccionar el más eficiente. En todos los protocolos se colocaron 100 semillas por 200 mL de las diferentes soluciones de desinfección. A continuación se describe de forma independiente cada uno de los protocolos de trabajo ensayados:
1. Las semillas fueron sumergidas durante cinco minutos en una solución de Tween 80 (500 µL.200 mL-1). Posteriormente se colocaron un minuto en etanol al 70 % y 10 minutos en solución de hipoclorito de calcio al 5 % con Tween 80 (500 µL.200 mL-1), la que fue preparada según metodología descrita (14). Finalmente se realizaron cuatro lavados sucesivos con agua destilada estéril (dos minutos por lavado).
2. En este protocolo se utilizó como solución de desinfección la cloramina T al 1 %. Para ello, las semillas fueron colocadas en la solución de desinfección durante 20 minutos y agitadas de forma continua mediante el uso de un agitador (Genie 2). Posteriormente se lavaron cuatro veces con agua destilada estéril (dos minutos por lavado).
3. Las semillas fueron desinfectadas mediante la combinación de las soluciones de desinfección de hipoclorito de calcio y cloramina T, según se describe en los protocolos de desinfección 1 y 2. Primero se aplicó el protocolo de desinfección 1 y posterior al último lavado con agua destilada estéril se procedió a la aplicación del protocolo de desinfección 2.
4. Se desarrolló utilizando hipoclorito de calcio descrito en el protocolo de desinfección 1, pero se aumentó el tiempo de exposición a 20 minutos y se realizó en dos fases de desarrollo del cultivo, aplicándose nuevamente a las semillas ya germinadas. Las semillas germinadas y desinfectadas se colocaron en tubos con medio MS (Murashige y Skoog, por sus siglas en inglés) y se incubaron a 300C durante siete días para verificar la eficiencia del método utilizado.
Determinación del porcentaje de desinfección de las semillas. En los cuatro protocolos estudiados, las semillas previamente desinfectadas se colocaron en placas de Petri con medio MS, a razón de 20 semillas por placa y cinco repeticiones por tratamiento (métodos de desinfección). Se incubaron a 300C durante 96 horas. El porcentaje de desinfección de las semillas se determinó a través del conteo de semillas sin contaminación a las 24, 48, 72 y 96 horas, siguiendo la metodología descrita (15).
Determinación del porcentaje de germinación de las semillas. Se evaluó el porcentaje de germinación para determinar si los métodos utilizados no afectaron la actividad biológica de la semilla. Para ello, las semillas previamente desinfectadas se colocaron en cámaras húmedas, formadas por placas de Petri de 100 mm de diámetro con papel de filtro Whatman ® estéril dentro, humedecido con 2mL de agua destilada estéril. Se colocaron 20 semillas por placa y cinco repeticiones por tratamiento. Las placas se incubaron a 300C. Se realizó el conteo de semillas germinadas en diferentes períodos de emergencia (24, 48, 72 y 96 horas) y se determinó el porcentaje de germinación (16).
Porcentaje de pureza de las plántulas crecidas en tubos de cultivo con medio MS. Se determinó la aparición de contaminaciones microbianas en los tubos sembrados a partir de semillas previamente desinfectadas y germinadas (mediante la aplicación del protocolo de desinfección 4) durante siete días. Se determinó el porcentaje de pureza (15).
Análisis estadísticos. Todos los experimentos se repitieron tres veces. A los datos se les determinaron los intervalos de confianza de la media para p<0.05 y el tamaño de muestra (n) correspondiente. Los datos fueron analizados mediante el programa Statistica para Windows versión 6.0.
RESULTADOS Y DISCUSIÓN
En esta investigación se estudiaron varios métodos de desinfección de semillas de arroz de la variedad J-104 basados en el empleo de diferentes soluciones de desinfección, aplicadas de forma independiente o combinadas, seleccionándose la solución de desinfección de hipoclorito de calcio como la más eficaz. El protocolo 4 donde se aplicó esta solución en dos momentos diferentes es el más eficiente para estos fines (Figura 1).
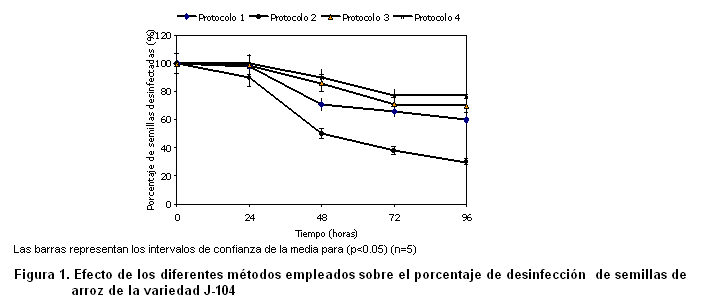
En la Figura 1 se muestra el porcentaje de semillas desinfectadas al aplicarse los diferentes protocolos de desinfección. Luego de realizarse el análisis estadístico de los datos, se encontraron diferencias significativas entre los tratamientos, lo que podría estar dado por el tipo de solución desinfectante que se utiliza, el tiempo de exposición, la cantidad y el tipo de microorganismos que se encuentran asociados o viven como endófitos en el cultivo del arroz.
En todos los bioensayos se demostró que el protocolo de desinfección aplicado logró eliminar los microorganismos presentes en la superficie de la semilla, lo que se denota por los altos grados de pureza mostrados en la fase inicial (Figura 1). Sin embargo, cuando comienza el proceso de germinación aparecen contaminantes bacterianos en el medio de cultivo, lo que indica la presencia de microorganismos endófitos, corroborándose la presencia de estos microorganismos en las semillas de arroz de la variedad J-104 y la imposibilidad de eliminarlos a través de la aplicación de estas metodologías (Figura 1). Estos resultados se corresponden con los informados en un estudio con diferentes variedades de arroz (17).
En los últimos años, las investigaciones sobre la comunidad microbiana endófita, se han centrado en especies de bacterias con capacidad para fijar nitrógeno molecular en plantas de interés agrícola, por la importancia que esto tiene en la nutrición nitrogenada de los cultivos y se han publicado numerosos trabajos relacionados con la comunidad endófita en gramíneas (18, 19, 20).
En la variedad en estudio se ha informado la presencia de microorganismos endófitos fijadores de nitrógeno, que desempeñan un papel fundamental en el desarrollo y la productividad del cultivo con la consecuente reducción de fertilizantes químicos (21). Estos microorganismos podrían estar presentes en la semilla, comenzar a liberarse como parte del efecto espermosfera (22) y constituir poblaciones microbianas que crecen como contaminantes en los medios de cultivos sintéticos utilizados para la producción de plantas por vía biotecnológica y para estudios de interacción planta-microorganismos, como es el caso del medio MS.
Se ha considerado que las bacterias endófitas podrían tener algunas ventajas competitivas sobre las rizosféricas, ya que la disponibilidad de nutrientes es mayor en el interior de las plantas y el número de microorganismos endófitos es menor que el de los rizosféricos (23). Además, las bacterias endófitas se encuentran mejor protegidas de las condiciones adversas que se presentan en el medio ambiente y de los procesos de desinfección que las rizosféricas (10, 24).
Es importante destacar que los productos desinfectantes no afectaron la actividad biológica de la semilla, lo que se demuestra a través de los altos porcentajes de germinación obtenidos (Figura 2).
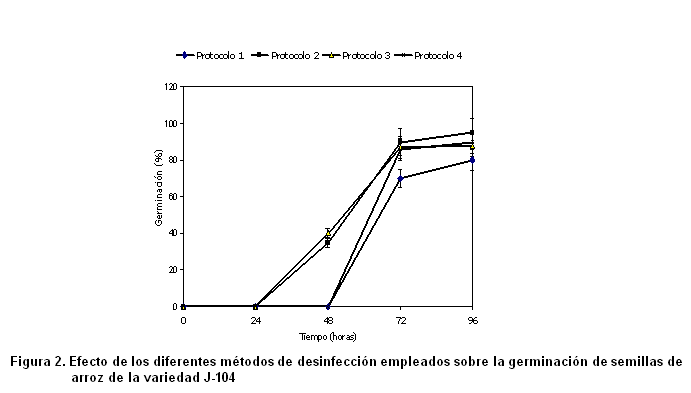
De modo general, este parámetro se incrementó a partir de las 24 horas, con su máximo a las 96 horas de incubación de las semillas, momento en que se alcanzan porcentajes de germinación superiores al 80 %. No obstante, se debe señalar que en los resultados de los protocolos de desinfección 1 y 4, se encontró retardo en la germinación de las semillas, lo que se superó después de las 48 horas. Esto podría indicar un probable efecto del hipoclorito de calcio (uno de los mejores desinfectantes conocidos, capaz de eliminar bacterias, levaduras, hongos, esporas e incluso virus) en esta fase de desarrollo del cultivo, que se pudiera relacionar con la eficiencia en la eliminación de las poblaciones epifíticas presentes en la superficie de las semillas y que probablemente desempeñan un papel fundamental en su germinación.
En este sentido, se ha señalado que el hipoclorito de calcio tiene un marcado efecto en la eliminación de bacterias, ya que a concentraciones micromolares es posible reducir significativamente las poblaciones bacterianas. Los métodos basados en su utilización se emplean para la desinfección de semillas en estudios que involucran patógenos portados en ellas, controles biológicos y endófitos (12). A pesar de esto, se conoce poco sobre el mecanismo exacto por el que el hipoclorito elimina a las bacterias (25).
Según la metodología utilizada, cuando se realiza una segunda aplicación del desinfectante seleccionado (hipoclorito de calcio) aumenta la eficiencia, lográndose disminuir significativamente las poblaciones de microorganismos endófitos. Este procedimiento es el que se realiza en el protocolo 4, cuyos resultados se muestran en la Figura 3.
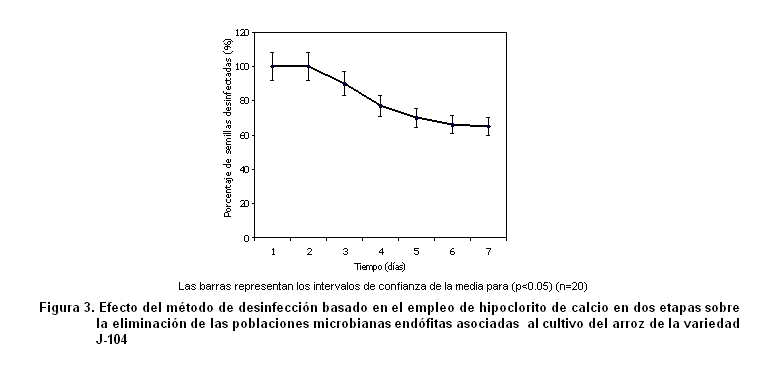
En este trabajo se han empleado diferentes soluciones para la desinfección de las semillas de arroz, ensayadas solas y combinando unas con otras. Otros también han utilizado el hipoclorito de calcio y la cloramina T para estos fines (11, 12, 13). Sin embargo, en ninguno de estos trabajos se ha logrado eliminar completamente las poblaciones de microorganismos presentes en la semilla, obteniéndose resultados similares en todos los protocolos de desinfección estudiados.
Existen otras metodologías que se utilizan para la desinfección de semillas, basadas en el uso de antibióticos como el ácido nalidíxico y la rifampicina. Sin embargo, es mejor tratar las semillas con desinfectantes para evitar daños a la planta y a los microorganismos que sean inoculados, dados por la aparición de posibles variaciones genéticas en la planta y en las poblaciones microbianas que se encuentran asociadas a ellas, las que podrían ser potencialmente eficientes en la estimulación del crecimiento vegetal y biocontrol de patógenos que afectan al cultivo (10, 26, 27).
Con esta investigación se logra una nueva metodología para la obtención de plantas de arroz en condiciones axénicas, que puede ser utilizada en la biotecnología agrícola, con énfasis en estudios de interacción planta-microorganismos. La aplicación de esta metodología logra eliminar la totalidad de los microorganismos que viven en la superficie de la semilla y un alto porcentaje de los endófitos, y con ello reducir el error experimental.
REFERENCIAS
1. Arregocés, O.; Rosero, M. y González, J. Guía de estudio: Morfología de la planta de arroz. Cali:Centro Internacional de Agricultura Tropical, 2005.
2. Polo, V. M. El arroz y sus leyendas. Consultado [1-10-2008]. Disponible en: <http://saludparalavida.sld.cu>.
3. Postma, J.; Montanari, M. y van den Boogert, P. H. J. F. Microbial enrichment to enhance the disease suppressive activity of compost. Eur. J. Soil Biol., 2003, vol. 39, p. 157-163.
4. Welbaum, G.; Sturz, A. V.; Dong, Z. y Nowak, J. Fertilizing soil microorganisms to improve productivity of agroecosystems. Crit. Rev. Plant Sci., 2004, vol. 23, p. 175-193.
5. Velazco, A. Utilización de Azospirillum brasilense en el cultivo del arroz (Oryza sativa) sobre un suelo Hidromórfico Gley de la provincia de Pinar del Rio. [Tesis de Grado]; INCA, 2001. 128 p.
6. Thakuria, D.; Talukdar, N. C.; Goswami1, C.; Hazarika, S.; Boro, R. C. y Khan, M. R. Characterization and screening of bacteria from rhizosphere of rice grown in acidic soils of Assam. Current Science, 2004, vol. 86, no. 7, p. 978-985.
7. Elbeltagy, A.; Nishioka, K.; Sato, T.; Suzuki, H.; Ye, B.; Hamada, T.; Isawa, T.; Mitsui H. y Minamisawa, K. Endophytic colonization and plant nitrogen fixation by a Herbaspirillum sp. isolated from wild rice species. Appl. Environ. Microbiol., 2001, vol. 67, p. 5285-5293.
8. Radwan, T.; Mohamed, Z. K. y Reis, V. M. Efeito da inoculação de Azospirillum e Herbaspirillum na produção de compostos indólicos em plântulas de milho e arroz. Pesq. Agropec. Bras., Brasília, 2004, vol. 39, p. 987-994.
9. Hernández, A.; Rives, N. y Heydrich, M. Caracterización de la comunidad microbiana y endófita asociada al cultivo del arroz variedad J-104. En: Congreso Científico del INCA (14: 2004, nov 9-12, La Habana). Memorias. CD-ROM. Instituto Nacional de Ciencias Agrícolas.
10. Rives, R. N.; Acebo, G. Y. y Hernández, A. R. Bacterias promotoras del crecimiento vegetal en el cultivo del arroz (Oryza sativa L.). Perspectivas de su uso en Cuba. Cultivos Tropicales, 2007, vol. 28, no. 2, p. 29-38.
11. Barraquio, W. L.; Revilla, L. y Ladha, J. K. Isolation of endophytic diazotrophic bacteria from wetland rice. Plant and Soil, 1997, vol. 194, no. 2-3, p. 15-24.
12. Chun, R.; Schneider, W. y Cohn, M. A. Sodium hypochlorite:Effect of solution pH on rice seed disinfestation and its direct on seedling growth. Plant Disease, 1997, vol. 81, p. 7-11.
13. Miché, L. y Balandreau, J. Effects of rice seed surface sterilization with hypochlorite on inoculated Burkholderia vietnamiensis, Lyon:Universite Claude Bernard, 2001.
14. Hernández, A.; Heydrich, M.; Acebo, Y.; Velázquez, M. G. y Hernández, A. N. Antagonistic activity of Cuban native rhizobacteria against Fusarium verticillioides (Sacc.) Nirenb. in maize (Zea mays L.). Appl. Soil Ecol., 2008, vol. 36, p. 184-186.
15. Velázquez, M., Hernández A., Heydrich, M. y Hernández, A. N. Estudio de la interacción maíz-Burkholderia cepacia. Revista Latinoamericana de Microbiología, 1999, vol. 41, p. 17-23.
16. Hernandez, A. Biological and chromatographic characterization of RIZOBAC® in rice. Informe final de proyecto de colaboracion. 2006, 32 p.
17. Baldani, V. L. D.; Alvarez, M. A.; Baldani, J. I. y Döbereiner, J. Inoculation of rice plants with the endophytic diazotrophs Herbaspirillum seropedicae and Burkholderia spp. Biology and Fertility of Soils, 2000, vol. 30, p. 485-491.
18. Boddey, R. M.; Urquiaga, S.; Alves, B. J. R. y Reis, V. Endophytic nitrogen fixation in sugarcane: present knowledge and future applications. Plant Soil, 2003, vol. 252, p. 139-149.
19. Velásquez, E.; Rojas, M.; Lorite, M. J.; Rivas, R.; Zurdo-Piñeiro, J. L.; Heydrich, M. y Bedmar, E. J. Genetic diversity of endophytic bacteria which could be found in the apoplastic sap of the medullary parenchym of the stem of healthy sugarcane plants. Journal of Basic Microbiology, 2008.
20. Muñiz, O.; Castro, R.; Biart, M. y Urquiaga, S. Contribución de los microorganismos nativos del suelo a la nutrición nitrogenada de seis variedades de arroz irrigado. En: Congreso Internacional del Arroz, Memorias [CD-ROM]. Instituto de Investigaciones del Arroz (3:2005:La Habana), 2005.
21. Hernández, A. N.; Hernández, A. y Heydrich, M. Selección de rizobacterias asociadas al cultivo del maíz. Cultivos Tropicales, 1995, vol. 16, no. 3, p. 5-8.
22. James, E. K.; Gyaneshwar, P.; Mathan, N.; Barraquio, W. L.; Pallavolu, M. R.; Ianetta, P. P.; Olivares, F. L. y Ladha, J. K. Infection and colonization of rice seedlings by the plant growth-promoting bacterium Herbaspirillum seropedicae Z67. Molecular Plant-Microbe Interactions, 2002, vol. 15, no. 9, p. 894-906.
23. Reinold-Hurek, B. y Hurek, T. Life in grasses: diazotrophic endophytes. Trends Microbiol., 1998, vol. 6, p. 139-144.
24. Nakagawara, S.; Goto, T.; Ozara, M.; Hotta, K. y Arata, Y. Spectroscopic characterization and the pH dependence on bactericidal activity of the aqueous chlorine solution. Anal. Sci. 1998, vol. 14, p. 691-698.
25. Vessey, J. K. Plant growth promoting rhizobacteria as biofertilizers. Plant and Soil, 2003, vol. 255, p. 571-586.
26. Hernández, A.; Diallo, B.; El Jaziri, M. y Heydrich, M. Extract from Burkholderia cepacia improves germination rate and plant growth in rice (Oryza sativa) and maize (Zea maize). Informe final de proyecto de colaboración. 2007, 30 p.
Recibido: 11 de julio de 2008
Aceptado: 1 de diciembre de 2008













