Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.34 no.1 La Habana ene.-mar. 2013
Indicadores bioquímicos para la selección temprana de genotipos de arroz (Oryza sativa L.) con tolerancia a la salinidad
Biochemical indicators for the early selection of genotypes of rice (Oryza sativa L.) to salt tolerance
Alexis Lamz PiedraI y Yanelis Reyes GuerreroI, Dra.C. María C. González CeperoII
IReservas Científicas del departamento de Fisiología y Bioquímica Vegetal.
IIInvestigador Titular del departamento de Genética y Mejoramiento Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, La Habana, Cuba, CP 32 700.
RESUMEN
El presente trabajo tuvo como objetivo identificar indicadores bioquímicos relacionados con la tolerancia a la salinidad en estadios tempranos de desarrollo de genotipos de arroz (Oryza sativa L.). Se analizaron muestras foliares de dos variedades con diferente grado de tolerancia a la salinidad (Pokkali y Amistad-82), cultivadas en condiciones semicontroladas, utilizando soluciones nutritivas simuladoras del estrés salino por la adición de NaCl hasta obtener conductividades eléctricas (CE) de 8 y 12 dS.m-1. A los 35 días después de la siembra, se evaluó la actividad de la enzima peroxidasa, los contenidos de proteínas totales y prolina así como la peroxidación de lípidos. Los resultados evidencian un comportamiento diferencial de las variedades en cuanto a su grado de tolerancia a la salinidad en la CE de 12 dS.m-1 lo cual permite usar algunas de las variables evaluadas, para la discriminación de genotipos de arroz tolerantes a condiciones de salinidad.
Palabras clave: estrés salino, malondialdehído, estrés oxidativo, prolina, arroz.
ABSTRACT
The present study aimed to perform biochemical studies to search possible indicators for differentiation in the early development stages of rice varieties, in relation to their degree of tolerance to saline stress. Leaf samples of two varieties with different degrees of tolerance to salinity (Pokkali and Amistad-82) and grew up in greenhouses growing in nutrient solutions simulating the salt stress (8 and 12 dS.m-1), were analyzed. At 35 days after planting, it was assessed the activity of the enzyme peroxidase, total protein content, proline and lipid peroxidation. The results showed a differential behavior of the varieties in their degree of tolerance when using the EC 12 dS.m-1 which allows using the activity of the enzyme peroxidase, proline concentration and lipid peroxidation in the discrimination of rice genotypes tolerant to salinity.
Key words: salt stress, malondialdehide, oxidative stress, proline, rice.
INTRODUCCIÓN
La salinidad de los suelos es uno de los problemas que más afecta la productividad de los cultivos a nivel mundial (1), por lo que encaminar esfuerzos a la solución de esta problemática se revertirá en la utilización y rescate de áreas subutilizadas, así como una mayor producción de alimentos (2).
En los programas de mejoramiento genético para la tolerancia al estrés medioambiental, resulta de vital importancia el establecimiento de marcadores que permitan incrementar la eficiencia en la selección temprana de genotipos con mayor tolerancia a dichos factores abióticos (3).
Por ello, ha sido objeto de estudio la variación tanto de sistemas isoenzimáticos así como de la actividad de algunas enzimas, porque en alguna medida se conocen las bases bioquímicas de la tolerancia y cuáles de estas pudieran constituir mecanismos adaptativos que se inducen en las plantas y que a su vez, presenten una estrecha vinculación con el estrés (4). El estudio de indicadores fisiológicos y bioquímicos pudiera proporcionar mayor eficiencia en la selección de materiales tolerantes a la salinidad (5). Esos resultados, constituirían una base importante para profundizar en el estudio de los mecanismos fisiológicos y bioquímicos involucrados en la tolerancia a la salinidad.
En Cuba, se han obtenido resultados en la liberación de genotipos de arroz tolerantes a la salinidad como son IACuba 25 e INCA LP-7 (2, 6) pero la selección en condiciones de campo es muy difícil por la gran variabilidad en la distribución de sales en los suelos, lo que demora el tiempo de obtención de nuevos genotipos, por lo que la búsqueda de indicadores que permitan la selección temprana de genotipos tolerantes, permitiría acotar el tiempo para incorporar nuevas variedades a la producción arrocera nacional. El presente trabajo tuvo como objetivo realizar estudios bioquímicos para la búsqueda de indicadores, que puedan ser útiles en la selección temprana de genotipos de arroz, con adecuado comportamiento ante el estrés salino.
MATERIALES Y MÉTODOS
En el estudio fueron utilizadas semillas de dos variedades de arroz con diferentes respuestas a la salinidad: Pokkali; testigo internacional tolerante a la salinidad (7) y Amistad 82 (A-82) testigo susceptible a la salinidad (8), de las cuales tres semillas pregerminadas se trasplantaron en recipientes plásticos (200 mL) que contenían suelo Hidromórfico Gley Nodular Ferruginoso (9) y fueron colocadas en cajas que contenían agua destilada. El experimento se condujo en condiciones de invernadero.
A los15 días después del trasplante (DDT), se les indujo el estrés salino mediante la aplicación de solución nutritiva Murashige y Skoog al 50 % ( MS ½) (10) ajustadas a conductividad eléctrica (CE) de 8 y 12 dS.m-1 obtenidas por la adición de NaCl y un control con solución nutritiva MS ½. A los 15 días se tomaron tres muestras de 0.25 g procedentes de la cuarta hoja de seis plantas de cada genotipo para la determinación de la peroxidación lipídica por el método del ácido tiobarbitúrico (11), la actividad de la enzima peroxidasa (POX) según (12), la concentración de proteína totales solubles (PTS) por el método de Bradford (13) y la determinación del contenido de prolina se realizó según Bates et al. (14).
Se realizaron tres repeticiones de cada determinación en un diseño completamente aleatorizado y los datos se procesaron mediante análisis de varianza simple, utilizando el paquete estadístico SPSS versión 11.5. Las diferencias significativas entre tratamientos se verificaron por la prueba de rango múltiple de Duncan (15).
RESULTADOS Y DISCUSIÓN
Se observó disminución en la acumulación de masa seca del área foliar (MSAF) con el aumento de la conductividad eléctrica (CE) en las soluciones nutritivas (Figura 1). Sin embargo, una mayor reducción se evidenció en la variedad susceptible (A-82) que manifestó una marcada reducción de la MSAF, mostrando diferencias significativas respecto al control desde la CE de 8 dS.m-1, la que siguió disminuyendo en la CE de 12 dS.m-1. Se evidenció como la variedad Pokkali, no mostró diferencias significativas entre el control y la CE de 8 dS.m-1, mientras que a 12 dS.m-1 la disminución de la MSAF de esta variedad, fue significativa respecto al control.
Estas reducciones en la producción de biomasa de las plantas en condiciones salinas, a menudo se atribuyen a los daños en el aparato fotosintético, así como en la fijación de CO2. Al respecto, Moradi e Ismail (1) reportaron que la tasa neta fotosintética, medida en términos de asimilación de CO2 de la hoja más joven totalmente extendida de tres variedades de arroz, disminuyó con el aumento del estrés salino.
Las reducciones en la acumulación de biomasa están relacionadas con el comportamiento de algunos parámetros del crecimiento vegetal. Varios autores han referido la disminución de algunos de estos parámetros del crecimiento vegetal en condiciones de estrés medioambiental (5, 16, 17). Al respecto, Duan et al. (18) sostienen que tanto el estrés hídrico, como la acumulación de iones provocado por el estrés salino, retrasan los procesos de división y diferenciación celular.
Este comportamiento de la variedad A-82 coincide con lo reportado por otros autores que encontraron similar comportamiento de esta variedad ante el estrés salino impuesto (8). Además, la disminución de la acumulación de biomasa en las plantas, de forma general, en condiciones salinas ha sido ampliamente fundamentada (19, 20). En este sentido, en el cultivo del arroz, en un estudio realizado con variedades contrastantes en su grado de tolerancia a la salinidad, se encontró que la variedad susceptible mostró una mayor reducción de su biomasa que las tolerantes (1).
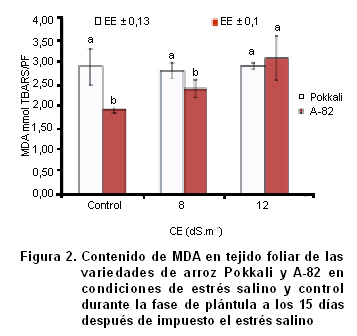
Peroxidación de lípidos
Al analizar la peroxidación lipídica (Figura 2) se pudo constatar cómo la variedad Pokkali no mostró diferencias significativas en las variaciones de la concentración de malondialdehído (MDA) en tejido foliar a medida que aumentó la concentración de NaCl en el medio de crecimiento, por lo que se puede asumir que la magnitud de peroxidación de lípidos en esta variedad se mantuvo estable en estas condiciones de estrés. Sin embargo, la variedad A-82 mostró diferencias significativas en la CE de 12 dS.m-1 respecto al control, observándose una mayor producción de MDA y por consiguiente, mayor daño por peroxidación lipídica.
La concentración de MDA foliar en genotipos contrastantes de Cenchrus ciliaris L. (21) y papa (22) se ha sugerido como un indicador potencial para la evaluación de la tolerancia al estrés salino. Teniendo en cuenta la CE de 12 dS.m-1 este indicador en el cultivo del arroz muestra un comportamiento que se corresponde con el carácter tolerante de la variedad Pokkali ante el estrés salino y el carácter susceptible de la variedad A-82. Estos resultados coinciden con los reportados por Li. (23) en tomate, Koca et al. (24) en sésamo y Arslan et al. (25) en trigo, quiénes reportaron que los cultivares tolerantes acumularon menor contenido de MDA que los susceptibles en altos niveles de salinidad.
Los resultados en la variedad Pokkali demuestran que esta posee un eficiente sistema de detoxificación de radicales libres (enzimático y no enzimático) por lo que el daño en los lípidos de la membrana provocados por el estrés oxidativo, es minimizado por dicho sistema.
Los resultados muestran que el análisis de la peroxidación de lípidos en la CE de 12 dS.m-1, permite discriminar genotipos de arroz que difieren en su grado de tolerancia a la salinidad.
Actividad de la enzima peroxidasa
En el análisis de la actividad de la enzima peroxidasa (POX) (Figura 3), en ambas variedades no se observaron diferencias significativas en la CE de 8 dS.m-1 respecto al control. Sin embargo, la variedad Pokkali manifestó una ligera disminución de la actividad enzimática en la CE de 12 dS.m-1, mientras que A-82, en la CE de 12 dS.m-1 manifestó un aumento significativo de la actividad POX.
El aumento de la actividad POX en la variedad A-82, puede estar asociado al aumento del daño oxidativo provocado por el estrés salino, lo que se puede corroborar al observar la producción de MDA en la CE de 12 dS.m-1 (Figura 2), siendo en esta CE donde hubo una mayor actividad POX para esta variedad.
El daño oxidativo en condiciones de estrés salino, así como en otros factores estresantes, ha sido objeto de estudio por disímiles investigadores (26, 27). Este daño oxidativo, es provocado por la producción de radicales libres de oxígeno o especies reactivas de oxígeno como también se les llama (ROS, del Ingles Reactive Oxygen Species), entre las que se puede mencionar O2- , H2O2 y OH-. Las ROS son altamente reactivas y pueden alterar el metabolismo celular, provocando daño oxidativo en lípidos de las membranas, proteínas y ácidos nucleícos (28, 29, 30).
Para prevenir el daño en los componentes celulares producido por las ROS, las plantas han desarrollado un complejo sistema de antioxidantes (enzimático y no enzimático). A menudo, se asocian los daños oxidativos en los componentes celulares, a una mayor actividad de los sistemas de desintoxicación de ROS (31, 32).
Varios autores sugieren el aumento de la actividad de la enzima POX y de otras enzimas involucradas en la eliminación de ROS en condiciones salinas para cultivares tolerantes al estrés salino, en una gran gama de cultivos, incluyendo el arroz (33, 34, 35, 36) atribuyéndole a estos aumentos una mayor protección ante el estrés oxidativo (37, 38).
En este sentido, en algunos estudios, utilizando la variedad Pokkali como testigo tolerante al estrés salino (39), se informaron respuestas similares a las encontradas en este trabajo, lo que puede estar asociado a su carácter tolerante al estrés salino, no manifestando daño oxidativo intenso al aumentar la CE del medio de crecimiento por lo que no le es necesario que la misma aumente la actividad POX ya que con los valores constitutivos pueden remediar el daño oxidativo ocasionado.
Por otra parte, el aumento en la variedad A-82 en CE de 12 dS.m-1, no precisamente tiene que estar asociada a la tolerancia al estrés salino. En este sentido, algunos autores sugirieron, que un aumento en la actividad de enzimas antioxidantes podría ser indicativo del aumento en la producción de especies reactivas de oxigeno (36), lo que provocaría daños irremediables en algunas estructuras celulares, debido a que el aumento en la actividad enzimática no remedia los altos niveles de ROS producidos.
No obstante, teniendo en cuenta que las variaciones de la actividad POX se producen a tal efecto en la CE de 12 dS.m-1, este pudiera utilizarse como un indicador para la selección de genotipos de arroz tolerantes al estrés salino.
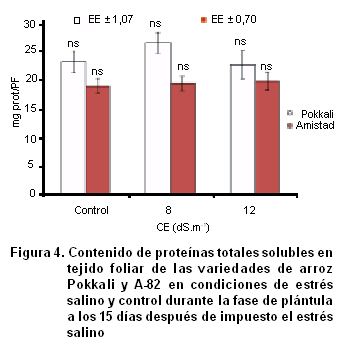
Contenido de proteínas totales (PT)
En el análisis de las proteínas totales (Figura 4) se pudo apreciar que no hubo variaciones con el aumento de la CE en las variedades estudiadas. Resultados similares han sido reportados por (40) en callos de Stylosanthes guianensis, los que detectaron un comportamiento homogéneo en el contenido de proteínas totales para las diferentes variantes de salinidad y explantes empleados. Este resultado en las variedades Pokkali y A-82 pudiera deberse a los cambios en los procesos a nivel celular. En este sentido se plantea que mientras determinados procesos que implican una síntesis activa de proteínas (como la división celular) son afectados total o parcialmente por el estrés osmótico debido a la presencia de sales en el medio de crecimiento, otro grupo importante de proteínas podrían ser sobre-expresadas (41). Entre estas se encuentran las enzimas antioxidantes como mecanismo para eliminar los radicales libres de oxígeno, cuyos niveles aumentan por lo general, bajo el efecto del estrés salino (36, 41), así como enzimas ATPasas, transportadores proteicos de iones y acuaporinas para mantener la homeostasis iónica intracelular (42).
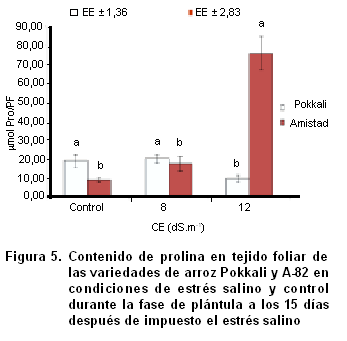
Contenido de prolina
El contenido de prolina no mostró en ninguna de las variedades diferencias significativas para CE de 8 dS.m-1 respecto al control (Figura 5), aunque con el aumento de la CE la variedad A-82 mostró una tendencia al aumento en los niveles acumulados de este aminoácido que en CE de 12 dS.m-1 alcanza niveles altamente significativos.
Por su parte, la variedad Pokkali mostró una ligera disminución en la CE de 12 dS.m-1, siendo en esta CE donde se observaron cambios significativos de los niveles de prolina para ambas variedades ante el estrés salino impuesto respecto a su control correspondiente.
El aumento del contenido de prolina en tejido foliar, así como radical, de cultivares de arroz expuestos a condiciones salinas ha sido ampliamente fundamentado, convirtiéndose esto en un rasgo distintivo en la mayoría de las plantas, planteándose además, que juega un papel importante en los mecanismos de ajuste osmótico o el uso eficiente del agua y como compuesto antioxidante no enzimático (43, 44).
En el presente estudio, una mayor acumulación de prolina se detectó en los tejidos foliares de la variedad susceptible A-82 en la CE de 12 dS.m-1, lo cual pudo estar dado por la mayor necesidad de ajuste osmótico ante el estrés salino para garantizar la toma de agua en estas condiciones.
Estos resultados, concuerdan con lo planteado por algunos autores, quiénes detectaron una mayor acumulación de prolina en el cultivar IR29, sensible a la salinidad (1) y por otros que detectaron mayor incremento de los niveles de prolina en cultivares sensibles de frijol común (45). Moradi e Ismail (1) sostuvieron que el incremento en la concentración de prolina no pudo ser asociado con la tolerancia a la salinidad en cultivares de arroz contrastantes en su grado de tolerancia a la salinidad. Elevados niveles de prolina puede también conferir regulación adicional bajo estrés salino, tal como su papel en el control de transportadores involucrados en el ajuste osmótico celular de la membrana plasmática en raíces de cebada (46).
Existen evidencias de una mayor acumulación del contenido de prolina en cultivares de arroz tolerantes a la salinidad respecto a cultivares sensibles (43, 47); así también, como respuesta para mantener la turgencia celular en cultivares de trigo (48); sin embargo, en el presente estudio los resultados no concuerdan con lo anteriormente señalado.
Otra posible explicación de la mayor acumulación de prolina en A-82 pudiera estar dado por el hecho de que la acumulación de este aminoácido no solo es provocada por la activación de la biosíntesis, sino también por la inactivación de la degradación, lo que resulta en una disminución en el nivel de acumulación de prolina en plantas rehidratadas (49).
No obstante, repuestas diferentes pueden ser observadas por los diferentes cultivares de arroz en cuanto a la acumulación de prolina en condiciones de estrés salino teniendo en cuenta la CE de 12 dS.m-1. Dado el hecho de que la biosíntesis de prolina es un proceso altamente demandante de energía y que se requieren cantidades pequeñas de prolina probablemente para el control de transportadores de la membrana plasmática (32), la sobreproducción de prolina en A-82 más bien puede ser interpretada como un mayor daño ante el estrés salino.
Estos resultados evidencian una respuesta diferencial ante el estrés salino impuesto entre las variedades Pokkali y A-82, si se tiene en cuenta la CE de 12 dS.m-1 y los indicadores evaluados, peroxidación lipídica, evaluada mediante la concentración de malondialdehído, actividad de la enzima peroxidasa y acumulación de prolina, lo que permite usar estas variables para la discriminación de genotipos de arroz tolerantes a la salinidad en edades tempranas de crecimiento y desarrollo.
REFERENCIAS
1. Moradi, F. e Ismail, A. M. Responses of photosynthesis, chlorophyll fluorescence and ROS-scavenging systems to salt stress during seedling and reproductive stages in rice. Annals of Botany, 2007, vol. 99, p. 1161-1173.
2. González, L. M.; González, M. C. y Ramírez, R. Aspectos generales sobre la tolerancia a la salinidad en las plantas cultivadas. Cultivos Tropicales, 2002, vol. 23, no. 2, p. 27-37.
3. García, A.; Florido, M. y Lara, R. M. Estudios bioquímicos para la selección in vitro de variedades de arroz con tolerancia a estrés hídrico. Biotecnología Vegetal, 2003, vol. 3, no. 3, p. 181-186.
4. Weng, J. H. Genetic variation of Zoysia in Taiwan as analyzed by isoenzyme patterns and salinity tolerance. Plant Production Sciencevol, 2002, vol. 5, no. 3, p. 236-241.
5. Argentel, L.; López, R. D.; González, L. M. /et al./. Evaluación de la tolerancia a la salinidad en estadios tempranos y finales del desarrollo en triticales (X Triticum secale). Cultivos Tropicales, 2010, vol. 31, no. 1, p. 48-53.
6. Orellana, P. y Peña, P. L. Caracterización in vitro de la respuesta al NaCl en callos en las fases de multiplicación y regeneración de varios genotipos de arroz. Biotecnología Vegetal, 2003, vol. 3, no. 1, p. 13-18.
7. Kumar, S.; Titov, S.; Mofazzal, M.; Siddika, A.; Sultana, A. y Shahidul, M. D. Phenotypic and genotypic screening of rice genotypes at seedling stage for salt tolerance. African Journal of Biotechnology, 2009, vol. 8, no. 23, p. 6490-6494.
8. Cristo, E.; González, M. C.; Cárdenas, R. M. y Pérez, N. Evaluación de la tolerancia a la salinidad en el estado juvenil de tres nuevas líneas de arroz (Oryza sativa L.) utilizando marcadores morfoagronómicos. Cultivos Tropicales, 2001, vol. 22, no. 2, p. 43-45.
9. Cuba. Minagri. Instituto de Suelos. Nueva Versión de Clasificación Genética de los Suelos de Cuba. Instituto de Suelos de Cuba. 1999, 64 p.
10. Murashige, T. y Skoog, F. A revised medium for rapid growth and bioassay with tobacco tissue culture. Plant Physiol., 1962, p. 473-479.
11. Hodges, M. D.; DeLong, J. M.; Forney, C. F. /et al./. Improving the thiobarbituric acid-reactive-substances assay for lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 1999, vol. 207, p. 604-611.
12. Bergmeyer, H. U. Peroxidase En: Bergemyer HU (Eds). 1974. Methods of enzymatic analyses. Academic Press Inc. New York and London, p. 685-690.
13. Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., 1976, vol. 72, p. 248-254.
14. Bates, L. S.; Waldren, R. P. y Teare, I. D. Rapid determination of free proline for water-stress studies. Plant Soil, 1973, vol. 39, p. 205-207.
15. Duncan, D. B. A significance test for differences between ranked treatments in analysis of variance. Virginia J. Sci., 1951, vol. 2, p. 171-189.
16. Mostajeran, A. y Rahimi-Eichi, V. Effects of Drought Stress on Growth and Yield of Rice (Oryza sativa L.) Cultivars and Accumulation of Proline and Soluble Sugars in Sheath and Blades of Their Different Ages Leaves. American-Eurasian J. Agric. & Environ. Sci., 2009, vol. 5, no. 2, p. 264-272.
17. Reyes, Y.; Mazorra, L. M.; Martínez, L. y Núñez, M. Efecto del análogo de brasinoesteroides (Biobras-16) en la germinación y el crecimiento inicial de las plantas de dos variedades de tomate en condiciones de estrés salino. Cultivos Tropicales, 2010, vol. 31, no. 3, p. 82-88.
18. Duan, D. Y.; Li, W. Q.; Liu, X. J.; Ouyang, H. y An, P. Seed germination and seedling growth of Suaeda salsa under salt stress. Ann. Bot. Fennici., 2007, vol. 44, no. 3. p. 161-169.
19. Jamil, M.; Lee, K. B.; Jung, K.; Lee, D.; Han M. y Rha, E. Salt stress inhibits gemination and early seedling growth in cabage (Brassica oleracea capitata L.) Pakistan Journal of Biological Sciences, 2007, vol. 10, no. 6, p. 910-914.
20. Reyes, Y.; Martínez, L.; Rosabal, L.; Mazorra, L. M.; Pieters, A. y Núñez, M. Efecto de la 24-epibrasinólida en el crecimiento, los niveles de prolina y de malondialdehido de plántulas de arroz (Oryza sativa L.) sometidas a estrés salino. Cultivos Tropicales, 2012, vol. 33, no. 1, p. 19-27.
21. Lanza, S.; Grunberg, K. / et al./. Oxidative damage and antioxidant defenses as potential indicators of salt-tolerant Cenchrus ciliaris L. genotypes. Flora - Morphology, Distribution, Functional Ecology of Plants, 2010, vol. 250, no. 9, p. 622-626.
22. Daneshmand, F.; Javad, M. y Manouchehri, K. Physiological responses to NaCl stress in three wild species of potato in vitro. Acta Physiol. Plant, 2010, vol. 32, p. 91-101.
23. Li, Y. Physiological responses of tomato seedlings (Lycopersicon esculentum) to salt stress. Modern Appl. Sci., 2009, vol. 3, p. 171-176.
24. Koca, H.; Bor, M.; Özdemir, F. y Türkan, I. The effect of salt stress on lipid peroxidation, antioxidative enzymes and proline content of sesame cultivars. Env. Exp. Bot., 2007, vol. 60, p: 344-351.
25. Arslan, M.; Arslan, M. y Ali, Q. Response of two genetically diverse wheat cultivars to salt stress at different growth stages: leaf lipid peroxidation and phenolic contents. Pak. J. Bot., 2010, vol. 42, no. 1, p. 559-565.
26. Zhu, J.; Alvarez, S.; Marsh, E. L.; LeNoble, M. E.; Cho; I. J.; Sivaguru, M.; Chen, S.; Nguyen, H. T.; Wu, Y.; Schachtman, D. P. /et al./. Cell wall proteome in the maize primary root elongation zone. II. Region-specific changes in water soluble and lightly ionically bound proteins under water deficit. Plant Physiol, 2007, vol. 145, p. 1533-1548.
27. Van, F.; Bailey-Serres, J. y Mittler, R.; Unraveling the Tapestry of Networks Involving Reactive Oxygen Species in Plants. Plant Physiol., 2008, vol. 147, p. 978-984.
28. Ben-Amor, N.; Jimenez, A.; Megdiche, W.; Lundqvist, M.; Sevilla, F.; y Abdelly, K. Kinetics of the anti-oxidant response to salinity in the halophyte Cakile maritime. J. intergr. Plnat Biol., 2007, vol. 49, p. 982-992.
29. Eyidogan, F; y Oz, M. T. Effect of salinity on antioxidant responses of chickpea seedlings. Acta Physiol. Plant, 2007, vol. 29, p. 485-493.
30. Joseph, B. y Jini, D. Development of salt stress- tolerant plants by gene manipulation of antioxidant enzymes. Asian Jornal of Agricultural Reseach, 2011, vol. 5, no. 1, p. 17-27.
31. Sekmen, A. H.; Turkana, I.; y Takiob, S. Differential responses of antioxidative enzymes and lipid peroxidation to salt stress in salt- tolerant Plantago maritime and salt sensitive Plantago media. Plant Physiol., 2007, vol. 131, p. 399-411.
32. Desingh, R. y Kanagaraj, G. Influence of salinity stress on photosynthesis and antioxidative systems in two cotton varieties. Gen. Appl. Plant Physiol, 2007, vol. 33, p. 221-234.
33. Meloni, D. A.; Oliva, M. A.; Martinez, C. A. y Cambraia, J. Photosynthesis and activity of superoxide dismutase peroxidase and glutathione reductase in cotton under salt stress. Environ. Exp. Bot., 2003, vol. 49, p. 69-76.
34. Meloni, D. A.; Gulotta, M. R. y Oliva Cano, M. A. El estrés salino incrementa la actividad de enzimas antioxidantes y la concentración de polifenoles en Vinal (Prosopis ruscifolia G.). Quebracho, 2008, vol. 15, p. 27-31.
35. Meratan, A. A.; Ghaffari, S. M. y Niknam, V. Effects of salinity on growth, proteins and antioxidant enzimes in three Acanthophyllum species of different ploidy levels. JUST, 2008, vol. 33, p. 1-8.
36. Dolatabadian, A. y Saleh, R. Impact of exogenous ascorbic acid on antioxidant activity and some physiological traits of common bean subjected to salinity stress. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2009, vol. 37, n. 2, p. 165-172.
37. Rahnama, H. y Ebrahimzadeh, H. Antioxidant isozymes activities in potato plants (Solanum tuberosum L.) under salt stress. Journal of Sciences, Islamic Republic of Iran, 2006, vol.17, no. 3, p. 225-230.
38. Kartashov, A. V.; Radyukina, N. L; Ivanov, Y. V.; Pashkovskii, P. P.; Shevyakova, N. I. y Kuznetsov, V. V. Role of antioxidant systems in wild plant adaptation to salt stress. Plant Physiol., 2008, vol. 55, p. 463-468
39. Dionisio-Sese, M. L. y Tobita, S. Antioxidant responses of rice seedlings to salinity stress. Plant Science, 1998, vol. 135, p. 1-9.
40. Fuentes, L.; Pérez, Y.; Domínguez, A.; Mesa, A. R. y González, S. Influences of the NaCl in biochemical indicators evaluated in callus of Stylosanthes guianensis CIAT-184. Pastos y Forrajes, 2008, vol. 31, no. 1, p. 35-46.
41. Eryilmaz, F. The relationships between salt stress and anthocyanin content in higher plants. Biotechnol. & Biotechnol. Eq., 2006, vol. 20, n. 1 p. 47-52.
42. Xiong, L. y Zhu, J. K. Molecular and genetic aspects of plant responses to osmotic stress. Plant, Cell and Environment, 2002, vol. 25, p. 131.
43. Ahmad, M. S. A., Jave, F. y Ashraf, M. Iso-osmotic effect of NaCl and PEG on growth, cations and free proline accumulation in callus tissues of two indica rice (Oryza sativa L.) genotypes. Plant Growth Regul., 2007, vol. 53, p. 53-663.
44. Cha-um, S. Thi hong, N. y Kirdmanee, C. Effect of manitol - and salt-induced iso-osmotic stress on proline accumulation, photosynthetic abilities and growth characters of rice cultivars (Oryza sativa L. Spp. Indica). Pak. J. Bot., 2010, vol. 42, n. 2, p. 927-941.
45. Alemán, S.; Domínguez, A.; Domínguez, D.; Fuentes, L.; Miranda, K.; Pérez, Y. Pernía, B.; Sosa, D.; Sosa, M. e Infante, D. Estudio anatómico y bioquímico en materiales cubanos y venezolanos de Pheseolus vulgaris L. bajo condiciones de estrés hídrico. Estudios Transdisciplinarios, 2010, vol. 2, no. 1, p. 89-99.
46. Cuin, T. A. y Shabala, S. Exogenously supplied compatible solutes rapidly ameliorate NaCl-induced potassium efflux from barley roots. Plant and Cell Physiology, 2005, vol. 46: p. 1924-1933.
47. Shereen, A.: Ansari, R. U.; Yasmin, S.; Raza, S.; Mumtaz, S.; Khan, M. A. y Mujtaba, S. M. Physiological responses of rice (Oryza sativa L.) to salt stress. Pak. J. Bot., 2007, vol. 39, p. 2527-2534.
48. Bayoumi, T. Y.; Manal, H. E. y Metwali, E. M. Application of physiological and bichemical índices as a screening for drought tolerance in wheat genotypes. African Journal of Biotechnology, 2008, vol. 7, no. 14, p. 2341-2352.
49. Ramachandra, A.; Kolluru, V. y Munusamy, V. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, vol. 161, p.1189-1202.
Recibido: 8 de noviembre de 2011
Aceptado: 27 de agosto de 2012
Alexis Lamz Piedra, Reserva Científicas del departamento de Fisiología y Bioquímica Vegetal. Email: alamz@inca.edu.cu