INTRODUCCIÓN
La soya (Glycine max [L.] Merrill) es la oleaginosa de mayor importancia a nivel mundial porque de sus granos, que constituyen la principal fuente de proteína vegetal, se obtienen diversos productos esenciales en la alimentación humana y animal 1,2. El cultivo de soya finalizó con 348 millones de toneladas en la campaña 2016-2017, constituyendo un récord histórico a nivel mundial 3. Debido a su relevancia, este cultivo se ha utilizado como modelo en investigaciones dirigidas al estudio de las respuestas de plantas hacia la aplicación de inductores biológicos. Entre estos, el quitosano y sus derivados son reconocidos bioestimulantes no microbianos 4,5) muy utilizados en la agricultura porque mejoran la germinación, el crecimiento y los rendimientos de los cultivos en condiciones normales y bajo estreses abióticos, además de emplearse en el recubrimiento de semillas y conservación de frutas y verduras 5-7. El quitosano es un copolímero de N-acetil-D-glucosamina y D-glucosamina, que se obtiene de la quitina presente en el exoesqueleto de los crustáceos, cuando se eliminan más del 80 % de los grupos acetilos de los residuos de N-acetil-D-glucosamina presentes en su precursor 6. Su papel biológico en plantas depende de sus principales características físico-químicas (masa molecular, grado de acetilación y concentración), además de la forma y momento de aplicación 6,8. La aplicación de quitosano a semillas es una de las formas más importantes en la estimulación de la germinación, el crecimiento y los rendimientos de algunos cultivos, el control de enfermedades o la activación de defensas innatas de las plantas contra patógenos, ya sea por imbibición, recubrimiento o cebado de las semillas 6,9-11. En leguminosas se han realizado estos estudios y la respuesta en la germinación y el crecimiento de las plantas ha dependido de la concentración de quitosano 12-14. En soya, sin embargo, no se conoce la influencia de la masa molecular del quitosano cuando se aplica por imbibición de las semillas en el proceso germinativo y el crecimiento temprano de las plantas, por lo que el objetivo del presente trabajo fue comparar el efecto de dos polímeros de quitosano, de mediana y baja masa molecular, en la germinación y el crecimiento vegetativo (V1) in vitro, mediante imbibición de semillas del cultivar IS-27 de soya.
MATERIALES Y MÉTODOS
Semillas del cultivar IS-27 de soya fueron desinfectadas con alcohol (75 %) e hipoclorito de sodio (25 %) por cinco minutos y se enjuagaron seis veces con agua destilada estéril antes de ser embebidas durante una hora en soluciones estériles de quitosano (100 mL) y agua destilada, como tratamiento control. Las concentraciones de quitosano probadas fueron de 10, 100 y 500 mg L-1 de los polímeros con masas moleculares de 124 kDa (Q1) y 25,3 kDa (Q2) con 85 % de desacetilación promedio. Luego, las semillas fueron colocadas en placas Petri con medio vegetal semisólido Phytoagar-agua (0,8 %) e incubadas en la oscuridad a 29 oC, durante 72 horas para su germinación. Transcurrido este tiempo, se determinó el porcentaje de germinación de las semillas (5 réplicas de 15 semillas en cada placa) y la longitud de la radícula (3 réplicas de 10 semillas cada una), antes de ser transferidas a recipientes (0,41 kg), que contenían 20 mL de solución nutritiva Hougland estéril, a razón de cuatro recipientes con 10 plantas cada uno, por tratamiento. Los recipientes fueron colocados en un cuarto de luces: fotoperiodo de 12 horas, temperatura de 25-30 oC y humedad de 60 % durante diez días (fase R1) para realizar las evaluaciones morfoagronómicas de desarrollo vegetativo de las plántulas. Las evaluaciones realizadas fueron: número de hojas trifoliadas (primer par), longitud del tallo y radical (cm), masa seca (MS) de la parte aérea (PA) y de las raíces (g) a 70 oC durante 72horas, y el área foliar (AF, cm2) con el medidor portátil AM 300, UK, a cada plántula. Además, se calculó la relación raíz-vástago (r/v)= MS raíz/MS vástago y el índice de área foliar (IAF)= AF/MS total de la planta (cm2 g-1).
En el experimento repetido dos veces, se utilizó un análisis bifactorial 3 x 2, entre los factores: concentración y compuesto de quitosano, con tres y dos niveles, respectivamente, comparado con un testigo de referencia (control de imbibición en agua). La comparación de medias se realizó con el empleo de la Prueba de Rangos Múltiples de Tukey HSD (p< 0,05) para discriminar diferencias entre las medias, en el paquete de programas Statgraphics Plus, versión 5.1.
RESULTADOS
En el proceso de germinación de semillas de soya y la longitud de la radícula no hubo interacción de los factores: concentración (10, 100 y 500 mg L-1) y masa molecular de los quitosanos (124 kDa (Q1), 25,3 kDa (Q2), ni diferencias significativas entre los niveles de cada factor por separados (Datos no mostrados).
El porcentaje de germinación que se determinó a las 72 horas de embebidas las semillas con ambos polímeros, mostró valores superiores (82 y 87 %) y diferentes respecto a las embebidas en agua (76,2 %). Los valores de longitud de la radícula alcanzados con todos los tratamientos, oscilaron entre 5,3 cm y 5,7 cm de largo.
En la respuesta morfoagronómica de las plántulas de soya, a pesar de haber interacción entre los factores estudiados en todas las variables de crecimiento evaluadas, se observó una mayor influencia de la concentración que de la masa molecular de los polímeros de quitosano (Tabla 1).
Tabla1. Efecto de la imbibición de semillas durante una hora con quitosanos (Q1 y Q2) en el crecimiento vegetativo de plántulas de soya a los diez días postratamiento
| Quitosano (mg L-1) | No. hojas | Longitud tallo (cm) | Longitud radical (cm) | Masa seca PA (g) | Masa seca radical (g) | Área foliar (cm2) |
|---|---|---|---|---|---|---|
| Control | 0,56 | 7,41 | 12,84 | 0,094 | 0,022 | 5,41 |
| Q1- 10 | 0,59 a | 10,95 b | 16,90 b | 0,086 a | 0,032 b | 5,49ab |
| Q1- 100 | 0,32 b | 9,66 c | 16,51 b | 0,075 b | 0,031 b | 5,08 ab |
| Q1- 500 | 0,40 b | 12,27 a | 22,04 ab | 0,079 ab | 0,037 a | 6,26 a |
| Q2- 10 | 0,29 b | 10,25 bc | 17,99 ab | 0,078 ab | 0,035 ab | 4,80 b |
| Q2- 100 | 0,60 a | 11,49 ab | 23,03 a | 0,080 ab | 0,038 a | 5,04 ab |
| Q2- 500 | 0,66 a | 11,16 ab | 20,40 ab | 0,084 a | 0,038 a | 5,18 ab |
| ESx | 0,06* | 0,42* | 1,79* | 0,003* | 0,001* | 0,36* |
Letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Tukey HSD
El número de hojas trifoliadas fue estimulado con 10 mg L-1 del quitosano de mayor masa (Q1) y las concentraciones 100 y 500 mg L-1 del quitosano de menor masa molar (Q2), pero solo con la concentración mayor de Q2 se obtuvieron valores superiores y diferentes de las plántulas que fueron embebidas en agua (Tabla 1).
El quitosano de mayor masa (Q1) a la concentración de 500 mg L-1 se destacó en la longitud del tallo, pero sin diferencias con el quitosano de menor masa (Q2) a las concentraciones mayores, mientras que este último quitosano, a la concentración de 100 mg L-1, fue quién incrementó la longitud radical, con diferencias significativas de 10 y 100 mg L-1 del quitosano Q1 (Tabla 1).
A pesar de estimularse la masa seca de la parte aérea con la concentración de 10 mg L-1 de Q1 y 500 mg L-1 de Q2, que tan solo se diferenciaron de la concentración de 100 mg L-1 del quitosano de mayor masa; estos no superaron a las plantas controles (semillas embebidas en agua).Contrariamente, la masa seca radical se incrementó por efecto de la imbibición de las semillas con los quitosanos, específicamente, con el quitosano Q2 a las concentraciones de 100 y 500 mg L-1además de esta última concentración de Q1 (Tabla 1).
En cuanto al área foliar sólo la concentración de 500 mg L-1 del quitosano de mayor masa estimuló esta variable, respecto a las plántulas controles (Tabla 1).
De forma general, la respuesta morfoagronómica de soya a la imbibición de semillas dependió de la concentración de los polímeros, obteniéndose los mayores incrementos con 500 mg L-1, que en algunas variables no difirió de 100 mg L-1 con ambos quitosanos.
El crecimiento de soya puede cuantificarse por la masa seca y el área foliar total de la planta, siendo esta última variable, la más relevante para cuantificar la producción por unidad de superficie 15. Por esta razón, en este trabajo, se determinaron las proporciones obtenidas con la ganancia de biomasa seca y el índice de área foliar (IAF) de las plántulas, causadas por la interacción entre las concentraciones y los compuestos de quitosano (Figuras 1 y 2).
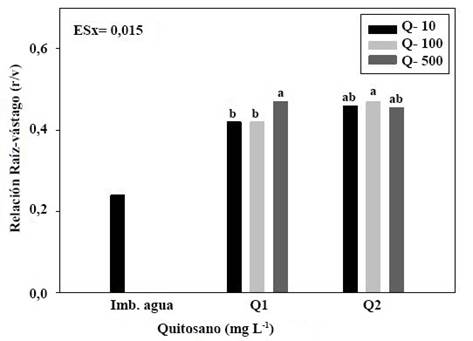 Letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Tukey HSD
Letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Tukey HSDFigura 1 Relación raíz -vástago (r/v) de plántulas de soya a los diez días de la imbibición de semillas con quitosanos de diferente masa molecular (Q1 y Q2)
En la Figura 1 se observa un incremento en la proporción de la biomasa de las plántulas (raíces y vástago) por efecto de la aplicación de ambos polímeros de quitosano, que duplica el valor obtenido en las plantas controles provenientes de semillas embebidas en agua. Las concentraciones de 500 mg L-1 del polímero de mayor masa molecular (Q1) y 100 mg L-1 de Q2, fueron más efectivas para aumentar la relación (r/v) respecto al efecto causado por las concentraciones de 10 y 100 mg L-1 de Q1.
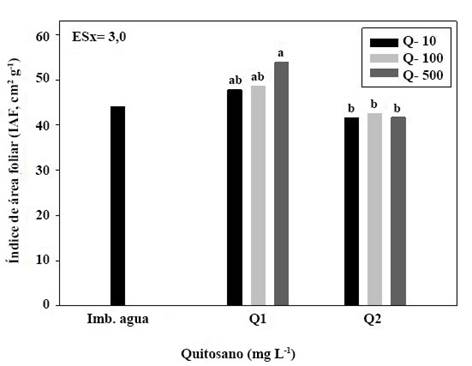 Letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Tukey HSD
Letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Tukey HSDFigura 2 Índice de área foliar (IAF) de las plántulas de soya a los diez días de la imbibición de semillas con quitosanos de diferente masa molecular (Q1 y Q2)
El índice de área foliar (IAF) de soya se incrementó con el quitosano de mayor masa molecular (Q1), con incrementos de diez porciento más con la concentración de 500 mg L-1al aplicarse por imbibición de semillas (Figura 2).
DISCUSIÓN
Resultados de investigaciones con quitosano como estimulador del crecimiento de varias especies de plantas y condiciones de cultivo, refieren la influencia de la masa molecular y la concentración de quitosano en el desarrollo de las plantas 6,8,9,16. El efecto de la masa molecular y la forma de aplicación del quitosano ha sido demostrado en la estimulación del crecimiento de arroz (Oryza sativa L.) y del rendimiento de flores y cormos de fresa (Fragaria sp.)17,18. En soya, la respuesta en la nodulación y el crecimiento de las plantas ha sido afectada por la influencia de la concentración, la masa molecular y el modo de aplicación de los compuestos de quitosano 17,19,20.
Aunque en leguminosas se han encontrado efectos beneficiosos en su desarrollo con la aplicación de quitosano por diferentes métodos de tratamiento a las semillas 12,21,22, no se conoce cómo influye las diferencias de masa molecular de quitosanos en la germinación de soya por imbibición de las semillas. En este sentido, al comparar los quitosanos de diferentes masas moleculares por imbibición de semillas se encontraron diferencias ligeras entre los polímeros de mediana (Q1) y baja (Q2) masa molecular, y estas diferencias se debieron más bien a la concentración de quitosano, en el desarrollo vegetativo inicial in vitro de soya (Tabla 1, Figuras 1 y 2). El porcentaje de germinación se estimuló con la aplicación de ambos polímeros respecto a las semillas embebidas en agua, mientras que el largo de la radícula de las semillas germinadas no fue modificado ni por la masa molecular ni por las concentraciones de quitosano evaluadas (Datos no mostrados).
En todas las variables de crecimiento del cultivar IS-27 de soya hubo un efecto estimulador de la concentración de 500 mg L-1, excepto en la emisión de hojas con el polímero de mayor masa molecular (Q1), además de incrementarse el índice de área foliar con Q1 (Tabla 1, Figura 1). Zeng & colaboradores 12) propusieron que el efecto estimulador del tratamiento de semillas con quitosano en la germinación, el crecimiento, los rendimientos y la protección de soya contra insectos, es causado por la formación de una película semipermeable en la superficie de la semilla, que mantiene la humedad de la misma y absorbe la humedad del suelo, promoviendo así la germinación. Además, evita la entrada de oxígeno y restringe la pérdida de dióxido de carbono (CO2) en la semilla, manteniendo una concentración alta de CO2 en la película que impide la respiración y disminuye el consumo de nutrientes en el interior de la semilla. Por otro lado, el quitosano puede aumentar los azúcares solubles y reforzar la actividad proteolítica que genera la liberación de aminoácidos libres que tienen efecto inhibitorio en muchos hongos patógenos de plantas.
En leguminosas, como en otros cultivos, la relación r/v se ha determinado para conocer la influencia de múltiples factores como genotipos, estadios de crecimiento, sistema de labranza, déficit hídrico en el suelo, entre otros 23-25. En la fase R1 del crecimiento de las plántulas, la relación de la biomasa raíz-vástago mostró diferencias a favor de la aplicación de quitosano, con el doble de incremento que las plantas controles (Figura 1). Se observó un aumento del desarrollo radicular en longitud y masa seca que pudo favorecer la absorción y translocación de nutrimentos desde la raíz hacia la parte área de la planta (Tabla 1). Varios trabajos refieren el efecto estimulante del quitosano en el crecimiento de los cultivos como resultado de incrementar la disponibilidad y la absorción de nutrientes y el proceso de fotosíntesis mediante la acumulación de metabolitos y el aumento de pigmentos foliares 6,11,26,27. En particular, el tratamiento de semillas con quitosano mejora la asimilación del nitrógeno en plantas de IS-27 de soya debido a un aumento de la actividad enzimática nitrato reductasa ya la acumulación de nitrógeno foliar 22 y resultados no publicados.
El índice de área foliar (IAF) se puede relacionar con los procesos de fotosíntesis, respiración, y productividad de los cultivos 15. En soya, el área foliar delas plantas difiere para distintos genotipos y momentos de siembras 28. En el trabajo, el área foliar de las plántulas fue incrementada con la concentración de 500 mg L-1del polímero de mayor masa molecular (Q1), así como el IAF, con las tres concentraciones evaluadas (10,100 y 500 mg L-1) (Tabla 1, Figura 2). Esta estimulación en el área foliar de soya ha sido informado con anterioridad, al aplicarse a las semillas conjuntamente con el inoculante Azofert®, previo a la siembra y, por aspersión foliar en las fases V2 y R2 en campo, con la concentración de 1 g L-1 del polímero de mediana masa molecular empleado en este trabajo, con incrementos de 62,85 % respecto a las plantas controles 22. Este efecto, también ha influenciado la actividad fotosintética (área foliar y pigmentos) de plantas de frijol (Phaseolus vulgaris L.), con la aplicación de nanopartículas de quitosano de bajo masa molecular (27 kDa) combinadas con ácido giberélico 29.
Tomando en cuenta lo anterior y los resultados de este trabajo se puede concluir que polímeros de mediana y baja masa molecular causan ligeras diferencias biológicas en los estadios iniciales de las plántulas cultivadas en solución Hougland
CONCLUSIONES
El desarrollo in vitro de las plántulas IS-27 de soya, hasta la fase R1, estuvo influenciado por la imbibición de las semillas con los polímeros de quitosano.
Las diferencias de masa molecular de los quitosanos (124 kDa (Q1) y 25,3 kDa (Q2) influyeron en la germinación y la mayoría de las variables morfoagronómicas de crecimiento.
La concentración de 500 mg L-1 de ambos quitosanos se destacó en el desarrollo inicial de las plántulas de soya.











 texto en
texto en 


