Introducción
El glaucoma refractario se define como cualquier tipo de glaucoma con trabeculectomía (TBT) previa fallida y presión intraocular (PIO) > 21 mm/Hg, a pesar del uso de dos o más colirios hipotensores.1 En muchas ocasiones, el glaucoma refractario significa un alto riesgo de fracaso de la cirugía de filtración,2,3,4,5,6) como ocurre en los glaucomas pediátricos,7) en los neovasculares o en condiciones que secundariamente provocan un aumento de la PIO y consecuente daño del nervio óptico como uveítis, afaquia, pseudofaquia, cirugía posvitreorretiniana y posqueratoplastia penetrante.2,3 La raza es un factor pronóstico, con muchas más probabilidades de que falle en negros que en caucásicos.8
Durante décadas, la trabeculectomía ha sido la cirugía incisional de elección para el tratamiento del glaucoma no controlado.2 Sin embargo, encuestas de la American Glaucoma Society han mostrado un aumento en la proporción de profesionales que usan derivaciones de tubo.8 El estudio Tube versus Trabeculectomy (TVT) demostró que la cirugía de implante Baerveldt, (BGI; Advanced Medical Optics, Santa Ana, CA, EE. UU.) tuvo una mayor tasa de éxito en comparación con la TBT, con menos complicaciones posoperatorias en pacientes con glaucoma previo o cirugía de cataratas.2
Actualmente los dispositivos de drenaje de glaucoma (DDG) están disponibles en diferentes tamaños, materiales y diseños.9 Reducen la presión intraocular (PIO) al drenar el humor acuoso a través de un tubo hasta una placa terminal subconjuntival.10) Atendiendo a la presencia o no de una válvula reguladora de la PIO, se clasifican en: no restrictivos (Molteno, Baerveldt y Schocket) y restrictivos con válvula (Ahmed, Krupin Denver).8 Un dispositivo de drenaje de glaucoma con válvula está diseñado para reducir la incidencia de hipotonía posoperatoria, ya que permite solo un flujo unidireccional desde la cámara anterior al espacio subconjuntival con una presión de apertura mínima,5 aunque el resultado final en términos de reducción a largo plazo de la PIO se ha encontrado que es mejor con los dispositivos no valvulados en algunos estudios.3,4,9,11
Con estos dispositivos, la PIO parece depender, a largo plazo, del área de la superficie del implante, que determina el tamaño de la bula, la respuesta del tejido y el grosor de la cápsula fibrosa que controla la filtración del humor acuoso a través de la pared de la ampolla.11
En este artículo, presentamos la evolución posoperatoria a corto plazo de un caso clínico con diagnóstico de glaucoma refractario, al que se le implanta un dispositivo de drenaje Baerveldt.
Caso clínico
Paciente femenina, de 52 años de edad, con antecedentes de asma bronquial, miopía y glaucoma juvenil, diagnosticado a los 22 años de edad. Le fueron realizadas dos TBT (1986 y1996) en el ojo izquierdo (OI) y una en el año 1986 en el ojo derecho (OD). En el 2008, se le realizó cirugía de facoemulsificación más implante de lente intraocular, sin complicaciones; 1 año después sufrió trauma ocular contuso en el ojo derecho.
Acudió a nuestro Servicio hace un año, y refirió disminución progresiva de la visión. Cumplía tratamiento en ambos ojos, con combinación fija de timolol 0,5 % + dorzolamida 2 %: 1 gota cada 12 horas y latanoprost 0,005 % (coliro): 1 gota a las 9:00 pm. Al examen oftalmológico se constataron los siguientes datos positivos: agudeza visual mejor corregida (AVMC) 0,4; PIO con tonómetro de Goldmann 30 y 23,5 mmHg y espesor corneal central (ECC) 543 y 547 micras en los respectivos ojos.
En la biomicroscopia con lámpara de hendidura, se evidenció: bulas de filtración planas, cámara anterior de buena profundidad (Van Herick grado III) y respuesta fotomotora disminuida. En el OD se observó, además, pupila discórica, iridectomía basal amplia en hora 12 y 10 y LIO subluxado a cámara anterior. En el OI, LIO centrado y transparente en saco capsular.
El examen fundoscópico reveló: discos ópticos de tamaño normal, relación de área copa/ disco 0,8 y 0,9, con copa elongada vertical de ubicación central para los respectivos ojos. En el OD, el anillo neurorretiniano (ANR) mostró regla ISNT (inferior - superior - nasal - temporal) positiva con disminución del grosor inferior y muesca hacia sector inferotemporal. En el OI el ANR se encontró ausente en sector inferior y temporal. En ambos ojos se visualizó rechazo nasal de vasos, así como vasos en bayoneta, presencia de atrofia peripapilar en zona beta y defecto de la capa de fibras nerviosas retiniana en forma difusa.
Los estudios solicitados incluyeron: OCT Spectralis y campo visual Octopus (Fig. 1 y 2).
Se decidió realizar ciclofotocoagulación transescleral en el OD en los 2 cuadrantes inferiores. Se utilizó una potencia de 1 500 Mw durante 2 segundos. Se realizaron seis aplicaciones por cuadrantes, respetando las horas 3 y 9, a 2 mm detrás del limbo. Se reevaluó a las 24 horas, 7 días, 1, y 3 meses, y se logró el control tensional, sin aparente progresión de la enfermedad. En consulta de los seis meses se constató PIO de 30 y 18 mm/Hg para los respectivos ojos. Se decidió implantar DDG (Baerveldt 350 mm2) en el sector temporal superior del ojo derecho.
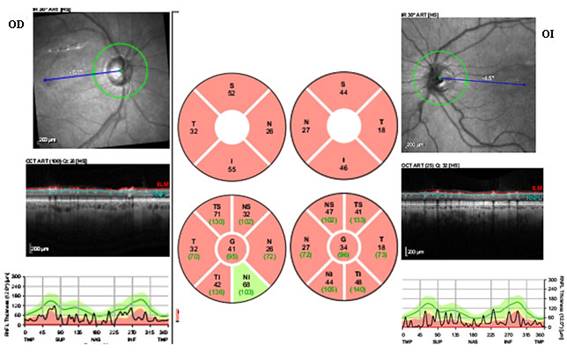
Fig. 1 Evaluación estructural del paciente mediante tomografía de coherencia óptica Spectralis, donde se visualiza afectación severa de la capa de fibras nerviosas retiniana, con predominio en el ojo izquierdo.
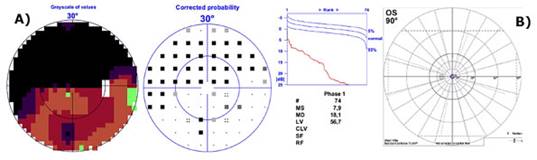
Fig. 2 Estudio funcional perimetría estática blanco/blanco. A) OD: Escotoma de Bjerrum superior e inferior en evolución, que se correlaciona con los defectos de la capa de fibras nerviosas retiniana visualizados por OCT Spectralis. B) OI: La perimetría cinética evidencia un daño funcional severo.
Técnica quirúrgica
Después de la preparación del campo quirúrgico con iodopovidona al 10 %, se aplicó anestesia subtenoniana con lidocaína 2 %. Posteriormente, se realizó un colgajo conjuntival base fórnix. Se disecó ampliamente la conjuntiva y la cápsula de Tenon y se expuso el cuadrante temporal superior; los músculos rectos lateral y superior se aislaron con ganchos musculares. Se colocó un implante de drenaje de glaucoma de Baerveldt de 350 mm2 debajo del abdomen del complejo lateral y superior del músculo recto bajo visualización directa, y se suturó a la esclera a unos 8-10 mm del limbo, utilizando suturas no reabsorbibles de nailon 8/0. El tubo se ató en la unión entre el tubo y la placa con sutura de nailon 6-0 para minimizar la hipotonía posoperatoria inmediata. Se insertó una cánula de calibre 30 en el extremo del tubo distal para confirmar el cierre hermético. El túnel de entrada para el tubo se realizó a 4 mm del limbo esclerocorneal, mediante punción de la esclera con una aguja calibre 23 G, y luego se introdujo el tubo (que se cortó a la longitud adecuada, con el bisel orientado hacia adelante) en la cámara anterior, el cual se situó en un plano paralelo al iris y se verificó su posición. Por último, se cerró la conjuntiva con suturas reabsorbibles de Vicryl 8/0.
Evolución posoperatoria
A las 24 horas se apreció biomicroscópicamente la sutura conjuntival adecuada, el plato valvular bien posicionado, la ampolla de filtración en formación, la córnea transparente, la cámara anterior amplia (grado III según clasificación de Shaeffer) y el tubo del dispositivo visible, sin obstrucciones ni contacto de su orificio con estructuras vecinas. (Fig. 3).
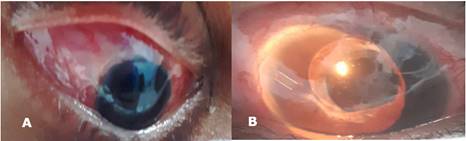
Fig. 3 Evolución posoperatoria a las 24 horas. A: Plato valvular bien posicionado. B: Imagen biomicroscópica del segmento anterior, donde se visualiza el tubo valvular que no contacta con estructuras vecinas.
Se indicó prednisolona 0,5 % y ciprofloxacino 0,3 %, en forma de colirios: 1 gota cada 3 horas, y quedó suspendido el tratamiento hipotensor. A la semana, se constató en el examen oftalmológico: PIO 5 mmHg, atalamia grado III y AVMC de 0,2. Se prescribió el tratamiento con midriático ciclopléjico, antinflamatorios tópicos y sistémicos. A los 15 días, se observó resolución de cuadro inflamatorio. PIO: 12 mm/Hg, AVMC 0,6, con cámara anterior de buena profundidad.
La paciente en estos momentos tiene 3 meses de operada, con PIO controlada, agudeza visual conservada, examen oftalmológico normal y sin evidencias de progresión del daño glaucomatoso.
Discusión
El manejo de los glaucomas refractarios ha mejorado considerablemente en las últimas tres décadas. Las opciones disponibles para su tratamiento, con diferentes niveles de éxito, incluyen: cirugía mínimamente invasiva para glaucoma (MIGS), DDG, plastia ciliar por ultrasonido y ciclofotocoagulación con láser diodo, ondas continuas o micropulso.5)
Seleccionar un dispositivo implica equilibrar muchos factores, incluida la edad del paciente, el subtipo de glaucoma y los objetivos del tratamiento.12 Nuestra paciente tiene 52 años, con una conjuntiva comprometida por múltiples cirugías y uso crónico de hipotensores oculares. Atendiendo a estos antecedentes, decidimos elegir un sistema no valvulado de Baerveldt, con el objetivo de disminuir el riesgo de encapsulación de la ampolla y lograr una presión a largo plazo más baja. Sin embargo, el tubo de Ahmed sería más adecuado para pacientes con riesgo de hipotonía (glaucoma uveítico, neovascular o miopes elevados), edad avanzada y aquellos que requieren una disminución inmediata de la PIO después de la cirugía.9,10,11
El implante Baerveldt (Abbott Medical Optics, Abbott Park, IL), descrito por primera vez en los años 90, es uno de los dos tipos de DDG más utilizados. Son derivaciones de silicona, con una construcción de flujo libre sin diseño de válvula, que requieren la colocación de una sutura soluble o removible alrededor del tubo (opción que utilizamos en nuestro caso), la oclusión de este por un stent o la colocación del plato y tubo por separado en un procedimiento de dos etapas.6,13) Esto hará, que su rendimiento sea seguro.
En la actualidad existen tres tipos de dispositivos según las características morfológicas de la placa, el tubo y su lugar de inserción: el modelo BG103-250, de uso pediátrico, que se inserta en la cámara anterior, formado por una placa y tubo recto; el modelo BG101-350 (adultos); y el de pars plana BG 102-350, con una placa de 350 mm2 unida a un tubo de 7 mm mediante un codo de 90º para su inserción en la cavidad vítrea.5
A diferencia de otros sistemas, este dispositivo se inserta debajo de dos músculos rectos en un solo cuadrante. Por tanto, técnicamente es más compleja de implantar, con mayor probabilidad de diplopía.13 Sin embargo, hay una menor incidencia de encapsulación y mejor filtración.9,10,11
Existen varios factores que influyen en los resultados a largo plazo, como el tamaño de la placa, el material, la presencia o ausencia de restricción de flujo y el estado general del ojo.5
Controlar las complicaciones posoperatorias tempranas sin afectar la eficacia a largo plazo es un desafío y los sistemas no valvulados tienen un pobre control del flujo de salida del humor acuoso. Nuestro paciente presentó a los 7 días, hipotonia y atalamia, probablemente porque la válvula tiene un área de superficie grande y la buena encapsulación de la placa tarda en ocurrir. Hay informes, de asociación entre la hipotonía posquirúrgica prolongada y la posterior PIO aumentada, por fibrosis que limita la filtración. El aplanamiento de la cámara anterior es peligroso, por el riesgo de contacto del tubo con la córnea y/o cristalino, que causa pérdida de células endoteliales y formación de opacidades.4
El estudio Ahmed versus Baerveldt (AVB), que informa los resultados a 3 años, mostró que la cirugía de tubo Baerveldt logró una PIO posoperatoria más baja, pero tienen un mayor riesgo de hipotonía y de reintervenciones.9) La tasa de encapsulación de la ampolla fue mayor en el grupo Ahmed en comparación con el grupo Baerveldt, quizás porque, aunque ambos implantes están hechos de silicona, la topografía del dispositivo de Ahmed, visualizada por microscopía electrónica, tiene una rugosidad 10 veces mayor que Baerveldt, lo que se asocia a un aumento de la adhesión de fibroblastos, que puede predisponer a encapsulación fibrosa.14 De esta forma, podríamos afirmar que el implante de Baerveldt parece ser más eficaz, y Ahmed más seguro. El uso de corticoides es esencial para disminuir la inflamación, que es un factor de riesgo importante, el cual puede ocasionar el fallo funcional de la ampolla.2
Se reporta una tasa de complicaciones del segmento posterior (desprendimiento coroideo, maculopatía hipotónica, hemorragia supracoroidea, endoftalmitis, etc.) del 12 al 48 %.12 Otros dispositivos, como el implante Molteno (placa simple o doble) o Krupin, tienen una tasa de complicaciones retinianas de 14 a 50 %14) y 38 a 40 %,15 respectivamente.
El glaucoma refractario se asocia a la pérdida visual, ya que se acompaña generalmente de otras enfermedades oculares. En relación con la pérdida de visión transitoria es común y toma un promedio de 2,5 meses para recuperarse después de la colocación de Baerveldt.16
El estudio TVT mostró que la cirugía de derivación Baerveldt con una placa terminal de 350 mm2 ofrece una mayor tasa de éxito en pacientes que se han sometido a una TBT previa y/o cirugía de cataratas que aquellos que se sometieron a una TBT sola.2 Por su parte, la investigación Ahmed versus Baerveldt,3) reportó que Baerveldt tuvo una tasa de fallo y una PIO más baja, y menor uso de medicamentos como adyuvantes después de la cirugía, que Ahmed.
En cuanto al tratamiento, algunos especialistas recurren con frecuencia a la ciclodestrucción como un medio para tratar el glaucoma refractario, porque evita complicaciones relacionadas con la ampolla de filtración, es económico y fácil de realizar. Existe un mayor riesgo de hipotonía y peores resultados generales en pacientes que se someten a múltiples sesiones. La tasa de hipotonía está más influenciada por una mayor energía en cada aplicación que por la energía total entregada o el número de aplicaciones utilizadas.17
Se han utilizado, además, dispositivos MIGS en pacientes con glaucoma severo o refractario y PIO no controlada, incluidos aquellos con antecedentes de cirugía de glaucoma fallida previa.18,19,20
En nuestro caso clínico, se logró un control estable de la PIO, sin evidencias de progresión del daño glaucomatoso. No se observaron cambios en la motilidad ocular o agudeza visual. Las complicaciones posoperatorias fueron transitorias y recibieron tratamiento médico. El implante Baerveldt proporciona un medio eficaz para lograr una reducción de la PIO en el glaucoma refractario.














