Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión On-line ISSN 1561-297X
Rev Cubana Estomatol v.42 n.1 Ciudad de La Habana ene.-abr. 2005
Artículos de revisión
Universidad FES Zaragoza, México
Injertos óseos. Una alternativa efectiva y actual para la reconstrucción del complejo cráneo-facial
CD. CMF. Sergio Soto Góngora1 y CD. Miriam Guadalupe Texis González2
Resumen
El empleo de injertos óseos como alternativa de reconstrucción de defectos óseos, ya sean congénitos u ocasionados como traumatismos, secuelas oncológicas e infecciosas, tienen como finalidad restablecer la integridad anatómica y funcional de una estructura alterada. Durante décadas, los investigadores se han dado a la tarea de encontrar en los injertos ciertas características que respondan a cada una de las necesidades de reconstrucción; este hecho a llevado a estudiar y comparar los beneficios de algunas estructuras óseas potencialmente donadoras, que incrementen las probabilidades de éxito del tratamiento y disminuyan considerablemente los posibles riesgos y complicaciones durante la toma del injerto. De igual manera, se han estudiado diversos materiales implantológicos, sin embargo, estos no poseen la capacidad natural de inducir el proceso de regeneración ósea, haciendo de ellos materiales inertes biocompatibles de "relleno", que no sustituyen las características de los injertos, pero utilizados conjuntamente si así se requiere, pueden mejorar los resultados. El presente trabajo plantea la utilización de injertos óseos como una alternativa viable, efectiva y actual en materia de reconstrucción.
Palabras clave: Injertos, injertos óseos, complejo cráneo-facial, huesos, cresta ilíaca, costilla
El primer indicio del empleo de injertos óseos para la reconstrucción de defectos óseos data de 1668, cuando Van Meekren trasplantó hueso heterólogo de un perro al hombre para restaurar un defecto en el cráneo. En 1809 Merrem, realizó el primer trasplante de injerto autólogo óseo con éxito. En 1878 Macewen, según se informa, trasplantó con éxito un hueso alogénico en humanos. En 1891 Bardenheur fue el primero en realizar un injerto de hueso autólogo a la mandíbula. En 1908, Payr describió el uso de trasplantes libres de tibia y costilla. En 1938 Orell produjo un material de injerto de hueso bovino por medio del uso de álcalis fuerte, y en 1942 Wilson, creó un banco de huesos usando técnicas de congelación.
De acuerdo con los resultados obtenidos de estas investigaciones, se realizó la clasificación actual de injertos de acuerdo con su origen y estructura, con el propósito de establecer algunas de sus características más importantes, que permitan al cirujano realizar la elección adecuada basado en las necesidades estructurales y funcionales requeridas. Según estos criterios, los injertos han sido clasificados en:
- Autólogos (autoinjertos): este tipo de injerto se compone por tejido tomado del mismo individuo, y proporciona mejores resultados, ya que es el único que cumple con los 3 mecanismos de regeneración ósea (osteogénesis, osteoinducción y osteoconducción), además evita la transmisión de enfermedades y el rechazo inmunológico.
- Homólogos (aloinjertos): se componen de tejido tomado de un individuo de la misma especie, no relacionado genéticamente con el receptor; cuenta con capacidad osteoinductiva y osteoconductora, y según Betts "se comporta como una estructura que permitirá la neoformación ósea a partir del remplazo gradual que sufre el injerto por el hueso del huésped, haciendo este proceso lento y con considerable perdida de volumen".1 Existen 3 tipos de aloinjertos óseos: congelados, desecados (liofilizados) y desmineralizados.
- Isogénicos (isoinjertos): se componen por tejido tomado de un individuo genéticamente relacionado con el individuo receptor.
- Heterólogos (xenoinjertos): se componen de tejido tomado de un donador de otra especie, además clínicamente no son aceptables debido a su gran antigenicidad.1-4
En cuanto a su estructura, los injertos óseos pueden ser: corticales y esponjosos; cada uno posee determinadas características y cualidades. La estructura cortical produce un buen relleno mecánico debido a su composición, ya que se puede adaptar y contornear fácilmente. Para su óptima función debe ser correctamente fijado al lecho receptor, por medio de placas o tornillos a presión; la estructura esponjosa se fusiona más rápidamente al lecho receptor debido a que los grandes espacios abiertos que presenta, permiten una rápida revascularización propiciando la neoformación ósea; sin embargo, tiene ciertas limitantes, ya que no tiene suficiente resistencia mecánica para tolerar tensiones en defectos de gran tamaño. Es por ello que la unión natural de una lámina cortical y esponjosa proporcionan mejores resultados colocando la porción trabecular contra el huésped y la cortical hacia la superficie externa. Sin embargo, se han considerado otras variedades de injertos óseos, tales como: médula, partículas, y pasta de hueso, entre otros.
Los injertos óseos son los únicos que tienen la particularidad de inducir de manera natural el proceso de regeneración ósea, que ocurre a partir de estos 3 mecanismos básicos:
- Osteogénesis: depende exclusivamente de la supervivencia de las células trasplantadas, principalmente de los preosteoblastos y osteoblastos. Se origina principalmente en hueso esponjoso, debido a su rápida revascularización, que puede ser completa a las 2 semanas, mientras que en el cortical puede llevar varios meses.
- Osteoinducción: se inicia por medio de la transformación de células mesenquimales indiferenciadas perivasculares de la zona receptora, a células osteoformadoras en presencia de moléculas reguladoras del metabolismo óseo. Dentro de estas moléculas cabe destacar el grupo de las proteínas morfogenéticas, pero también se encuentran otra serie de proteínas implicadas en el metabolismo óseo, como son el PDGF16, 17, FGF18, 19, IGF20, 21, 22, 23, 24, 25, EGF26, 27, TGF14, 15 y VEGF15. La fuente de estas proteínas son los injertos autólogos, el plasma rico en factores de crecimiento y las proteínas morfogenéticas obtenidas mediante técnicas de ingeniería genética. La proteína morfogenética, que se deriva de la matriz mineral del injerto, es reabsorbida por los osteoclastos y actúa como mediador de la osteoinducción; esta y otras proteínas deben ser removidas antes del inicio de esta fase, que comienza 2 semanas después de la cirugía y alcanza un pico entre las 6 semanas y los 6 meses, para decrecer progresivamente después.4-6
- Osteoconducción: es un proceso lento y prolongado, donde el injerto tiene la función de esqueleto. Este tipo de curación predomina sobre todo en los injertos corticales, donde el injerto es progresivamente colonizado por vasos sanguíneos y células osteoprogenitoras de la zona receptora, que van lentamente reabsorbiéndolo y depositando nuevo hueso.
Las 3 fases (osteogénesis, osteoinducción y osteoconducción), ocurren simultáneamente siempre y cuando se trate de un injerto autólogo trabecular, cortico-trabecular o cortical. El hueso trabecular induce el proceso de osteogénesis. El cortico-trabecular además de ser útil para la reconstrucción anatómica, provee la mayor parte de la proteína osteogénica, de gran importancia en la segunda fase de la cicatrización ósea. La cortical sola como injerto provee una estructura muy resistente, para su cicatrización se da únicamente la fase de osteoconducción, además puede actuar como barrera de invasión del tejido blando, comportándose de manera similar a una membrana microporosa utilizada para la regeneración ósea guiada. 5,7
El rechazo inmunológico, representa un problema común y latente principalmente con aloinjertos y xenoinjertos; es el resultado de la reacción celular del huésped a los antígenos trasplantados. Los antígenos responsables de este rechazo son los pertenecientes al sistema del antígeno de histocompatibilidad mayor. Sin embargo, el empleo de algunos métodos pueden prolongar la supervivencia del injerto, como el tratamiento con inmunosupresores, que se ha convertido en una necesidad práctica en todas las combinaciones donante-receptor. En la actualidad se utilizan como agentes inmunosupresores la azatioprina, los corticosteroides, la ciclosporina, las globulinas antilinfocitarias y los anticuerpos mononucleares anti-células T.
A pesar de que la inmunosupresión ha permitido lograr grandes avances en la supervivencia de los injertos, también tiene grandes contratiempos, ya que aumenta la sensibilidad a las infecciones oportunistas provocadas por hongos, virus y otros microorganismos.8 Es por ello que la similitud genética entre el receptor y el donador de un tejido trasplantado, parece ser el principal factor responsable del éxito del injerto. Tal es el caso del isoinjerto, pero principalmente del autoinjerto, por ello este último es considerado como el injerto idóneo de reconstrucción de primera elección, ya que cumple con los siguientes criterios:
- Son biológicamente aceptables, es decir, no provocan ningún tipo de respuesta inmunológica adversa.
- Inducen de forma activa el proceso osteogénico.
- Se puede obtener estructura cortical, esponjosa o cortico-esponjosa, que sea capaz de soportar las fuerzas mecánicas producidas en el sitio quirúrgico, además de contribuir al soporte interno de la zona.
Además, con el objetivo de incrementar las probabilidades de éxito del injerto, es necesario realizar un manejo adecuado durante la toma del injerto, así como una cuidadosa manipulación extracorpórea del mismo, a manera de incrementar la viabilidad de las células osteogénicas supervivientes, para lo cual es conveniente:
- Evitar el calentamiento óseo por fricción generado mediante la osteotomía y ostectomía de la toma del injerto, y el remodelado de este; no deberá sobrepasar los 42 ºC.
- Se deberá preservar el periostio, ya que este posee un gran potencial osteogénico.
- Conservar en un medio adecuado al injerto, ya que el potencial osteogénico del injerto se pierde si se mantiene expuesto al aire durante más de media hora e inmerso en suero salino por más de una hora, o si es sumergido en soluciones antibióticas como bacitrina o neomicina.
- Fijar al injerto mediante tornillos de compresión al lecho receptor, para disminuir la reabsorción del injerto.4,10,11
- El sitio receptor debe estar libre de contaminación para evitar la infección.11
La elección del sitio donador debe realizarse tomando en cuenta algunos factores importantes como: el tamaño del injerto requerido, el tipo de estructura ósea adecuada, la conformación anatómica, la cicatriz del sitio donador, el acceso al sitio donador, los posibles inconvenientes, complicaciones y secuelas del sitio donador y la habilidad del cirujano, entre otros. Actualmente el manejo de diferentes regiones potencialmente donadoras, facilita la toma del injerto y la reconstrucción anatómica. En este trabajo se propone el empleo de injertos tomados de: costilla, cresta ilíaca, calota, diáfisis tibial, radio, maxilar (tuberosidad, espina nasal anterior y pared anterior del seno maxilar), mandíbula (cuerpo, rama y sínfisis mentoniana).
A continuación se mencionaran algunas de las características, beneficios y posibles complicaciones de cada una de las regiones anteriormente citadas, dejando al criterio del cirujano la técnica y empleo de los injertos óseos en materia de reconstrucción. Por otra parte, algunos autores refieren que "las zonas donantes de injertos óseos más empleadas en cirugía craneofacial son: calota craneal, cresta ilíaca y costilla".4
Injerto óseo costal
La toma de injerto costal ha sido el sitio de mayor elección durante décadas; su principal ventaja radica en que se pueden obtener grandes bloques cortico-esponjosos de hasta 10 a 15cm, además su gran maleabilidad lo hace fácilmente adaptable a las complejas formas del esqueleto craneofacial, en tanto que su principal desventaja es la gran reabsorción que sufre el injerto según se reporta en algunas investigaciones, además de las posibles complicaciones operatorias y posoperatorias, como el neumotórax, dolor pleurítico y depresiones en el tórax, entre otras.4
Toma de injerto costal
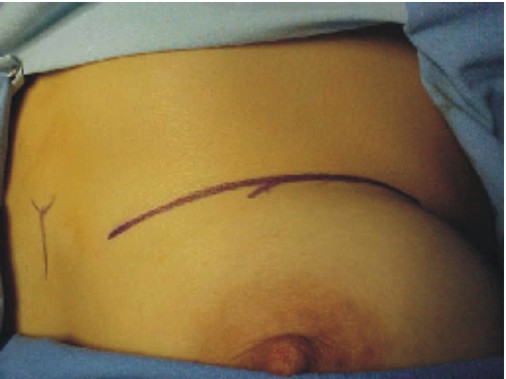
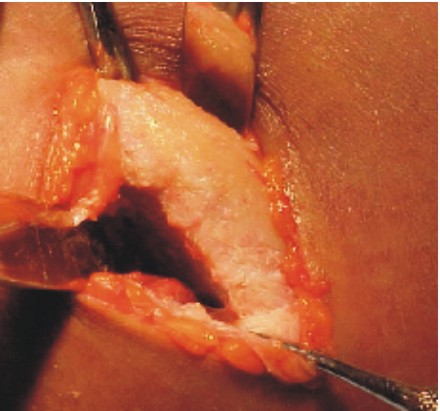
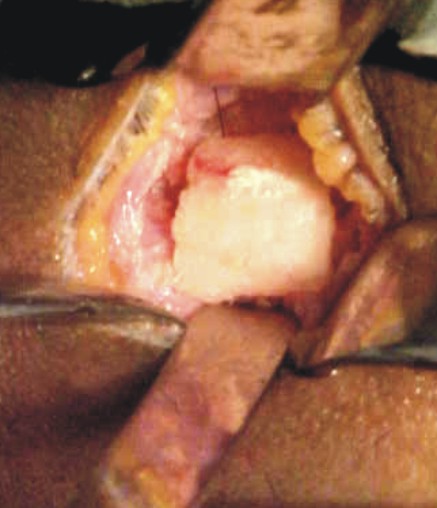
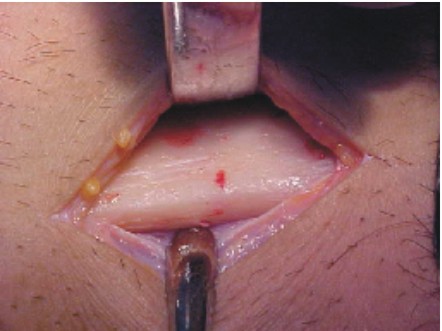
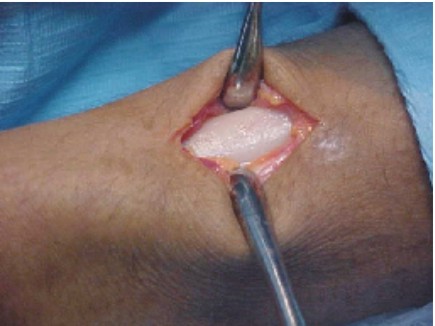
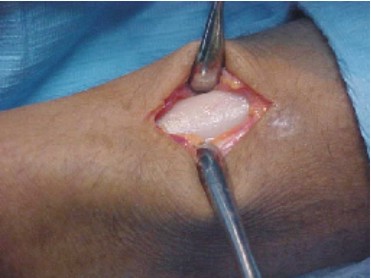
- La extensión de la incisión varía según la proporción del tejido que se pretenda obtener, se disecan los músculos pectoral mayor, menor, serrato anterior y hacia la parte posterior el dorsal ancho, se preserva intacto el periostio (figs. 1-3).10
Fig. 1. Diseño de la incisión. Fig. 2. Incisión.
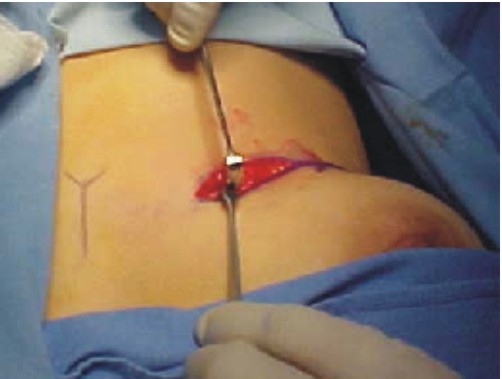
Fig. 3. Disección y exposición de la séptima costilla.
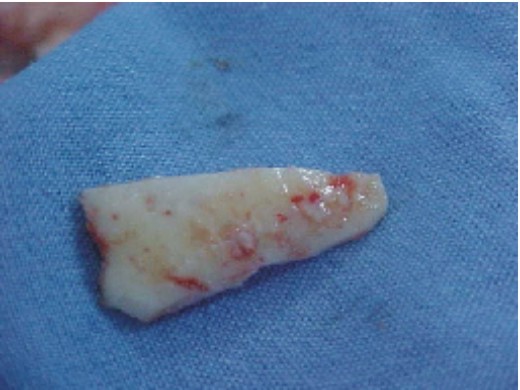
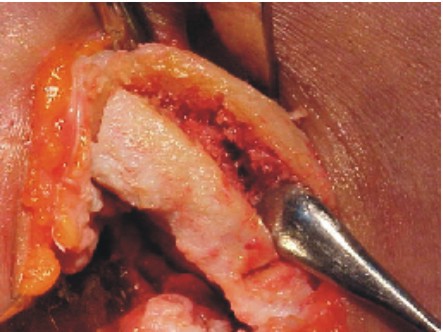
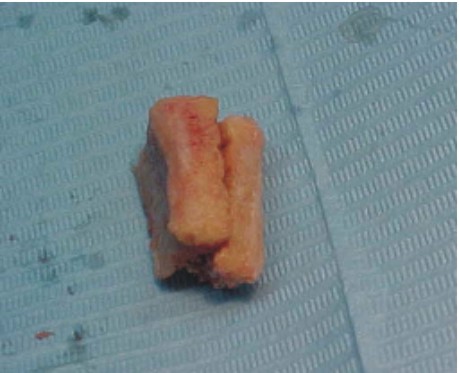
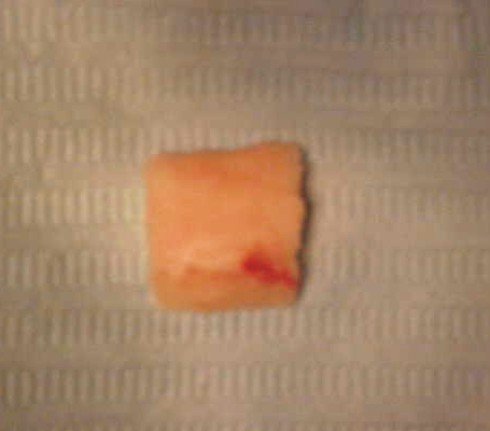
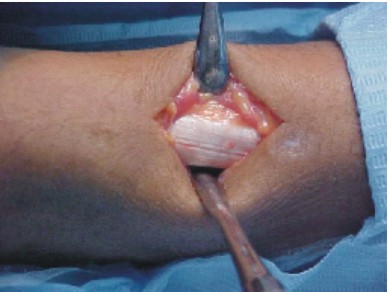
- La extracción del injerto se realiza por medio de cizallas seccionando en cada uno de los extremos, se realizan los cuidados necesarios evitando perforar la cavidad pleural (fig. 4).
Fig. 4. Injerto costal.
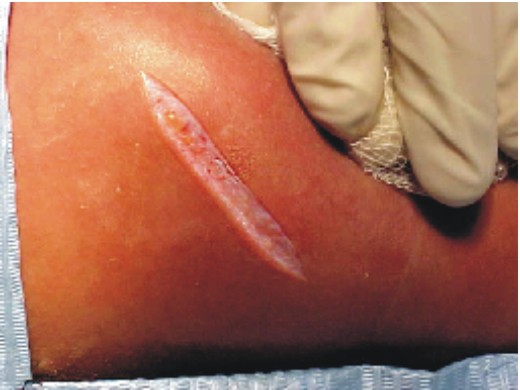
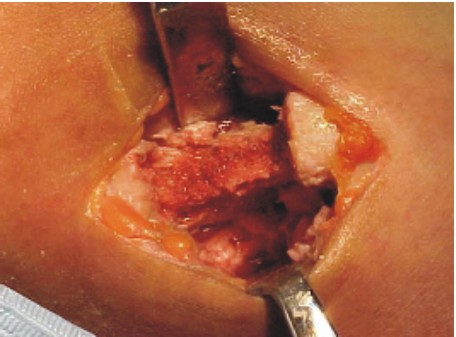
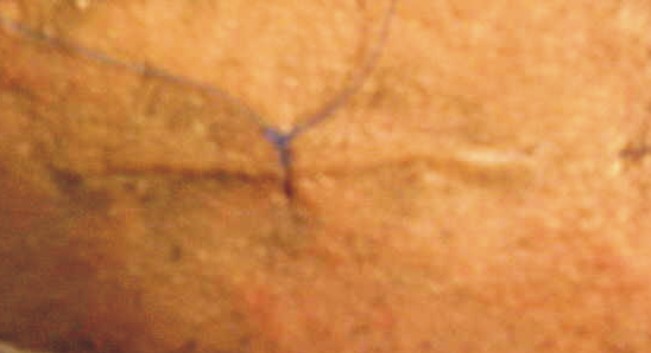
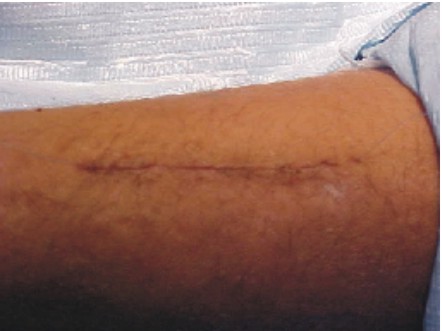
- Sutura por planos, aproximando los músculos seccionados sobre el lecho costal (fig. 5).
Fig. 5 Sutura.
Injerto óseo de cresta ilíaca
Según la experiencia de diversos autores que han utilizado varios tipos de injertos óseos como el de calota, clavícula, costilla y cresta ilíaca, refieren que éste último es el que tiene mejores resultados e integración.12,13
Existen diferentes técnicas para la obtención de injerto de cresta ilíaca (toma de espina ilíaca anterior superior, toma de partículas de médula y toma ilíaca de espesor total). Estas dependen del tipo de estructura ósea que se pretenda obtener, como bloques cortico-esponjosos de 12 a 14 cm, hasta grandes cantidades de médula ósea (50 cc), que pueden ser utilizadas para aumentar contornos, estabilizar hendiduras, obturar grietas alveolares, así como reconstruir diversos defectos óseos. Entre las posibles complicaciones posquirúrgicas que se pueden presentar están: dolor, dificultad para caminar, parestesia temporal o permanente del nervio femoral cutáneo, defectos del contorno de la cresta, íleo paralítico, entre otros. Para ello es necesario tomar en cuenta algunas consideraciones durante la toma del injerto como: evitar lesionar el nervio femoral cutáneo, por lo que la incisión debe realizarse hacia un lado y oblicuamente con respecto a la cresta ilíaca, además si el borde de la cresta no es necesaria para la reconstrucción, se utiliza un segmento por debajo de la cresta, abordando la parte medial del hueso.2,4,11,12,14,15
La siguiente técnica ilustra la toma de injerto de la espina ilíaca anterior superior.
Toma de injerto de cresta ilíaca
- Se realiza una incisión oblicua con orientación inferior y posterior a la cresta ilíaca, a 1 cm del dorso de la espina y de una longitud aproximada de 5 cm, se seccionan las inserciones anteriores de los músculos abdominales oblicuo externo e interno y un segmento de la facia del tensor latáe, hasta llegar al periostio. El paquete vásculo- nervioso cutáneo femoral lateral y el nervio cutáneo femoral lateral son las únicas estructuras que no deben ser dañadas durante la disección (figs.6 y 7).
Fig. 6. Incisión.
Fig. 7. Disección.
- Se realiza un corte con osteotómo, aproximadamente a 2 cm del borde de la cresta, produciendo una fractura de la cortical dejando expuesto el hueso esponjoso (figs. 8 y 9).
Fig. 8.
Fig.9. Extracción de hueso esponjoso.
- Se seccionan las tablas óseas, por medio del osteotómo, para obtener un injerto de tipo cortical (figs. 10-12).
Fig. 10. Fig. 11. Tablas corticales.
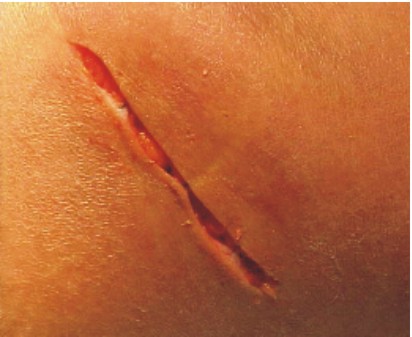
Fig. 12. Sutura por planos.
Injerto óseo de calota craneal
"Actualmente los injertos de hueso autógeno tomados de la bóveda craneana se han convertido en los más solicitados en cirugía craneofacial".16 La extracción de hueso parietal u occipital de espesor total o parcial, han constituido un injerto de excelente calidad para un gran número de procedimientos reconstructivos del complejo craneofacial, debido a que los injertos de origen membranoso, han demostrado clínica y experimentalmente tener un índice de reabsorción muy por debajo de su homólogo endocondral, manteniendo así el volumen inicial del injerto. Los injertos craneales de espesor total deben tomarse en colaboración con un neurocirujano.2,4,14,16,17
Algunas ventajas adicionales de esta zona son la ausencia de dolores posoperatorios (en relación con la toma de cresta ilíaca o de costilla), además la cicatriz queda oculta por el pelo; la principal desventaja del injerto es la dificultad de modelarlo debido a su gran componente cortical. Tessier ha propuesto para esto conservar el periostio en su cara externa, para que sirva de soporte a las microfracturas que se producen al contornear estos injertos. Las complicaciones posibles son: hematoma epidural o subdural, seroma, fístula del líquido cefalorraquídeo, daño cerebral, dehiscencia de la herida, rasgadura de la duramadre, hemorragia aracnoidea e infección de la herida.4,14
Según algunos estudios experimentales realizados por Díaz Fernández y colaboradores, demostraron que con el método de extracción del injerto con división in situ, se ofrecieron mejores posibilidades de reconstrucción en cuanto a forma, volumen y flexibilidad, por lo que se recomienda en defectos pequeños y medianos sobre todo en la región frontal y áreas adyacentes, en donde el contorno y la simetría son los 2 aspectos fundamentales que se deben conseguir.
Toma de injerto de calota craneal
- Cuando se requieren cantidades pequeñas de hueso se limita la incisión y la disección, se aborda la región parieto-occipital, descubriendo la cortical externa (figs. 13-15).
- Se realizan osteotomías para delimitar el injerto de espesor parcial, con riguroso cuidado para no lesionar estructuras internas (fig. 16)
Figs. 13 y 14. Preoperatorio, región parieto-occipital.
Fig. 15. Incisión y disección. Fig. 16. Osteotomía.
- Por medio de elevadores se toma la cortical externa, dejando expuesto el hueso trabecular que une ambas tablas óseas (figs. 17-20).
Fig. 17. Extracción del injerto de espesor parcial. Fig. 18. Lecho quirúrgico, cortical interna.
Fig. 19. Injerto cortical de espesor parcial. Fig. 20. Sutura.
Injerto óseo de diáfisis tibial
La tibia es el segundo hueso más largo del cuerpo, localizado en la cara interna de la pierna, se articula con el fémur, peroné y talón. Entre las principales ventajas que ofrece esta zona donadora, son la extracción del injerto bajo anestesia regional, pudiendo obtener bloques de hueso cortico-esponjoso con acceso al canal médular; su exéresis no condiciona trastornos funcionales si se conservan de 5 a 8 cm proximales en cada uno de sus extremos, para estabilizar tanto la rodilla como el tobillo, se pueden transferir de 20 a 25 cm de hueso cortical.17
Toma de injerto de diáfisis tibial
- Se realiza una incisión y se disecan los tejidos sobre la cara externa de la pierna, con objeto de que la incisión no se ubique sobre la cresta tibial, debido a que en esta zona la tibia solo esta recubierta por piel, un fino panículo adiposo y aponeurosis, por dicha razón, las cicatrices sobre la cresta son dolorosas y la sutura por planos es difícil por la escasez de tejido (fig. 21). (Lonato Ponce JA, Parada Mediana A. Alternativas en reconstrucción mandibular. Tesis. UNAM. FES-Zaragoza; 2002).
Fig. 21. Incisión.
- Se realizan múltiples osteotomías para delimitar el injerto (figs. 22 y 23).
Fig. 22. Osteotomía. Fig.23. Delimitación del injerto.
- Por medio de cinceles se libera la cortical conservando el injerto en un contenedor con suero fisiológico y se sutura por planos (figs. 24 y 25).
Fig. 24. Extracción del injerto. Fig. 25. Sutura.
Injerto óseo radial
Es un hueso largo del antebrazo, se encuentra dispuesto paralelamente al cúbito; su extremidad proximal es pequeña y forma parte de la articulación del codo, en tanto el extremo distal es grande y forma parte de la articulación de la muñeca. De esta región se puede obtener un bloque cortico-esponjoso de hasta 8 cm con acceso al canal medular (fig. 26).
Toma de injerto radial
- Se efectúa la incisión de aproximadamente 2 cm sobre la cara anterior del radio, proximal a la línea metafisiaria (figs. 26 y 27).
Fig. 26. Preoperatorio. Fig. 27. Incisión.
- Se realiza la disección de músculos y tejidos blandos, descubriendo el periostio (figs. 28 y 29).
Fig. 28. Músculo extensor de la muñeca y los dedos. Fig. 29. Disección de tejidos.
- Se realizan múltiples osteotomías para delimitar al injerto. Posteriormente por medio de cinceles se extrae la cortical, dejando expuesto el canal medular (figs. 30-33).
Fig. 30. Osteotomías. Fig. 31. Ostectomía.
Fig. 32. Exposición del injerto cortical y medular. Fig. 33. Sutura por planos.
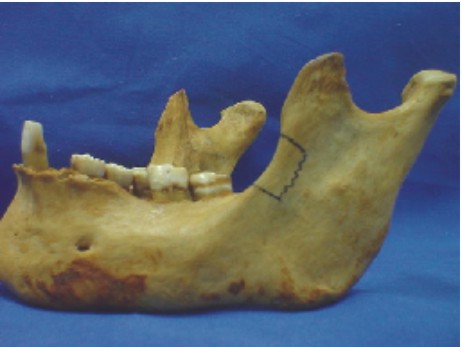
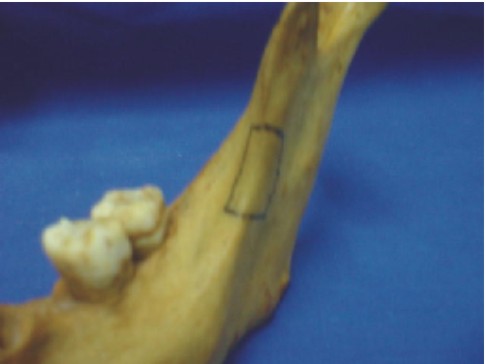
Injerto óseo mandibular (rama)
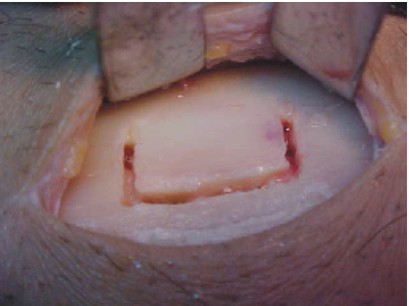
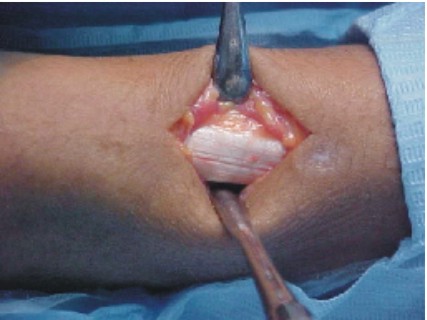
El injerto de rama mandibular es ideal para la reconstrucción de defectos óseos de pequeño tamaño. De esta zona se pueden obtener láminas de hueso cortical y esponjoso de hasta 2,5 cm. Su empleo ofrece grandes ventajas, ya que no deja cicatriz externa, conserva las estructuras vitales de la zona, no altera la función muscular ni articular y el acceso permite una visión amplia (figs. 34 y 35).18
Este procedimiento debe llevarse a cabo de acuerdo con los tiempos quirúrgicos representados en las figuras 34-37, previa asepsia, antisepsia y anestesia regional.
Fig. 34 y 35. Previo diseño del injerto.
Fig. 36. Incisión y disección. Fig. 37. Osteotomías.
- Este procedimiento se realiza bajo anestesia regional.
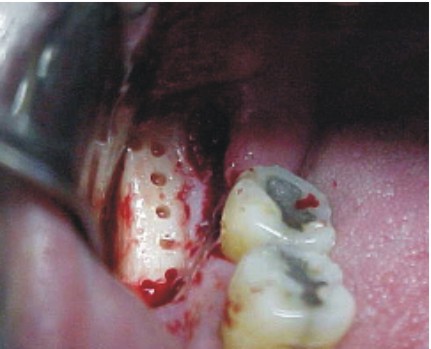
- Se realiza una incisión sobre el contorno de la línea oblicua externa, hacia el proceso alveolar del primer molar inferior, con una longitud aproximada de 2 cm (fig. 36).
- Con fresas quirúrgicas y pieza de mano de baja velocidad, se realizan múltiples osteotomías, para diseñar y facilitar la extracción del injerto, evitando profundizar excesivamente para no lesionar la arteria y el nervio dentario inferior (fig. 37).
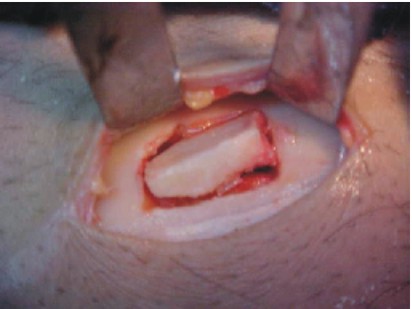
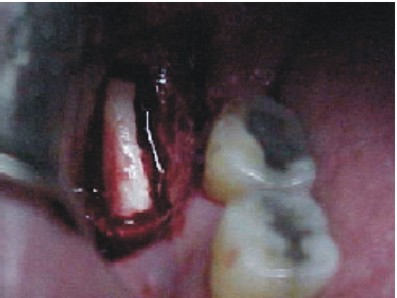
- Mediante un escoplo o cincel plano y fino, se practica la ostectomía del fragmento vestibular (figs. 38 y 39).
- Se coloca la lámina ósea obtenida en solución fisiológica.
- Se sutura con seda negra 3-0.
Fig. 38. Extracción del injerto. Fig. 39. Injerto córtico-esponjoso.
Conclusiones
Indudablemente los injertos óseos, y de estos, principalmente los autoinjertos, ofrecen grandes y mayores beneficios comparados con materiales implantológicos (aloplásticos, biocerámicos, polímeros, composites, entre otros) empleados para la reconstrucción de defectos óseos del complejo cráneo-facial. Las regiones potencialmente donadoras (costilla, cresta ilíaca, calota craneal, radio, diáfisis tibial, mandíbula, maxilar, entre otros), proporcionan al cirujano un tipo de injerto idóneo para cada necesidad de reconstrucción, por lo que se deja a criterio de este su elección y utilización.
Summary
BONE GRAFTS. AN EFFECTIVE AND CURRENT ALTERNATIVE FOR THE RECONSTRUCTION OF THE CRANIOFACIAL COMPLEX
The use of bone grafts as an alternative to reconstruct osteal congenital or caused defects, such as traumatisms, oncological and infectious sequelae, is aimed at restoring the anatomical and functional integrity of an altered structure. During decades, investigators have tried to find in grafts certain characteristics that response to each of the reconstruction needs. This fact has led to the study and comparison of the benefits of some osteal structures that are potential donors and may increase the chances of success and considerably reduce the possible risks and complications during the graft taking. Likewise, diverse implantation materials have been studied, but they do not have the natural capacity to induce the osteal regeneration process, which makes them inert biocompatible "filling" materials that do not substitute the characteristics of the grafts, but they can improve the results if they are used together. The present paper recommends the use of bone grafts as a viable, effective and current alternative as regards reconstruction.
Key words: Grafts, bone grafts, craniofacial complex, bones, iliac crest, rib.
Referencias bibliográficas
1. Betts N, Fonseca R. Allogenic grafting of dentoalveolar clefts. Oral Maxilofac Clinic North 1991;3(3): 122.
2. Mendoza Herrera DC. Injertos óseos alveolares (Internet) 2000 (fecha de acceso 09 de abril del 2003); 197: 1-5. Disponible en: http://www.encolombia.com/ortopedivol197-revision10-2.hmt
3. William B I. Actualizaciones en cirugía bucal. Vol. II. Argentina: Editorial;1981.
4. Raspall G. Cirugía maxilofacial. Madrid : Panamericana; 1997.
5. Misch CE, Diets F. Bone-grafting materials in implant dentistry. Implant Dent 1993; 3(2):158-67.
6. Bowen Antolín A, Benet Iranzo F, Carmona Rodríguez J, Mallagray Martínez R, Ortega López J, González de la Vega, Pomar A. Técnicas quirúrgicas avanzadas para la regeneración ósea en implantología. Dent Dig (Internet) Mayo 2002 (fecha de acceso 09 de abril del 2003); (128): 1-6. Disponible en: http://www.gacetadental.com/foyci
7. Arteaga Ortiz H, Martínez Bravo J, Martínez Echevarría H, Ortega Arteaga V. Regeneración ósea guiada en implantes oseointegrados con injerto óseo autólogo y membrana de polietrafluoretileno expandido de uso en plomería. Rev ADM 2000; LVII (5):165 -74.
8. Robbins SL . Cotran RS. Patología estructural y funcional. 2ª ed. México: Interamericana; 1998.
9. Christmann EF. Técnica quirúrgica. Argentina: El Ateneo; 1987.
10. Geneser Finn. Histología. 3ª ed. México: Panamericana; 2003.
11. Lore John M. Cirugía de cabeza y cuello. 3 ed. Argentina: Panamericana; 1990.
12. Kimura Fujikami T, Gutiérrez Acuña AP. Reconstrucción mandibular. Rev ADM 1994; LI (4): 226-32.
13. Richter M. Two rare tumors of the mandible. Renoval and reconstruction. Acta Stomatol Belg 1989;. 86(4): 265-74.
14. Kaban L. Cirugía bucal y maxilofacial en niños. México: Interamericana Mc Graw-Hill; 1992.
15. Moreno Delgado M. Reporte clínico de cirugía de elevación sinusal bilateral con hueso esponjoso de cresta iliaca, preparatoria para el transplante de los gérmenes de los terceros molares superiores, a un lecho óseo neoformado. Rev ADM 1999; Vol. LVI (1): 12-17.
16. Díaz Fernández JM, Rodríguez Román L. Caracterización del injerto parietal. Rev. Cubana Cir. 1996; 35(2):1-4.
17. Piccò Díaz I, López Haro, Herrera Pineda. Reconstrucción maxilar con injerto de calota e implantes dentales. Rev ADM 2001; LVIII(6): 229-32.
18. Palacios Gómez A. Técnicas quirúrgicas de cabeza y cuello. México: Interamericana;1967.
Recibido: 24 de febrero de 2004. Aprobado: 12 de junio de 2004.
CD. CMF. Sergio Soto Góngora.
1Académico del área de cirugía bucal en la FES-Zaragoza UNAM.
2Cirujano Dentista egresada de la FES-Zaragoza UNAM.