Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med v.48 n.2 Ciudad de la Habana abr.-jun. 2009
TRABAJOS ORIGINALES
Infección por Helicobacter pylori en pacientes con mucosa sana y con gastritis erosiva
Helicobacter pylori infection present in patients with a healthy mucosa and erosive gastritis
María Teresa Martínez EchavarríaI; Guillermo Noa PedrosoII
I Licenciada en Microbiología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
II Especialista de I Grado en Medicina General Integral. Especialista de I Grado en Gastroenterología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
RESUMEN
Helicobacter pylori es una bacteria que coloniza e infecta la mucosa del epitelio gástrico del hombre. La infección condiciona la aparición de una gastritis que puede evolucionar hacia úlcera péptica, adenocarcinoma gástrico o linfoma tipo MALT. En otros casos, la infección se presenta de forma silente. Se estudió le presencia de HP en pacientes con gastritis y en otros con mucosa sana que acudieron a la Consulta de Endoscopia, del Hospital Clinicoquirúrgico "Hermanos Ameijeiras", por desórdenes en las vías del tracto digestivo superior. Se investigaron 50 pacientes, 30 tenían gastritis erosiva y 20, la mucosa sana, confirmado histológicamente. Se detectó Helicobacter pylori por amplificación de un fragmento del gen ure A mediante la reacción en cadena de la polimerasa, en el 90 % de los casos con gastritis erosiva y en el 75 % de los sujetos con mucosa sana. La razón de productos cruzados (OR) fue 3 con un intervalo de confianza de 0,52-18,9. Se concluyó que la infección por HP es tan elevada en los pacientes con gastritis como en aquellos con mucosa gástrica sana.
Palabras clave: Helicobacter pylori, gastritis.
ABSTRACT
Helicobacter pylori (HP) is a bacterium causing colonization and infection of gastric epithelium of man. Infection allows appearance of a gastritis that may to evolve to a peptic ulcer, a gastric adenocarcinoma, or a type MALT lymphoma. In other cases, infection has a silent presentation. Authors studied presence of HP in patients with gastritis and in others with a healthy mucosa, seen in endoscopy consultation of "Hermanos Ameijeiras" Surgical Clinical Hospital by others disorders in high digestive tract pathways. Fifty patients were investigated, 30 of them had an erosive gastritis, and 20 had a healthy mucosa histology confirmed. HC was detected by amplification of a fragment of Ure A gen, by means of polymerase chain reaction (PCR), in 90% of cases with erosive gastritis, and in 75 % of subjects with a healthy mucosa. The reason of odds ratio (OR) was of 3 with a confidence interval (IC) of 0.52-18.9. We conclude that HP infection is so high in patients with gastritis than in those with a healthy gastric mucosa.
Key words: Helicobacter pylori, gastritis.
INTRODUCCIÓN
Helicobacter pylori (HP) es un bacilo gramnegativo que coloniza e infecta la mucosa del epitelio gástrico. La bacteria sobrevive a la acción de la capa de mucus que recubre la superficie del epitelio gástrico, se establece en la superficie luminar del estómago, donde desencadena una intensa respuesta proinflamatoria que se caracteriza por la liberación de linfocitos B y T, que denotan la aparición de una gastritis crónica. Luego se produce la infiltración de la lámina propia y del epitelio gástrico por neutrófilos quimioatractantes, macrófagos y leucocitos polimorfonucleares, que eventualmente fagocitan la bacteria y que permiten el diagnóstico de una gastritis activa. La interacción de HP con la superficie de la mucosa también trae como consecuencia la liberación de citoquinas como las interleuquinas 6, 8 y 10 y el factor de necrosis tumoral alfa, lo que trae como consecuencia el reforzamiento de la respuesta inflamatoria.
La mayoría de las personas infectadas por HP no desarrollan complicaciones clínicas significativas sino que presentan una gastritis crónica asintomática. Sin embargo, algunos pacientes que presentan otros factores de riesgo adicionales pueden desarrollar una úlcera péptica, un linfoma tipo MALT o un adenocarcinoma gástrico.1
Se estima que aproximadamente 1 billón de la población mundial esta infectada por HP, aunque el dato exacto se desconoce porque no se sabe con exactitud que cantidad de personas infectadas hay en los países en vías de desarrollo, donde la incidencia es mayor que en los países desarrollados. En los países en vías de desarrollo, la infección se adquiere comúnmente en la niñez, por lo que al llegar a la adultez prácticamente el 90 % de la población se encuentra afectada. En los países desarrollados, en cambio, la infección se adquiere en la adultez y poco menos del 10 % de los niños menores de 12 años resultan infectados. Asimismo, el papel patogénico de HP puede diferir, en dependencia del área geográfica y de la raza. La raza blanca parece ser menos susceptible a la infección que el resto de los grupos raciales.2
Hoy se acepta que prácticamente todas las personas infectadas por HP desarrollan una gastritis crónica superficial y si no se lleva a cabo un tratamiento que permita la erradicación de la infección, ésta se prolonga durante décadas, y en muchos casos durante toda la vida. La gastritis crónica se define como una entidad, esencialmente histológica, caracterizada por un incremento del infiltrado a expensas de células inflamatorias crónicas de tipo mononucleares, con presencia de polimorfonucleares o sin ellos, que puede comprometer la mucosa del cuerpo, la del antro gástrico o ambas. En la mayor parte de los casos —más del 85 %— la inflamación está asociada a la infección por HP, por lo que esta bacteria es la causa más importante de gastritis crónica.3,4
La reacción en cadena de la polimerasa (PCR del inglés Polymerase Chain Reaction) es un método de alta especificidad y sensibilidad, que ha sido sugerido como patrón de oro para el estudio de HP. A su favor cuenta con la ventaja de poder ser utilizada con cualquier tipo de muestra, aunque se predicen diferencias en la sensibilidad y la especificidad en dependencia de la muestra utilizada.5 No obstante, la confiabilidad que reporta en muestras de biopsia gástrica ha sido demostrada, por lo que su empleo en la detección de HP en estas muestras es muy difundido.
Con este estudio nos proponemos estimar la presencia de HP en pacientes con gastritis y en pacientes con mucosa sana, que acudieron a la Consulta de Endoscopia, del Hospital Clinicoquirúrgico "Hermanos Ameijeiras", por otros desórdenes en las vías del tracto digestivo superior.
MÉTODOS
Se realiza un estudio transversal, de junio a agosto del 2008, a 50 pacientes cubanos adultos a los que se les realizó una panendoscopia con un videogastroscopio Olympus Evis Lucera GIF H 260 y pinzas o fórceps de biopsias de la firma OLYMPUS. Se incluyeron los pacientes con diagnóstico endoscópico de gastritis erosiva (GE) y mucosa gástrica normal (MN), confirmado histológicamente. Se excluyeron los pacientes tratados con antibióticos, derivados imidazólicos o productos bismutados, omeprazol (o sus variantes farmacológicas), aspirina, antiinflamatorios no esteroideos y esteroideos en los últimos 30 días previos a la endoscopia, con sangrado digestivo alto activo, con cirugía gástrica previa (gastrectomías) y con síndrome pilórico completo o incompleto.
Las biopsias para la confirmación histológica se tomaron de antro y cuerpo (5 muestras) y se sumergieron en una solución de formol al 10 %. Posteriormente, fueron sometidas a una tinción de hematoxilina y eosina y evaluadas por un patólogo experto en afecciones del aparato digestivo.
Para la detección de HP, se tomó una muestra gástrica antral a 5 cm del píloro, se colocó en un microtubo con 0,5 mL de solución salina fisiológica estéril y se extrajo el ADN mediante el método de lisis total con Tween 20 y Proteínasa K.6
Se amplificó un fragmento de 204 pb del gen ure A, mediante un sistema semianidado.7 Se utilizaron los cebadores descritos en la tabla 1, sintetizados por la GIBCO. Las reacciones se realizaron en un termociclador minicycler research. El programa tuvo las siguientes características: 94 °C × 1 min, 55 °C × 1 min y 72 °C × 1 min. Se realizan: 30 ciclos para el primer proceso y 20 ciclos para el segundo. El método detecta al menos 100 ufc por muestra de biopsia y no presenta reacción cruzada con genoma humano, Providencia rettgeri, Morganella morganii, Pseudomona aeruginosa, Proteus mirabilis, Klebsiella pneumoneae, Klebsiella oxytoca, Citrobacter cinaedi y Escherichia coli.
Los productos se visualizaron mediante electroforesis submarina en gel de agarosa al 2 %, teñido con bromuro de etidio. El tamaño del amplicon se verifica mediante comigración con el marcador de peso molecular 100 pb Ladder (Promega).
Los resultados se vertieron en una matriz de cálculo del sistema EXCEL y se calculó la razón de productos cruzados.
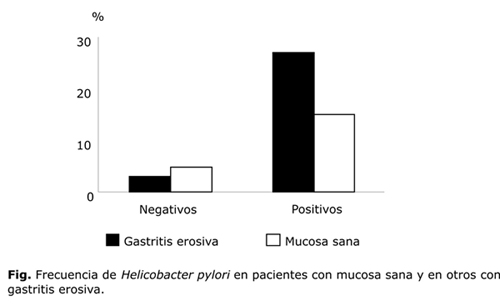
En total se estudiaron 50 pacientes, de ellos 30 tenían GE, cuyos diagnósticos fueron confirmados como gastritis crónica con actividad o sin ella y 20 tenían MN, también confirmado histológicamente. En el 90 % de los casos con GE se verificó la presencia de HP y sólo el 10 % resultó negativo. En el 75 % de los pacientes con MN también predominó la presencia de HP, sólo el 25% de ellos resultó negativo (tabla 2). Por lo que en general predominaron los pacientes infectados con HP (fig.).
La razón de productos cruzados (OR) fue 3 con un intervalo de confianza de 0,52-18,9.
DISCUSIÓN
Esta afección representa hoy la infección más frecuente en el planeta y su principal resultado no es solamente la gastritis sino las alteraciones asociadas a ella, como úlcera gastroduodenal, metaplasia intestinal, cáncer gástrico y linfoma MALT.8
La gastritis crónica por HP es muy frecuente en la población mundial y tiene alta tasa de prevalencia en Asia y en los países en vías de desarrollo. Esta enfermedad normalmente cursa de forma asintomática en la mayoría de los casos, mientras que en otros pacientes se presenta como una dispepsia hasta que aparecen las complicaciones de la enfermedad como pueden ser la úlcera péptica, el linfoma tipo MALT y el adenocarcinoma gástrico. La gastritis crónica parece ser más común en la población asiática e hispana, que en el resto de las poblaciones, afecta a ambos sexos por igual.8,9
La presencia de HP en la mucosa gástrica está directamente relacionada con el daño hístico típico de la gastritis. Al respecto se dice que aproximadamente la mitad de la población mundial presenta este tipo de complicación, que llega a ser del 90 % en los países subdesarrollados. Asimismo se sabe que del total de los pacientes aquejados de gastritis, el 80 % está infectado por HP,10 lo cual se asemeja mucho a lo reportado por nosotros en este estudio donde el 90 % de los pacientes con gastritis estaban infectados por HP.11 Estos resultados coinciden con los reportados por Gutiérrez y otros, en el 2005,12 quienes reportaron el 71 % de prevalencia de la infección en un estudio realizado mediante cultivo de biopsia gástrica. Las diferencias entre ambos estudios pudieran deberse a que la sensibilidad del PCR, utilizado por nosotros, es mucho mayor que la del cultivo.
Según Barranco,13 en la mayoría de los casos la infección por HP cursa de forma asintomática, lo que ha quedado demostrado en el presente estudio, donde el 75 % de los pacientes con mucosa sana estaban infectados por HP. Un argumento que pudiera sustentar estos hallazgos es que algunos de estos pacientes hayan adquirido la bacteria recientemente y que el muestreo realizado para este estudio se haya hecho antes de que el germen comenzara a producir los cambios en la mucosa gástrica, sin embargo, no nos parece lógico porque precisamente en ese momento los pacientes suelen desarrollar una forma aguda de la misma, denominada gastritis neutrofílica, que cursa al menos con algún tipo de infiltrado inflamatorio generalmente de neutrófilos.14
Otros trabajos desarrollados en el Instituto Nacional de Gastroenterología reportan un número de pacientes, aunque en menor proporción, infectados por HP con MN.15,16
Llama la atención que no sólo en la gastritis sino que la incidencia de úlcera gástrica, duodenal y cáncer gástrico entre los pacientes infectados por HP difiere entre individuos, países y áreas geográficas.17 Los resultados de este trabajo nos llevan a una gran interrogante, porqué unos individuos infectados por HP, desarrollan gastritis y otros no. Esta disyuntiva ha sido motivo de múltiples investigaciones donde se han demostrado factores dependientes de las cepas de bacterias, factores ambientales y dependientes del huésped. La respuesta inmunológica del huésped difiere de un individuo a otro. Las citoquinas y la apoptosis se ha propuesto que desempeñan un papel determinante en la respuesta inmunológica del huésped. Aunque la apoptosis epitelial gástrica es un proceso programado de muerte celular fisiológica para mantener un recambio celular saludable, muchos estudios han mostrado que los estómagos infectados por HP contienen mayor cantidad de células apoptóticas que los estómagos normales in vivo y que HP es capaz de inducir apoptosis en las células epiteliales gástricas in vitro.18,19
Kim y otros20 encontraron que los factores de virulencia como son el gen cagA y la producción de la citotoxina vacuolizante vacA parecen no correlacionarse con enfermedades gastroduodenales serias. Ello indica que otros factores pueden regular la evolución de los pacientes con infección por HP entre los que figuran: la región geográfica en que se lleve a cabo la colonización, la respuesta inflamatoria inmune individual, factores genéticos del huésped, factores ambientales como la dieta y la edad del paciente al momento de adquirir la infección. Esto coincide con nuestras ideas a pesar de que no disponemos de los recursos necesarios para incursionar en estos campos de la investigación como la diferenciación genómica de las cepas de HP y el polimorfismo genético del huésped que determinan la variabilidad en la respuesta inflamatoria a la infección.
Se estimó la razón de productos cruzados para evaluar el riesgo de la positividad del PCR, pero no fue estadísticamente significativa.
Se concluyó que la prevalencia de la infección por HP es elevada en los pacientes con gastritis, en nuestra población. Asimismo, la prevalencia de la infección por HP en los pacientes cubanos con mucosa gástrica sana también es elevada. Si tenemos en cuenta el resultado del cálculo del riesgo de estar infectado, podemos concluir que en nuestra población la infección por HP se comporta como en el resto de los países en vías de desarrollo, donde esta resulta tan elevada en los pacientes con gastritis como en los pacientes con mucosa gástrica sana.
REFERENCIAS BIBLIOGRÁFICAS
1. Sutton P, Wilson J, Genta R, Torrey D, Savinainen A, Pappo J et al. A genetic basis for atrophy: dominant non-responsiveness and helicobacter induced gastritis in F1 hybrid mice. Gut. 1999;45:335-40.
2. Ahmed KS, Khan AA, Ahmed I. Impact of household hygiene and water source on the prevalence and transmission of Helicobacter pylori: a South Indian perspective. Singapore Med J. jun 2007;48(6):543-9.
3. Hoshino FB, Katayama K, Watanabe K, Takahashi S, Uchimura H, Ando T. Heterogeneity in the cag A gene of Helicobacter pylori and its clinical role. J Gastroenterol. 2000;35:945-6.
4. González-Carbajal Pascual M, Concepción LI. Helicobacter pylori, gastritis crónica y úlcera gastroduodenal en Helicobacter pylori ¿el tercer dogma? La Habana: Ed. Científico Técnica; 2003.
5. Loffeld RJLF, Stobberingh E, Arends JW. A review of diagnostic techniques for Helicobacter pylori infection. Dig Dis Sci. 1993;11:173-80.
6. Roosendal R, Kuipers EJ, Van der Brule AJC, Peña AS, Uyterlinde AM, Walboomers JMM, et al. Importance of the fiberoptic endoscope cleaning procedure for detection of Helicobacter pylori in gastric biopsy specimens by PCR. J Clin Microbiol. 1994;32:1123-6.
7. Kawamata O, Yoshida H, Hirota K, Yoshida A, Kawaguchi R, Shiratori Y, et al. Nested-Polymerase Chain Reaction for the detection of Helicobacter pylori infection with novel primers designed by sequence analysis of Urease A gene in clinically isolated bacterial strains. Bioch Biophys Res Comm. 1996;219(1):266.
8. Hala MT El-Zimaity. Gastric atrophy, diagnosing and staging. World J Gastroenterol. 2006; 12(36):5757-62.
9. Giannakis M, SL Chen, SM Karam. Helicobacter pylori evolution during progression from chronic atrophic gastritis to gastric cancer and its impact on gastric stem cells. Proc Natl Acad Sci USA. 2008;105(11):4358-63.
10. Alexander GA, OW Brawley. Association of Helicobacter pylori infection with gastric cancer. Mil Med. Jan 2000;165(1):21-7.
11. Franceschi F, Genta RM, Sepulveda AR. Gastric mucosa: long-term outcome after cure of Helicobacter pylori infection. J Gastroenterol. 2002;37 Suppl 13:17-23.
12. Gutiérrez B, Vidal T, Valmaña CE, Camou-Juncas C, Santos A, Mégraud F, et al. Helicobacter pylori infection in Havana, Cuba. Prevalence and cagA status of the strains. VacciMonitor. 2005;14(2).
13. Barranco H. Gastritis crónica por Helicobacter pylori. http://www.radionuevitas.co.cu/secciones/salud_020808.asp
14. Peterson WL, Graham DY. Helicobacter pylori. En: Sleisenger and Fordtran. Enfermedades Gastrointestinales y Hepáticas. 8va. ed. 2006:775-90.
15. González-Carbajal M, Ospina A, Borbolla E. Influencia de la ingestión de bebidas alcohólicas y del Helicobacter pylori en la gastritis crónica de pacientes alcohólicos. Instituto Cubano de Gastroenterología. Rev Gastroenterol Perú. 1999.
16. González-Carbajal M, De la Cruz N, Grá B, Concepción L. Efecto de la triple terapia con metronidazol, tetraciclina y bismuto en la erradicación del Helicobacter pylori en la gastritis crónica. Instituto Cubano de Gastroenterología. Rev Peruana Gastroenterol. 2002.
17. Kitahora T. Factors to predict the outcome of Helicobacter pylori associated gastroeduodenal diseases. J Gastroenterol. 2000;35:947-48.
18. Moss SF, Calam J, Agarwal B, Wang S, Holt PR. Induction of gastric epithelial apoptosis by Helicobacter pylori. Gut. 1996;38:498-501.
19. Wagner S, Beil W, Westermann J, Logan RPH, Bock CT, Trautwein C, et al. Regulation of gastric epithelial cell growth by Helicobacter pylori: Evidence for a major role of apoptosis. Gastroenterology. 1997;113:1836-47.
20. Kim JM, Kim JS, Jung HC, Song IS, Kim CY. Virulence factors of Helicobacter pylori in Korean isolates do not influence proinflamatory citokine gene expresion and apoptosis in human gastric epithelial cells, not do these factors influence the clinical outcome. J Gastroenterol. 2000;35:898-906.
Recibido: 5 de mayo de 2009.
Aprobado: 26 de mayo de 2009.
Lic. María Teresa Martínez Echavarría. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", Servicio de Oncología, San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba. CP 10300. Correo electrónico: mtemtnez@infomed.sld.cu