Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.50 no.4 Ciudad de la Habana oct.-dic. 2011
Resultados citogéneticos en pacientes con leucemia mieloide crónica
Cytogenetic results in patients with chronic myeloid leukemia
Ms. C. Marlene Quesada Dorta,I Lic. Gretta Pantaleón Florido,I Lic. Daisy Bello Álvarez,II Dra. Karina Casanueva Calero,I Dr. José Carnot UríaI
I Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
II Editorial Ciencias Médicas. La Habana, Cuba.
RESUMEN
Introducción: La leucemia mieloide crónica es una enfermedad mieloproliferativa caracterizada por 3 fases evolutivas. La evaluación citogenética de la enfermedad permite confirmar el diagnóstico y establecer el pronóstico.
Objetivo: Reportar los resultados del estudio citogenético de 180 pacientes con diagnóstico clínico de leucemia mieloide crónica y correlacionarlos con las 3 fases de dicha neoplasia.
Métodos: El análisis cromosómico de las muestras de médula ósea se realizó por las técnicas de bandas G y los cariotipos se clasificaron según los criterios del Sistema Internacional de Nomenclatura Cromosómica.
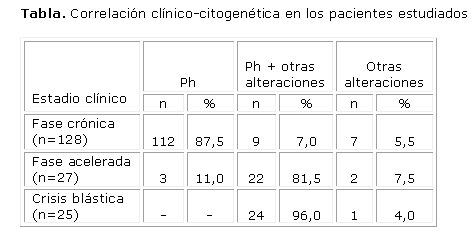
Resultados: El 94 % de los pacientes estudiados presentó la translocación t(9;22), que apareció con mayor frecuencia en los individuos en fase crónica (87,5 %). En contraste, las anomalías cromosómicas secundarias al cromosoma Philadelphia resultaron las más frecuentes en los que estaban en fase acelerada y en crisis blástica (81,5 % y 96 %, respectivamente). Los resultados obtenidos confirman la relación que existe entre las alteraciones cromosómicas y las diferentes fases evolutivas de la leucemia mieloide crónica.
Palabras clave: Leucemia mieloide crónica, citogenética, cromosoma Philadelphia, anomalías cromosómicas secundarias.
ABSTRACT
Introduction: The chronic myeloid leukemia is a myeloproliferative disease characterized by three progressive phases. Its cytogenetic analysis assessment allows us to verify the diagnosis and to establish the prognosis.
Objective: To report the cytogenetic results from 180 patients clinically diagnosed with chronic myeloid leukemia and correlate them with the three phases of such neoplasia.
Methods: The chromosomal analysis of bone marrow samples was performed using the techniques of G bands and the karyotypes were classified according to the criteria of the International System of Chromosomal Nomenclature.
Results: The 94 % of study patients had the translocation t(9:22) more frequent in subjects in chronic phase (87,5 %). In contrast, the chromosomal anomalies secondary to Philadelphia chromosome were the more frequent ones in those cases in accelerated phase and of blast crisis (81.5 % and 96 %), respectively. Results obtained confirm the relation existing among the chromosomal alterations and the different evolution phases of chronic myeloid leukemia.
Key words: Chronic myeloid leukemia, cytogenetic, secondary Philadelphia chromosome anomalies.
INTRODUCCIÓN
La leucemia mieloide crónica (LMC) es una enfermedad mieloproliferativa de carácter clonal que afecta las líneas hematopoyéticas. Es responsable del 15 % de los casos de leucemia en el mundo, con una incidencia de 1:2 casos por cada 100 000 hab.1-4 Aparece con mayor frecuencia en la población masculina y en las edades comprendidas entre 45 y 55 años aunque se ha demostrado que la incidencia aumenta con la edad (12,4 x 100 000 para el grupo de más de 85 años).1,2,5 La LMC, desde el punto de vista diagnóstico, se caracteriza por leucocitosis cuyos valores pueden oscilar entre 40 x 109/L y 300 x 109/L, con un promedio de 150 x 109/L. El otro pilar básico es la esplenomegalia.1
La LMC presenta 3 fases. La gran mayoría de los pacientes tiene una fase inicial llamada fase crónica, que dura aproximadamente de 3 a 6 años y es relativamente indolente, mantiene buena respuesta al tratamiento y menos de 5 % de blastos en sangre y médula. Con la progresión de la enfermedad hay una fase intermedia o acelerada (duración de 6 a 18 meses) caracterizada por manifestaciones clinicobiológicas que evidencian un cambio en la evolución: resistencia al tratamiento, síntomas generales, anemia, trombocitopenia, basofilia periférica (> 20 %) e incremento en el número de blastos y promielocitos en la sangre y/o la médula que pueden alcanzar 10 a 20 %. La fase final de la enfermedad (llamada fase o crisis blástica) tiene una duración de 2 a 6 meses y se caracteriza por la infiltración blástica extramedular y/o más de 20 % de células blásticas en medula ósea o sangre periférica. El cuadro clinicobiológico es similar a una leucemia aguda, con resistencia a la quimioterapia. En general, la LMC progresa lentamente de la fase crónica a la fase acelerada y, por último, a la fase blástica; pero hay casos que se transforman rápidamente de la fase crónica a la crisis blástica.6-9
La LMC fue la primera neoplasia asociada con una lesión genética. El cromosoma Philadelphia (Ph), marcador citogenético de esta enfermedad, fue descubierto en 1960 por Nowell y Hungerford,10 y posteriormente descrito, por Rowley,11 en 1973, como una translocación recíproca entre los cromosomas 9 y 22, simbolizada como t(9;22)(q34;q11)1 (Fig.). El gen híbrido BCR-ABL, resultado de esta translocación, tiene una función primordial en la patogenia de la enfermedad pues la proteína que codifica, una verdadera oncoproteína, es condición necesaria para que se desarrolle esta neoplasia.12
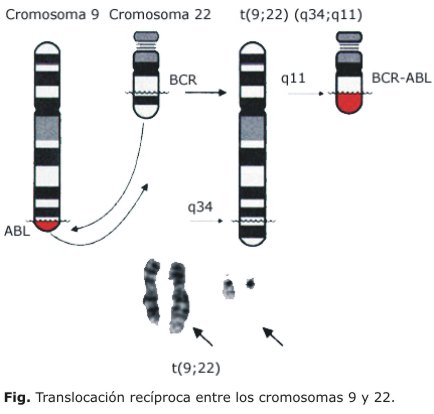
El cromosoma Ph está presente en 95 % de los pacientes desde el comienzo de la enfermedad y se mantiene en las fases más avanzadas. El porcentaje de células Ph+ disminuye con el tratamiento por lo que la respuesta a un agente terapéutico puede ser evaluada mediante el seguimiento de las metafases Ph+. Esta evolución citogenética, además de contribuir a establecer en muchos casos el pronóstico para cada paciente, constituye uno de los parámetros más importantes para el correcto seguimiento y la medición de la respuesta citogenética permite detectar la enfermedad mínima residual.1,2
El mecanismo molecular por el cual esta enfermedad progresa de una fase relativamente indolente a una más avanzada no se conoce con exactitud y se ha planteado que probablemente sea la consecuencia de una serie de cambios genéticos adicionales. Esta hipótesis se apoya en el hecho de que más de 80 % de los pacientes en etapas avanzadas (fase acelerada y crisis blástica) tienen anomalías citogenéticas secundarias, de las cuales las más frecuentes son: +8, +Ph, i(17q), +19, -Y y +21. Se ha reportado que la presencia de estas anomalías varía significativamente de acuerdo con el tratamiento recibido durante la etapa crónica.2,13-15
Este trabajo tiene como objetivo reportar los resultados de los estudios citogenéticos realizados a 180 pacientes en el Laboratorio de Genética Molecular del Hospital Clinicoquirúrgico "Hermanos Ameijeiras" con diagnóstico de LMC, desde 1983 hasta la actualidad, y correlacionarlos con las 3 fases de la leucemia mieloide crónica.
MÉTODOS
Se realizó un estudio descriptivo a 180 pacientes con diagnóstico de LMC: 86 del sexo femenino y 94, del masculino; 128 pacientes estaban en fase crónica, 27 en fase acelerada y 25 en crisis blástica. Las edades oscilaron entre 12 y 86 años, con un promedio de edad de 45 años.
Las células leucémicas se obtuvieron por aspiración de médula ósea en cresta ilíaca y se cultivaron en medio RPMI 1 640 (Gibco-BRL) suplementado al 10 % con suero fetal bovino (Gibco-BRL) y L-glutamina (10 µg/mL). Se procesaron de 3 formas diferentes: un método directo después de la incubación con Colcemid (0,05 µg/mL), durante 1 h, para obtener células en metafase y cultivos a corto plazo de 24 y 48 h.
El posterior proceso y la tinción con bandas G se realizaron de acuerdo con los métodos convencionales. Se seleccionaron las metafases de mejor morfología cromosómica para su análisis e interpretación al microscopio de luz convencional a objetivo 100X. El cariotipo se clasificó según los criterios del Sistema Internacional de Nomenclatura Cromosómica (ISNC).16 Para considerar una línea celular anormal se tomaron los criterios estándares establecidos.
RESULTADOS
El estudio citogenético de los 180 pacientes reveló que el 94 % tenía la t(9;22)(q34;q11).
De los 128 pacientes en fase crónica, 112 presentaron la t(9;22) sin alteraciones cromosómicas adicionales, en 9 se encontraron aneuploidías inespecíficas y aberraciones estructurales (deleciones y cromosomas en anillos) adicionales al Ph y 3, presentaron mosaico de cariotipo normal y cromosoma Ph (tabla).
Se hallaron anomalías cromosómicas secundarias como aneuploidías inespecíficas, trisomías de los cromosomas 8 y 22, i(17q), Ph adicional y ausencia del cromosoma Y en el 82 % de los pacientes en fase acelerada. Solamente 3 tuvieron como única alteración cromosómica la t(9;22) y 2 fueron Ph- (tabla).
De los 25 pacientes en crisis blástica, el 96 % tuvo anomalías cromosómicas secundarias y los cromosomas involucrados con mayor frecuencia fueron el 8 y el 19 (trisomías), el extra Ph y el i(17q). En un paciente se encontró una translocación recíproca que involucraba los cromosomas 5 y 15 (tabla).
DISCUSIÓN
Nuestros resultados muestran que el 94 % de los pacientes estudiados presentó el cromosoma Ph lo cual se corresponde con lo reportado en la literatura internacional. Encontramos un ligero incremento en la expresión de la t(9;22) en la población masculina lo cual se correlaciona con la mayor frecuencia de aparición de la LMC en hombres.1,5
En el 3 % de los pacientes, el estudio citogenético no demostró la existencia del cromosoma Ph aunque presentaban el cuadro clínico y citológico propio de la enfermedad. En estos casos, el análisis molecular permitiría detectar la existencia del gen híbrido BCR-ABL aunque en el cariotipo no se observe la translocación.14 De esta forma queda demostrada la utilidad de combinar ambas técnicas pues, en ocasiones, la información que brinda la citogenética convencional es limitada, ya sea por dificultades en el cultivo o por la ausencia de metafases analizables, lo cual se ha solucionado con el desarrollo de técnicas moleculares complementarias como la hibridación fluorescente in situ (FISH de sus siglas en inglés) y la reacción en cadena de la polimerasa (PCR de sus siglas en inglés).17
Las aneuploidías inespecíficas encontradas en los pacientes en fase crónica y acelerada no se reportan en la literatura con elevada frecuencia porque son anomalías que ocurren al azar e inestables genéticamente. La causa más frecuente de inestabilidad del genoma es un fallo de los mecanismos encargados de reparar las lesiones que ocurren como respuesta a tóxicos endógenos o exógenos. Se ha propuesto que el gen híbrido BCR-ABL puede inducir mutaciones en los genes que intervienen en estos mecanismos13 lo que pondría en marcha un fenotipo mutado. Solo prevalecen aquellas alteraciones que le confieren ventajas al clon leucémico y que constituyen un indicador de valor pronóstico de gran utilidad en la evolución de la enfermedad y la predicción de una fase aguda anterior a las manifestaciones clínicas.18
La trisomía 8, el isocromosoma 17 y el extra Ph constituyen marcadores citogenéticos de las fases más avanzadas (acelerada y de crisis blástica) de la LMC. El i(17q) es bastante frecuente en la crisis blástica y raramente se detecta en otros tipos de leucemias, linfomas y tumores sólidos, mientras que el cromosoma Ph adicional incrementa la expresión de la proteína BCR-ABL y sus efectos. Estos cambios cromosómicos le confieren peor pronóstico al paciente ya que la enfermedad sigue un curso más agresivo, se hace más resistente a la terapia por lo cual resulta más difícil obtener una remisión completa o de larga duración.2,14,18
Algunos autores involucran a los cromosomas 5 y 15 en variantes de translocación compleja, como cambio secundario frecuente en la crisis blástica de la LMC. En el único paciente con la t(5;15) no se pudo precisar si se trataba de una translocación de novo o si fue una variante que involucrara a los cromosomas 9 y 22 por las limitaciones de la citogenética convencional.19,20
Se concluyó que los resultados citogenéticos obtenidos son similares a los reportados en la literatura lo cual avala el trabajo realizado por el Grupo de Citogenética del Laboratorio de Genética Molecular del Hospital "Hermanos Ameijeiras" y se confirmó la relación que existe entre las alteraciones cromosómicas y las diferentes fases evolutivas de la LMC.
Estos estudios son indispensables para el diagnóstico y el pronóstico de esta neoplasia, así como para realizar el seguimiento del paciente y valorar la eficacia del tratamiento. Los resultados se deben interpretar teniendo en cuenta la historia clínica del paciente y los hallazgos de laboratorio. Por ello es necesaria una estrecha colaboración entre los citogenetistas y los hematólogos que permita interpretar el significado y el valor del cambio cromosómico hallado en determinado paciente.
REFERENCIAS BIBLIOGRÁFICAS
1. Chávez-González MA, Ayala-Sánchez M, Mayani M. La leucemia mieloide crónica en el siglo XXI: biología y tratamiento. Rev Invest Clín. 2009;61:221-32.
2. Dávila-Rodríguez M, Cerda-Flores R, Leal-Garza C, Arana-Trejo RM, Báez-de la Fuente E, Cortes-Gutiérrez E. Alteraciones cromosómicas secundarias en pacientes con leucemia mieloide crónica en un hospital del noreste de México. Gac Méd Mex. 2004;140:589-92.
3. Goldman J, Melo J. Chronic myeloid leukemia. Advances in biology and new approchaes to treatment. N Engl J Med. 2003;349:1451-64.
4. Barnes DJ, Melo J. Management of chronic myeloid leukemia. Targest for molecular therapy. Sem Hematol. 2003;40:34-49.
5. Baccarani M, Pane F, Saglio G. Monitoring treatment of chronic myeloid leukemia. Haematologica. 2008;93:161-6.
6. Cortés J, Kantarjian H. Advanced phase chronic myeloid leukemia. Sem Hematol. 2004;40:79-86.
7. Calabretta B, Perrotti D. The biology of CML blast crisis. Blood. 2004;103:4010-22.
8. Rodríguez M, Cardona A, Grajales M, Enciso L, Ruiz G, Yepes A, et al. Leucemia mieloide cronica en crisis blastica. Bases moleculares y diagnóstico. Rev Venez Oncol. 2007;19:287-96.
9. Cazzola M. IDH1 and IDH2 mutations in myeloid neoplasms-Novel paradigms and clinical implications. Haematologica. 2010;95:1623-7.
10. Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukaemia. Science. 1960;132:1497.
11. Rowley JD. A new consistent chromosomal adnormality in chronic myelogeneus leukaemia identified by quinacrine fluorescence and Giemsa staining.
12. Quintás-Cardama A, Cortés J. Molecular biology of BCR-ABL1-positive chronic myeloid leukemia. Blood. 2009;113:1619-30.
13. Kantarjian H, Schifer Ch, Jones D, Cortés J. Monitoring the response and course of chronic myeloid leukemia in the modern era of BCR-ABL tyrosine kinase inhibitors: practical advice on the use and interpretation of monitoring methods. Blood. 2008;111:1774-80.
14. Such E, Cervera J, Costa D, Solé F, Vallespí T, Luño E, et al. Cytogenetic risk stratification in chronic myelomonocytic leukemia. Haematologica. 2011;96:375-83.
15. Rowley J. Chromosomal translocations: revisited yet again. Blood. 2008;112:2183-9.
16. Shaffer LG, Slovak ML, Campbell LJ, eds. An International System for Human Cytogenetic Nomenclature. S Karger, Basel 2009.
17. Testoni N, Marzocchi G, Luatti S, Amabile M, Baldazzi C, Stacchini M, et al. Chronic myeloid leukemia: a prospective comparison of interphase fluorescence in situ hybridization and chromosome banding analysis for the definition of complete cytogenetic response: a study of the GIMEMA CML WP. Blood. 2009;114:4939-43.
18. Malcovati L, Germing U, Kuendgen A, Della Porta MG, Pascutto C, Invernizzi R, et al. Time-Dependent Prognostic Scoring System for Predicting Survival and Leukemic Evolution in Myelodysplastic Syndromes. J Clin Oncol. 2007;25:3503-10.
19. Terreros MC, Quesada M. Nueva translocación cromosómica der(5) t(5;15)(q33;q11) en un caso de leucemia mieloide crónica. Rev Arg Oncol. 1998;5:468-70.
20. Gohring G, Giagounidis A, Busche G, Hofmann W, Kreipe HH, Fenaux P et al. Cytogenetic follow-up by karyotyping and fluorescence in situ hybridization: implications for monitoring patients with myelodysplastic syndrome and deletion 5q treated with lenalidomide. Haematologica. 2011;96:319-22.
Recibido: 20 de marzo de 2011.
Aprobado: 21 de abril de 2011.
Ms. C. Marlene Quesada Dorta. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10 300. mqdorta@infomed.sld.cu