Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión impresa ISSN 0034-7523
Rev cubana med vol.52 no.3 Ciudad de la Habana jul.-set. 2013
TEMA ACTUALIZADO
La sigmoidoscopia: una alternativa útil para la pesquisa del cáncer colorrectal
Sigmoidoscopy: A useful alternative for colorectal cancer screening
Dra. Elizabeth Montes de Oca Megías,I Dra. Elsy Valentina García Jordá,I Dr. Guillermo Noa Pedroso,II Dr. Jorge Luis García Menocal,I Dra. Vivianne Anido Escobar,I Dr. Julian Ruiz TorresI
I Centro Nacional de Cirugía de Mínimo Acceso. La Habana. Cuba.
II Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana. Cuba.
RESUMEN
El cáncer colorrectal es un problema de salud cuya incidencia y mortalidad se encuentran en ascenso, incluso en edades tempranas. Dentro de sus métodos de cribado se encuentra la sigmoidoscopia flexible, pero su uso es un tema controversial, pues es defendida por algunos como un método primario de pesquisa, mientras que otros no la aceptan por la imposibilidad de la exploración total del colon. Se revisó la literatura al respecto para conocer la utilidad de la sigmoidoscopia en la disminución de la incidencia y mortalidad por esta neoplasia.
Palabras clave: cáncer colorrectal, cáncer de colon, métodos de pesquisa, estrategias de cribado, sigmoidoscopia.
ABSTRACT
Colorectal cancer is a health problem which incidence and mortality are increasing, even at early ages. Flexible sigmoidoscopy is one of its screening methods, but its use is a controversial topic because it is defined by some people as a primary screening method, while others do not accept it because of the impossibility of the total exploration of the colon. On this respect, a literature review was made to know the usefulness of sigmoidoscopy in the reduction of colorectal cancer incidence and the mortality caused by this neoplasia.
Key words: colorectal cancer, colon cancer, screening methods, screening strategies, sigmoidoscopy.
INTRODUCCCIÓN
La sigmoidoscopia flexible (SF) fue incluida dentro de las recomendaciones para el cribado del cáncer colorrectal (CCR) por la Sociedad Americana del Cáncer (ACS) en el año 1992, basados en estudios de casos y controles.1,2
A pesar de que la colonoscopia es el método de cribado más utilizado para la detección del CCR en los EE.UU.,3-5 defendido por diferentes sociedades como Preventive Services Task Force (USPSTF), American College of Gastroenterology (ACG) y ACS como la mejor estrategia de cribado para individuos de riesgo promedio, todas incluyen a la SF como un método primario de pesquisa, con una frecuencia cada 5 años. Solo el ACG la considera como una alternativa de cribaje.6-8
En los países de la Unión Europea, la colonoscopia no se recomienda como herramienta primaria para pesquisa del CCR,4,5 prefieren utilizar la SF, como lo enfatizan 3 ensayos clínicos recientes: el estudio del Reino Unido (UK trial),9 el estudio noruego para la prevención del CCR (NORCCAP)10 y el estudio italiano para el screening colo-rectal (Score trial).11
En estudios japoneses, el test inmunológico de sangre oculta en heces fecales (FIT) ha demostrado que existió una reducción de la mortalidad por CCR entre 70 % y 80 %.12-14 Otros investigadores han considerado importante la utilidad de combinar la FIT y la SF,15,16 así mismo, desde 1983 se ha llevado a cabo un screening en masa con la combinación de estas técnicas.17 También se reporta una investigación que comenzó en 1988 y ya en 1992 comienzan a utilizar pequeños endoscopios electrónicos con este fin.15-17 No se encontraron reportes de grandes estudios en América Latina para demostrar la efectividad de la SF en la disminución de la morbilidad y la mortalidad por CCR.
DESARROLLO
El CCR cumple con los criterios de la OMS para ser pesquisado,18 dada su alta incidencia y mortalidad y por la existencia de diferentes exámenes con exactitud diagnóstica y posibilidades terapéuticas que reducen la mortalidad por CCR de una manera costo-efectiva.19
Los métodos diagnósticos que van a ser utilizados en la pesquisa de cualquier enfermedad deben de reunir algunas características esenciales: ser baratos (costo-efectivo), fáciles de realizar, aceptados por la población y que demuestren eficacia, efectividad y eficiencia.20
En los Estados Unidos se han establecido guías de screening para el CCR,6-8 similares a las establecidas por la Asociación Española de Gastroenterología (AEG),21 la Organización Mundial de Gastroenterología (WGO),22 así como la de otros países como Colombia y Chile.23 Todas incluyen a la SF como método de tamizaje para población de riesgo medio (adultos asintomáticos mayores de 50 años, sin otros factores de riesgo), con algunas diferencias en cuanto a las recomendaciones (cuadro 1).
La SF se realiza con un endoscopio que permite examinar hasta 60 cm del margen anal (recto, sigmoides y parte del colon descendente), previo lavado del colon con un enema o administración de laxantes y sin necesidad de sedación. La duración de la exploración es de 10-15 min. La detección de una lesión premaligna o una neoplasia obliga a efectuar un examen completo mediante colonoscopia, dado que existe un riesgo superior a 2, de encontrar lesiones sincrónicas proximales.24,25
Diversos estudios demuestran que la SF reduce la incidencia y mortalidad por CCR. Selby y otros,2 en un estudio de casos y controles, analizan los antecedentes de SF de cribaje en un grupo de 261 pacientes que murieron de CCR distal y un grupo control de 868 sujetos del mismo plan y encontró que este método fue menos empleado en los pacientes fallecidos (8,8 %), que en los del grupo control (24,2 %), con lo cual demostró que el riesgo de muerte se redujo en los individuos con SF de cribaje con un odds ratio de 0,3 (0,19-0,48).
Otra investigación similar fue realizada por Newcomb y otros,1 en Wisconsin, EE. UU., quienes analizaron también los antecedentes de SF de cribaje en un grupo de 66 sujetos que murieron de CCR y un grupo control de 196 sujetos, ellos hallaron que la SF se realizó mucho menos en los pacientes muertos por CCR (10 %), que en los del grupo control (30 %) y el riesgo de muerte por CCR se redujo en los individuos con SF de pesquisa, odds ratio de 0,21 (0,08-0,52).
También Muller y Sonnenberg,26 en otro estudio de casos y controles (1988-92), en veteranos del ejército USA, valoraron los antecedentes de SF de cribaje con un grupo de estudio de 4 337 sujetos que murieron de CCR, pero con 2 grupos controles, el primero con 16 531 pacientes vivos y el segundo con 16 199 fallecidos y encontraron, igualmente, que este método de tamizaje protegió para el CCR con odds ratio de 0,41 (0,33-0,50) respecto al grupo control de vivos y de 0,44 (0,36-0,53) para el grupo de fallecidos (cuadro 2).
El estudio aleatorizado de Telemark, Noruega, se inició en 1983 con 400 personas asignadas al azar a un examen de pesquisa y 399 para un grupo de control sin cribado. A los 13 años se informó una reducción del riesgo de incidencia de CCR del 80 % en el grupo de estudio en comparación con el grupo control. En esta investigación la tasa de asistencia fue muy elevada (81 %) y a todos los individuos con pólipos detectados en la pesquisa se les realizó colonoscopia, luego de la revisión, a los 2 y 6 años.27
En Europa se han realizado algunas investigaciones dirigidas a evaluar la efectividad de una única SF a los 60 años, las más sobresalientes son UK Flexible Sigmoidoscopy Screening Trial9 y el Italian multicenter randomized controlled trial of "once-only" sigmoidoscopy.11 En el primero se tomó un grupo control de 112 939 personas que no se realizaron screening y como grupo estudio 57 099 individuos sometidos a una SF, se detectaron 2 051 personas con adenomas de alto riesgo (5 %) tratadas y sometidas a colonoscopia, en el seguimiento a los 11 años se diagnosticaron 706 personas con CCR, mientras en el grupo control se encontraron 1 018 personas con CCR, se demostró que hubo una reducción de la incidencia por CCR para el colon distal en 50 % y para todo el colon, de 33 % y una disminución de los índices de la mortalidad por CCR en 43 %; además, el estudio mostró que la SF es segura, factible y con buena aceptación por la población.9
El reporte italiano estuvo representado por un grupo de intervención de 17 148 pacientes con 251 casos diagnosticados de CCR, con 65 fallecidos para una mortalidad de 34,66/100 000 personas/año y el grupo control estuvo constituido por 17 144 pacientes, de estos 306 con CCR y 83 defunciones, con una mortalidad de 44,45/100 000 personas/año, con una reducción de incidencia y mortalidad de 31 % y 38 %, respectivamente, lo que demuestra la utilidad de este método.11 Sin embargo, Hoff,10 en su estudio NORCCAP (Norwegian Colorectal Cancer Prevention Study), no logró demostrar una disminución en la incidencia de CCR mediante pesquisa con SF con 7 años de seguimiento, pero la mortalidad si mostró una reducción de 59 % para CCR de cualquier localización y de 76 % para el cáncer rectosigmoideo (cuadro 3).
El programa de cribado PLCO (próstata, pulmón, colon y ovario), llevado a cabo en EE. UU., incluyó 77 465 hombres y mujeres de 55-74 años, de estos 64 658 sujetos (83,5 %) fueron sometidos a SF y se identificó al menos un pólipo o masa en 15 150 de ellos (23,4 %). Al 74,2 % de estos se les mantuvo seguimiento con colonoscopia. El proceder tuvo gran aceptación y el seguimiento fue mayor en sujetos con pólipos mayores de 0,5 cm.28 Recientemente, se reportaron datos de una investigación de este programa de pesquisa realizado inicialmente en 10 centros de detección y con un estudio posterior a los 3 o 5 años. De 77 447 inscritos, 67 073 (86,6 %) tenían al menos 1 SF y 39 443 (50,9 %) tenían 2. La intervención de diagnóstico se produjo en 74,9 % después de un primer resultado positivo y en 78,7 % después de un SF de repetición positiva. La segunda SF aumentó el rendimiento de detección en 32 %. El CCR o adenoma avanzado se detectó en 37,8 por cada 1 000 personas, después de la primera proyección y en 49,8 por cada 1 000 personas después de todas las proyecciones. La segunda SF aumentó el rendimiento de detección de cáncer o adenoma avanzado en 26 % en mujeres y en 34 % en los hombres. De 223 sujetos que recibieron un diagnóstico de CCR, el 80 % se hizo en estadios tempranos (64,6 % en estadio I y 17,5 % en estadio II).29
Liebermam30 plantea que existe una asociación significativa entre el uso de la SF y la reducción de la mortalidad por CCR en la región explorada, no se comporta así para la incidencia. La SF posee una sensibilidad elevada (70-80 %) para las lesiones situadas al alcance de esta. Cuando se detecta un carcinoma o un adenoma ![]() 1 cm, lo más indicado es realizar la colonoscopia, dada la mayor incidencia de lesiones sincrónicas proximales.5,31
1 cm, lo más indicado es realizar la colonoscopia, dada la mayor incidencia de lesiones sincrónicas proximales.5,31
Sin embargo, existe controversia sobre la necesidad de explorar todo el colon cuando se detecta un adenoma < 10 mm, especialmente si es tubular y con displasia de bajo grado.23 Un metaanálisis reciente que incluye 13 estudios demuestra que el riesgo de presentar una neoplasia proximal es de 2,68 (IC del 95 %: 1,93-3,73) para cualquier adenoma distal y de 2,36 (IC del 95 %: 1,30-4,29) para adenomas < 10 mm.32 Esta asociación también existe, aunque sin alcanzar la significación estadística, cuando el pólipo distal es hiperplásico (OR: 1,44; IC del 95%: 0,79-2,62).32
Senore y otros,33 de 426 individuos con pólipos diagnosticados mediante SF, detectaron neoplasia avanzada mediante colonoscopia en 9,4 % de los pacientes con pólipos distales de alto riesgo y del 2,5 % en aquellos con pólipos de bajo riesgo, por lo que consideran una estrategia costo efectiva limitar la colonoscopia para pacientes referidos con pólipos distales de alto riesgo.
En un estudio chino que compara la eficacia de la sangre oculta en heces, la SF y la colonoscopia, se detectó que de 26 pacientes con lesiones avanzadas en el colon proximal, 14 (53,8 %) no presentaban alteración alguna del colon distal. La sensibilidad y la especificidad de la sangre oculta en heces para las lesiones avanzadas de colon fueron 14,3 % y 79,2 %, mientras que para la SF fue de 77,8 % y 83,9 %, respectivamente. La combinación de sangre oculta en heces con la SF no mejoraría significativamente los resultados de la SF por sí sola y la colonoscopia resultó ser el método más seguro y preciso para la detección de neoplasias colorrectales.34
Dos estudios japoneses, uno sobre la combinación de la SF con la sangre oculta en heces fecales y otro sobre la utilidad del método endoscópico en programas de cribaje, comentan que la SF por sí sola puede detectar alrededor del 70 % de los CCR y adenomas, pero no puede detectar las lesiones en el colon proximal. En contraste, dos tercios de los cánceres no detectados por sangre oculta en heces fecales existen en el recto y sigmoides. Por lo tanto, la desventaja de cada prueba puede ser complementada por la combinación de las dos.35,36 Saito refiere que la colonoscopia completa o la combinación de la SF con el enema de bario de doble contraste debe ser recomendado para los pacientes con resultados positivos de sangre oculta en heces fecales.37 Nozaki y otros consideran que la SF debe prevalecer por su fácil preparación, la brevedad del proceder y el menor porcentaje de complicaciones, es más segura que la colonoscopia, aumenta su eficacia en mayores de 50 años y en aquellos que se someten al examen por primera vez cuando es combinado con una prueba de sangre oculta en heces.38
Pareciera que el uso de la SF en el sexo femenino pudiera no ser tan beneficiosa.39,40 Las mujeres son más propensas a tener una SF limitada, por el aumento en la angulación del colon y el dolor durante el examen.39 Un estudio de cribaje de CCR que evaluó a féminas asintomáticas determinó que al 35 % de las pacientes con neoplasia avanzada se les había identificado mediante SF.40 Otros investigadores han postulado que la SF pudiera ser menos eficaz en poblaciones específicas, como se ha demostrado que las lesiones proximales avanzadas pueden estar asociadas con la edad y la raza negra.41,42
Existen evidencias de que este examen puede ser llevado a cabo con alta calidad por médicos no gastroenterólogos y personal no médico entrenado.43,44 Shapero y otros avalan que la realización de SF por enfermeros es segura, sobre todo en circunstancias de pesquisa, y con idéntica rentabilidad diagnóstica que la efectuada por endoscopistas expertos.45
No obstante, es necesario que este proceder se realice de manera que los indicadores de calidad se cumplan, tales como la profundidad adecuada de la inserción y las tasas de detección de adenoma.25,46,47 Fracchia y otros, en su estudio aseguran que el índice de detección de adenomas en la SF depende de la calidad de la preparación del colon distal, del tiempo de exploración, de completar la SF y de la experiencia del examinador.31
Otra ventaja de la SF es su seguridad, aunque no está exenta de riesgo. El ensayo clínico UK Flexible Sigmoidoscopy estima que se producen 0,3 casos de hemorragia, 0,025 perforaciones y 0,15 muertes por cada 1 000 exploraciones.9,47 Levin y otros, en su estudio plantean que el número de complicaciones que aparecen tras una SF es sustancialmente bajo en correspondencia con la colonoscopia.48 Además, estos mismos autores la consideran un parámetro para medir la calidad del proceder.49
Como ya se mencionó, la presencia de pólipos distales se asocia con un mayor riesgo de pólipos proximales.50-53 Sin embargo, sólo la mitad de las neoplasias proximales avanzadas están asociadas con lesiones distales, lo que apoya la realización de la colonoscopia.50-53
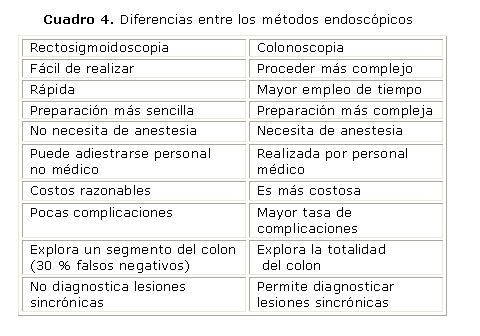
Aunque la colonoscopia es ampliamente considerada como la prueba de oro para la evaluación de las enfermedades del colon, la SF ofrece varias ventajas para el cribado. Estos incluyen fácil preparación, menor tiempo de exploración, mayor aceptabilidad, no necesita sedación, menor tasa de complicaciones y la posibilidad de que el procedimiento sea realizado por médicos no gastroenterólogos, enfermeras y asistentes entrenados 51-54 (cuadro 4). Además, diversos estudios han demostrado su utilidad en la disminución de la incidencia y la mortalidad del CCR. Esto demuestra que los programas de pesquisa pueden ser implementados y extendidos por todo el mundo, dado que la tasa de cribado en muchos países es baja, por el pobre soporte económico.24 Todos estos atributos sugieren que la SF puede ser una efectiva primera línea de estrategia de cribado, sobre todo en poblaciones de bajos recursos. A partir de aquí, la Organización Mundial de Gastroenterología propone una cascada de pesquizaje de CCR, que se basa en una serie de recomendaciones que se aplican a los diferentes niveles en función de la disponibilidad de recursos22 (cuadro 5).
Se concluye que la SF es un método de cribaje útil que influye sobre la reducción de la incidencia y la mortalidad del CCR distal y de una forma menos significativa, la del CCR proximal. Su uso debe adecuarse al contexto del lugar y a la situación socioeconómica donde se vaya a pesquisar, tomando como premisa que lo importante es detectar tempranamente la enfermedad y realizar terapéuticas oportunas para disminuir la incidencia y la mortalidad por esta causa.
REFERENCIAS BIBLIOGRÁFICAS
1. Newcomb PA, Norfleet RG, Storer BE, Surawicz TS, Marcus PM. Screening sigmoidoscopy and colorectal cancer mortality. J Natl Cancer Inst. 1992;84:1572-5.
2. Selby JV, Friedman GD, Quesemberry CP, Weiss NS. A case-control study of screening sigmoidoscopia and mortality from colorrectal cancer. N Engl J Med. 1992;326:653-7.
3. Wang A, Lieberman D. Screening Guidelines for Colorectal Cancer: What Should We Advocate to Our Patients? Curr Colorectal Cancer Rep. 2010;6:8doi 15.D 10.1007/s11888-009-0036-3.
4. Hoff G, Dominitz JA. Contrasting US and European approaches to colorectal cancer screening: which is best? Gut. 2010;59:40714.
5. Bretthauer M. Colorectal cancer screening. J Intern Med. 2011;270:8798.
6. Calonge N, Petitti DB, DeWitt TG, Dietrich AJ, Gregory KD, Harris R, et al. US Preventive Services Task Force. Screening for colorectal cancer: US Preventive Services Task Force recommendation statement. Ann Intern Med. 2008;149:627-37.
7. Levin B, Lieberman DA, McFarland B, Smith RA, Brooks D, Andrews KS, et al. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology. CA Cancer J Clin. 2008,58:130-60.
8. Rex DK, Johnson DA, Anderson JC, Schoenfeld PS, Burke CA, Inadomi JM. American College of Gastroenterology guidelines for colorectal cancer screening 2009 [corrected]. Am J Gastroenterol. 2009,104:739-50.
9. Atkin WS, Cuzick J, Duffy SW, Edwards R, Hart A, Kralj-Hans I, et al. UK Flexible Sigmoidoscopy Screening Trial. Lancet. 2010;375:1624-33.
10. Hoff G, Grotmol T, Skovlund E, Bretthauer M. Norwegian Colorectal Cancer Prevention Study (NORCCAP):BMJ. 2009;338:b1846.
11. Segnan N, Senore C, Bonelli LA, Andreoni B, Giliani O, Giacomin A, et al. Once-Only Sigmoidoscopy in Colorectal Cancer Screening: Follow-up Findings of the Italian Randomized Controlled Trial—SCORE. J Natl Cancer Inst. 7 Sep 2011;103(17):1310-22.
12. Ross W. Colorectal cancer screening in evolution: Japan and the USA. J Gastroenterol Hepatol. 2010;25(SUPPL.1):S49-S56.
13. National Cancer Center: Center for Cancer Control and Information Services. Cancer Statistics in Japan `07. [citado 15 May 2009]. Disponible en: http://ganjoho.ncc.go.jp/public/statistics/ backnumber/2007_en.html
14. Lee KJ, Inoue M, Otani T, Iwasaki M, Sasazuki S, Tsugane S. Colorectal cancer screening using fecal occult blood test and subsequent risk of colorectal cancer: a prospective cohort study in Japan. Cancer Detect Prev. 2007;31:3-11.
15. Fujiyoshi T, Takagi K, Fujiyoshi M, Hashimoto M, Tsuji Y, Fujimoto N, et al. Sigmoidoscopy and other tests for screening of colorectal cancer. J Med Syst. 1993;17:157-62.
16. Nozaki R, Takagi K, Takano M. Mass screening method for colorectal cancer using an endoscopy-built-in special car. Ther Res 1997;18(Suppl. 2):S524S530 (resumen en japonés y en inglés).
17. Nozaki R, Tanaka N, Tadakuma N, Morita N, Takano M. Colorectal cancer screening using a combination of fecal occult blood testing and flexible sigmoidoscopy. Early Colorectal Cancer. 2001;5:179-84 (resumen en japonés y en inglés).
18. Wilson JM, Jungner YG. Principles and practice of mass screening for disease. Bol Oficina Sanit Panam 1968; 65(4): 281-293.
19. Morales Cuenca G, Aguayo Albasini J L. Cribaje del cáncer colorrectal en la población de bajo riesgo (sin factores de riesgo conocidos). Arch Cir Gen Dig 2003 Jul 28. Disponible en: http://www.cirugest.com/revista/2003-07-28.htm.
20. Lieberman D. Colorectal cancer screening in primary care. Gastroenterology. 2007;132:2591-4.
21. Grupo de trabajo de la guía de práctica clínica de prevención del cáncer colorrectal. Guía de práctica clínica. Barcelona: Asociación Española de Gastroenterología, Sociedad Española de Medicina de Familia y Comunitaria y Centro Cochrane Iberoamericano; 2009. [citado 20 Sep 2012] Disponible en: http://www.guiasalud.es/GPC/GPC_494_colorrectal_(2009).pdf
22. WGO/IDCA Internacional para Cáncer Digestivo: Tamizaje del cáncer colorrectal. [citado 28 Mar 2012] Disponible en: http://www.worldgastroenterology.org/colorrectal-cancer -screening.html
23. Sáenz Roque. Cáncer colorrectal. Una proposición de protocolos de diagnósticos y tratamiento para países de Latinoamérica. Reunión de Consenso. Santiago de Chile; 2004. [citado Jun 7, 2008] Disponible en: http://www.aige.org/protocolos.php
24. Lieberman D. Progress and Challenges in Colorectal Cancer Screening and Surveillance. Gastroenterology 2010;138:2115-26.
25. Atkin W, Rogers P, Cardwell C, Cook C, Cuzick J, Wardle J, et al. Wide variation in adenoma detection rates at screening flexible sigmoidoscopy. Gastroenterology. 2004;126:1247-56.
26. Müller AD, Sonnenberg A. Protection by endoscopy against death from colorrectal cancer. Arch Intern Med. 1995; 155:1741-8.
27. Thiis-Evensen E, Hoff GS, Sauar J, Langmar kF, Majak BM, Vatn MH. Population-based surveillance by colonoscopy: effect on the incidence of colorectal cancer. Telemark Polyp Study I. Scand J Gastroenterol. 1999;34:414-20.
28. Weissfeld JL, Schoen RE, Pinsky PF, Bresalier RS, Church T, Yurgalevitch S, et al. Flexible sigmoidoscopy in the PLCO cancer screening trial: results from the baseline screening examination of a randomized trial. J Natl Cancer Inst. 6 Jul 2005;97(13):989-97.
29. Weissfeld JL, Schoen RE, Pinsky PF, Bresalier RS, Doria-Rose VP, Laiyemo AO, et al. Flexible sigmoidoscopy in the randomized prostate, lung, colorectal, and ovarian (PLCO) cancer screening trial: added yield from a second screening examination. J Natl Cancer Inst. 22 Feb 2012;104(4):280-9.
30. Lieberman DA. Screening for Colorectal Cancer. N Engl J Med 2009; 361:1179-87.
31. Fracchia M, Senore C, Armaroli P, Ferraris R, DiPlacido R, Musso A, et al. Assessment of the multiple components of the variability in the adenoma detection rate in sigmoidoscopy screening, and lessons for training. Endoscopy. 2010;42:448-55.
32. Lewis JD, Ng K, Hung KE, Bilker WB, Berlin JA, Brensinger C, et al. Detection of proximal adenomatous polyps with screening sigmoidoscopy: a systematic review and meta-analysis of screening colonoscopy. Arch Intern Med. 2003;163:413-20.
33. Senore C, FONT ="#0000ff">Segnan N, Bonelli L, Sciallero S, Pennazio M, Angioli D, et al. Predicting proximal advanced neoplasms at screening sigmoidoscopy. Dis Colon Rectum.Agos 2004;47(8):1331-40.
34. Sung JY, Chan FK, Leung WK, Wu JC, Lau JY, Chinkg J, et al. Screening for Colorectal Cancer in Chinese: Comparison of Fecal Occult Blood Test, Flexible Sigmoidoscopy, and Colonoscopy. Gastroenterology. 2003;124:608-14.
35. Onoue K, Suzuki Y, Suzuki K. A study on the method for mass screening of colorectal cancer, the third report: a screening program using fecal occult blood test and sigmoidoscopy. J Gastroenterol Mass Surv. 1995;33:5003 (en japonés).
36. Tsuji Y, Takano M, Nozaki R. Usefulness of sigmoidoscopy in predicting disease of the deeper colon. J Jpn Soc Coloproctol 1998;51:547-54 (resumen en japonés y en inglés).
37. Saito H. Screening for colorectal cancer: current status in Japan. Dis Colon Rectum. 2000;43(Suppl.):S78-S84.
38. Nozaki R, Murata R, Tanimura S, Ohwan T, Ogata S, Yamada K, et al. Community based mass screening for Colorectal Cancer by a combination of fecal occult blodd testing and flexible simoidoscopy. Digestive Endoscopy. 2006;18:122-7.
39. Euloubeidi MA, Farraye FA, Wallace MB. Why are women likely than men to have a limited screening flexible sigmoidoscopy?. A study of 3 701 patients. Gastroenterology. 2000;118(4):A258.
40. Schoenfeld P, Cash B, Flood A, Dobhan R, Eastone J, Coyle W, et al. Colonoscopic screening of average-risk women for colorectal neoplasia. N Engl J Med 2005, 352:2061-8.
41. Lieberman DA, Holub JL, Moravec MD, Eisen GM, Peters D, Morris CD. Prevalence of colon polyps detected by colonoscopy screening in asymptomatic black and white patients. JAMA. 2008,300:1417-22.
42. Levin TR, Palitz A, Grossman S, Conell C, Finkler L, Ackerson L, et al. Predicting advanced proximal colonic neoplasia with screening sigmoidoscopy. JAMA. 1999;281:1611-7.
43. Maule WF. Screening for colorectal cancer by nurse endoscopists. N Engl J Med. 1994;330:183-7.
44. Schoen RE, FONT ="#0000ff">Pinsky PF, Weissfeld JL, Bresalier RS, Church T, Prorok P, et al. Results of repeat sigmoidoscopy 3 years after a negative examination. JAMA. 2003;290:41-8.
45. Shapero TS, Hoover J, Paszat LF, Burgis E, Hsieh E, Rothwell DM, et al. Colorectal cancer screening with nurse-performed flexible sigmoidoscopy: results from a Canadian community-based program. Gastrointest Endosc.2007;65(4):640-5.
46. Levin TR, Farraye FA, Schoen RE, Hoff G, Atkin w, Bond JH, et al. Quality in the technical performance of screening flexible sigmoidoscopy: recommendations of an international multi-society task group. Gut. 2005;54:807-13.
47. Derleth M, Dominitz JA. One-Time Flexible Sigmoidoscopy reduces Colorectal Cancer Incidence and Mortality. Gastroenterology. 2010;139:1784-91.
48. Levin T, Conell C, Shapiro J, Chazan S, Nadel M, Selby J. Complications of Screening Flexible Sigmoidoscopy. Gastroenterology. 2002;123:1786-92.
49. Levin TR, Farraye FA, Schoen RE, Hoff G, Atkin W, Bond JH, et al. Quality in the technical performance of screening flexible sigmoidoscopy: recommendations of an international multisociety task group. Gut. 2005;54:807813. doi: 10.1136/gut.2004.052282.
50. Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med. 2000;343:169-74.
51. Smith RA, Cokkinides V, Brawley OW. Cancer Screening in the United States, 2012. A Review of Current American Cancer Society Guidelines and Current Issues in Cancer Screening. CA Cancer J Clin. 2012;62:129-42.
52. Hoff G, Dominitz JA. Contrasting US and European approaches to colorectal cancer screening: which is best? Gut. 2010;59:407-14.
53. Ransohoff DF. How much does colonoscopy reduce colon cancer mortality? Ann Intern Med. 2009;150:50-2.
54. Levin T, Conell C, Shapiro J, Chazan S, Nadel M, Selby J. Complications of Screening Flexible Sigmoidoscopy. Gastroenterology. 2002;123:1786-92.
Recibido: 16 de enero de 2013.
Aprobado: 8 de junio de 2013.
Dra. Elizabeth Montes de Oca Megías. Centro Nacional de Cirugía de Mínimo Acceso, Calle Párraga No. 215, entre San Mariano y Vista Alegre. La Víbora. 10 de Octubre. La Habana, Cuba.