Introducción
La enfermedad celíaca es un trastorno sistémico asociado a la hipersensibilidad del gluten que afecta primariamente el intestino delgado y se asocia a la presencia de anticuerpos específicos.1 Los estimados de la prevalencia de enfermedad celíaca en la población general varían ampliamente, pero los estudios de mayor escala de países occidentales han comunicado una prevalencia entre 0,5 % y 1 %.2,3
Dentro de la diversidad de manifestaciones que identifican a la enfermedad celíaca sintomática, las intestinales o abdominales son las que con mayor frecuencia obligan a recurrir a las consultas médicas.4 La incertidumbre diagnóstica es acentuadamente importante en los pacientes con síntomas intestinales. El reto diagnóstico es distinguir los problemas gastrointestinales únicamente funcionales, de las afecciones orgánicas, como la enfermedad celiaca.
El diagnóstico oportuno de la enfermedad celíaca urge también porque asegura la solución del problema de salud, se considera que la adherencia a una dieta libre de gluten resuelve típicamente los síntomas y puede prevenir las morbilidades asociadas a la celiaquía.5
Las pruebas serológicas para la detección de anticuerpos antitransglutaminasa tisular (anti-TGt) es el primer paso diagnóstico de la enfermedad celíaca, pero su desempeño varía apreciablemente en los diferentes escenarios clínicos y poblaciones.6 Varios estudios nacionales han investigado la utilidad de los anticuerpos anti-TGt para el diagnóstico de la celiaquía limitados a la población pediátrica. En el estudio nos dirigimos a definir la seroprevalencia de los anticuerpos anti-TGt de clase IgA e IgG (IgA/G) también en la población adulta con manifestaciones intestinales sugestivas de enfermedad celíaca.
Métodos
Se realizó un estudio descriptivo transversal para la determinación de autoanticuerpos de celiaquía realizada en el departamento de laboratorio clínico del Hospital Clínico Quirúrgico “Hermanos Ameijeiras” del Ministerio de Salud Pública de Cuba (MINSAP). Todos los procedimientos efectuados en este estudio fueron realizados con fines diagnósticos en correspondencia con los estándares éticos de la comisión científica del hospital en estudio. Los métodos se desarrollaron según los procedimientos operativos aprobados. Se obtuvo además el consentimiento informado de cada participante en el estudio.
La población de estudio consistió en 87 pacientes consecutivos referidos al departamento de laboratorio clínico con la indicación médica de la prueba de anticuerpos de celiaquía por presentar síntomas sugestivos de celiaquía desde febrero de 2019 hasta febrero de 2020. Como criterios de inclusión se consideró la presencia de síntomas gastrointestinales crónicos como: diarrea, distensión abdominal, dispepsia, dolor abdominal y hábitos irregulares. Se excluyeron los pacientes con diagnóstico previamente establecido de enfermedad celiaca, los adheridos a dieta libre de gluten, y los menores de dos años de edad. El diagnóstico serológico de enfermedad celiaca fue confirmado por los datos histológicos característicos de enfermedad celíaca obtenidos de la biopsia duodenal.7 Se consideró como pacientes pediátricos a los < 18 años y adultos a los ≥ 18 años. Los datos demográficos, clínicos e histológicos se obtuvieron de la historia clínica y digital de los pacientes.
Determinación de los anticuerpos antitransglutaminasa tisular
La determinación de los anticuerpos anti-TGt IgA/G se realizó por los métodos de ELISA e inmunoblot. Los anticuerpos anti-TGt de isotipos IgA e IgG fueron cuantificados en muestras de suero diluidas 1:101en microplacas de ELISA recubiertas de transglutaminasa (TGt) recombinante humana unida a péptidos específicos de gliadina, lo que permite la exposición de neoepitopos de TGt para aumentar la sensibilidad y especificidad de la prueba (CeliCheck New Generation, AESKU.DIAGNOSTICS GmbH & Co. KG, Wendelsheim, Germany; distribuida por BioLab, Ciudad de Panamá, Panamá). Estos epitopos no muestran reacciones cruzadas con la gliadina. Se utilizó el antisuero anti-IgA/G conjugado con peroxidasa para garantizar la detección de ambas clases de inmunoglobulinas y evitar los falsos negativos de pacientes con déficit de IgA. Las concentraciones de los anticuerpos anti-TGt fueron calculadas sobre una curva de calibración de seis puntos (rango: 0-300 U/mL) y expresadas en U/mL. Los resultados se consideraron válidos cuando los valores de los controles positivo, negativo y el de corte estuvieron en el rango de referencia. Según la recomendación del fabricante se consideraron como positivos de anti-Tgt los valores ≥ de 24 U/mL.
Los anticuerpos anti-TGt IgA/G también fueron evaluados cualitativamente por la plataforma múltiplex de inmunoblot que detecta simultáneamente cinco especificidades de anticuerpos de enfermedades intestinales (Gastro Pro, AESKU.DIAGNOSTICS GmbH & Co. KG, Wendelsheim, Germany; distribuida por BioLab, Ciudad de Panamá, Panamá). La prueba de gastro pro fue aplicada solo en pacientes con resultados positivos de anti-TGt por ELISA y los que tenían indicaciones médicas además de los anticuerpos de celiaquía, de otros anticuerpos gastrointestinales. El inmunoblot gastro pro es un enzimoinmunoensayo de membrana, en el cual los distintos antígenos están aplicados en forma de líneas sobre una membrana de nitrocelulosa. Las tiras de membrana con los antígenos específicos se incuban con muestras de suero diluidas en una proporción 1:101. El antisuero anti-IgA y anti-IgG conjugado con peroxidasa reconoce la presencia del anticuerpo del paciente en la línea de los neo-epitopos de la TGt. Tras la adición del sustrato, una reacción enzimática convierte el conjugado en un precipitado azul. Los resultados se consideraron válidos cuando los controles fueron visibles y el control funcional de mayor intensidad de color que el de corte. Los resultados se interpretaron tomando como referencia exclusivamente el control de corte de cada tira.
Los resultados de las determinaciones de los AAI fueron registrados en la historia clínica del paciente de la base de datos correspondiente al software GALEN Clínicas del hospital del estudio.
Para llevar a cabo el análisis estadístico se utilizó el paquete estadístico Statistical Package Social Science (Spss) 20.0 se utilizó para el análisis de datos. Las pruebas para la normalidad demostraron una distribución asimétrica de los anticuerpos. La estadística descriptiva se expresó como mediana, amplitud intercuartil (AI) y rango mínimo-máximo para las variables continuas y como frecuencia y porcentaje para las variables categóricas. Las variables cuantitativas se analizaron con la prueba U de Mann-Whitney.
La concordancia entre los resultados clasificados como positivos y negativos de los métodos de ELISA e inmunoblot se evaluó mediante el cálculo del coeficiente de concordancia Kappa (k). Los valores de k pueden oscilar desde 0 (concordancia nula) hasta 1 (concordancia máxima). Se tomó en consideración la interpretación cualitativa del índice de Kappa de Landis y Koch utilizada clásicamente, en la que la fuerza de concordancia se califica como: pobre o débil para valores menores a 0,40; moderada para valores de entre 0,41 y 0,60; buena para valores entre 0,61 y 0,80; y muy buena para valores superiores hasta 1.8
La significación estadística fue definida como p<0,05 calculado bilateralmente (2-tailed).
Resultados
Se conformó una muestra de 87 pacientes, de los cuales 83 (95,4 %) fueron adultos y 4 (4,6 %) fueron pediátricos. El sexo femenino predominó en los pacientes adultos, y la distribución entre femenino y masculino fue igual en los pacientes pediátricos. Se presenta la media de edad de ambos grupos (Tabla 1).
Tabla 1 Características demográficas de la población estudiada (n=87)
|
Edad años |
Femeninas n % | ||
|---|---|---|---|
| Media/DE | Rango | ||
| Adultos, n=83 | 42,82/14,58 | 18-75 | 49 (59,04) |
| Pediátricos, n=4 | 6,50/4,04 | 3-12 | 2 (50,0) |
DE: desviación estándar.
La frecuencia de los resultados positivos de los anticuerpos anti-TGt IgA/G determinados por los métodos de ELISA e inmunoblot se muestra en la tabla 2. Siete pacientes resultaron positivos de anticuerpos anti-TGt IgA/G por el método de ELISA, de los cuales 6 fueron pacientes adultos, y 5 (71,4 %) fueron del sexo femenino. Dos de los pacientes positivos de anti-TGt IgA/G fueron individuos mayores de 50 años. La prueba de inmunoblot, que se aplicó a 50 pacientes, se correspondió con 9 resultados positivos de anti-TGt IgA/G, de los cuales 8 fueron de adultos y 5 (55,6 %) fueron del sexo femenino. La prevalencia de anti-Tgt IgA/G en este trabajo resultó más frecuente en la población pediátrica que en la adulta. (1/4; 25,0 % vs 6/83; 7,23 %).
La frecuencia de los resultados positivos de anti-Tgt IgA/G por cualquiera de los dos métodos utilizados (ELISA/ inmunoblot) fue superior a los resultados positivos de ELISA e inmunoblot por separado.
Los 7 pacientes positivos de anticuerpos anti-TGt por ELISA fueron evaluados por histología duodenal que resultó en atrofia de las vellosidades e infiltración intraepitelial de linfocitos, hallazgos correspondientes con la presencia de enfermedad celiaca en el 100,0 % (7/7) de estos (Tabla 2).
Tabla 2 Frecuencia y títulos séricos de anticuerpos anti-transglutaminasa tisular (TGt) IgA/G por los métodos de ELISA e inmunoblot
| Anti-TGt IgA/G Frecuencia n (%) | Mediana/AI UI/mL | Media/DE UI/mL | Rango UI/mL | |
| ELISA n=87 | 7 (8,05) | 2,0/5,0 | 9,57/30,10 | 1-222 |
| Inmunoblot n=50 | 9 (18,0) | - | - | - |
| ELISA/inmunoblot n=50 | 12 (24,0) | - | - | - |
AI: amplitud intercuartil, DE: desviación estándar.
Se evaluó la concordancia entre los resultados clasificados como negativos y positivos del ELISA y el inmunoblot, la cual se correspondió con un coeficiente kappa de 0,407, considerado como indicador de concordancia moderada entre los dos métodos9 (Tabla 3).
Tabla 3 Concordancia de los resultados de anticuerpos anti-transglutaminasa tisular (TGt) IgA/G por los métodos de ELISA e inmunoblot
| Anti-TGt ELISA | ||||
|---|---|---|---|---|
|
Negativos n (%) |
Positivos n (%) |
Total n (%) |
||
| Anti-TGt Inmunoblot | Negativos | 38 (76) | 3 (6) | 41 (82) |
| Positivos | 5 (10) | 4 (8) | 9 (18) | |
| Total | 43 (86) | 7 (14) | 50 (100) | |
Kappa: 0,407; IC (95 %): 0,0701-0,7430, p= 0,004.
Los pacientes con resultados positivos de inmunoblot presentaron concentraciones séricas más elevadas de los anticuerpos anti-TGt IgA/G que los pacientes negativos por inmunoblot, aunque la diferencia no alcanzó nivel de significación estadística (7,0 vs 3,0 U/mL; p=0,080) (Fig.).
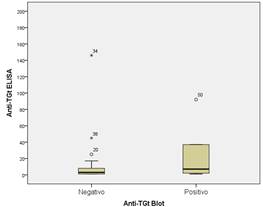
Fig. Concentración sérica de anticuerpos anti-transglutaminasa tisular (TGt) IgA/G determinada por ELISA en los pacientes negativos y positivos de inmunoblot (mediana/amplitud intercuartil: 3,0/7,0 vs 7,0/63,0; p= 0,08).
De los siete pacientes positivos de anti-TGt por ELISA, 3 alcanzaron títulos cinco veces mayores que el valor de corte, y otros 3 duplicaron el valor de corte considerado como ≥ 24 U/mL.
Discusión
La seroprevalencia de enfermedad celiaca en la población con síntomas gastrointestinales crónicos resultó considerable. Esto demuestra que los síntomas gastrointestinales por si solos no son suficientes para diagnosticar la enfermedad celiaca. La enfermedad celiaca se pudo confirmar en el 100,0 % de los 7 pacientes positivos de anticuerpos anti-TGt por ELISA. La serología dirigida a la presencia de anticuerpos anti-TGt IgA/G ha sido determinante para la selección de pacientes tributarios del procedimiento invasivo de endoscopia superior.
La enfermedad celíaca puede desarrollarse a cualquier edad, incluso en pacientes geriátricos.9 En este estudio dos de los pacientes positivos de anti-TGt IgA/G fueron individuos que se encontraban en la sexta década de vida. Esto no necesariamente debe significar demora en el diagnóstico y que su enfermedad haya sido de larga duración, sino que es posible que se trate de una pérdida de tolerancia de novo al gluten. Estudios de seguimiento han demostrado pérdida de la tolerancia al gluten en la adultez.10 Sin embargo, estudios de cohorte prospectivos realizados recientemente han demostrado que la mayoría de los pacientes desarrollan la enfermedad celiaca antes de los 10 años de edad.11 En este contexto vale destacar que el diagnóstico serológico mediante la detección de anti-TGt IgA/G en este trabajo resultó mucho más frecuente en la población pediátrica que en los adultos.
La incidencia de la enfermedad celiaca es superior en la mujer que en el hombre, pero posiblemente esto pueda atribuirse a que los hombres permanecen más subdiagnosticados.12 Una revisión sistemática y meta-análisis encontraron una ligera superioridad en la seropositividad celíaca entre las mujeres que participaron en los estudios de tamizaje,13 aunque algunos estudios en población adulta han informado una seroprevalencia similar entre mujeres y hombres.14 Este estudio mostró el predominio de las mujeres entre las muestras positivas de anti-TGt IgA/G, que fue más acentuado con el método de ELISA que con el inmunoblot.
Los anticuerpos anti-transglutaminasa representan la primera indicación médica en los pacientes con síntomas clínicos sugestivos de enfermedad celiaca.1,6 El uso de los anticuerpos anti-gliadina nativa, aunque se explotó por varias décadas, adolece de variabilidad diagnóstica y de falta de exactitud. Los anticuerpos anti-gliadina nativa poseen inferior sensibilidad y especificidad que los anti-TGt y por tanto no deben ser incluidos en el tamizaje de la enfermedad celiaca.15
Ninguna prueba para la enfermedad celiaca posee una sensibilidad y especificidad perfecta. Por lo que en este trabajo se combinó para la detección de anti-TGt IgA/G, el método de ELISA con el de inmunoblot. Este último consistió en un panel comercial de anticuerpos individuales de enfermedades digestivas, e incluía los anticuerpos anti-gliadina nativa, cuya reactividad no se tomó en consideración.
La estrategia de utilizar más de un método puede incrementar la sensibilidad, si se considera como positivo cualquiera de los resultados positivos, pero el aumento de la sensibilidad se produce a expensas de la reducción de la especificidad. La sensibilidad de la prueba resultó mayor si se consideran los resultados positivos de anti-TGt IgA/G por cualquiera de los dos métodos utilizados. Una limitación de este trabajo ha sido la consideración de los resultados de la biopsia duodenal solamente de pacientes positivos de anti-TGt IgA/G por ELISA. Queda por valorar en estudios posteriores que incluyan la prueba confirmatoria de la biopsia duodenal en todos los participantes, si la aplicación del método de inmunoblot para la detección de anti-TGt representa una ganancia en la sensibilidad diagnóstica de la enfermedad celiaca.
A diferencia del método de ELISA, el inmunoblot es un método cualitativo que no es considerado como referencia para tamizaje de los anticuerpos anti-transglutaminasa. Se recomienda que todos los pacientes positivos de anti-transglutaminasa por métodos alternativos como el inmunoblot, deban someterse a la confirmación histológica de enfermedad celiaca, para evitar un diagnóstico incorrecto seguido por un tratamiento innecesario con dieta libre de gluten.16
El algoritmo histórico para el diagnóstico de la enfermedad celiaca ha contemplado la indicación de la endoscopia superior con biopsia del duodeno frente a síntomas atribuibles a malabsorción u otros asociados a la celiaquía, tanto en pacientes pediátricos como adultos. Esta práctica se aplica aún en diversas partes del mundo5 y también en Cuba.17 En el estudio reciente de García Menéndez de una muestra de 46 niños diagnosticados como celíacos por criterios histopatológicos, el 45,7 % resultaron negativos de anticuerpos anti-TGt o HLA-DQ2/DQ8, lo que pone en duda el diagnóstico de enfermedad celiaca.17
La disponibilidad de una herramienta serológica confiable ha conducido al desarrollo de una estrategia de combinación entre las pruebas serológicas y la endoscopia. En pacientes adultos las recomendaciones de las guías internacionales de expertos proponen como primer paso diagnóstico la prueba de los anticuerpos anti-TGt, a modo de tamizaje, y si la prueba de anti-TGt es positiva, entonces se pasa a la indicación de la endoscopia con biopsia duodenal.18 La biopsia duodenal confirmatoria asegura que el diagnóstico serológico sea correcto antes de que el paciente se someta a la dieta libre de gluten de por vida.1
Todos los pacientes positivos de anticuerpos anti-TGt IgA/G por ELISA de este estudio, tanto los adultos como la paciente pediátrica fueron evaluados por endoscopia superior con biopsia después de los resultados de serológicos. La biopsia duodenal de sus muestras aportó las alteraciones características de la enfermedad celíaca como atrofia de vellosidades y aumento de linfocitos intraepiteliales,7 por lo que en ellos se pudo cerrar el diagnóstico clínico de enfermedad celíaca.
En el diagnóstico pediátrico de la celiaquía, la serología puede jugar un papel aún más dominante, si se consideran los títulos séricos de los anticuerpos. La práctica pediátrica se ha movido hacia la llamada estrategia de evitar la biopsia. Las guías de 2012 de la Sociedad Europea para la gastroenterología, hepatología y nutrición pediátricas (ESPGHAN12, del inglés: European Society for Paediatric Gastroenterology, Hepatology and Nutrition) recomiendan que los pacientes pediátricos sintomáticos no van a requerir más de la biopsia duodenal para confirmar el diagnóstico de la enfermedad celiaca si sus concentraciones de anticuerpos anti-TGt superan 10 veces el límite del rango normal y se demuestra la presencia del genotipo HLA-DQ2 o HLA-DQ8.18 En la práctica esta estrategia puede reducir la endoscopia en un 30-50 %.19
La práctica de esta estrategia en pediatría ha desencadenado numerosos estudios sobre la utilidad de las concentraciones de los anticuerpos anti-TGt para prescindir de la biopsia en pacientes adultos. Algunos de éstos muestran similarmente, un valor predictivo alto de los anticuerpos anti-TGt cuando se hallan en concentraciones extremas en los adultos.20
Otras fuentes de evidencia, sugieren que para alcanzar una buena correlación con las alteraciones histológicas en adultos, los valores de corte de los anticuerpos anti-TGt pudieran ser diferentes a los que se usan en pacientes pediátricos.21 Aún es prematuro concluir que la estrategia libre de biopsia pueda ser extendida a la práctica de los pacientes adultos. Los pacientes positivos de anti-TGt IgA/G en este trabajo presentaron concentraciones bastante variables de anticuerpos, lo que pudiera corresponder con distintos grados de la atrofia de las vellosidades duodenales.21,22 Merece evaluar en una muestra mayor la correlación entre las concentraciones de anticuerpos anti-TGt y las lesiones histológicas de la enfermedad celiaca.
El presente trabajo permitió diagnosticar la enfermedad celiaquía en una proporción importante de los pacientes sintomáticos, y funcionó como criterio de selección para la indicación de la endoscopia con biopsia como prueba confirmatoria de la celiaquía. La enfermedad celiaca ha sido diagnosticada y estudiada en Cuba desde hace décadas, fundamentalmente en pacientes pediátricos,23 aunque no se ha llevado a cabo un cálculo de incidencia y prevalencia de alcance nacional.24 Castañeda ha informado una prevalencia estimada de celiaquía en Cuba de 0,5 %.24
La seroprevalencia de los anticuerpos anti-TGt ha sido estudiada en la población pediátrica en varias provincias del país mediante el ensayo inmunocromatográfico de un paso Heber Fast Line® antitransglutaminasa.25 La seropositividad de los anticuerpos anti-TGt ha sido variable en los diferentes estudios nacionales. La seroprevalencia de la celiaquía con el método inmunocromatográfico resultó de 1,8 % en la población infantil sana de la provincia de Pinar del Río, situada en el occidente de la isla.24
El tamizaje de los anticuerpos anti-TGt con el ensayo inmunocromátográfico referido de 535 niños y adolescentes con síntomas gastrointestinales crónicos en el Hospital Pediátrico Universitario de Santa Clara, se correspondió con el 2,1 % de positividad.24 La seroprevalencia de los anticuerpos anti-TGt por el ensayo inmunocromatográfico fue de 11/110 (10,0 %) en pacientes pediátricos con síntomas sugestivos de enfermedad celíaca como dolor abdominal, retardo del crecimiento y anemia del Hospital Pediátrico Docente “William Soler de la Habana.”26
Los síntomas predominantes en los pacientes con indicaciones de anticuerpos de celiaquía que se incluyeron en este estudio fueron los abdominales. Los síntomas abdominales crónicos pueden afectar adversamente el desempeño diario y la calidad de vida.27 El reto diagnóstico frente a esta sintomatología es discriminar entre los pacientes con síntomas gastrointestinales funcionales solamente y aquellos con enfermedad orgánica, como pudiera ser la enfermedad celíaca. El análisis serológico mediante de la determinación de los anticuerpos anti-TGt en este estudio permitió clasificar el 8,05 % de los pacientes con síntomas abdominales como probables portadores de celiaquía, lo que fue confirmado por estudio histológico.
Se tuvo en cuenta que la mayoría de los pacientes con síntomas abdominales crónicos no tienen enfermedad celíaca, la aplicación de la prueba de los anticuerpos anti-TGt ha evitado la utilización de otros medios diagnósticos innecesarios en su manejo clínico.
La población estudiada para el cribado de los anticuerpos anti-TGt fueron pacientes con síntomas gastrointestinales crónicos, pero la enfermedad celíaca puede presentarse con un amplio rango de otros síntomas atípicos. Para la detección óptima de todos los pacientes con enfermedad celíaca, las pruebas de anticuerpos deben ser consideradas en pacientes con otra sintomatología o condición de salud en las cuales la prevalencia de la enfermedad celíaca puede ser alta, como el déficit de hierro, la infertilidad, diabetes tipo 1, el síndrome de Down, y la reducida densidad ósea.1,4,16
Se concluye que se ha diagnosticado serológicamente la enfermedad celíaca en una proporción considerable de pacientes con síntomas gastrointestinales. La prueba serológica de anticuerpos anti-TGt por ELISA mostró un desempeño diagnóstico satisfactorio. Se recomienda ahora la evaluación de un algoritmo diagnóstico con inclusión de pruebas de anticuerpos secuenciales en pacientes con síntomas sugestivos de enfermedad celíaca.














