Introducción
El síndrome de dificultad respiratoria aguda (SDRA) representa una complicación frecuente en la COVID-19. Las anormalidades en el intercambio gaseoso originadas por el shunt intrapulmonar (hipoxemia y posterior hipercapnia) es su patente respiratoria y puede agravarse cuando concomita con entidades extrapulmonares descritas como el accidente cerebrovascular (ACV). Debido esencialmente a que dichas alteraciones gasométricas pueden producir o agravar el daño cerebral preexistente, daño cerebral secundario (DCS).
La ventilación mecánica artificial (VMA) es necesaria para mantener una adecuada oxigenación (O2) y permitir la remoción de dióxido de carbono (CO2) generados por la falla respiratoria. Esta estrategia ha sido designada como ventilación protectora pulmonar (VP) ya que protege a los pulmones de estímulos nocivos generados por la VMA.1,2,3
Sin embargo, la VP cursa frecuentemente con hipercapnia: término que incluye una presión parcial de dióxido de carbono (PaCO2): > 45 mmHg y acidosis (pH: < 7,35), puede generar resultados indeseables sobre el flujo sanguíneo cerebral (FSC), la presión intracraneal (PIC) y la presión de perfusión cerebral (PPC). En contraposición a una de las metas fundamentales de la VMA en el ACV la cual es mantener PaCO2 entre 35 y 45 mmHg (pH entre 7,35 y 7,45).3,4,5
Se proponen 2 vías fundamentales en las cuales en un paciente con VMA puede aparecer DCS: 1 debido a un estado de neuroinflamación y 2 a través de los efectos generados por la programación de la VMA por medio de la estrategia de VP. El efecto del O2 y el CO2 a nivel cerebral puede manifestarse a través del segundo mecanismo, por lo que el ejercicio ventilatorio durante el daño cerebral y pulmonar caracteriza los principales retos terapéuticos de esta patología.3,6
La investigación tuvo como objetivo describir las implicaciones del O2 y el CO2 sobre la dinámica cerebral durante el tratamiento ventilatorio del SDRA en el ACV.
Métodos
Se realizó una búsqueda en las bases referenciales como: PubMed/Medline, ScIElO, Google Académico y BVS Cuba. Los términos incluidos fueron: brain-lung crosstalk, ARDS, mechanical ventilation, COVID-19 related stoke, ARDS related stroke y su traducción al español. Fueron referenciados libros de neurointensivismo y ventilación mecánica artificial.
El período de búsqueda incluyó los últimos 20 años. Se seleccionaron 46 referencias bibliográficas que cumplieron con los criterios de selección.
En cada apartado se destaca la neurofisiopatología, la evidencia clínica y la pauta terapéutica a considerar.
Resultados
Los efectos de la VMA en el cerebro normal han sido escasamente descritos, básicamente se asume que son pocos y dependen fundamentalmente del nivel de PaCO2 logrado.4,7
Sin embargo, durante un ACV la situación es más compleja. Debido a que se han alterado los mecanismos de autorregulación cerebral; el FSC es persistente pese a los cambios generados en la PPC, la presión arterial media (PAM) y la PIC.8 Por consiguiente, la readaptación y estabilización neurológica dependerá fundamentalmente del manejo clínico impuesto.
Efectos del O2
Hipoxemia
Representa la principal fuente de DCS. En la etapa aguda del ACV, el tejido cerebral es particularmente susceptible cuando niveles de O2 caen por debajo de los umbrales metabólicamente efectivos. Entre las complicaciones respiratorias, el SDRA se caracteriza por hipoxemia con infiltrados pulmonares bilaterales.9,10
Aunque las causas exactas son innumerables, solo unos pocos mecanismos fisiológicos explican la patente arterial. En el paciente crítico, el desajuste entre la ventilación alveolar y la perfusión en numerosas zonas del pulmón es debido a la disminución o ausencia de ventilación con perfusión conservada y el shunt derecha-izquierda (porcentaje de sangre venosa sistémica que saltea la membrana alveolo-capilar; no realiza intercambio gaseoso y transfiere sangre venosa no oxigenada al sistema arterial sistémico). Estos son los elementos más comunes.3,7
A nivel neurológico, la hipoxemia no solo reducirá el suministro de O2 cerebral, sino que también provocará vasodilatación refleja con el consiguiente aumento de la PIC. En el ictus isquémico (ACVi) subtipo más común encontrado entre pacientes COVID-19,2 se puede perturbar el área de penumbra isquémica que prolonga la zona afectada.11 Se observa la secuencia fisiopatológica y su implicación neurológica (fig.).
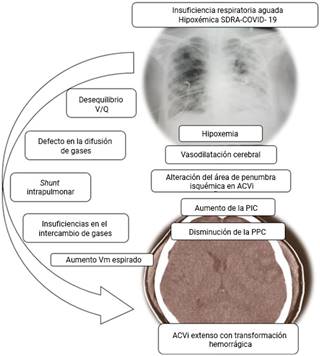 V/Q: ventilación perfusión; ACVi: ictus isquémico; Vm: volumen min; PIC: presión intracraneal; PPC: presión de perfusión cerebral. Adaptado por Caballero-López y otros.4
V/Q: ventilación perfusión; ACVi: ictus isquémico; Vm: volumen min; PIC: presión intracraneal; PPC: presión de perfusión cerebral. Adaptado por Caballero-López y otros.4
Fig. Fisiopatología neurológica de la hipoxemia.
Evidencia clínica
Se ha descrito que en la primera h del evento, la saturación arterial de O2 (SaO2) < 90 % duplica el riesgo de muerte.10 En la serie de Rowat y otros,11 la mortalidad en hipoxémicos fue del 40 %, frente al 20 % de los no hipoxémicos (OR: 1,5; IC: 95 %: 1,0 - 4,1). Entre otras complicaciones, estos enfermos tuvieron mayor predisposición a las infecciones respiratorias (p= 0,04).
El tema es particularmente relevante en los pacientes con HIC, ya que el riesgo de deterioro neurológico ocurre en las primeras 24 h del comienzo de los síntomas y está asociado con peores resultados a largo plazo.12
Battaglini y otros,13 sostienen que existe correlación entre la presencia de SDRA e hipoxemia cerebral. De manera que la reducción sistémica de O2 puede afectar la oxigenación del tejido cerebral (PbtO2). La medición de la PbtO2 ha confirmado que este parámetro está fuertemente asociado con la oxigenación sistémica y con marcadores funcionales pulmonares que incluyen la PaCO2 y la PAM. Así, la disminución del índice presión parcial de O2/fracción inspiratoria de O2 (PaO2/FiO2) se relaciona con niveles bajos de PbtO2.
Huang y otros,14 en una revisión centrada en los efectos neurológicos del SDRA, encontraron 2 estudios en los cuales existió correlación entre el deterioro cognitivo, hipotensión arterial (PAM < 50 mmHg) e hipoxemia (PaO2: 71 mmHg) al ingreso.
Un posible mecanismo descrito es su asociación con alteraciones estructurales a nivel del hipocampo (relacionado con la capacidad de aprendizaje y la memoria), con el consiguiente déficit de memoria secundario, independientemente al grado de hipoxemia.15
En la COVID-19 algunos pacientes pueden afectarse por los efectos de la hipoxemia cerebral que genera la falla respiratoria (neurosuceptibilidad); Por lo que algunos trastornos neurológicos como convulsiones, lesiones desmielinizante y el ACV se explican a través de elementos como el metabolismo anaerobio, hiperinflamación neuronal, hipercoagubilidad y obstrucción del FSC.16,17
Battaglini y otros18 realizaron un estudio retrospectivo el cual tuvo como objetivo determinar la incidencia de complicaciones neurológicas en pacientes ventilados con COVID-19. Entre ellos, el ACVi se presentó en el 3,19 %. Un estado inflamatorio medido por proteína C reactiva (PCR) y los días de VMA, representaron factores predisponentes de alteraciones neurológicas (OR: 1,092; CI 95 %: 1,046 - 1,154; p< 0,001). Esto sugiere que la magnitud de la respuesta inflamatoria y la gravedad del deterioro respiratorio están fuertemente relacionadas con la ocurrencia de complicaciones neurológicas. Por esta razón, la hipoxemia en el neurológico ventilado debe tratarse energéticamente y evitar siempre que sea posible.
Quílez-Tierno19 sostiene que es difícil concluir si en los pacientes con SDRA, la hipoxemia refractaria es el principal mecanismo responsable del detrimento neurológico. Su fundamento se basa en que el deterioro observado no es exclusivo de la hipoxia y podría incluir aspectos relacionados con la VMA y sus efectos sobre la respuesta inflamatoria.
Habitualmente el grado de oxigenación óptima se puede alcanzar al utilizar una FiO2 adecuada y una presión positiva al final de la espiración (PEEP), con el objetivo de reclutar alveolos colapsados y disminuir la elastancia pulmonar. Sin embargo, la circulación cerebral durante el daño neurológico y pulmonar está influenciada por complejas interacciones cardiopulmonares y la aplicación de PEEP puede afectarla mediante vías, mediados por CO2 y la hemodinámica general.3
Pauta terapéutica
En pacientes con ACV sin SDRA se recomienda mantener PaO2≥ 75 mmHg, con SpO2: ≥ 95 %.20
Escasos estudios brindan información sobre esta meta con SDRA. Robba y otros10 sugieren un mínimo aceptable de SaO2 entre 88 y 92 %, con PaO2: 60-80 mmHg. Aunque algunos autores sostienen que los objetivos netos propuestos son probablemente demasiados bajos. Este objetivo resulta similar a la clásica propuesta del manejo del SDRA no COVID-19 (PaO2: 55-80 mmHg y SpO2: 88-95 %).3,21
Hiperoxemia
Aunque el nivel inferior de O2 es deletéreo en fases agudas del ACV, el estado de hiperoxemia presenta complicaciones cerebrales que incluyen vasoconstricción, heterogeneidad del flujo sanguíneo microvascular y aumento de las especies reactivas del O2(ERO). Si bien la hipoxemia disminuye la producción de ATP con agotamiento celular, actualmente se ha descrito un mecanismo similar que incluye daño mitocondrial, aumento de las ERO, inhibición del ciclo del ácido cítrico y la producción de ATP mitocondrial. El resultado es la pérdida de la homeostasis celular por falla en la cadena transportadora de electrones (citotoxicidad y daño por isquemia-reperfusión). Clínicamente se manifiesta como isquemia cerebral tardía (ICT) e incremento de la mortalidad.9,10,22
Evidencia clínica
En una revisión sistemática con meta-análisis reciente que incluyó 3 ensayos clínicos randomizados (RCT) y 26 estudios de cohorte (257 223 pacientes), la hiperoxia fue relacionada con la mortalidad en los estudios revisados (OR ajustado: 1,20; CI 95 %: 1,09-1,32), más no en los RCT (OR ajustado: 1,36; CI 95 %: 1,04-1,77). De manera específica, la asociación fue establecida en el ACVi (OR no ajustado: 1,31; CI 95 %: 1,03-1,65) y la HIC (OR no ajustado: 1,47; CI 95 %: 1,19-1,81).23
Distintas investigaciones en el tema muestran diversos resultados (tabla 1).
Tabla 1 Efecto de la hiperoxemia en pacientes neurocríticos
| Autores | Tipo de estudio (objetivo) | Resultados |
|---|---|---|
|
|
Retrospectivo multicéntrico (Determinar asociación entre Hxm y mortalidad. Pacientes con VMA y ACV) |
La Hxm representó un factor independiente de mortalidad intrahospitalaria, por encima de pacientes normoxémicos o hipoxémicos (OR: 1,2; *1,04-1,5). |
|
|
Prospectivo unicéntrico (Determinar asociación entre Hxm e ICT. Pacientes con HSA) |
Al AM, la Hxm se asoció a la aparición de ICT (OR: 3,16; 0,92-3,44) y peor pronóstico (OR: 2,30; *1,03-5,12). |
|
|
Retrospectivo unicéntrico (Determinar asociación entre Hxm e ICT, Vc, mortalidad y empeoramiento neurológico. Pacientes con HSA) |
Al AM, la Hxm temprana (primeras 72 h) es un predictor independiente de Vc (OR: 1,15 por cada 50 mmHg de aumento de la PaO2; *1,03-1,28) más no de mortalidad (OR: 1,10; *1,03-1,28; |
|
|
Retrospectivo unicéntrico (Determinar asociación entre la PaO2, PAM y mortalidad en adultos neurocríticos† con VMA) |
La Hxm no representó un predictor independiente de mortalidad comparado con pacientes con normoxemia (OR: 1,16; *0,85-1,59). |
|
|
Retrospectivo multicéntrico (Determinar asociación entre la Hxm y deterioro neurológico. Pacientes con TCE y VMA) |
No existió asociación significativa entre la Hxm y el deterioro neurológico observado a los 6, 12 y 24 meses (OR: 0,99; *0,78-1,25). |
Hxm: hiperoxemia. VMA: ventilación mecánica artificial. ACV: accidente cerebrovascular. HSA: hemorragia subaracnoidea. ICT: isquemia cerebral tardía. Vc: vasoespasmo cerebral. PaO2: presión parcial de oxígeno. PAM: presión arterial media. TCE: trauma craneoencefálico. AM: análisis multivariado. *CI: 95 %. †ACV, TCE, recuperados de parada cardiorrespiratoria, HSA y ACVi.
Pauta terapéutica
En esta subpoblación, se exhorta mantener SaO2> 94 %, sin embargo, habitualmente no se provee información sobre el límite superior. Una propuesta sería usar un mínimo de FiO2 para mantener la SaO2 en 99 % y PaO2: hasta 100 mmHg. También titular la FiO2 al 100 % solo durante la intubación y luego reducir paulatinamente (≤ 50 %) hasta obtener la PaO2.20,21
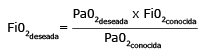
Cuando el estado cardiopulmonar del paciente permanece estable, existe una relación lineal entre la PaO2 y FiO2. De manera que, al conocer ambos valores puede utilizarse la FiO2 necesaria para lograr la PaO2 ideal a través de la fórmula:21
Efectos del CO2
Hipercapnia
En condiciones de normalidad, el CO2 tiene una función importante en el mantenimiento del FSC. La reactividad cerebral al CO2 es la capacidad que tienen las arteriolas cerebrales de contraerse o dilatarse en respuesta a los cambios de PaCO2. Fisiopatológicamente, el endotelio reacciona a los cambios del pH del espacio perivascular por efecto del óxido nítrico (ON) sintetizado a partir de la isoforma neuronal de la ON sintetasa, potasio, calcio (Ca+) o prostaglandinas. El Ca+ intracelular disminuye y aumenta la vasodilatación refleja. Se ha planteado que el mecanismo de vasodilatación cerebral depende más de la acidosis que de la hipercapnia. A este nivel, se producen cambios en la musculatura lisa, específicamente sobre el esfínter precapilar de las arteriolas cerebrales que genera dilatación. El rango en el cual el cambio de PaCO2 posee mayor impacto sobre el calibre de los vasos cerebrales es entre 20 y 60 mmHg; este intervalo modifica el FSC un 3 % por cada mmHg que varía la PaCO2. En individuos sanos, un incremento de la PaCO2> 70 mmHg genera efectos depresores neurológicos con diminución del ritmo respiratorio e hipoventilación. Valores de PaCO2= 80 mmHg, el FSC aumentará desde 100 hasta 200 %. Factores que en presencia de DCA son capaces de aumentar la PIC y producir herniación del tronco encefálico.29,30,31,32,33
Neuroprotección hipercápnica
Se ha sugerido que el efecto cerebral de la hipercapnia leve a moderada puede ser beneficioso en pacientes recuperados de un paro cardiorrespiratorio. En la HSA, PaCO2 entre 60-100 mmHg contribuye a la profilaxis de la ICT al aumentar el FSC y disminuir el daño por isquemia- reperfusión. Modelos experimentales en animales asumen resultados favorables también.32,33
El efecto guarda relación con la regulación intrínseca de la apoptosis proteica a través de 2 componentes efectores:
Inhibición en la activación de la molécula caspasa- 3 por aumento en las concentraciones del citocromo C: esta molécula ha sido identificada como marcador en la activación de la apoptosis celular y su valor se eleva en múltiples modelos de daño neuronal.
Reducción de las concentraciones de glutamato durante el DCA: se ha relacionado con el agravamiento neurológico por aumento de sus concentraciones y el influjo acelerado de Ca+ intraneuronal.32,33,34
VP e hipercapnia permisiva (HP)
Un elemento a considerar en la VP es la presencia de hipercapnia, este fenómeno ha sido denominado HP. Actualmente se acepta que la HP forma parte de las técnicas de VP y consiste en usar un volumen tidal bajo, que ocasiona el ascenso regulado de la PaCO2 por encima de sus valores normales (Su valor más amplio se establece entre 50 y 150 mmHg y pH entre 7,10 -7,30), lo que se permite para lograr el objetivo de protección pulmonar; de manera que provoca cierto grado de hipoventilación y limitación de la sobredistensión pulmonar.4,5,21
Kahl y otros35 estudiaron la autorregulación cerebral al CO2 en pacientes con SDRA e hipercapnia precoz (PaCO2≥ 50 mmHg y pH < 7,35 en las primeras 24 h del evento) sin ACV. Como conclusión, no encontraron efectos adversos sobre la dinámica vásculo-cerebral, y se sugiere que es bien tolerada en esta población (OR: 0,023; CI 95 %: 0,054 - 0,100; p= 0,556).
Sin embargo, se carece de evidencia suficiente disponible para concluir que la HP es beneficiosa en los pacientes con SDRA más allá de la protección aportada por los volúmenes corrientes bajos (tabla 2).
Tabla 2 Mecanismos beneficiosos y perjudiciales de la hipercapnia(33)
| Efectos | Hipercapnia | Mecanismo propuesto |
|---|---|---|
| Reducción de producción de mediadores proinflamatorios | Prevención de la activación de la vía de las MAPk | |
| Reducción significativa de la apoptosis, estrés oxidativo y marcadores de inflamación. | Inhibición de la activación de las vías MAPk y SAPk/JNK a nivel de las células epiteliales alveolares | |
| Disminución de la respuesta inflamatoria y mejoría de la mecánica pulmonar | Inhibición de la vía canónica de NFƙB, degradación del IkB-α y la translocación del p65 nuclear | |
| Retraso de la reparación de la membrana alveolar | Disminución de la migración celular dependiente de la vía NFƙB | |
| Disminución del aclaramiento del edema alveolar | Inhibición de la bomba de Na+-K+-AT pasa mediante un proceso de endocitosis | |
| Disminución de la capacidad de defensa del huésped tras una agresión de origen microbiano | Inhibición selectiva de IL-6 y TNF. Disminución de la fagocitosis mediada por macrófagos alveolares. |
MAPk: mitógeno- activador de la proteína- kinasa. SAPk/JNK: señal activadora de la proteína- kinasa (Jun kinasa amino- terminal). NFƙB: factor nuclear kappa B. IkB- α: proteína reguladora de complejos diméricos NFƙB. p65: factor de transcripción mediador de la respuesta inmune.
Hipercapnia e hipertensión intracraneal (HICn)
Hasta el momento, existen limitaciones en cuanto a la obtención de estudios que evalúen los efectos de la hipercapnia en presencia de HICn en humanos. Se asume que, la hipercapnia puede aumentar la HICn y ocasionar papiledema, cefalea y profundización de la conciencia con reducción de la escala de coma de Glasgow; incluso pueden sinergizarse con los efectos de la hipoxemia.4
En guías recientes, no proveen recomendaciones al respecto.36 Estas limitantes, sugieren individualizar y neuromonitorizar activamente al paciente con HICn y VMA.
Para ello, se prefiere la medición invasiva de la PIC. Sin embargo, este proceder no está al alcance de todos los escenarios clínicos y no está exento de complicaciones.37
Opciones no invasivas como la ultrasonografía del diámetro de la vaina del nervio óptico (uDVNO), surgen como alternativas atractivas por realizarse a la cabecera del paciente y su bajo costo económico. El punto de corte habitualmente aceptado es entre 5 y 5,9 mm (PIC > 20 mmHg).37
En poblaciones COVID-19, Battaglini y otros,18 la usaron la uDVNO junto a otras técnicas no invasivas como el doppler transcraneal (DTC) y la pupilometría automática en pacientes ventilados. La PIC fue medida por uDVNO en el 92,45 % de los enfermos, se encontró HICn en 10 pacientes, los cuales presentaron mayor estadía en UCI en comparación con aquellos sin HICn (42,30 ± 23,21vs. 28,26 ± 22,28 días; p= 0,042) y al compararlos con las realizadas por DTC. Esto confirma que, en estos enfermos, la monitorización no invasiva de la PIC puede ser esencial para detectar tempranamente aquellos con riesgo de prolongar su estadía en UCI.
Evidencia clínica
Con las limitantes antes descritas, los estudios consultados muestran resultados diversos. A razón de los autores de esta comunicación, no existe suficiente evidencia para inferir su uso de rutina en los pacientes neurocríticos (tabla 3).
Tabla 3 Efecto de la hipercapnia en pacientes neurocríticos
| Autores | Tipo de estudio (objetivo) | Resultados |
|---|---|---|
|
|
Retrospectivo unicéntrico (Determinar asociación entre Hcp y resultados neurológicos. Pacientes con HSA) |
Un valor de PaCO2> 48,3 mmHg se comportó como factor de evolución desfavorable (OR: 1,12; *1,03 - 1,21, |
|
|
Retrospectivo unicéntrico (Describir el efecto de la Hcp sobre la PIC. Pacientes con VMA y HSA) |
Valores de PaCO2 entre 50 y 60 mmHg no elevó la PIC hasta niveles peligrosos (desde 2 hasta 18 mmHg, media: 10,2 mmHg) en comparación con grupo de PaCO2 en 40 mmHg |
|
|
Retrospectivo unicéntrico (Describir el valor óptimo de Hcp como profilaxis de la ICT. Pacientes con VMA y HSA) |
El aumento de la PaCO2 desde 38,77 mmHg hasta 53,18 mmHg después de 120 min, aumentó el FSC hasta 146 ± 93 % del valor basal. Se propone que 45 min de Hcp podría ser segura y adecuado en relación con aumento del FCS |
|
|
Retrospectivo multicéntrico y binacional. Múltiples pacientes neurocríticos (9477 pacientes con ACV) (Determinar asociación entre la Hcp y mortalidad en adultos ventilados) |
Al AM la Hcp aumentó el riesgo de muerte intrahospitalaria (O: 1,43; *1,27-1,6; |
Hcp: hipercapnia. VMA: ventilación mecánica artificial. ACV: accidente cerebrovascular. HSA: hemorragia subaracnoidea. ICT: isquemia cerebral tardía. AM: análisis multivariado. *CI: 95 %.
Pauta terapéutica
En pacientes con ACV se ha objetivado durante la fase aguda del evento mantener normocapnia (35-45 mmHg en el ACVi y 35-40 mmHg en la HIC). Lamentablemente, rara vez este valor se puede alcanzar en presencia de SDRA.20,29
Al ser el efecto de la hipercapnia perjudicial, la recomendación es siempre evitarla e individualizar cada paciente con neuromonitoreo intensivo.
Algunas estrategias de rescate pulmonar como maniobras de reclutamiento alveolar, posición prono o bloqueo neuromuscular pueden evaluarse de forma cuidadosa.
Hipocapnia
La alcalosis hipocapnia (PaCO2< 35 mmHg), al incrementar el pH del líquido cefalorraquídeo (LCR), es capaz de producir vasoconstricción cerebral, reducir el FSC y la PIC.32 Este efecto ha sido utilizado como profilaxis de la HICn. Empero, a largo plazo incrementa la actividad metabólica cerebral y propicia la aparición de isquemia cerebral y/o agrava la preexistente, algunas razones son:
La respuesta al CO2 en los tejidos sanos es diferente a los lesionados, por lo que el impacto del flujo global y regional es diferente.
La vasorreactividad al CO2 resulta dispareja según la evolución temporal del daño.
El efecto de reducción de volumen es limitado, ya que los vasos más reactivos al CO2 son las arterias que contienen solo 30 % del VSC.
El resultado neto es un impacto mayor sobre el FSC, con disminución del 30 %, así como un efecto débil a nivel del VSC, con una reducción de solo 7 %. Valores entre 20 y 25 mmHg de PaCO2 se asocian a descenso del FSC entre 40 y 50 %. Conjuntamente, se produce liberación de mediadores excitatorios como el N-Methyl-D-aspartato, con potenciales efectos convulsivos.7,31,32,42,43
Evidencia clínica
En pacientes no neurológicos con SDRA, la hipocapnia se relacionó a malos resultados. Kahl y otros35 encontraron que esta complicación se asoció a un empeoramiento de la autorregulación cerebral (OR: 0,155 [95% CI 0,014; 0,296], p= 0,032).
En una corte retrospectiva de 102 ventilados con HSA, al menos un episodio de hipocapnia ocurrió y fue congruente con aparición de vasoespasmo sintomático (OR: 1,25; CI 95 %: 1,07-1,47) y peor pronóstico (OR: 1,33; CI 95 %: 1,04-1,70).44
Además, la hiperventilación espontánea, es un fenómeno común entre pacientes con ACV o entre aquellos que tienen soporte ventilatorio mínimo, constituye un factor independiente de mal pronóstico.9
Hextrum y otros45 estudiaron la asociación entre hiperventilación espontánea, ICT y resultados fatales en pacientes ventilados con HIC. Valores iniciales de PaCO2 reducida, se comportaron como predictor de mortalidad intrahospitalaria (OR: 0,94 por mmHg; CI 95 %: 0,89-0,996; p= 0,042). Estudios de resonancia magnética nuclear fueron realizados a 33 pacientes del estudio, se encontró que la hipocapnia se asoció a alto riesgo de daño isquémico a excepción de aquellos que concomitaron con hipotensión arterial (el efecto de asociación fue mayor en aquellos con hipertensión arterial).
Williamson y otros46 realizaron un estudio retrospectivo similar en pacientes con HSA. Esta vez incluyó 207 pacientes con ventilación espontánea o presión soporte. Al análisis multivariado, la hipocapnia moderada (PaCO2< 35 mmHg y pH > 7,45; OR: 2,49, CI 95 %: 1,10-5,62) y severa (PaCO2< 30 mmHg y pH > 7,50; OR: 3,12; CI 95 %: 1,30-7,49) fueron asociados a la aparición de ICT. La hipocapnia severa, se asoció a peores resultados clínicos al alta hospitalaria (OR: 4,52; CI 95 %: 1,37-14,89).
Por último, otros elementos que pudieran contribuir al fallo neurológico en presencia de hipocapnia resultan sus efectos a nivel pulmonar: broncoconstricción, disminución en la síntesis de surfactante pulmonar, daño inducido por reperfusión y edema.10,31
Pauta terapéutica
Actualmente, la indicación de hiperventilación en la HICn muestra recomendaciones con baja calidad de evidencias. Cook y otros46 sugieren episodios < 30 min durante la elevación aguda de la PIC (recomendación fuerte, muy baja calidad de la evidencia) como medida de sostén, mientras se resuelve el problema hipertensivo. Por otro lado, el Consenso Europeo de Medicina Intensiva36 no provee recomendaciones para usar en pacientes con HICn (no recomendación, no evidencia) y solo sugieren usarla en presencia de herniación cerebral (recomendación débil, no evidencia).
Se muestra que el manejo ventilatorio en estos casos resulta complicado, evitar el daño pulmonar o neurológico representa un verdadero reto. El monitoreo gasométrico y neurológico, el cumplimiento de las metas de oxigenación y ventilación ayudan a minimizar las afectaciones clínicas descritas.
Se plantea como principal limitante de esta contribución es la no realización de métodos estadísticos para establecer conclusiones más certeras, como los que se presentan en los meta-análisis. A pesar de reunirse un cúmulo actualizado e importante sobre el tema a través de una investigación profunda.
Se concluye que el control de la oxigenación y la excreción de CO2 durante el manejo del SDRA y el ACV resultan cruciales en el mantenimiento de la homeostasis neuronal, evita la disminución de la PPC y el aumento de la PIC. Hasta el momento, las investigaciones sobre el tema son escasas, por lo que se sugiere evitar a toda costa la hipoxemia e hiperoxemia, limitar o evadir la hipercapnia y usar la hiperventilación hipocápnica solo en condiciones de herniación del tallo encefálico.