Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.59 n.1 Ciudad de la Habana ene.-abr. 2007
Instituto Nacional de Tecnología Agropecuaria, Argentina
Adaptación de un protocolo de inmunohistoquímica para la detección de Leptospira spp. en muestras de tejido fijado en formaldehído
Dr. Fernando Delgado,1 Dra. Bibiana Brihuega,2 Dr. Agustín Venzano,3 Téc. Daniel Funes,4 Dr. Francisco Blanco Viera,5 Téc. Carmelo Auteri,4 Téc. Graciela Romero,4 Dr. Félix Capellino1 y Dr. Luis Sarmiento6
Resumen
Se evaluó la técnica de inmunohistoquímica en muestras de tejido fijado en solución salina de formaldehído 10 % e incluidas en parafina, para utilizarla como método de laboratorio que permitiera identificar leptospiras en los tejidos. Se utilizaron muestras obtenidas a partir de la inoculación experimental de 8 cobayos con L. interrogans pomona aislada de un caso clínico. Se reprodujo la enfermedad en el modelo de laboratorio. Las secciones histológicas de los riñones de los animales inoculados se sometieron a estudios histopatológicos, inmunofluorescencia, tinción de Warthin-Starry y técnica de inmunohistoquímica con muestras fijadas en formaldehído. La técnica de inmunohistoquímica implementada resultó ser una herramienta eficaz para el diagnóstico de la leptospirosis.
Palabras clave: Leptospirosis, diagnóstico, inmunohistoquímica.
La leptospirosis es probablemente la zoonosis de mayor distribución mundial, porque afecta a diferentes especies animales, sobre todo mamíferos, incluido al hombre que puede infectarse accidentalmente.1 Esta enfermedad infectocontagiosa es producida por espiroquetas pertenecientes al género Leptospira. Según la clasificación fenotípica, estas bacterias se agrupan en L. interrogans y L. biflexa.
Las cepas patógenas de leptospiras afectan a los animales domésticos y a los silvestres; algunos de estos actúan como hospedadores de mantenimiento o accidentales en función del serovar considerado. Es muy importante el papel que desempeña el hospedador de mantenimiento, porque asegura la perpetuidad del microorganismo en el medio.2 También es importante la presencia de infección renal con leptospiruria prolongada en animales susceptibles que actúan como fuente de infección, porque así puede diseminarse a otros animales y también afectar al hombre.3
El diagnóstico clínico de esta enfermedad, no es tarea fácil, porque los signos no son patognomónicos y la información epidemiológica conduce apenas a la sospecha clínica. Es por esto que se basa principalmente en los exámenes de laboratorio que detectan al agente etiológico, o en aquellos que demuestran la presencia de anticuerpos en el huésped. Para un correcto diagnóstico, es importante conocer la patogenia de la enfermedad y la metodología diagnóstica a utilizar en cada etapa de la infección, como así también tener en cuenta el valor y las limitaciones de las diferentes técnicas diagnósticas.
El aislamiento y la tipificación constituyen la verdadera base para el diagnóstico. El primero es difícil porque las condiciones para su crecimiento in vitro son muy exigentes, por lo que un resultado negativo no es indicativo de ausencia de leptospira en la muestra. El aislamiento en cambio no deja lugar a dudas sobre el diagnóstico. En los últimos años se han realizado avances para mejorar los medios de cultivo y la estandarización de los métodos de toma y remisión de muestras al laboratorio; se necesita conocer la dinámica de la infección para poder tomar las muestras adecuadas.
Por otro lado, la técnica de aglutinación microscópica (MAT), que evalúa la presencia de anticuerpos séricos contra el agente, es considerada por la Organización Mundial de la Salud (OMS) como la prueba de oro.4 Entre sus limitaciones se destacan la detección tardía de anticuerpos y la imposibilidad de revelar animales portadores renales o genitales asintomáticos con serología negativa, que todavía pueden eliminar leptospiras por orina, semen o secreciones cérvico-vaginales.
En casos de aborto, donde son escasas las posibilidades de aislamiento por causa de la autólisis que presenta el feto, se puede intentar la recuperación del microorganismo de la orina materna o realizar técnicas microscópicas, como inmunofluorescencia directa, o técnicas de biología molecular, para detectar las leptospiras en trozos de órganos.
La histopatología de rutina puede aportar mucho al diagnóstico de la enfermedad. La observación de lesiones compatibles refuerza la sospecha clínica de leptospirosis, pero por causa de los frecuentes procesos autolíticos ya mencionados no siempre puede realizarse este tipo de estudio.
La técnica de inmunofluorescencia directa permite detectar antígenos bacterianos en muestras de tejido animal y el grado de autólisis de la muestra tiene menor importancia. Así, la técnica permite revelar presencia o ausencia de antígenos, sin importar la presencia o no de lesiones.4
Por su parte la técnica inmunohistoquímica (IHQ) combina elementos inmunológicos, histológicos y bioquímicos que permiten detectar un antígeno y, a diferencia de la inmunofluorescencia, ubicarlo histológicamente en una muestra determinada. Se ha utilizado mucho para el diagnóstico de diversas enfermedades de muy distintas etiologías, así como en estudios de biología celular.5-10 También se ha descrito su aplicación en casos de leptospirosis,11 por lo que sería posible utilizar esta técnica para detectar antígenos de leptospira en muestras de animales donde esta se sospecha.
El objetivo del presente trabajo fue implementar un protocolo de inmunohistoquímica para la detección de leptospira, con muestras fijadas en solución salina de formaldehído 10 % e incluidas en parafina según técnicas de rutina para histopatología, en el contexto de un ensayo en el cual se realizaron otros métodos de diagnóstico convencionales.
Métodos
En el ensayo se inocularon con la cepa L. pomona, 8 cobayos de 200 g vía intraperitoneal con 1,5 mL. Esta cepa fue aislada de orina en un caso clínico de porcinos. La concentración de la cepa inoculada fue de 1 x 107 leptospiras/mL, conteo efectuado por cámara de Petroff-Hauser.
Los cobayos en estudio fallecieron entre el 5to. y 7mo. día posinoculación y se les realizó necropsia. De cada animal se tomaron, entre otras, muestras pareadas de tejido renal que fueron cultivadas en los medios EMJH y Fletcher, conservadas a - 20 ºC y en solución salina de formaldehído 10 %. Como controles, se utilizaron muestras de animales sanos.
Se realizaron las pruebas de inmunofluorescencia directa12,13 con conjugado polivalente y 4 cepas de leptopiras correspondientes a los serogrupos Pomona, Icterohaemorrhagiae, Canicola y Hardjo (1), los estudios histopatológicos con tinción de hematoxilina-eosina (2), la tinción argéntica de Warthin-Starry14 (3) y la técnica de IHQ para la detección de leptospiras (4).
Para la realización de los ensayos 2, 3 y 4, se incluyó a las muestras en parafina mediante los protocolos histológicos de rutina, y se utilizaron cortes de tejido de 5 mm.
Técnica de inmunohistoquímica
Se utilizó como anticuerpo primario, un antisuero obtenido en conejo contra el serogrupo Pomona, producido en el Laboratorio de Leptospirosis, Instituto de Patobiología, CICVyA, INTA Castelar. Al momento del ensayo, las muestras de tejido llevaban incluidas en parafina 6 meses. Los cortes fueron montados en portaobjetos con carga positiva (Genex-brand®), recomendados para inmunohistoquímica. El protocolo de trabajo fue el siguiente:
Desparafinado: se logró mediante el pasaje de los cortes por xileno (10 min), y graduaciones decrecientes de alcohol etílico (100º 10 min, 96º 5 min, y 70º 5 min).
Bloqueo de la actividad endógena de peroxidasa: incubación de los cortes en solución de peróxido de hidrógeno 3 % en metanol por 15 min, e incubación en agua destilada por 10 min.
Recuperación antigénica: se sumergieron los cortes en solución buffer citrato 10 mM pH 6, y se calentaron a 121 ºC, en autoclave por 15 min. Se les dejó enfriar 5 min, y luego se llevaron a un baño de solución buffer TBST (50 mM Tris- HCl, 300 mM NaCl, 0,1 % Tween 20, pH 7,6) en el que permanecieron 15 min.
Inmunomarcación: se incubaron los cortes de tejido con una solución de albúmina bovina sérica fracción V (SIGMA), 1 % en buffer TBST por 5 min con la intención de bloquear sitios de unión inespecíficos. Luego se colocó el antisuero anti L-Pomona realizado en conejos a una dilución 1:50, durante toda la noche a 4 ºC, en cámara húmeda.
Revelado de la reacción: se utilizó la técnica LSAB2®, de DAKO, con AEC como sustrato cromógeno.
Coloración de contraste: se sumergieron los cortes en hematoxilina de Mayer durante 15 s; luego se colocaron bajo un flujo de agua corriente para el revelado.
Montaje: se realizó con medio de montaje acuoso (VectaMount AQ, Vector Lab Ind)
La observación de las preparaciones se hizo en un microscopio Leitz Dialux 20 EB. Las fotografías fueron tomadas con una cámara digital Olympus C4000, montada a este.
Resultados
La cepa de leptospira correspondiente al serogrupo Pomona provocó la muerte de todos los cobayos. Los signos observados en los animales correspondieron a los esperados en los casos de leptospirosis: decaimiento, inapetencia, ictericia, e hiperemia conjuntival.
Patología
Las lesiones macroscópicas mostraron hemorragias petequiales en tejido subcutáneo, ictericia, congestión en órganos con puntillado hemorrágico, esplenomegalia y hepatomegalia.
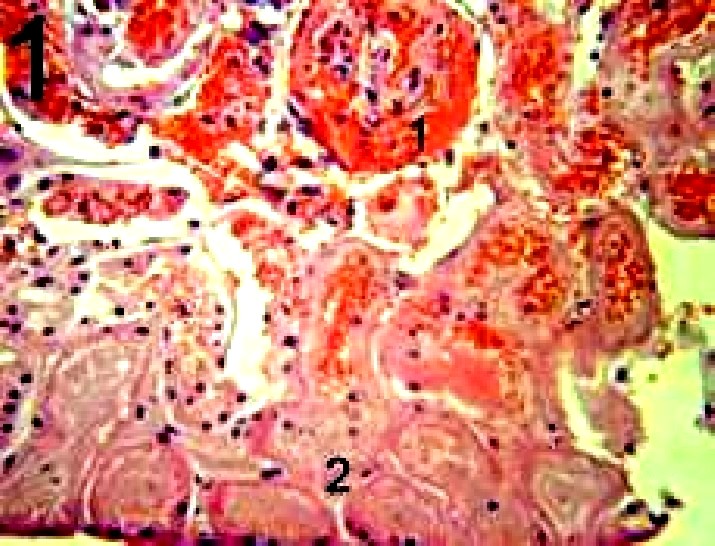
En los estudios histopatológicos se observó, en riñón glomerulopatía, con depósito proteináceo, hemorragias e infiltración leucocitaria en glomérulos, y necrosis multifocal del epitelio tubular con infiltración hialina intracelular y extracelular (fig. 1). En pulmón, se encontraron cambios patológicos característicos de neumonía intersticial aguda, y degeneración fibrinoide en las arterias. En hígado, se encontró arteritis fibrinoide en ramas de la arteria portal.
Fig. 1. Depósito proteináceo en cápsula de Bowman, hemorragias e infiltración leucocitaria en glomérulos, y necrosis multifocal del epitelio tubular con infiltración hialina intracelular y extracelular en el riñón, H/E, 400x.
Inmunofluorescencia
Se detectó fluorescencia positiva en las secciones renales de animales inoculados (fig. 2). En los controles negativos no se observó fluorescencia.
Fig. 2. Células de leptospiras en el tejido del riñón, mediante la técnica de inmunofluorescencia, 400x.
Warthin-Starry
La tinción de Warthin-Starry realizada en cortes de animales inoculados mostró leptospiras en túbulos renales (fig. 3).
Fig. 3. Leptospiras libres en el interior de los túbulos y junto al apex de las células tubulares. Riñón, Warthin-Starry, 400x.
Inmunohistoquímica
Se observó inmunomarcación positiva en los cortes de riñón de animales inoculados. La positividad estuvo dada por algún grado de coloración rosada, observable en los sitios donde se esperaría encontrar al agente, coincidente con los sitios señalados por la tinción de Warthin-Starry (fig. 4). Se observó inmunomarcación sobre el borde apical de las células tubulares y dentro de los túbulos en los cortes analizados provenientes de animales inoculados. No se observó inmunomarcación inespecífica ni inmunomarcación específica en cortes de animales control.
Fig. 4. Leptospiras inmunomarcadas libres en el interior de los túbulos y junto al apex de las células tubulares. Riñón, IHQ, 400x.
Discusión
La observación microscópica de lesiones causadas por Leptospira spp. puede ser utilizada para arribar a un diagnóstico presuntivo, porque el agente produce lesiones de tipo necrótico inflamatorias no patognomónicas. La tinción de Warthin-Starry permite detectar las leptospiras en los tejidos, pero puede haber un margen de error en las observaciones. Estas técnicas tienen como principal desventaja el hecho de requerir muestras de tejido en buen estado de conservación para distinguir correctamente las estructuras, lo que no siempre es posible porque los fetos abortados, principal signo clínico en animales de producción, suelen tener cierto grado de autólisis.
La técnica de inmunohistoquímica, que mediante el uso de un anticuerpo específico permite detectar sobre preparaciones histológicas la presencia o no de un antígeno, podría utilizarse para el diagnóstico de la enfermedad. En este trabajo, con el uso de un antisuero anti-Pomona, se logró evidenciar la presencia de la bacteria en animales enfermos mediante esta técnica, la cual tiene como ventajas, respecto a la observación de lesiones microscópicas, el posibilitar la detección de antígenos específicos en el sitio de lesión, es decir, ver la lesión y el potencial agente causal; y respecto a la tinción Warthin-Starry, hacer más sencilla la observación del antígeno, lo que mejoraría la calidad del diagnóstico. De manera similar, para la correcta realización de la técnica, la muestra a analizar debería estar en buen estado de conservación, lo que limitaría su utilidad en aquellos casos bien conservados.
El protocolo de trabajo utilizado permitió el uso de muestras almacenadas en depósito ya incluidas, o aún en formaldehído durante largos períodos. Esto puede ser una ventaja cuando se desean realizar muestreos a grandes distancias del laboratorio de trabajo, porque una vez colocada la muestra en el fijador, no requiere refrigeración, a diferencia de la muestra necesaria para inmunofluorescencia que requiere ser almacenada en frío. Más aún, el utilizar esta técnica en muestras fijadas con fijadores de rutina, podría permitir la realización de estudios retrospectivos con muestras recolectadas con anterioridad.
Futuros estudios son necesarios para determinar con mayor certeza las características, ventajas y desventajas de la IHQ aplicada al estudio y diagnóstico de esta enfermedad. También para lograr una mejor comparación entre esta y otras técnicas, sobre todo en lo referente a su sensibilidad, capacidad de detección frente a muestras con diversos grados de autólisis, utilización de antisueros polivalentes, etcétera.
Se puede concluir que la inmunohistoquímica es una herramienta sumamente útil en patología veterinaria, la cual podría ser utilizada con éxito en el diagnóstico e investigación de la leptospirosis.
Adaptation of an immunohistochemistry protocol for the detection of Leptospira spp. in samples of formaldehyde-fixed tissue
Summary
The immunohistochemistry technique was evaluated in tissue samples fixed in formaldehyde saline solution 10 % and included in paraffin to be used as a lab method allowing to identify leptospires in tissues. Samples obtained from the experimental inoculation of 8 guinea pigs carriers of L. interrogans
Key words: Leptospirosis, diagnosis, immunohistochemistry.
Referencias bibliográficas
1. Levett PN. Leptospirosis. Clin Microbiol Rev 2001;14:296-326.
2. Brihuega B. Patogenia de la Leptospirosis Experimental. Temas de Zoonosis III. Argentina:Ed. Asociación Argentina de Zoonosis; 2006. p.165-9.
3. Stanchi N, Brihuega B. Temas de Microbiología Veterinaria.
4. Office International des Epizooties. Manual of Standards for Diagnostic Tests and Vaccines. OIE; 1996.
5. Spraker TR, ORourke KI, Balachandran A, Zink RR, Cumings BA, Miller MW, et al. Validation of monoclonal antibody F99/97.6.1 for immunohistochemical staining of brain and tonsil in mule deer (Odocoileus hemionus) whith chronic wasting disease. J Vet Diagn Invest 2002;14:3-7.
6. Heggebo R, McL Press C, Gunnes G, Ulvuvnd MJ, Tranulis MA, Landsverk T. Detection of PrPSc in lymphoid tissues of lambs experimentally exposed to the scrapie agent. J Comp Path 2003;128:172-81.
7. Estrada-Chávez C, Pereira-Suárez AL, Meraz M, Arriaga C, García-Carranca A, Sánchez-Rodríguez C, et al. High-level expression of NRAMP1 in peripheral blood cells and tuberculous granulomas from Mycobacterium bovis-infected bovines. Infect Immun 2001;69(11):7165-8.
8. Hostetter J, Huffman E, Byl K, Steadham E. Inducible nitric oxide synthase immunoreactivity in the granulomatous intestinal lesions of naturally occurring bovine johnes disease. Vet Pathol 2005;42:241-9.
9. Delgado F, Pereira AL, Funes D, Francinelli G, Venzano A, Tagle MC, et al: Detección de Mycobacterium avium susp. Paratuberculosis y factores de activación de macrófagos en tejidos de rumiantes con paratuberculosis, mediante la técnica de inmunohistoquímica. Tandil, Argentina:X Congreso Argentino de Ciencias Morfológicas; 2006.
10. Boenisch T. Métodos inmunohistoquímicos de Coloración; 3ra. ed. Dako Corp.; 2002.
11. Gibson da Silva F, de Freitas JC, Kuroki Anzai E, Yumi Hashimoto V, Giraldi N, Delbem AC, et al. Leptospires detection in kidney, liver and uterus of cows slaughtered in Paraná state,
12. Faine S, Adler B, Bolin C. Leptospire and leptospirosis.
13. Faine S. Guidelines for control of Leptospirosis,
14. Linda L. Vacca: Laboratory Manual of Histochemestry.
Recibido: 29 de noviembre de 2006. Aprobado: 12 de diciembre de 2006.
Dr. Fernando Delgado. Instituto de Patobiología, CC 77 (1708), Morón, Buenos Aires, Argentina. Teléf.: 0054-114-621-1289. Correo electrónico: fdelgado@cicv.inta.gov.ar
1 Médico Veterinario.
2 Médica Veterinaria. Investigadora.
3 Médico Veterinario. Investigador.
4 Técnico de Laboratorio.
5 Máster en Ciencias. Médico Veterinario.
6 Doctor en Ciencias. Médico Veterinario.
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons