Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.61 n.1 Ciudad de la Habana ene.-abr. 2009
ARTÍCULO ORIGINAL
Resultados preliminares del perfeccionamiento del DAVIH-AgP24 con el empleo del sistema de amplificación biotina-tiramina/estreptavidina-peroxidasa
Preliminary results of DAVIH-AgP24 with the biotin-tiramyne/streptavidine-peroxidase amplification system
Anitza Fragas QuinteroI; Eva Ortiz LosadaII; Héctor M. Díaz TorresIII; Eladio Silva CabreraIV; Maricela Izquierdo Márquez II
I Licenciada en Ciencias Farmacéuticas. Aspirante a Investigadora. Laboratorio de Investigaciones del SIDA (LISIDA), La Habana, Cuba.
II Licenciada en Ciencias Biológicas. Máster en Ciencias. Investigadora Auxiliar. LISIDA, La Habana, Cuba.
III Especialista de I Grado en Medicina Interna. Máster en Ciencias. Investigador Auxiliar. LISIDA, La Habana, Cuba.
IV Especialista de II Grado en Microbiología. Doctor en Ciencias. Investigador Titular. LISIDA, La Habana, Cuba.
RESUMEN
OBJETIVO: se modificó el ELISA DAVIH-Ag P24 con la introducción de la disociación por calor de las muestras de plasma y el empleo de un sistema de amplificación biotina-tiramina/estreptavidina-peroxidasa, para incrementar su sensibilidad.
MÉTODOS: se determinó la repetibilidad interensayo en el DAVIH-Ag P24 amplificado. Se evaluaron 32 muestras de plasma de individuos infectados por el VIH-1 en 3 categorías clínicas (caso SIDA, asintomáticos y con infecciones oportunistas menores).
RESULTADOS: en la determinación de la repetibilidad interensayo se obtuvo un coeficiente de variación entre 4 y 10,3 %. Con el DAVIH-Ag P24 amplificado se incrementó el nivel de detección de P 24 hasta 0,5 pg/mL. El DAVIH-Ag P24 amplificado alcanzó 66 % de sensibilidad, mientras que el DAVIH-Ag P24 obtuvo 31 %.
CONCLUSIONES: este estudio preliminar permitió demostrar que la incorporación de las nuevas modificaciones al sistema DAVIH-Ag P24 amplificado logró aumentar los niveles de detección de P24 y ganar en sensibilidad.
Palabras clave: Antígeno P24, disociación de inmunocomplejos, sistema de amplificación biotina-tiramina/estreptavidina-peroxidasa, terapia antirretroviral.
ABSTRACT
OBJECTIVE: ELISA DAVIH-Ag p24 was modified by introducing heat dissociation of plasma samples and a tyramine/streptavidine-peroxidase amplification system, with the objective of increasing sensitivity.
METHODS: Between-assay repeatability was determined in amplified DAVIH-Ag p24. Thirty two plasma samples from HIV-1-infected individuals classified in three clinical categories (AIDS case, asymptomatic and minor opportunistic infections) were evaluated.
RESULTS: the variation coefficient ranged 4-10.3 % in between-assay repeatability. With the amplified DAVIH-p24 Ag, the p24 antigen detection level increased to 0.5 pg/mL. Amplified DAVIH-p24 Ag reached 66 % sensitivity whereas standard DAVIH-p24 Ag sensitivity rate was 31 %.
CONCLUSIONS: This preliminary study proved that the introduction of new modifications in amplified DAVIH-p24 Ag managed to increase the p24 antigen detection levels and to gain sensitivity.
Key words: p24 antigen, immune complex dissociation, biotin-tyramine/streptavidine-peroxidase amplification system, antiretroviral therapy.
INTRODUCCIÓN
La proteína de 24 kDa del virus de inmunodeficiencia humana (VIH), es un componente estructural importante de las partículas retrovirales.1 Se estima que la misma está presente en cantidades aproximadas a las 1 200 moléculas (5 x 10-17 g de P24) por cada virión.2,3 La concentración en sangre de la P24 del VIH-1 se modifica notablemente en el desarrollo de la infección, de ahí su uso como marcador de progresión en los estudios de terapia antirretroviral y en el diagnóstico de la infección en el período perinatal de niños nacidos de madres seropositivas.3
A inicios de la década de los años 90, se realizaron estudios a pacientes infectados por VIH-1 y se demostró que los niveles de detección de P24 eran un fuerte marcador para los estudios de progresión a SIDA. Sin embargo, los ensayos de captura de P24 eran considerados menos sensibles que los llevados a cabo para la determinación de la carga viral.2
En la actualidad, los sistemas de detección de la P24 se perfeccionan grandemente, en función de aumentar su sensibilidad. La eliminación, mediante de la desnaturalización por calor, de los inmunocomplejos (IC) que interfieren en el ensayo, permite aumentar la detección de esta proteína presente en las muestras. Este proceder, junto a un paso de amplificación, disminuye significativamente el límite de detección entre 1-0,5 pg/mL. Múltiples estudios corroboran este aumento en la sensibilidad como resultado de la incorporación de estas modificaciones a los sistemas de captura de la P24.1-7
En los laboratorios DAVIH (La Habana, Cuba) se produce un sistema inmunoenzimático tipo sandwich (DAVIH-AgP24) de detección de la P24 que comprende un rango de concentración entre 514-16 pg/mL. En el presente estudio se empleó la desnaturalización por calor como tratamiento previo a las muestras y la incorporación de un paso de amplificación biotina-tiramina/estreptavidina-peroxidasa, con el objetivo de aumentar su sensibilidad.
MÉTODOS
Controles y muestras
Control positivo: proteína de 24 kDa del VIH-1, purificada por cromatografía de afinidad utilizando sefarosa 4B activada en bromuro de cianógeno y acoplada con anticuerpo monoclonal antiP24.8 Se presenta liofilizada y se conserva de 2 a 8 °C hasta el momento de su uso. Este método de purificación es empleado en la actualidad y con este mismo objetivo en el sistema ELISA DAVIH-Ag P24 (Laboratorios DAVIH, La Habana, Cuba).
Control negativo: muestras de plasma humano negativo a antígeno y anticuerpos contra VIH-1/2, VHC, no reactiva a antígeno de superficie del VHB y VDRL (Laboratorios DAVIH, La Habana, Cuba).
Muestras: se colectaron 32 muestras de plasma de individuos seropositivos al VIH-1 con diagnóstico confirmatorio por western blot y otras pruebas complementarias de acuerdo con el algoritmo de pesquisaje serológico establecido en Cuba.9 Las muestras se agruparon según clasificación clínica en: 11 como caso SIDA, que se encontraban bajo tratamiento antirretroviral (triterapia), 2 con infecciones oportunistas menores (no SIDA) y 19 asintomáticos sin tratamiento.
ENSAYOS
ELISA DAVIH-Ag P24
Es un ensayo inmunoenzimático de tipo sandwich, que utiliza anticuerpos monoclonales como sistema de captura y anticuerpos policlonales específicos contra la P24 del VIH-1 conjugado con peroxidasa (SIGMA) en la detección. Para el revelado de la reacción se utiliza como cromógeno, la tetrametilbencidina (SIGMA). La placa se lee a una longitud de onda de 450 nm en un lector de ELISA (Organon Teknika).9 El ensayo dura alrededor de 20 a 22 h. Se siguieron estrictamente las instrucciones del fabricante.
ELISA DAVIH-Ag P24 amplificado
- Obtención del complejo biotina-tiramina
Se obtuvo de la mezcla de 2 soluciones de 0,3 mM de tiramina (SIGMA) y 0,3 mM de éster de biotina-N-hidroxisuccinamida (SIGMA) diluidas por separado en 1 mL de dimetilsulfóxido (MERCK-Schuchardt). Las 2 soluciones obtenidas se mezclaron hasta homogeneizar. La solución resultante se incubó toda la noche a temperatura ambiente con agitación constante. Se envasó en viales a razón de 500 µL y se almacenó de 2 a 8 °C hasta el momento de su uso.10
- Tratamiento de las muestras
Las muestras de plasma se diluyeron 1:6 con tritón X-100 (BDH) 0,5 % y se calentaron a 100 °C, durante 5 min, en un bloque térmico (PTC-100MJ Research Inc. EUA).11-14 Se preparan al momento de su uso.
- Procedimiento
Las muestras de plasma tratadas se colocaron a razón de 180 µL por pocillo en la microplaca (MAXISORP F-16), sensibilizada con anticuerpo monoclonal de origen murino contra la P24 (Laboratorios DAVIH, La Habana, Cuba) y se incubaron de 18 a 20 h a 37 °C. La placa se lavó 5 veces con solución balanceada de sales pH 7,2 con Tween 80 (PBS-T80). Se le adicionaron 200 µL por pocillo de IgG policlonal humana contra la P24 conjugada con peroxidasa (Laboratorios DAVIH, La Habana, Cuba) y se incubó a 37 °C durante 90 min. Después de 10 lavados, se adicionó, en cada pocillo, 200 µL del complejo biotina-tiramina diluido en Tris-HCl 50 mM pH 8 + seroalbúmina bovina (SAB) 1 % + peróxido de hidrógeno (H2O2) 0,003 % y se incubó a temperatura ambiente durante 15 min. Se realizó otro paso de lavado similar al anterior y se adicionó 200 µL por pocillo de estreptavidina-peroxidasa (SIGMA) diluida en PBS-T80 a la que se le añadió SAB (SIGMA) 1 % y se incubó a temperatura ambiente durante 15 min. Para el revelado de la reacción se utilizó la tetrametilbenzidina (TMB) (SIGMA) como reactivo cromógeno en una solución sustrato fosfato-citrato pH 5 + H2O2 (Laboratorios DAVIH, La Habana, Cuba) y se adicionó a razón de 200 µL por pocillo después de efectuarse 10 ciclos de lavados. La placa se incubó durante 20 min a temperatura ambiente en cámara oscura y la reacción se paralizó con 50 µL de ácido sulfúrico 4M (Riedel-de Haen). La lectura se realizó en un lector de ELISA (Organon Teknika) a una longitud de onda de 450 nm.
El valor de corte se estableció calculando la media de los valores de densidad óptica (DO) de los controles negativos más 3 desviaciones estándar (DE). Las muestras con un valor de absorbancia mayor o igual al valor de corte se consideraron como positivas al ensayo.
La repetibilidad interensayo del DAVIH-Ag P24 amplificado se determinó para 6 concentraciones de P24 (16, 8, 4, 2, 1 y 0,5 pg/mL) por duplicado, en 10 ensayos.
Se elaboró una curva patrón a partir de diluciones al doble (base dos) del control positivo en un rango desde 514 hasta 16 pg/mL, para el DAVIH-Ag P24 y desde 514 hasta 0,5 pg/mL para el DAVIH-Ag P24 amplificado, con el objetivo de determinar el nivel de detección de este último. Se asumió como detectable aquel valor de concentración cuya DO fuera mayor o igual que la media de los valores de DO de los controles negativos, más 3 DE.
EVALUACIÓN DE LAS MUESTRAS
Las 32 muestras de plasma se analizaron en paralelo y por duplicado en ambos sistemas. Para el DAVIH-Ag P24 se trabajó de acuerdo con las instrucciones del fabricante (Laboratorios DAVIH, La Habana, Cuba) y en el caso del DAVIH-Ag P24 amplificado se siguió el procedimiento descrito anteriormente.
Análisis estadístico
Se calculó la media, DE y coeficiente de variación (CV) de los valores de DO para cada concentración de P24 entre 16 y 0,5 pg/mL en los 10 ensayos. La homogeneidad entre las medias se estimó mediante la Dócima de Grubb y para determinar la homogeneidad entre las varianzas se empleó la Dócima de Cochran con valores críticos para ambas dócimas de a 1 % y 5 %.15 Los valores de DO obtenidos de cada concentración de la P24, para los 10 ensayos, se llevaron a un diagrama de dispersión y se analizaron por regresión lineal mediante el programa computadorizado Microsoft Excel 2003. La sensibilidad alcanzada en la evaluación de las 32 muestras de plasma por DAVIH-Ag P24 y DAVIH-Ag P24 amplificado se determinó como describe Ochoa y otros (2000).16
RESULTADOS
Los resultados obtenidos en relación con la media, DE y CV, para las 6 concentraciones estudiadas se muestran en la tabla 1. El CV para el estudio de repetibilidad interensayo se encontró entre 4 y 10,3 % en todos los casos. Los resultados de los estadígrafos (G1 y G2) para la Dócima de Grubbs y (C) para la Dócima de Cochran, resultaron ser menores que los valores críticos para a 1 % y 5 % (tabla 1).
En la figura 1 se representa un diagrama de dispersión para los valores de DO referentes a la concentración de P24 (16, 8, 4, 2, 1 y 0,5 pg/mL) en los 10 ensayos. Se llevó a cabo un análisis de regresión lineal y la R2 obtenida fue cercana a 1 (R2= 0,9852).
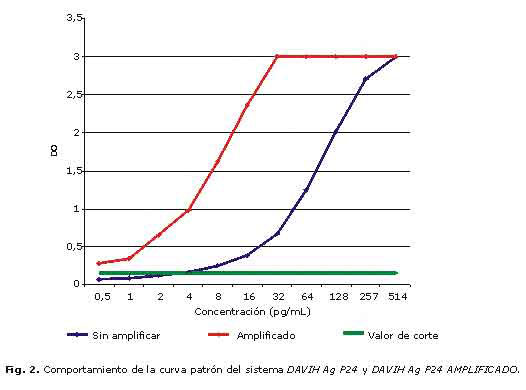
En la figura 2 se muestran las curvas patrón para los sistemas DAVIH-Ag p24 y DAVIH-Ag p24 amplificado, con un rango de concentración establecido que se traduce en niveles de detección de P24. El sistema DAVIH-Ag P24 amplificado alcanzó un nivel de detección de 0,5 pg/mL, mientras que el sistema DAVIH-Ag p24 se mantuvo con el mismo nivel de detección reportado por el productor (16 pg/mL).
En la tabla 2 se muestran los resultados de la evaluación de 32 muestras de plasma de individuos infectados por VIH/SIDA en los sistemas DAVIH-Ag P24 y DAVIH-Ag P24 amplificado. Del total de muestras estudiadas, el sistema DAVIH-Ag P24 clasificó 10 muestras como reactivas para 31 % de sensibilidad, mientras que por el DAVIH-Ag P24 amplificado resultaron reactivas 21 muestras para una sensibilidad de 66 %. La sensibilidad del sistema DAVIH-Ag P24 amplificado fue mayor para todas las categorías clínicas estudiadas, tal y como se aprecia en la tabla 2.
DISCUSIÓN
Los ensayos inmunoenzimáticos cuantitativos utilizan curvas de calibración para calcular la concentración de las muestras estudiadas, de ahí lo importante que es lograr parámetros óptimos en el ensayo. Ochoa y otros (2000)16 plantearon en relación con la repetibilidad interensayo, que los valores del coeficiente de variación para el caso de ELISA cuantitativos no deben superar 20 %, resultan óptimos los inferiores a 10 %. La OIE17 señala a su vez, que para valores de DO no normalizados, se admite en la estimación del CV, una variación menor o igual que 20 %. Esto coincide con los resultados obtenidos en el estudio de repetibilidad interensayo, donde se observó que los valores del CV fueron menores que 20 % y no exceden de 10 %, lo que determinó una adecuada precisión para el estuche. Las Dócimas de Grubbs y Cochran indicaron que existió una distribución normal de los valores muestrales y homogeneidad entre las varianzas.
Ochoa y otros (2001)18 plantearon que en ensayos biológicos, a diferencia de los ensayos químicos, se necesita un análisis de regresión lineal que valore más el ajuste de la curva. En la figura 1 se observó poca dispersión de los valores de DO en los 10 ensayos correspondientes para cada concentración estudiada de P24. Esto da la medida de la calidad del ajuste que se logró para la curva patrón de concentración de P24, al ser aplicado el análisis de regresión lineal para los valores de DO obtenidos. La R2 resultante fue cercana a 1 (R2= 0,9852), lo que se considera óptimo para análisis de este tipo. Esto coincide con Ochoa y otros (2001),18 ellos plantearon que mientras más cercano a 1 mejor será la calidad en el ajuste en los análisis de regresión.
El sistema DAVIH-Ag P24 amplificado logró disminuir el límite de detección hasta los 0,5 pg/mL. Los valores de DO obtenidos para ese punto de la curva fueron mayores o iguales que el valor de corte. Estudios reportados en la literatura señalan que para sistemas comerciales de detección de P24 basados en el mismo principio que el nuestro, se logran niveles de detección de 0,5 pg/mL (500 fg/mL) cuando se incorporan estas modificaciones en el ensayo. Estos resultados coinciden con los obtenidos por nuestro sistema.3,11-13,14
La disociación previa de las muestras y la incorporación de un paso de amplificación, que utiliza la capacidad de la peroxidasa para incorporar residuos fenólicos biotinilados revelados mediante la estreptavidina-peroxidasa, permitieron detectar bajos niveles de P24 en todos los grupos de muestra analizados y con esto ganar en sensibilidad en el sistema DAVIH-Ag P24 amplificado. Schupbach y otros3 obtienen valores similares en cuanto a sensibilidad, pues para una población positiva estudiada lograron 61,9 %.
En los individuos clasificados como caso SIDA ocurre una intensa replicación viral y un deterioro evidente del sistema inmune; la producción de anticuerpos (Ac) contra la P24 disminuye considerablemente y aumentan los niveles de antígeno P24 (Ag P24). Los resultados obtenidos, al parecer contradictorios, en este grupo donde la frecuencia de antigenemia es mucho mayor asociados directamente a etapas más graves de la enfermedad, pueden estar relacionados con el tratamiento antirretroviral a que estaban sometidos estos pacientes y por ello los niveles que se detectaron de Ag P24 estaban atenuados como respuesta a la terapia. Según Praharaj y otros,11 así como Balakrishnan y otros,13 los niveles de Ag P24 circulante pueden ser reducidos con el empleo de las drogas antirretrovirales. Schupbach y otros2 determinaron en sus estudios que la aplicación de la terapia antirretroviral logró disminuir en gran medida el número de partículas virales, lo cual trajo consigo que no ocurriera prácticamente lisis celular y, por tanto, los niveles de P24 libre en plasma disminuyeran notablemente. Resultados similares fueron obtenidos por Respess y otros,12 así como Tehe y otros,19 en pacientes con SIDA que se encontraban bajo tratamiento antirretroviral, cuando el nivel de detección de Ag P24 en condiciones amplificadas fue de 40 y 34 %, respectivamente.
En los individuos asintomáticos, el organismo comienza a comprometer su sistema inmunológico con el período infeccioso y empieza a liberar Ac contra la P24, con la consecuente formación de IC. Esto provoca la aparición de resultados falsos negativos, cuando se enfrenta este grupo de pacientes a sistemas de captura de Ag P24 sin modificar. Diversos autores utilizan la desnaturalización por calor de las muestras con una previa dilución en Tritón X-100 0,5 %. Este paso facilita que ocurra la reducción de los puentes disulfuro de las moléculas de Ac y, por ende, la destrucción irreversible de las uniones funcionales entre el antígeno y el Ac; pierde este su estructura tridimensional y queda el antígeno libre para su detección.1,2,6
La P24 no siempre está como complejo con el Ac, sino que puede aparecer formando agregados de P24 o como componente estructural de viriones incompletos, producto de la lisis celular.2,20 Schupbach y otros3 plantearon la utilización de una solución de ruptura para facilitar la eliminación de estos agregados de la P24 y favorecer así su detección. En el presente estudio el empleo de una solución de Tritón X-100 a 0,5 %, además de la desnaturalización por calor como método de ruptura para los IC, influyó en la destrucción de los IC y de los agregados de la P24; de ahí el aumento del número de muestras positivas que se obtuvo para el sistema DAVIH-Ag P24 amplificado.
Estos resultados coincidieron con los obtenidos por otros autores, donde los niveles de detección para este grupo de pacientes no superaron 72,7 % en sistemas amplificados de detección de P24.12
En los individuos asintomáticos la latencia clínica no se corresponde con un período de latencia virológica, aunque el VIH se replica intensamente en el tejido linfoide, no aparecen síntomas de la enfermedad. Por este motivo es importante contar con sistemas de detección de Ag P24 de alta sensibilidad, que permitan detectar los niveles de P24 en este período, como un marcador complementario a la hora de definir el inicio temprano de la terapia antiviral en este grupo de pacientes.19,21
El escaso número de muestras analizadas en los pacientes con infecciones oportunistas menores, que aún no clasifican como caso SIDA, no permitió hacer un análisis más profundo de los resultados. A pesar de no ser un número representativo de muestras, el sistema DAVIH-Ag P24 amplificado detectó 100 %.
La ganancia en sensibilidad de los sistemas de captura de P24 es de vital importancia como ensayo complementario, para estudios de progresión de la enfermedad en pacientes infectados por el VIH-1 y para el monitoreo de la terapia antirretroviral.3,4,19,21 Este estudio preliminar permitió demostrar que con la incorporación de las nuevas modificaciones al sistema DAVIH-Ag P24 amplificado, se logró aumentar los niveles de detección de P24 y ganar en sensibilidad de forma precisa.
REFERENCIAS BIBLIOGRÁFICAS
1. Constantine N, Zink H. HIV testing technologies after two decades of evolution. Indian J Med Res. 2005;121:519-38 .
2. Schupbach J. Viral RNA and p24 Antigen as Markers of HIV Disease and Antiretroviral Treatment Success. Int Arch Allergy Immunol. 2003;132:196-209.
3. Schupbach J, Tomasik Z, Knuchel M, Opravil M, Gunthard H, Nadal D, et al. Optimized virus disruption improves detection of HIV-1 p24 in particles and uncovers p24 reactivity in patients with undetectable HIV-1 RNA under long-term HAART. J Med Virol. 2006;78:1003-10.
4. Pascual A, Cachafeiro M, Funk L, Fiscus A. Comparison of an assay using signal amplification of the heat-dissociated p24 antigen with the Roche Monitor Human Immunodeficiency Virus RNA Assay. J Clin Microbiol. 2002;2472-5.
5. Zijenah L, Tobaiwa B, Rusakaniko S, Kusum J, Nathoo M, Nhembe M, et al. Signal-Boosted qualitative ultrasensitive p24 antigen assay for diagnosis of subtype C HIV-1 infection in infants under the age of 2 years. J Acquired Inmune Defic Syndr. 2005;39:391-4.
6. Patton C, Sherman G, Coovadia H, Stevens S, Meyers M. Ultrasensitive human Immunodeficiency virus type 1 p24 antigen assay modified for use on dried whole-blood spots as a reliable, affordable test for infant diagnosis. Clin Vacc Inmunol. 2006;13:152-5.
7. Nouhin J, Nguyen M. Evaluation of Boosted-p24 antigen assay for the early diagnosis of pediatric HIV infection in Cambodia. J Trop Med Hyg. 2006;75(6):1103-5.
8. Ruíz N, Álvarez G, Noa E. Procedimientos para la obtención de reactivos biológicos de los estuches DAVIH Ag P24 y DAVIH Ac P24. VacciMonitor. 2003;4:16-23.
9. Izquierdo M, Silva E, Díaz H, Lubián A, Nibot C, Tabares D. Estudio comparativo de dos sistemas de captura de la proteína de 24 kD del virus de inmunodeficiencia humana tipo 1. Biotecnología Aplicada. 2000;17:102-4.
10. Bobrow M, Harris D, Shaughnessy J, Litt G. Catalyzed reporter deposition, a novel method of signal amplification. Application to immunoassays. J Immunol Methods. 1989;125:279-85.
11. Timothy R, Sterling R, Hoover J, Vlahov D, Bartlett G, Schupbach J. Heat-denatured Human Immunodeficiency Virus Type 1 protein 24 antigen: Prognostic value in adults with early-stage disease. J Infect Dis. 2002;186:1181-5.
12. Praharaj A, Angadi K, Kalghalgi A, Tripathy S, Sawhney M, Nagendra A. Early Diagnosis of Human Immunodeficiency Virus Infection by p24 Antigen Detection. MJAFI. 2003;59:313-5.
13. Respess R, Cachafeiro A, Withum D, Fiscus S, Newman D, Branson B, et al. Evaluation of an ultrasensitive p24 assay as a potential alternative to Human Immunodeficiency Virus Type 1 RNA viral load assay in resource _ limited settings. J Clin Microbiol. 2005;43(1):506-8.
14. Balakrishnan P, Salomón S, Kumarasamy N, Kenneth M. Low-cost monitoring of HIV infected individual son highly active antirretroviral therapy (HAART) in developing countries. Indian J Med Res. 2005;121:345-55.
15. NCE (Norma Cubana Experimental). Guía para la validación de métodos de ensayos químicos para alimentos. Anexo A, A 1-3; 2001.
16. Ochoa R, Martínez J, Estrada E, García A, Ferriol X, Blanco R, et al. Validación de inmunoensayos cualitativos usados para evaluar la inmunogenicidad de vacunas. VacciMonitor. 2000;1:17-20.
17. International Standard Organization (ISO). Manual of Standards for Diagnostic Test and Vaccines. 5th ed. Part I. Cap I.1.3. Principles of Validation of Diagnostic Assays for Infectious Diseases; 2004. p.32-45.
18. Ochoa R, Martínez JC, Ferriol X, Margarita A, Estrada E, Blanco R, et al. Sensibilización de placas para ensayos inmunoenzimáticos con antígenos vacunales. VacciMonitor. 2001;10(4):14-7.
19. Tehe A, Mauric Ch, Hanson L, Borget Y, Abiola N, Schupbach J, et al. Quantification of HIV-1 p24 by a highly improved ELISA: An alternative to HIV-1 RNA based treatment monitoring in patients from Abidjan, Cote d´Ivoire. J Clin Virol. 2006;37:199-205.
20. Cimerman S, Araripe M, Salomáo L, Sobhie R. Less sensitive HIV-1 Enzyme Immunoassay as an adjuvant method for monitoring patients receiving Antiretroviral Therapy. AIDS Patient Care STDs. 2007;21(2):100-5.
21. Sutthent R, Gaudart N, Chokpaibulkit K, Tanliang N, Kano Ksinsombath C, Chaisilwatana P. P24 antigen detection assay modified with a booster step for diagnosis and monitoring of human immunodeficiency virus Type 1 Infection. J Clin Microbiol. 2003;41(3):1016-22.
Recibido: 26 de febrero de 2008.
Aprobado: 7 de septiembre de 2008.
Lic. Anitza Fragas Quintero. Laboratorio de Investigaciones del SIDA (LISIDA). Carretera de Jamaica y Autopista Nacional. La Habana, Cuba. Correo electrónico: cicdc@infomed.sld.cu; lisida@infomed.sld.cu














