Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.64 no.2 Ciudad de la Habana Mayo-ago. 2012
ARTÍCULO DE REVISIÓN
Diagnóstico de la leishmaniasis: de la observación microscópica del parásito a la detección del ADN
Leishmaniasis diagnosis: going from microscopic observation of parasite to DNA detection
Dr. C. Ana M. Montalvo, MSc. Jorge Fraga, Dr. C. Lianet Monzote, MSc. Marley García, MSc. Lisset Fonseca
Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: la leishmaniasis es una enfermedad causada por varias especies del género Leishmania, de la cual se han incrementado los reportes en los últimos años. Diversos factores genéticos, inmunológicos y asociados al parásito determinan el establecimiento de la infección y la ocurrencia de enfermedad, que se presenta en formas clínicas muy diversas, lo cual condiciona, entre otros elementos, el método diagnóstico que se aplica.
Métodos: se hizo una revisión de la literatura básica y actualizada sobre aspectos generales de la leishmaniasis: la enfermedad y su situación epidemiológica, el ciclo de vida y la transmisión, vectores, presentaciones clínicas y diagnóstico; este último acápite contiene información sobre los principales métodos que se utilizan en el presente. Se puntualizó en la forma en que se apoya el diagnóstico desde el grupo de Leishmania del Instituto de Medicina Tropical "Pedro Kourí", que constituye el centro nacional de referencia para esta enfermedad tropical.
Resultados: se muestra información actualizada sobre los temas escogidos, con un enfoque orientador y práctico, dirigido al personal de salud que debe enfrentar casos con sospecha de leishmaniasis. Se muestran tablas y gráficos que resumen de manera organizada aspectos relevantes, así como el algoritmo de trabajo que se sigue en el instituto con relación al diagnóstico de esta enfermedad, con énfasis especial en las aplicaciones al diagnóstico molecular que ha realizado el grupo de trabajo.
Conclusiones: debido a que la leishmaniasis permanece aún sin control, el diagnóstico oportuno continúa siendo una necesidad. Todos los métodos aportan información de utilidad para la toma de decisiones en el tratamiento clínico, la imposición del tratamiento y el enfoque epidemiológico de esta parasitosis. Entre ellos, proponemos un algoritmo de trabajo en nuestro laboratorio, con el empleo de los métodos que resultan más útiles de acuerdo a nuestras condiciones y experiencias.
Palabras clave: Leishmania, leishmaniasis, diagnóstico, algoritmo.
ABSTRACT
Introduction: leishmaniasis is a disease caused by several species from Leishmania genus, which has been increasingly reported in the last few years. Several genetic, immunological factors and others related to this parasite have been associated to the outcome of the infection, and the occurrence of illness in varied clinical forms. All the aforementioned has an impact on the diagnostic method that should be used.
Methods: a basic and recent literature review was made, mainly focused on general aspects of leishmaniasis as epidemiological situation of disease, life cycle and transmission, vectors, clinical presentation and diagnosis; the latter shows information about the main methods used at present. The procedure followed by the Leishmania group at "Pedro Kourí" Institute of Tropical Medicine to support the diagnostic activities was presented as well.
Results: updated practical information about the chosen topics was presented, with a practical guiding approach aimed at the health personnel that must face suspected leishmaniasis cases. Tables and figures summarized relevant aspects in an organized form, as well as the working algorithm of Institute concerning diagnosis was presented. The application of molecular diagnosis by this working team was particularly underlined.
Conclusions: as leishmaniasis is still out of control, opportune diagnosis remains a must. All the methods provide useful information for taking decisions on clinical management, treatment and epidemiology of this parasitosis; hence, a working algorithm was submitted in our lab based on the most useful methods under our present conditions and experience.
Key words: Leishmania, leishmaniasis, diagnosis, algorithm.
LA ENFERMEDAD Y SU SITUACIÓN EPIDEMIOLÓGICA ACTUAL
La leishmaniasis es una enfermedad causada por protozoos parásitos del género Leishmania y se caracteriza por presentar una variedad clínica y epidemiológica en relación con las especies involucradas en la infección, los vectores transmisores, así como factores ligados al hospedero.1,2
Alrededor de 20 especies son patógenas para el hombre, las cuales se distribuyen en distintas regiones del Viejo y el Nuevo Mundo (tabla 1). Según la Organización Mundial de la Salud, la enfermedad es endémica en 88 países de 4 continentes y se notifican alrededor de 2 millones de casos nuevos cada año (http://www.who.int/leishmaniasis/burden/magnitude/burden_magnitude/). Algunos autores indican que el número global de casos se incrementó, particularmente en Brasil,3 Bolivia, Perú,4 Colombia,5 y Afganistán.6 Tal incremento puede ser el resultado del inadecuado control de vectores y reservorios en las zonas endémicas, de la mayor detección de leishmaniasis cutánea asociada a infecciones oportunistas (VIH/sida),7 de la emergencia en la resistencia al tratamiento8 y del impacto reciente de los cambios climáticos, que inciden en la distribución y el comportamiento de los vectores implicados en la transmisión de distintas enfermedades, entre estas, la leishmaniasis.9
Tabla 1. Principales especies patógenas para el hombre y su distribución geográfica
| Género | Complejo | Especie | Distribución geográfica |
| Leishmania (Leishmania) | Leishmania donovani | Leishmania donovani | China, subcontinente indio, Etiopía, Sudán, Kenya, Irán, Arabia Saudita, Yemen |
| Leishmania infantum | Albania, Argelia, Francia, Grecia, Italia, Marruecos, Portugal, España, Siria, Túnez, Turquía, Yemen | ||
| Leishmania chagasi | Argentina, Bolivia, Brasil, Colombia, Ecuador, El Salvador, Guadalupe, Guatemala, Honduras, Martinica, México, Nicaragua, Paraguay, Surinam, Venezuela | ||
| Leishmania archibaldi | India, Sudán, Etiopía, Líbano, Israel | ||
| Leishmania tropica | Leishmania tropica | Afganistán, Argelia, Azerbaiyán, Grecia, Irán, Irak, Israel, Marruecos, Túnez, Turquía, Yemen | |
| Leishmania aethiopica | Etiopía, Kenya | ||
| Leishmania major | Afganistán, Argelia, Chad, Irán, Irak, Israel, Libia, Mauritania, Marruecos, Siria, Sudán | ||
| Leishmania mexicana | Leishmania mexicana | Belice, Colombia, Costa Rica, República Dominicana, Ecuador, Guatemala, Honduras, México, Panamá, Venezuela | |
| Leishmania amazonensis | Bolivia, Brasil, Colombia, Costa Rica, Ecuador, Guayana Francesa, Panamá, Perú, Venezuela | ||
| Leishmania garnhami | Venezuela | ||
| Leishmania (Viannia) | Leishmania guyanensis | Leishmania guyanensis | Brasil, Colombia, Ecuador, Guayana Francesa, Perú, Surinam, Venezuela |
| Leishmania panamensis | Belice, Colombia, Costa Rica, Ecuador, Honduras, Nicaragua, Panamá, Venezuela | ||
| Leishmania naiffi | Brasil, Guayana Francesa, Ecuador, Perú | ||
| Leishmania braziliensis | Leishmania braziliensis | Argentina, Belice, Bolivia, Brasil, Colombia, Costa Rica, Ecuador, Guatemala, Honduras, Nicaragua | |
| Leishmania peruviana | Perú | ||
| Leishmania lainsoni | Brasil, Bolivia, Perú |
Adaptado de Antinori y otros, 2012.
De los casos de infección cutánea 90 % ocurre en Afganistán, Pakistán, Argelia, Irán, Brasil y Perú, mientras que 90% de la enfermedad visceral ocurre en la India, Bangladesh, Nepal, Sudán y Brasil,10 lo cual confirma que esta enfermedad tiene fuertes vínculos con la pobreza11 y dificulta aún más su control.
ASPECTOS GENERALES DEL CICLO DE VIDA Y LA TRANSMISIÓN
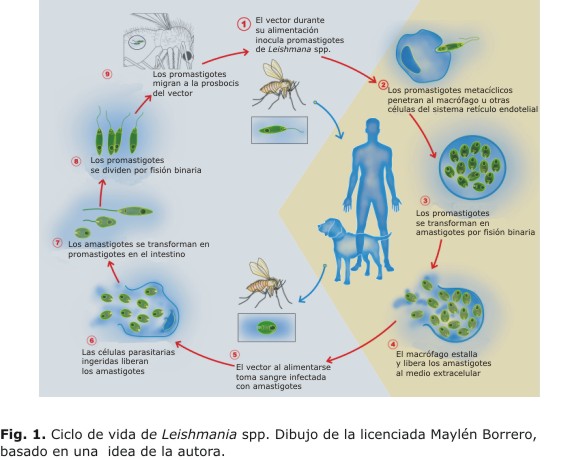
La forma infectiva del parásito es el promastigote metacíclico,12 que se inocula en el mamífero mediante la picadura del insecto, y cuya transmisión constituye un ejemplo típico de antropozoonosis (Fig. 1). Por otra parte, aspectos relacionados con la conducta humana, como la urbanización y destrucción de los bosques,13 la ocurrencia de conflictos armados,14 y el incremento del turismo, provocan la migración de población susceptible hacia áreas endémicas y favorecen la dispersión de Leishmania.15
Es muy probable que como consecuencia del calentamiento global la leishmaniasis se disperse hacia zonas actualmente templadas, donde los incrementos de la temperatura pudieran favorecer la extensión de las estaciones en las cuales se alimentan los vectores que transmiten el parásito, o que la baja temperatura provoque una extensión de su período larval16. También eventos naturales que en los últimos años se han hecho cada vez más frecuentes, como los terremotos, han provocado nuevos focos de la enfermedad en áreas que, con anterioridad, permanecían libres de esta infección17.
Además de la transmisión natural, es importante conocer que existe transmisión del parásito a partir de personas infectadas con Leishmania que utilizan drogas endovenosas, cuando existe uso de jeringuillas compartidas, lo que ha conllevado a la coinfección Leishmania-HIV. De forma general, se acepta que la incidencia global reportada para esta coinfección está subestimada, debido en parte a que la forma visceral de la enfermedad ocurre en "poblaciones olvidadas" y también al hecho de que al no estar la leishmaniasis dentro de la lista de enfermedades oportunistas, esta coinfección se notifica raramente.18
VECTORES
Los vectores de todas las especies de Leishmania descritas son hembras hematófagas de la familia Psychodidae, subfamilia Phlebotominae y de las 500 especies conocidas, solo 31 se identifican como vectores de especies patógenas y 43 como vectores probables, pertenecientes a los géneros Phlebotomus en el Viejo Mundo y Lutzomyia en el Nuevo Mundo19.
En Cuba no se reconocen vectores transmisores de Leishmania. En 1920 se describió para Cuba y las Islas Caimán la presencia de 2 especies de Lutzomyia: Lu. cubensis y Lu. orestes20. En la década de los 80 se notificaron 2 especies y una nueva subespecie del género para Cuba: (Lu. novoae y Lu. diazi) y (Lu. cayennensis cruz); solo Lu. orestes, entre todas, es la que manifiesta hábitos antropofílicos y hematófagos. Al mismo tiempo, se realizó la caracterización biológica y ecológica de estos vectores, y se notificó su distribución en todas las regiones de la geografía cubana 21.
Contrario a lo que sucede en América Latina, donde la mayor actividad de los flebótomos es nocturna, Lu. orestes tiene hábitos diurnos con picos de actividad hematofágica que se relacionan con cambios en la temperatura, humedad y luminosidad; y tal como ocurre en otros casos, el ataque de las hembras se produce en oleadas,22 lo cual amplifica, teóricamente, su potencialidad vectorial. En años posteriores, se desarrollaron estudios encaminados a demostrar las posibilidades de transmisión experimental de Leishmania mediante este vector, utilizando como modelo el hámster dorado.23
En la actualidad, sería imprescindible demostrar que Lu. orestes cumple los requisitos indispensables propuestos por Killick-Kendrick (1990), para poder considerarse como vector de Leishmania, y plantear, de manera fehaciente, que existen en Cuba posibilidades de transmisión de este parásito. No existen investigaciones recientes que aporten claridad sobre aspectos relativos a la posible transmisión en el país. Sin embargo, es necesario conocer los datos antes mencionados, porque no se puede descartar por completo la posibilidad de que bajo condiciones epidemiológicas específicas, en las que se presenten todos los elementos que componen la cadena epidemiológica de transmisión, se pueda producir este fenómeno que debería demostrarse rigurosamente.
PRESENTACIONES CLÍNICAS
En la leishmaniasis la presentación clínica es variada y depende por lo general de varios factores, entre los cuales la susceptibilidad genética del hospedero,24 el contexto inmunológico en que se produce la infección25 y la especie de Leishmania infectante26 son los más importantes. Así, se pueden presentar de manera general, la leishmaniasis cutánea, mucocutánea y visceral, con características clínicas específicas que aparecen descritas en un artículo reciente,27 por lo cual no se hará extensión en este aspecto. En varios países también se notifican otras presentaciones clínicas intermedias o atípicas.28
DIAGNÓSTICO DE LA LEISHMANIASIS
El diagnóstico por lo general depende de la forma clínica de presentación y de las posibilidades tecnológicas existentes en el servicio médico que recibe al paciente. Una vez que se presenta un paciente con las caracterítiscas clínicas o epidemiológicas que hagan sospechar una leishmaniasis, pueden realizarse una serie de exámenes que se describirán más adelante, en relación con la forma de presentación de la enfermedad.
Aspectos clínicos útiles para la orientación del diagnóstico de las leishmaniasis
Al existir diversas formas de presentación de la leishmaniasis cutánea y mucocutánea, los aspectos clínicos que pudieran hacer pensar en la presencia de alguna de estas son diversos, razón por la cual se comentarán más adelante. De manera general, la evolución de la lesión inicial en el sitio de la picada del vector es similar. Tras un período de incubación de 2 semanas a 3 meses aparece una pápula o nódulo pequeño, que puede acompañarse de inflamación ganglionar, y a veces cura de manera espontánea. En otras ocasiones, la lesión evoluciona hacia una enfermedad de diversas características clínicas,29 algunas de las cuales se describirán a continuación tomando en cuenta el área geográfica de origen.
En el Nuevo Mundo abundan las especies dermotrópicas, que producen manifestaciones más variadas que en el Viejo Mundo. Se puede presentar una lesión solitaria, o lesiones múltiples, en sitios cercanos a la picada del vector o en áreas distantes del cuerpo. La leishmaniasis cutánea localizada, que es la forma más común, se caracteriza por la aparición de una úlcera indolora de límites definidos, con aparición de costra central y a veces hemorrágica. Puede curar de forma espontánea dejando una cicatriz hipopigmentada. En dependencia del balance de la relación hospedero parásito, esa lesión puede evolucionar en algunos pacientes hacia otras formas más complejas.29
La forma recidiva cutis es rara en esta área geográfica. Existen poco reportes donde se ha vinculado con parásitos que pertenecen al subgénero L. (Viannia), en Brasil30 y Ecuador31 También Leishmania (L) amazonensis se ha relacionado con esta presentación.32
La leishmaniasis cutánea diseminada se caracteriza por la aparición de múltiples y variadas lesiones, en lo fundamental acneiformes y papulares, en áreas no contiguas del cuerpo.33 En zonas del norte de Brasil, donde aumentó la frecuencia de esta presentación, L. braziliensis fue la única especie que se identificó.34
La leishmaniasis cutánea difusa se caracteriza por la presencia de nódulos abundantes en parásitos, que no ulceran, y se considera una forma rara de presentación.35 Existen reportes en Centro y Sur América y también Etiopía, donde las especies relacionadas son L. mexicana, L. amazonensis y L. aethiopica, respectivamente.29
La leishmaniasis mucocutánea la padece de 1 a 10 % de los pacientes con leishmaniasis cutáneas36 y la produce en lo fundamental L. braziliensis, pero también se ha asociado con infecciones por L. guyanensis, L. panamensis y L. amazonensis. Puede aparecer de manera simultánea a la enfermedad cutánea o presentarse varios años después de la cura. Ocurre por diseminación hematógena o linfática de los parásitos desde la piel hasta la mucosa oronasofaríngea35 y se hace evidente por los síntomas nasales crónicos, que pueden continuar con la destrucción progresiva de la cavidad bucal y nasofaríngea, en el contexto de una respuesta inmune hiperactiva37. Los reportes son escasos fuera de América Latina, y en ellos el agente etiológico típico es L. aethiopica10. Es una enfermedad mutilante que deja secuelas físicas y psíquicas, las cuales dificultan la reinserción social de las personas que la padecen.
Se considera que en el Viejo Mundo, las especies que prevalecen pueden producir manifestaciones clínicas limitadas, en comparación con aquellas que predominan en el Nuevo Mundo. Es decir, L. major, L. tropica y L. aethiopica pueden causar, en 86 a 98 % de los casos, lesiones ulcerativas localizadas que en su mayoría curan tras un periodo de evolución de hasta 2 años. L. tropica produce la forma recidiva cutis, que se caracteriza por la aparición simultánea de lesiones papulares o vesiculares alrededor de la úlcera, o posterior a la cura38 y puntualmente se ha relacionado con la leishmaniasis mucosa,39 mientras L. aethiopica produce las formas localizada y mucocutánea y también se relaciona con la enfermedad cutáneo difusa38,40. L. donovani, usualmente viscerotrópica, puede producir una forma cutánea posterior a la enfermedad visceral, conocida como leishmaniasis cutánea pos-kala-azar.41
La diferenciación de estas infecciones cutáneas es imprescindible, porque otras enfermedades como la lepra, el cáncer de piel, la tuberculosis, las micosis cutáneas, así como las picaduras de insectos infectadas, el impétigo, la sarcoidosis y los neoplasmas pueden producir lesiones similares.42 Entre los hongos pueden encontrarse Paracoccidioides braziliensis, Histoplasma capsulatum y Sporothrix schenkii, así como bacterias piogénicas tipo Staphylococcus y Streptococcus o también Mycobaterium.43
En relación con los casos de leishmaniasis visceral, los pacientes presentan síntomas y signos de una infección sistémica persistente como fiebre, fatiga, debilidad, pérdida de apetito y de peso. La invasión de parásitos a la sangre y el sistema retículo endotelial, provoca inflamación de nódulos, bazo e hígado. La hiperpigmentación de la piel que se presenta en pacientes del subcontinente indio y antes dio nombre a la enfermedad, es un síntoma poco común, el cual se produce por una insuficiencia suprarrenal y, al parecer, guardaba relación con la duración prolongada de la enfermedad en tiempos en que el tratamiento efectivo no era posible.44
Esta forma clínica debe diferenciarse de la malaria, el síndrome de esplenomegalia tropical, esquistosomiasis, cirrosis, tripanosomiasis africana, tuberculosis, brucelosis, fiebre tifoidea, endocarditis bacteriana, histoplasmosis, malnutrición, linfoma y leucemia.45 Sin embargo, en la mayoría de las ocasiones no existen condiciones o recursos en las zonas endémicas para discriminar estas enfermedades.
Diagnóstico de laboratorio de las leishmaniasis
Los métodos que se pueden utilizar para realizar el diagnóstico son diversos y su utilidad depende, por lo general, de la forma clínica de presentación (tabla 2). A continuación se comentan los más importantes.
Tabla 2. Principales formas de diagnóstico recomendadas en relación con la forma clínica
| Método diagnóstico | Forma clínica relacionada | Características distintivas* |
| Examen parasitológico | Leishmania cutáneas | Aplicable en raspados, aspirados, biopsia |
| Prueba cutánea | Leishmania cutáneas | No diferencia infecciones pasadas o recientes. |
| Detección de anticuerpos | Leishmania visceral | Gran variedad de antígenos Buena sensibilidad y especificidad en zonas endémicas |
| Reacción en cadena | Aplicable a todas las formas clínicas | Alta sensibilidad y especificidad. |
* Se presentan algunas características de los métodos que pueden resultar de utilidad en la toma de decisiones.
Método parasitológico
Los métodos de diagnóstico parasitológico son muy específicos42 y se aplican en todas las formas clínicas de la enfermedad. Estos incluyen el examen microscópico de extendidos, raspados, biopsias o aspirados, tomados por lo general del borde de las lesiones y teñidos con Giemsa,45 pero la sensibilidad es baja, aproximadamente de 50 a 70 % en el Viejo Mundo46 y puede llegar a ser aún menor en el Nuevo Mundo, con valores de 15 a 30 %.47,48 También se realiza el examen histopatológico para hacer la búsqueda de amastigotes en distintos tejidos.
En la forma visceral la muestra para el examen parasitológico directo se toma del aspirado de bazo, nódulos linfáticos o médula ósea,42 proceso muy invasivo para el paciente y durante el cual pueden ocurrir complicaciones derivadas de hemorragias, por lo que se requiere alta pericia en estos procederes y otras condiciones técnicas.49
Cultivo
El cultivo de esas mismas muestras biológicas, por lo general en medio bifásico, (Novy, Mc Neal, Nicolle) resulta más informativo; puede facilitar la identificación y caracterización de especies por métodos isoenzimáticos o moleculares, pero requiere de mayores condiciones técnicas en el laboratorio y se necesita tiempo para ofrecer el resultado.33 La observación de promastigotes móviles fácilmente identificables en la fase líquida del medio cultivo, producto de la transformación de los posibles amastigotes presentes en la muestra sembrada, constituye el resultado positivo. Una reciente modificación el cultivo microcapilar en medio monofásico, parece más promisorio, porque se demostró que la utilización de una mezcla del aspirado de lesión y medio de cultivo a partes iguales, sembrada en pequeños volúmenes de 50 µL en tubos microcapilares no heparinizados, ocasiona a un incremento de la sensibilidad y requiere menor tiempo de incubación para obtener los resultados, lo que implica un avance en términos de costo y tiempo;50 pero ese resultado no se ha extendido a los servicios de salud.
Prueba cutánea de Montenegro
La medición de la respuesta de hipersensibilidad tardía, como manifestación de la respuesta inmune mediada por células, también se utiliza como complemento diagnóstico (prueba cutánea de Montenegro). Consiste en la inyección de 0,1 mL de antígeno de Leishmania en el antebrazo. Si la induración local que produce tras 2 o 3 d es igual o mayor que 5 mm, la reacción se considera positiva29 y la observación de la reacción epidérmica que se genera a consecuencia de la estimulación celular. Sin embargo, se aplica fundamentalmente como método complementario en casos de sospecha de enfermedad cutánea y mucocutánea, en estudios epidemiológicos de todas las formas de la enfermedad y en ensayos de vacunas, debido a que no diferencia infecciones pasadas o recientes.51
Los métodos que se mencionaron con anterioridad son los más utilizados en los distintos niveles de salud en las áreas endémicas, que generalmente disponen de bajos recursos, y en muchos casos el éxito depende de la experiencia del observador y de las condiciones de las instalaciones. En algunos laboratorios se toman varias muestras del propio paciente, ya sea de una misma lesión o de lesiones diferentes, como forma de incrementar las posibilidades de éxito en la detección. Sin embargo, la sensibilidad varía en dependencia de numerosos factores: el número y la dispersión de los parásitos, fundamentalmente en los casos del Nuevo Mundo, donde su abundancia en las lesiones puede variar según la especie,52,53 de la contaminación frecuente del cultivo por la presencia de elementos bacterianos o fúngicos en la muestra biológica; y el hecho de que distintas especies de Leishmania pueden tener diferentes requerimientos para su cultivo.54
Métodos indirectos serológicos
Los métodos serológicos se pueden aplicar al diagnóstico de casos de enfermedad cutánea, pero no hay acuerdo sobre la mayor utilidad de uno u otro, y a veces las recomendaciones de los autores son contradictorias. También se comunica una eficacia diferente entre el Viejo y el Nuevo Mundo, debido a la variación en la sensibilidad y la aparición de reacciones cruzadas.55
Recientemente, se describieron protocolos de ELISA especie-específicos con valores de sensibilidad comparables (84,6 % y 88,5 %) y una especificidad adecuada (96,2 %), que se recomiendan como pruebas complementarias para el diagnóstico de formas cutáneas causadas por L. braziliensis, L. guyanensis y L. amazonensis.56 Sin embargo, al ser métodos que detectan anticuerpos contra una especie en particular, su utilidad se reduce en áreas donde coexista más de una especie del parásito.
Por otra parte, un estudio comparativo demostró que la inmunofluorescencia indirecta con antígeno de promastigotes de L. amazonensis y la tira inmunocromatográfica con antígeno recombinante rK39, tuvieron mejor desempeño para el diagnóstico de casos clásicos en áreas endémicas, con valores de sensibilidad de 83,3 y 88,9 %, respectivamente. Por el contrario, la aplicación del ELISA, independientemente del antígeno utilizado, mostró valores de sensibilidad diagnóstica siempre bajos (50 %, 66,7 % y 69,4), y debido a la aparición adicional de reacciones cruzadas, no se recomendó ninguno en particular para las áreas endémicas.57
También se utilizan el antígeno soluble o la fracción enriquecida de membrana, con una sensibilidad similar para ambos, del 89,5% y una especificidad variable del 89,5% y 93,4% respectivamente, en dependencia del preparado antigénico de que se trate58.
De manera general, debido a que los anticuerpos circulantes en las presentaciones cutáneas tienen niveles muy bajos y la especificidad de los ensayos puede ser también variable, particularmente en áreas donde puedan ocurrir reacciones cruzadas con otros parásitos, como Trypanosoma cruzi,51 estos métodos permanecen como herramientas complementarias en los casos de leishmaniasis cutáneas.
Por el contrario, en la leishmaniasis visceral la detección de anticuerpos específicos resulta muy útil para el diagnóstico,58 y se utilizan ensayos de ELISA, inmunoflurescencia (IF) y electroinmunotransferencia (Western blot), que muestran en ocasiones una alta seguridad diagnóstica, pero que tienen el inconveniente de ser poco adaptables a condiciones de campo.59
El polipéptido recombinante de 39 kDa: rK39 se utilizó en países endémicos en un sistema ELISA de detección de anticuerpos con excelentes valores de sensibilidad (93-100 %) y especificidad (97-98 %).60,61 Este elemento promovió su transformación en formato de tira inmunocromatográfica, más factible para condiciones de campo. Un análisis de validación que incluyó 13 estudios en áreas de alta endemicidad ofreció valores similares para la sensibilidad (93,9 %) y especificidad (95,3 %) y también se confirmó su valor diagnóstico en la India y Nepal.62,63 Sin embargo, su validez en el Este africano ha sido variable, puesto que los pacientes sudaneses, por razones no esclarecidas aún, presentan títulos de anticuerpos más bajos contra esta proteína.64 Este método, fácil y reproducible, se considera actualmente la mejor herramienta diagnóstica de la leishmaniasis visceral para las áreas remotas del Viejo Mundo.
La prueba de aglutinación directa (DAT siglas en inglés) es un ensayo semicuantitativo donde ocurre aglutinación visible si existen anticuerpos65 y se ha evaluado en condiciones de campo en diversos países.66 Un metaanálisis que agrupó 30 estudios estimó los valores de sensibilidad y especificidad del ensayo en 94,8 % y 97,1 %, respectivamente.63 Se debe resaltar que aunque se ha desarrollado para condiciones de campo, requiere de incubaciones, disponibilidad de cierto equipamiento, personal bien entrenado y un control de calidad regular.64
En el Instituto de Medicina Tropical "Pedro Kourí" (IPK) se cuenta con el DAT como herramienta investigativa y complemento en el estudio de casos donde exista sospecha de enfermedad visceral, debido a que no se ha realizado la validación del ensayo en áreas endémicas. El antígeno que se utiliza, de L. donovani cepa 1S, se produce en el laboratorio de investigaciones en Leishmania, de acuerdo a las normas establecidas en el Instituto de Medicina Tropical de Amberes, Bélgica.
Diagnóstico molecular
Los métodos moleculares se utilizan ampliamente en el diagnóstico de la leishmaniasis, porque permiten detectar el ADN presente en una biopsia aún en cantidades mínimas (fentogramos) o lo que es igual, hasta un solo parásito.67,68 Aunque esta técnica ha demostrado ser la más sensible y específica, su uso está restringido al tercer nivel de cuidados hospitalarios, laboratorios de investigación y también se recomienda su empleo en centros de referencia.69
La información acerca de secuencias de ADN, y el conocimiento de los genomas completos de algunas especies de Leishmania, disponibles en la actualidad en las redes de información, constituyen un aporte fundamental para desarrollar ensayos basados en la reacción en cadena de la polimerasa (RCP), con aplicaciones que incluyen el diagnóstico. Para este propósito se utilizan varios genes, de preferencia secuencias multicopias, con la finalidad de desarrollar una máxima sensibilidad en la detección. Las dianas genéticas más utilizadas para el diagnóstico y sus características se muestran en la tabla 3.
Tabla 3. Características de algunas de las dianas genéticas más utilizadas para la detección
molecular o la identificación de especies del género Leishmania
| Nombre de la diana genética | Secuencia correspondiente | Nivel taxonómico de identificación | Sensibilidad y especificidad diagnóstica | Referencias |
| (ITS) | Espaciadores internos de la transcripción | Género | S: 79,3 % | Marfurt y otros, 200370 |
| (kDNA) | ADN del kinetoplasto | Género | S:90,1 % | Marques y otros, 200174 |
| Ssu-rRNA (18S) | Subunidad pequeña del | Género | S:92 % | Deborggraeve y otros, 2008; 2008ª81, 82 |
| (gp63) | Gen que codifica la glicoproteína | Especies | S: 85 % | Victoir y otros, 200387 |
| (cpb) | Gen que codifica la cisteíno proteinasa B | Especies | ND | Quispe y otros, 200488 |
| mini-exon | Genes que codifican los miniexones o spliced leader (SL) | Especies | S: 89,7 % | Marfurt y otros, 200370 |
| hsp70 | Genes que codifican la proteína de 7 kDa | Especies | S: 95 % | García y otros, 200791,92 |
S y E: indican la sensibilidad y especificidad diagnóstica de la reacción en cadena de la polimerasa correspondiente,
en aquellos casos en que se reportó. Se refieren solamente aplicaciones a la detección o identificación en muestras clínicas.
La superioridad de la reacción en cadena de la polimerasa se explica también por el hecho de admitir aplicaciones en un amplio rango de especímenes clínicos, lo que reviste gran importancia debido a la gran variedad de presentaciones de la leishmaniasis. Entre estas muestras se cuentan: biopsia y raspado de piel, aspirados de médula ósea y nódulos, muestras de sangre90,92,93 e incluso conjuntiva.94 Se notifica que es posible obtener ADN a partir de preparaciones de aspirados de médula ósea, teñidas previamente con Giemsa,95 y muy recientemente se reportó el uso de papel de filtro impregnado en la lesión,96 así como de aplicadores en la mucosa bucal para la detección de parásitos en casos de leishmaniasis visceral.97
En las formas cutáneas, la reacción en cadena de la polimerasa es la herramienta diagnóstica de más valor pues presenta valores de sensibilidad y especificidad altos.71,80,98 La sensibilidad y especificidad varía en dependencia de la diana genética (tabla 3) y de la normalización del ensayo, pero por lo general se reportan numerosos protocolos cuyos resultados no son comparables, puesto que responden a necesidades de países o regiones y a la detección del parásito en una u otra forma de la enfermedad;90,99,100 sin que exista una validación multicéntrica de estos, o se comparen los distintos protocolos disponibles, para enfrentar el diagnóstico molecular de manera uniforme.
La muestra de la cual se obtiene el ADN a analizar se puede tomar mediante aplicadores con algodón o palillos de dientes estériles, lo que constituye una alternativa no invasiva91,101 y también con papel de filtro.96 Se han desarrollado también reacción en cadena de la polimerasa especie-específicas para la identificación de especies del parásito de importancia médica a nivel local.99,102
En la enfermedad mucocutánea, la utilización del ADN del kinetoplasto (kDNA) como diana genética resulta muy sensible para detectar los parásitos, mientras que los genes que codifican los espaciadores internos de la transcripción (ITS), resultan más útiles para discriminar entre las especies que producen esta forma clínica en Brasil.71 Se describió también la detección de kDNA de parásitos del subgénero L. (Viannia) en tejidos de la mucosa de 81 % (21/26) de pacientes con enfermedad cutánea, lo cual pudiera indicar, paralelamente, que este es un hecho común en infecciones con parásitos de este subgénero.103
Por otra parte, se informó de 46 casos de leishmaniasis mucocutánea procedentes del Amazonas, que se detectaron mediante reacción en cadena de la polimerasa usando ADN obtenido de biopsias embebidas en parafina.104
Para la leishmaniasis visceral, la detección de parásitos por reacción en cadena de la polimerasa es más sensible que el examen microscópico, el cultivo y los exámenes serológicos, en particular en muestras que tienen una baja carga parasitaria.51 Los valores de sensibilidad varían, y se reporta un rango de 82 a 100 % si se compara con el examen microscópico,105,106 mientras que la especificidad puede estar entre 71,7 y 100 %.107,108 Se recomienda realizar la evaluación de pacientes sospechosos en sangre periférica, antes de proceder al examen sobre aspirado o biopsia.109 También este método puede ser útil para detectar los parásitos cuando hay peligro potencial para la transmisión de kala-azar mediante transfusión, en cuyo caso la serología tiene un papel muy limitado.110
El uso de aplicadores en la zona bucal permitió detectar por primera vez casos de leishmaniasis visceral mediante una reacción en cadena de la polimerasa que mostró 83 % de sensibilidad y 90,5 % de especificidad en grupos controles, usando como blanco una región del gen que codifica el fragmento 18S del rRNA.97 También, recientemente, se informó la posibilidad de detectar ADN de Leishmania en el fluido oral de personas con esta forma de la enfermedad, con valores de sensibilidad y especificidad que se consideran aceptables,111 al tiempo que continúan nuevas aplicaciones para el diagnóstico en países del Viejo Mundo.112
La leishmaniasis cutánea posvisceral también se puede diagnosticar mediante reacción en cadena de la polimerasa. Se describe un protocolo que utiliza cebadores que amplifican kDNA, que por su alta especificidad, resulta muy útil para el diagnóstico de pacientes inmunocomprometidos, donde el diagnóstico serológico falla a menudo.113
En relación con los casos de coinfección de Leishmania con VIH, la reacción en cadena de la polimerasa parece ser al menos tan sensible como otros métodos aplicados cuando se desea diagnosticar leishmaniasis visceral en muestras de sangre periférica. Un estudio comparativo indicó que la reacción en cadena de la polimerasa en sangre periférica y en muestras de médula ósea es altamente sensible y específica para el diagnóstico de la leishmaniasis visceral tanto en pacientes inmunocompetentes como en inmunocomprometidos, lo cual permite, adicionalmente, identificar la especie del parásito cuando se emplean como blanco cebadores que codifican para el rARN.114
Diagnóstico en el Instituto de Medicina Tropical "Pedro Kourí"
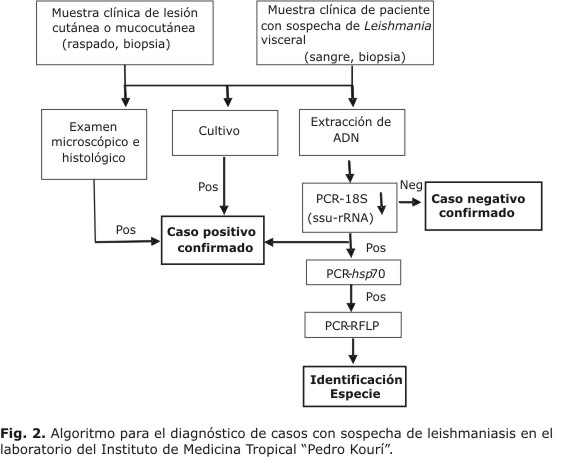
En el laboratorio de Leishmania del IPK, en paralelo al trabajo investigativo, se procesan las muestras clínicas humanas recibidas del hospital de la institución, cuando existe sospecha de leishmaniasis importada, para lo cual se sigue un algoritmo que responde al tipo clínico de leishmaniasis que se sospeche y las correspondientes herramientas diagnósticas que se aplican (Fig. 2).
En primer lugar se realiza el examen parasitológico directo de la muestra de raspado, impronta o biopsia. Esta muestra se fija en metanol, después se tiñe con Giemsa y se observa con cuidado en el microscopio de luz con aceite de inmersión, para realizar la identificación de los amastigotes, que se observan como estructuras redondeadas u ovaladas, de color azuloso, donde se distingue el núcleo, de color más intenso.
En paralelo, se realiza el cultivo del aspirado de la lesión, o de una muestra del tejido en medio Novy, McNeal, Nicolle (NNN) cuya fase líquida es el medio de Schneider y se incuba a 28 ºC.29 La búsqueda de promastigotes móviles del parásito, como resultado de la transformación de los amastigotes presentes en la muestra, se realiza mediante la observación diaria en un microscopio de luz invertido. Para ofrecer un resultado negativo, el cultivo se mantiene hasta 15 d.
Para el diagnóstico molecular se cuenta como método de referencia con la reacción en cadena de la polimerasa-18S, que amplifica un fragmento de 115 pb de la región 18S del gen que codifica el ARN ribosomal, y cuyos valores de sensibilidad y especificidad son adecuados: (S: 92 % en sangre, 92,9 % en médula ósea y E: 99,6 en personas procedentes de áreas no endémicas).77 Posteriormente, se informó una sensibilidad de 93,2% en casos de enfermedad cutánea y mucocutánea, y de 86 % en enfermedad visceral, siendo la especificidad de 95 % en personas de área endémica y de 98,3 % para personas procedentes de áreas no endémicas.81 Por estas razones se normalizó y adaptó a las condiciones del IPK.
En paralelo, se utiliza el gen que codifica la proteína de choque térmico de 70 kDa, como diana para la detección del parásito por reacción en cadena de la polimerasa y la posterior tipificación de la especie infectante, sobre la base del polimorfismo genético identificado en secuencias nucleotídicas de 14 especies de este protozoo, que fueron estudiadas en nuestro grupo de trabajo.115 La identificación de especie se logra mediante la restricción enzimática del producto de amplificación (RCP-RFLP),116 lo cual se aplicó al análisis de una representación de muestras clínicas procedentes de áreas endémicas de Colombia.117
Más recientemente, se desarrollaron 3 nuevas propuestas que permiten la detección y tipificación de distintas especies del parásito, en relación con el fragmento del gen hsp70 que se amplifique, (RCP-F, RCP-N y RCP-C), y la posterior digestión del producto de amplificación obtenido (RFLP-F, N y C) con aplicaciones variables según las distintas áreas geográficas o las formas clínicas de que se trate.118 Estos protocolos se encuentran hoy día en evaluación en áreas endémicas, con muestras clínicas diversas procedentes de países endémicos.
En conclusión, para diagnosticar correctamente la leishmaniasis no se debe despreciar ninguna de las alternativas posibles. Una vez que existan elementos epidemiológicos que indiquen la infección, será útil tanto la clásica observación del estadio intracelular del parásito o amastigote, presente en las células de tejidos infectados, hasta la detección de su ADN. Todos los métodos aportan información de utilidad para la toma de decisiones en el procedimiento clínico, la imposición del tratamiento y el abordaje epidemiológico de esta parasitosis. Entre estos, se propone un algoritmo de trabajo en nuestro laboratorio, con el empleo de los métodos que resultan más útiles de acuerdo a las condiciones y experiencias.
En este trabajo se pretende actualizar de forma rápida algunos aspectos relativos al diagnóstico de esta parasitosis, mostrar la forma en que se ha abordado en nuestro contexto, y ofrecer algunas alternativas que pudieran resultar de utilidad práctica, tanto para laboratorios de referencia en países no endémicos como en Cuba, y para algunas áreas endémicas de leishmaniasis.
REFERENCIAS BIBLIOGRÁFICAS
1. Blackwell JM, Fakiola M, Ibrahim ME, Jamieson SE, Jeronimo SB, Miller EN, et al. Genetics and visceral leishmaniasis of mice and man. Parasite Immunol. 2009;31:254-66.
2. Grimaldi G, Tesh RB. Leishmaniasis of the New World: current concepts and implications for future research. Clin Microbiol Rev. 1993;6:230-50.
3. Brandao-Filho SP, Campbell-Lendrum D, Brito ME, Shaw JJ, Davies CR. Epidemiological surveys confirm an increasing burden of cutaneous leishmaniasis in north-east Brazil. Trans R Soc Trop Med Hyg. 1999;93:488-94.
4. Davies CR, Reithinger R, Campbell-Lendrum D, Feliciangeli D, Borges R, Rodríguez N. The epidemiology and control of leishmaniasis in Andean countries. Cad Saúde Publica. 2000;16:925-50.
5. King RJ, Campbell-Lendrum DH, Davies CR. Predicting geographic variation in cutaneous leishmaniasis, Colombia. Emerg Infect Dis. 2004;10:598-607.
6. Reithinger R, Mohsen M, Aadil K, Sidiqi M, Erasmus P, Coleman PG. Anthroponotic cutanoeus leishmaniasis, Kabul, Afganistán. Emerg Infect Dis. 2003;727-9.
7. Molina R, Gradoni L, Alvar J. HIV and the transmission of Leishmania. Ann Trop Med Parasitol. 2003;1:29-45.
8. Croft SL, Sundar S, Fairlamb AH. Drug resistance in leishmaniasis. Clin Microbiol Rev. 2006;19:111-26.
9. Cárdenas R, Sandoval CM, Rodríguez-Morales A, Franco-Paredes C. Impact of clima variability in the occurrence of leishmaniasis in northeastern Colombia. Am J Trop Med Hyg. 2006;75:273-7.
10. Murray HW, Berman JD, Davies CR, Saravia NG. Advances in leishmaniasis. Lancet. 2005;366:1561-77.
11. Alvar J, Yactayo S, Bern C. Leishmaniasis and poverty. Trends Parasitol. 2006;22:552-7.
12. Sacks DL. Metacyclogenesis in Leishmania promastigotes. ExpParasitol. 1989;69:100-3.
13. Desjeux P. The increase in risk factors for leishmaniasis worldwide. Trans R Soc Trop Med Hyg. 2001;95:239-43.
14. Weina PJ, Neafie RC, Wortmann G, Polhemus M, Aronson NE. Old world leishmaniasis: an emerging infections among deployed US military and civilian workers. Clin Infect Dis. 2004;39:1674-80.
15. Blum JA, Hatz CF. Treatment of cutaneous leishmaniasis in travelers 2009. J Travel Med. 2009;16:123-31.
16. Schonian G, Mauricio I, Gramiccia M, Cañavate C, Boelaert M, Dujardin JC. Leishmaniases in the Mediterranean in the era of molecular epidemiology. Trends Parasitol. 2008;24:135-42.
17. Sharifi I, Poursmaelian S, Aflatoonian MR, Ardakani RF, Mirzaei M, Fekri AR, et al. Emergence of a new focus of anthroponotic cutaneous leishmaniasis due to Leishmania tropica in rural communities of Bam district after the earthquake, Iran. Trop Med Int Health. 2011;16:510-3.
18. Alvar J, Aparicio P, Aseffa A, Den Boer M, Cañavate C, Dedet JP, et al. The relationship between leishmaniasis and AIDS: the second 10 years. Clin Microbiol Rev. 2008;21:334-59.
19. Killick-Kendrick R. Phlebotomine vectors of the leishmaniasis: A review. Med Vet Entomol. 1990;4:1-24.
20. Fairchild GB, Trapido H. The West Indian species of Phlebotomus (Diptera, Psychodidae). Ann Entomol Soc Am. 1950;43:405-17.
21. González R, García I. Estudio y distribución de la familia Phlebotominae. Dos especies y una nueva subespecie para Cuba. La Habana: Ed. Científico Técnica; 1981.
22. Lugo J, Fuentes O, Castex M, Navarro A. Estudio de la actividad hematofágica y el tiempo de ingesta de Lutzomyia (C) orestes (Diptera, Psychodidae). Informe preliminar Rev Cub Med Trop. 1983;35:257-62.
23. Lugo J, Aldecoa T, Miqueli E, García A. Infestación experimental de Lutzomyia orestes (Diptera: Psychodidae) con 2 cepas del Complejo Leishmania mexicana. Rev Cub Med Trop. 1988;40:88-94.
24. Handman E, Elso C, Foote S. Genes and susceptibility to leishmaniasis. Adv Parasitol. 2005;59:1-75.
25. Mougneau E, Bihl F, Glaichenhaus N. Cell biology and immunology of Leishmania. Immunol Rev. 2011;240:286-96.
26. Rivas L, Moreno J, Cañavate C, Alvar J. Virulence and disease in leishmaniasis: what is relevant for the patient? Trends Parasitol. 2004;20:297-31.
27. Montalvo AM. Leishmaniasis. Aspectos de interés sobre un parasitismo exótico para Cuba. Rev Cub Hig Epidemiol. 2010;48(1).
28. Lindoso JA, Barbosa RN, Posada-Vergara MP, Duarte MI, Oyafuso LK, Amato VS, et al. Unusual manifestations of tegumentary leishmaniasis in AIDS patients from the New World. Br J Dermatol. 2009;160:311-8.
29. Goto H, Lauletta-Lindoso JA. Current diagnosis and treatment of cutaneous and mucocutaneous leishmaniasis. Expert Rev Anti Infect Ther. 2010;8:419-33.
30. Oliveira-Neto MP, Mattos M, Souza CS, Fernandes O, Pirmez C. Leishmaniasis recidiva cutis in New World cutaneous leishmaniasis. Int J Dermatol 1998; 37: 846-49.
31. Calvopina M, Uezato H, Gomez EA, Korenaga M, Nonaka S, Hashiguchi Y. Leishmaniasis recidiva cutis due to Leishmania (Viannia) panamensis in subtropical Ecuador: isoenzymatic characterization. Int J Dermatol. 2006;45:116-20.
32. Bittencourt AL, Costa JM, Carvalho EM, Barral A. Leishmaniasis recidiva cutis in American cutaneous leishmaniasis. Int J Dermatol. 1993;32:802-5.
33. Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S. Cutaneous leishmaniasis. Lancet Inf Dis. 2007;7:581-96.
34. Turetz ML, Machado PR, Ko AI, Alves F, Bittencourt A, Almeida RP, et al. Disseminated leishmaniasis: a new and emerging form of leishmaniasis observed in northeastern Brazil. J Infect Dis. 2002;186:1829-34.
35. Barral A, Guerreiro J, Bomfim G, Correia D, Barral-Neto M, Carvalho E. Lymphadenopathy as the first sign of human cutaneous infection by Leishmania braziliensis. Am J Trop Med Hyg. 1995;53:256-9.
36. Marsden PD. Mucosal leishmaniasis «espundia» Escomel, 1911. Trans R Soc Trop Med Hyg. 1986;80:859-76.
37. Weigle KA, Davalos M, Heredia P, Molineros R, Saravia NO, D´Alessandro A. Diagnosis of cutaneous and mucocutaneous leishmaniasis in Colombia: a comparison of seven methods. Am J Trop Med Hyg. 1987;36:489-96.
38. Akilov OE, Khachemoune A, Hasan T. Clinical manifestations and classification of Old World cutaneous leishmaniasis. Int J Dermatol. 2007;46:132-42.
39. Kharfi M, Fazaa B, Chaker E, Kamoun MR. Mucosal localization of leishmaniasis in Tunisia: 5 cases. Ann Dermatol Venereo. 2003;130:27-30.
40. Kuru T, Janusz N, Gadisa E, Gedamu L, Aseffa A. Leishmania aethiopica: Development of speciûc and sensitive PCR diagnostic test. Exp Parasitol. 2011;128:391-5.
41. Zijlstra EE, el-Hassan AM. Leishmaniasis in Sudan. Visceral leishmaniasis.Trans R Soc Trop Med Hyg. 2001;95:S27-58.
42. Herwaldt BL. Leishmaniasis. Lancet. 1999;354:1191-9.
43. Cuba CA, Marsden PD, Barreto AC, Rocha R, Sampaio RR, Patzlaff L. Parasitologic and immunologic diagnosis of American cutaneous leishmaniasis. Bol Oficina Sanit Panam. 1980;89:195-208.
44. Chappuis F, Sundar S, Hailu A, Ghalib H, Rijal S, Peeling RW, et al. Visceral leishmaniasis: what are the needs for diagnosis, treatment and control? Nat Rev Microbiol. 2007;5:873-82.
45. Bailey MS, Lockwood DNJ. Cutaneous leishmaniasis. Clin Dermatol. 2007;25:203-11.
46. Vega-Lopez F. Diagnosis of cutaneous leishmaniasis. Curr Opin Infect Dis. 2003;16:97-101.
47. Sotto MN, Yamashiro-Kanashiro EH, da Matta VL, de Brito T. Cutaneous leishmaniasis of the New World: diagnostic immunopathology and antigen pathways in skin and mucosa. Acta Trop. 1989;46:121-30.
48. Schubach A, Cuzzi-Maya T, Oliveira AV, Sartori A, de Oliveira-Neto MP, Mattos MS, et al. Leishmanial antigens in the diagnosis of active lesions and ancient scars of American tegumentary leishmaniasis patients. Mem Inst Oswaldo Cruz. 2001;96:987-96.
49. Kager PA, Rees PH. Splenic aspiration. Review of the literature. Trop Geogr Med. 1983;35:111-24.
50. Boggild AK, Miranda-Verastegui C, Espinosa D, Arévalo J, Adaui V, Gianfranco T, et al. Evaluation of a microculture method for isolation of Leishmania parasites from cutaneous lesions of patients in Peru. J Clin Microbiol. 2007;7:3680-4.
51. Reithinger R, Dujardin JC. Molecular diagnosis of leishmaniasis: current status and future applications. Journal Clin Microbiol. 2007;45:21-5.
52. Navin TR, Arana FE, de Mérida M. Cutaneous leishmaniasis in Guatemala: comparison of diagnostic methods. Am J Trop Med Hyg. 1990;42:36-42.
53. Ramírez JR, Agudelo S, Muskus C, Alzate JF, Berberich C, Barker D, et al. Diagnosis of cutaneous leishmaniasis in Colombia: the sampling site within lesions influences the sensitivity of parasitological diagnosis. J Clin Microbiol. 2000;38:3768-73.
54. Piscopo TV, Azzopardi CM. Leishmaniasis. Postgrad Med J. 2007;83:649-57.
55. Kar K. Serodiagnosis of leishmaniasis. Crit Rev Microbiol. 1995;21:123-5.
56. Romero GA, de la Gloria M, de Farias-Guerra MV, Paes MG, de Oliveira Macedo V, de Carvalho EM. Antibody response in patients with cutaneous leishmaniasis infected by Leishmania Viannia braziliensis or Leishmania Viannia guyanensis in Brazil. Acta Trop. 2005;93:49-56.
57. Cataldo JI, de Queiroz Mello FC, Mouta-Confort E, de Fátima Madeira M, de Oliveira Schubach A, da Silva Genestra M, et al. Immunoenzymatic assay for the diagnosis of American tegumentary leishmaniasis using soluble and membrane-enriched fractions from infectious Leishmania (Viannia) braziliensis. J Clin Lab Anal. 2010;24:289-94.
58. De Almeida Silva L, Romero HD, Prata A, Costa RT, Nascimento E, Carvalho SF, et al. Immunologic tests in patients after clinical cure of visceral leishmaniasis. Am J Trop Med Hyg. 2006;75:739-43.
59. Iqbal J, Hira PR, Saroj G, Philip R, Al-Ali F, Madda PJ, et al. Imported visceral leishmaniasis: Diagnostic dilemmas and comparative analysis of three assays. J Clin Microbiol. 2002;40:475-9.
60. Badaró R, Benson D, Eulálio MC, Freire M, Cunha S, Netto EM, et al. rK39: a cloned antigen of Leishmania chagasi that predicts active visceral leishmaniasis. J Infect Dis 1996;173:758-61.
61. Braz RFS, Nascimento ET, Martins DRA, Wilson ME, Pearson RD, Reed SG, et al. The sensitivity and specificity of Leishmania chagasi recombinant k39 antigen in the diagnosis of American visceral leishmaniasis and in differentiating active from subclinical infection. Am J Trop Med Hyg. 2002;67:344-8.
62. Sundar S, Maurya R, Singh RK, Bharti K, Chakravarty J, Parekh A, et al. Rapid, noninvasive diagnosis of visceral leishmaniasis in India: comparison of two immunochromatographic strip tests for detection of anti-K39 antibody. J Clin Microbiol. 2006;44:251-3.
63. Chappuis F, Rijal S, Singh R, Acharya P, Karki BM, Das ML, et al. Prospective evaluation and comparison of the direct agglutination test and an rK39-antigen-based dipstick test for the diagnosis of suspected kala-azar in Nepal. Trop Med Int Health. 2003;8:277-85.
64. Ritmeijer K, Melaku Y, Mueller M, Kipngetich S, O´Keeffe C, Davidson RN. Evaluation of a new recombinant k39 rapid diagnostic test for Sudanese visceral leishmaniasis. Am J Trop Med Hyg. 2006;74:76-80.
65. Harith AE, Kolk AH, Kager PA, Leeuwenburg J, Muigai R, Kiugu S, et al. A simple and economical direct agglutination test for serodiagnosis and sero-epidemiological studies of visceral leishmaniasis. Trans R Soc Trop Med Hyg. 1986;80:583-6.
66. Boelaert M, El-Safib S, Hailuc A, Mukhtarb M, Rijal S, Sundar S, et al. Diagnostic tests for kala-azar: a multi-centre study of the freeze-dried DAT, rK39 strip test and KAtex in East Africa and the Indian subcontinent. Trans R Soc Trop Med Hyg. 2008;102:32-40.
67. Bensoussan E, Nasereddin A, Jonas F, Schnur LF, Jaffe CL. Comparison of PCR assays for diagnosis of cutaneous leishmaniasis. J Clin Microbiol. 2006;44:1435-9.
68. Saiki RK, Walsh PS, Levenson CH, Erlich HA. Genetic analysis of amplified DNA with immobilized sequence-specific oligonucleotide probes. Proc Natl Acad Sci USA. 1989;86:6230-4.
69. Fagundes A, Schubach A, Paula CC, Bogio A, Antonio Lde F, Schiavoni PB, et al. Evaluation of polymerase chain reaction in the routine diagnosis for tegumentary leishmaniasis in a referral centre. Mem Inst Oswaldo Cruz. 2010;105:109-12.
70. Marfurt J, Niederwiese I, Divine MN, Beck HP, Felger I. Diagnostic genotyping of Old and New World Leishmania species by PCR-RFLP. Diag Microbiol Infect Dis. 2003;46:115-24.
71. Ovale-Bracho C, Porras de Quintana L, Muvdi Arenas S, Rios Parra M. Polymerase chain reaction with two molecular targets in mucosal leishmaniasis diagnosis: a validation study. Mem Inst Oswaldo Cruz. 2007;102:549-54.
72. Berzunza-Cruz M, Cabrera N, Crippa-Rossi M, Sosa-Cabrera T, Pérez-Montfort R, Becker I. Polymorphism analysis of the internal transcribed spacer and small subunit of ribosomal RNA genes of Leishmania mexicana. Parasitol Res. 2002;88:918-25.
73. Marques MJ, Volpini AC, Genaro O, Mayrink W, Romanha AJ. Simple form of clinical sample preservation and Leishmania DNA extraction from human lesions for diagnosis of American cutaneous leishmaniasis via polymerase chain reaction. Am J Trop Med Hyg. 2001;65:902-6.
74. Disch J, Pedras MJ, Orsini M, Pirmez C, de Oliveira MC, Castro M, et al. Leishmania (Viannia) subgenus kDNA amplification for the diagnosis of mucosal leishmaniasis. Diagn Microbiol Infect Dis. 2005;51:185-90.
75. Al-Hucheimi SN, Sultan BA, Al Dhalimi MA. A comparative study of the diagnosis of Old world cutaneous leishmaniasis in Iraq by polymerase chain reaction and microbiologic and histopathologic methods. Int J Dermatol. 2009;48:404-8.
76. Boggild AK, Valencia BM, Espinosa D, Veland N, Ramos AP, Arevalo J, et al. Detection and species identification of Leishmania DNA from filter paper lesion impressions for patients with American cutaneous leishmaniasis. Clin Infect Dis. 2010;50:e1-6.
77. Espinosa D, Boggild AK, Deborggraeve S, Laurent T, Valencia C, Pacheco R, et al. Leishmania OligoC-TesT as a simple, rapid, and standardized tool for molecular diagnosis of cutaneous leishmaniasis in Peru. J Clin Microbiol. 2009;47:2560-3.
78. Kumar R, Bumb RA, Ansari NA, Mehta RD, Salotra P. Cutaneous leishmaniasis caused by Leishmania tropica in Bikaner, India: parasite identification and characterization using molecular and immunologic tools. Am J Trop Med Hyg. 2007;76:896-901.
79. Gadisa E, Genetu A, Kuru T, Jirata D, Dagne K, Aseffa A, et al. Leishmania (Kinetoplastida): species typing with isoenzyme and PCR-RFLP from cutaneous leishmaniasis patients in Ethiopia. Exp Parasitol. 2007;115:339-43.
80. Deborggraeve S, Laurent T, Espinosa D, Van der Auwera G, Mbuchi M, Wasunna M, et al. A simplified and standardized polymerase chain reaction format for the diagnosis of leishmaniasis. J Infect Dis. 2008;198:1565-72.
81. Deborggraeve S, Boelaert M, Rijal S, De Doncker S, Dujardin JC, Herdewijn P, et al. Diagnostic accuracy of a new Leishmania PCR for clinical visceral leishmaniasis in Nepal and its role in diagnosis of disease. Trop Med Int Health. 2008;13:1378-83.
82. Amato VS, Tuon FF, de Andrade HF, Bacha JH, Pagliari C, Raniero Fernandes E, et al. Immunohistochemistry and polymerase chain reaction on paraffin-embedded material improve the diagnosis of cutaneous leishmaniasis in the Amazon region. Int J Dermatol. 2009;48:1091-5.
83. Chargui N, Bastien P, Kallel K, Haouas N, Messaid-Akrout F, Masmoudi A, et al. Usefulness of PCR in the diagnosis of cutaneous leishmaniasis in Tunisia. Trans R Soc Trop Med Hyg. 2005;99:762-8.
84. Vaish M, Mehrotra S, Chakravarty J, Sundar S. Non invasive molecular diagnosis of human visceral leishmaniasis J Clin Microbiol. 2011;49:2003-5.
85. Lemrani M, Hamdi S, Laamrani A, Hassar M. PCR detection of Leishmania in skin biopsies. J Infect Developing Countries. 2009;3:115-22.
86. Victoir K, De Doncker S, Cabrera L, Álvarez E, Arévalo J, Llanos-Cuentas A, et al. Direct identification of Leishmania species in biopsies from patients with American tegumentary leishmaniasis. Trans R Soc Trop Med Hyg. 2003;97:80-7.
87. Quispe-Tintaya KW, Ying X, Dedet JP, Rijal S, De Bolle X, Dujardin JC. Antigen genes for molecular epidemiology of leishmaniasis: polymorphism of cysteine proteinase B and surface metalloprotease glycoprotein 63 in the Leishmania donovani complex. J Infect Dis. 2004;189:1035-43.
88. Gadisa E, Kuru T, Genet A, Engers H, Aseffa A, Gedamu L. Leishmania donovani complex (Kinetoplastida,Trypanosomatidae). Comparison of deoxyribonucleic acid based techniques for typing isolates from Ethiopia. Exp Parasitol. 2010;126:203-8.
89. Oshaghi MA, Ravasan NM, Hide M, Javadian EA, Rassi Y, Sedaghat MM, et al. Development of species-specific PCR and PCR-restriction fragment length polymorphism assays for L.infantum/L.donovani discrimination. Exp Parasitol. 2009;122:61-5.
90. García A, Parrado R, De Doncker S, Bermúdez H, Dujardin JC. American tegumentary leishmaniasis: direct species identification of Leishmania in non-invasive clinical samples. Trans R Soc Trop Med Hyg. 2007;101:368-71.
91. García L, Kindt A, Bermúdez H, Llanos-Cuentas A, De Doncker S, Arévalo J, et al. Culture-independent species typing of neotropical Leishmania for clinical validation of a PCR-based assay targeting heat shock protein 70 genes. J Clin Microbiol. 2004;42:2294-7.
92. Akkafa F, Dilmen F, Apua Z. Identification of Leishmania parasites obtained from cutaneous leishmaniasis patients using PCR-RFLP technique in endemic regions, Sanliurfa province, in Turkey. Parasitol Res. 2008;103:583-6.
93. Jamjoon M, Sultan AH. Diagnostic of clinical samples spotted on FTA cards using PCR based methods. J Egypt Soc Parasitol. 2009;39:227-46.
94. Strauss-Ayali D, Jaffe CL, Burshtain O, Gonen L, Baneth G. Polymerase chain reaction using noninvasively obtained samples, for the detection of Leishmania infantum DNA in dogs. J Infect Dis. 2004;189:1729-33.
95. Alam MZ, Kovalenko DA, Kuhls K, Nasirova RM, Ponomareva VI, Fatullaeva AA, et al. Identification of the agent causing visceral leishmaniasis in Uzbeki and Tajiki foci by analysing parasite DNA extracted from patients' Giemsa-stained tissue preparations. Parasitology. 2009;136:981-6.
96. Boggild AK, Ramos AP, Valencia BM, Veland N, Calderón F, Arévalo J, et al. Diagnostic performance of filter paper lesion impression PCR for secondarily infected ulcers and nonulcerative lesions caused by cutaneous leishmaniasis. J Clin Microbiol. 2011;49:1097-100.
97. Vaish M, Mehrotra S, Chakravarty J, Sundar S. Noninvasive molecular diagnosis of human visceral leishmaniasis. J Clin Microbiol. 2010;49:2003-6.
98. Azmi K, Nasereddin A, Ereqat S, Schnur L, Schonian G, Abdeen Z. Methods incorporating a polymerase chain reaction and restriction fragment length polymorphism and their use as a `gold standard' in diagnosing Old World cutaneous leishmaniasis. Diagn Microbiol Infect Dis. 2011;71:151-5.
99. Volpini AC, Passos VMA, Oliveira GC, Romanha AJ. PCR-RFLP to identify Leishmania (Viannia) braziliensis and L. (Leishmania) amazonensis causing American cutaneous leishmaniasis. Acta Trop. 2004;90:31-7.
100. Rotureau B, Ravel C, Couppié P, Pratlong F, Nacher M, Dedet JP, et al. Use of PCR-restriction fragment length polymorphism analysis to identify the main New World Leishmania species and analyze their taxonomic properties and polymorphism by application of the assay to clinical samples. J Clin Microbiol. 2006;44:459-67.
101. Mimori T, Matsumoto T, Calvopiña MH, Gómez EA, Saya H, Katakura K, et al. Usefulness of sampling with cotton swab for PCR-diagnosis of cutaneous leishmaniasis in the New World. Acta Trop. 2002;81:197-202.
102. Martins L, Alexandrino A, Guimarães G. Detection of Leishmania braziliensis DNA in American tegumentary leishmaniasis patients. Rev Saude Publica. 2010;44:571-4.
103. Figueroa RA, Lozano LE, Romero IC, Cardona MT, Prager M, Pacheco R, et al. Detection of Leishmania in unaffected mucosal tissues of patients with cutaneous leishmaniasis caused by Leishmania (Viannia) species. J Infect Dis. 2009;200:638-46.
104. Guerra JA, Prestes SR, Silveira H, Coelho LI, Gama P, Moura A, et al. Mucosal leishmaniasis caused by Leishmania (Viannia) braziliensis and Leishmania (Viannia) guyanensis in the Brazilian Amazon. PLoS Negl Trop Dis. 2011;5:e980.
105. Piarroux R, Fontes M, Perasso R, Gambarelli F, Joblet C, Dumon H, et al. Phylogenetic relationships between Old World Leishmania strains revealed by analysis of a repetitive DNA sequence. Mol Biochem Parasitol. 1995;73:249-52.
106. Pal S, Aggarwal G, Haldar A, Majumdar A, Majumdar HK, Duttagupta S. Diagnosis of symptomatic kala-azar by polymerase chain reaction using patient's blood. Med Sci Monit. 2004;10:MT1-5.
107. da Silva ES, Gontijo CM, Pacheco Rda S, Brazil RP. Diagnosis of human visceral leishmaniasis by PCR using blood samples spotted on filter paper. Genet Mol Res. 2004;3:251-7.
108. Disch J, Caligiorne RB, Maciel F, Oliveira MC, Orsini M, Dias-Neto E, et al. Single-step duplex kDNA-PCR for detection of Leishmania donovani complex in human peripheral blood samples. Diagn Microbiol Infect Dis. 2006;56:395-400.
109. Osman OF, Oskman L, Zijlstra EE, Kroon NCM, Schoone J, Khalil EAG, et al. Evaluation of PCR for diagnosis of visceral leishmaniasis. J Clin Microbiol. 1997;35:454-7.
110. Otero ACS, da Silva VO, Luz KG, Palatnik M, Pirmez C, Fernandes O, et al. Short report: occurrence of Leishmania donovani DNA in donated blood from seroreactive Brazilian blood donors. Am J Trop Med Hyg. 2000;62:128-33.
111. Galaï Y, Chabchoub N, Ben-Abid M, Ben-Abda I, Ben-Alaya-Bouafif N, Amri F, et al. Diagnosis of Mediterranean visceral leishmaniasis by detection of Leishmania antibodies and Leishmania DNA in oral fluid samples collected by ORACOLTM device. PLoS One. 2011;49:3150-3.
112. Srivastava P, Mehrotra S, Tiwary P, Chakravarty J, Sundar S. Diagnosis of Indian visceral leishmaniasis by nucleic acid detection using PCR. J Clin Microbiol. 2011;6:e19304.
113. Salotra P, Sreenivas G, Beena KR, Mukherjee A, Ramesh V. Parasite detection in patients with post kala-azar dermal leishmaniasis in India: a comparison between molecular and immunological methods. J Clin Pathol. 2003;56:840-3.
114. Antinori S, Calattini S, Longhi E, Bestetti G, Piolini R, Magni R, et al. Clinical use of polymerase chain reaction performed on peripheral blood and bone marrow samples for the diagnosis and monitoring of visceral leishmaniasis in HIV-infected and HIV-uninfected patients: A single center, 8 year experience in Italy and review of the literature. Clin Infect Dis. 2007;44:1602-10.
115. Fraga J, Montalvo AM, De De Doncker, Dujardin JC, Van der Auwera G. Phylogeny of Leishmania species based on the heat-shock protein 70 gene. Inf Gen Evol. 2010;10:238-45.
116. Montalvo AM, Fraga J, Monzote L, Montano I, De Docnker S, Dujardin JC, et al. Heat-shock protein 70 PCR-RFLP: a universal simple tool for Leishmania species discrimination in the New and Old World. Parasitology. 2010;137:1159-68.
117. Montalvo AM, Fraga J, Montano I, Monzote L, Marín M, Van der Auwera G, et al. Differentiation of Leishmania (Viannia) panamensis and Leishmania (V.) guyanensis using BccI for hsp70 PCR-RFLP. Trans R Soc Trop Med Hyg. 2010;104:364-67.
118. Montalvo AM, Fraga J, Maes I, Dujardin JC, Van der Auwera G. Three new sensitive and specific heat shock protein 70 PCRs for global Leishmania species identification. Eur J Clin Microbiol Infect Dis. 2011; DOI 10.1007/s10096-011-1463-z.
Recibido: 2 de febrero de 2012.
Aprobado: 16 de febrero de 2012.
Ana Margarita Montalvo. Departamento de Parasitología. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía Km 6½. Lisa. La Habana, Cuba. Correo electrónico: amontalvo@ipk.sld.cu