Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana sep.-dic. 2014
ARTÍCULO ORIGINAL
Evaluación de la resistencia a insecticidas en Aedes aegypti (Diptera: Culicidae) de Argentina
Evaluation of insecticidal resistance observed in Aedes aegypti (Diptera:Culicidae) from Argentina
Dr.C. Juan Andrés Bisset Lazcano,I Dr. Rolando Esteban Mondelo,II Dra. C. María Magdalena Rodríguez Coto,I Lic. Yanelys Ricardo Leyva,I Lic. Daymi Hurtado Núñez,I Téc. Ilario FuentesI
I Instituto de Medicina Tropical "Pedro Kourí"(IPK). La Habana, Cuba.
II Universidad Nacional de Misiones. Argentina.
RESUMEN
Introducción: a pesar de los enormes esfuerzos que realiza el Ministerio de Salud de Argentina para el control de Aedes aegypti, persisten en algunas regiones del país determinados índices de infestación que favorecen el desarrollo de epidemias o brotes de dengue. En este negativo indicador se destaca las provincias de Misiones y Buenos Aires, donde desempeña un papel importante el uso de insecticidas.
Objetivos: determinar el nivel de resistencia a insecticidas químicos en cepas de Ae. aegypti de Misiones y Buenos Aires, Argentina.
Métodos: se determinó en larvas el nivel de resistencia a insecticidas organofosforados (temefos y fenitrotion) y a piretroides (deltametrina y cipermetrina) a través de los bioensayos de la Organización Mundial de la Salud. En el estado adulto se evaluó los piretroides (deltametrina, lambdacialotrina y cipermetrina) y el organofosforado clorpirifos.
Resultados: tanto las larvas como los adultos resultaron susceptibles a todos los insecticidas evaluados.
Conclusiones: el control químico de Ae. aegypti de las localidades estudiadas, de las provincias de Misiones y Buenos Aires, puede realizarse de forma efectiva, utilizando los insecticidas en uso para el control vectorial, como son, temefos como larvicida y como adulticidas e insecticidas, piretroides y el organofosforado clorpirifos.
Palabras clave: Aedes aegypti, Argentina, susceptibilidad a insecticidas, piretroides y organofosforados.
ABSTRACT
Introduction: despite the great efforts of the Ministry of Health in Argentina for the control of Aedes Aegypti, certain significant infestation indexes persist in some regions and lead to the occurrence of dengue epidemics or outbreaks. This negative indicator is remarkable in Misiones y Buenos Aires provinces where the use of pesticides is important.
Objective: to determine the levels of resistance of Aedes aegypti strains to chemical insecticidal effects in Misiones and Buenos Aires provinces in Argentina.
Methods: World Health Organization bioassays determined the level of resistance in mosquito larvae to organophosphate insecticides (temephos and fenitrotion) and to pyrethroids (deltametrin and cypermetrin). In adult mosquitoes, the action of pyrethroids (deltametrin, lambdacyalotrin and cypermetrin) as well as that of organophosphate ones called chlorpiriphos was evaluated.
Results: both the larvae and the adult insects were susceptible to all the insecticides.
Conclusions: The chemical control of Ae aegypti in the studied areas from Misiones and Buenos Aires provinces can be effectively exerted by using the insecticides for the vector control such as temephos as larvicide and pyrethroids and the organophosphate called chlorpiriphos as adulticides.
Key words: Aedes aegypti, Argentina, insecticidal susceptibility, pyrethroids and organophosphate compounds.
INTRODUCCIÓN
Durante el año 2010 > 1,7 millones de casos de dengue fueron diagnosticados en la región de las Américas, con 50 235 casos severos y 1 185 fallecidos.1 Aedes aegypti (Linnaeus, 1762) (Díptera: Culicidae) es la especie considerada el principal vector del virus de dengue en la región, con una distribución geográfica, predominantemente en regiones tropicales y subtropicales.2
Durante la primera mitad del siglo XX, Ae. aegypti estaba presente en el norte y el centro de la República Argentina. Se consideró erradicado desde 1963, en 1986 se diagnosticó reinfestación de las provincia de Misiones Formosa con este vector y en los años siguientes se extendió a las provincias centrales.3-5 La primera epidemia de dengue en Argentina ocurrió en 1998 en Tartagal, provincia de Salta y después en las provincias de Misiones y Formosa.6 Desde 1998, fueron llevadas a cabo extensas operaciones de control químico en la parte del norte del país. En 2002 en Clorinda (Formosa) y en 2003 en Iguazú (Misiones), comenzó un programa de control masivo llevado a cabo por la Fundación Mundo Sano, con la participación del Ministerio de Salud de Argentina, el gobierno municipal local y el Centro de Investigación de Plagas e Insecticidas (CIPEIN) (Seccacini et al., 2008). Los insecticidas más comúnmente utilizados fueron temefos como larvicida en depósitos de agua (tratamiento focal) y la cis -cipermetrina como adulticida (tratamiento espacial) en tratamientos de ultra-bajo volumen (ULV).7
El Ministerio de Salud de Argentina dispone recursos y esfuerzos en función del control de Aedes aegypti, pero a pesar de ello, persisten en algunas regiones del país determinados índices de infestación que favorecen el desarrollo de epidemias o brotes de dengue, desempeñando un papel importante el uso de insecticidas.
Para lograr el éxito en las estrategias de control, se debe tener conocimiento actualizado del nivel de susceptibilidad a los insecticidas en uso para el control de Ae. aegypti en el área a controlar, ya que el desarrollo de resistencia puede conducir a fallas en el control. Esta investigación tuvo como objetivo determinar el nivel de susceptibilidad a insecticidas en dos localidades de las provincias de Misiones y Buenos Aires, colectadas en el año 2011, con el fin de contribuir a un mejor uso de insecticidas y un control más efectivo de este vector con los insecticidas disponibles en la actualidad.
MÉTODOS
Cepas de Ae. aegypti utilizadas
Para el presente estudio experimental se utilizaron las siguientes cepas:
Rockefeller: cepa de laboratorio susceptible a insecticidas, suministrada por el Centro para el Control y la Prevención de Enfermedades (CDC), San Juan, Puerto Rico.
Misiones: cepa de Ae. aegypti colectada en al año 2011, en Posadas, ciudad capital de la provincia de Misiones (fig. 1). Ubicada al noreste de la República Argentina, la provincia Misiones cuenta con una superficie de 29 801 km2 y una población estimada de 1 029 645 habitantes, con una densidad demográfica de 33 hab/km2. Está rodeada por fronteras internacionales y sólo se une por el sur al territorio nacional a través de la provincia de Corrientes. Es un importante puerto fluvial y posee un aeropuerto. El clima es subtropical, con precipitaciones abundantes y la temperatura anual alcanza un promedio de 21 ºC. Las larvas colectadas se colonizaron y se trabajó con la descendencia F1 obtenida en el insectario del Instituto de Medicina Tropical “Pedro Kourí”, en La Habana, Cuba.
Buenos Aires: cepa de Ae. aegypti colectada en el año 2011, en la ciudad de Buenos Aires, capital y ciudad más populosa de la República Argentina (fig. 1), situada en el extremo nororiental de la provincia del mismo nombre, la cual cuenta con una superficie de 307 571 km² y con una población estimada de 14 654 379 habitantes. Presenta un amplio frente marítimo y fluvial. Es el área más urbanizada y de mayor concentración económica del país, con prácticamente todas las ramas industriales representadas. El clima es templado, con temperaturas anuales cuyo promedio es de 15 ºC y lluvias regularmente repartidas en el año, debido a que está expuesta a los vientos húmedos del Atlántico. Las larvas colectadas se colonizaron y se trabajó con la descendencia F1 obtenida en el insectario del Instituto de Medicina Tropical “Pedro Kourí”, en La Habana, Cuba.
Insecticidas utilizados
Insecticidas organofosforados
Temefos: o-dimetil fosforotioato odiéster con 4,4′ tiodifenol; con 93,3 % de pureza, suministrado por American Cyanamid Co, Princeton, NJ.
Fenitrotion: 0,0-dimetil 0-(4-nitro-m-tolyl) fosforotioato; 97 % de pureza, suministrado por Sumitomo Chemical Company.
Deltametrina: (S)-α-cyano-3-phenoxybenzyl(1R,3R)-3-(2,2-dibromovinyl)-2,2-dimetilciclo propano carboxylate; con 96,8 % de pureza, suministrado por Roussel Uclaf (Romainville, Francia).
Cipermetrina: (1RS)-cis, trans-3-(2,2-diclorovinil)-2,2-dimetilciclopropano carboxilato de (RS-ciano-3-fenoxibencilo [IUPAC]; con 98 % de pureza, suministrado por Chemotécnica S.A, Argentina),
Lambdacialotrina: (S-α-cyano- 3-phenoxybenzyl [Z)- [1R,3R]-3-[2-chloro- 3,3,3-trifluoroprop-1-enyl]-2,2-dimethylcyclopropanecarboxylate,con 98 % de pureza, suministrado por Syngenta SA, Switzerland).
Clorpirifos: (o,o-dietilo-[3, 5,6-tricloro-2-piridil] fosforotioato, con 98 % de pureza, suministrado por Chemotécnica S.A, Argentina).
Cría y mantenimiento de las colonias de Aedes aegypti
El mantenimiento de las cepas de Ae. aegypti se realizó siguiendo la metodología del Manual de Indicaciones Técnicas del Insectario.9 Para la cría de las larvas se utilizaron cubetas plásticas con 2,5 l de agua y 0,7 g de harina de pescado como alimento. Al pasar al estadío de pupa se colocaron en vasos de precipitados dentro de una doble jaula (30x30x30 cm) hasta que emergieron los adultos, que fueron alimentados con solución azucarada en el caso de los machos y para las hembras se colocaron curieles enjaulados; condiciones estas necesarias para el mantenimiento de la colonia y las posteriores puestas de huevos. En el vaso de precipitado que se colocó dentro de la jaula se dispuso, en su borde interior, una tira de papel de 4-5 cm de ancho debidamente rotulada, para la recogida de los huevos. Una vez puestos los mismos, las tiras de papel se retiraron, se acondicionaron entre 24-48 horas en algodón humedecido y se guardaron para su posterior uso.
Determinación de la susceptibilidad a insecticidas en larvas
Las larvas de Ae. aegypti en tercer tardío o cuarto estadio temprano, fueron evaluadas a través de los bioensayos de susceptibilidad de la OMS, para determinar la concentración que causó 50 y 90 % de mortalidad de la población (CL50-CL90) para cada insecticida.10 Se preparó una solución madre a 1 % para cada insecticida en un volumen final de 100 ml con acetona, se aplicaron cinco concentraciones de cada uno (preparadas a partir de la solución madre) y se realizaron cinco réplicas por cada concentración, las cuales causaron mortalidades entre 2 y 98 %. Se utilizó un control por cada replica que consistió en 1 ml del solvente (acetona). La mortalidad se determinó 24 horas después del tratamiento con los insecticidas y los resultados se analizaron mediante la prueba probit implementada en el programa estadístico SPSS versión 11.5. Se calculó el Factor de Resistencia (FR50 y FR90), comparando los valores de concentración letal media (CL50) de la cepa a evaluar con la CL50 de la cepa susceptible de referencia Rockefeller mediante la siguiente fórmula:
FR50= CL50 cepa en estudio/Cl50 cepa Rockefeller
Diagnóstico de la resistencia, de acuerdo al criterio recomendado por Mazarri y Georghiou:11
FR50≤ 5 Susceptible, FR50 entre 5 y 10 Resistencia moderada, FR50> 10 Resistente.
Determinación de la susceptibilidad a insecticidas en adultos
Se utilizó el método desarrollado por los centros para el control y la prevención de enfermedades, (CDC),12 que sigue el principio del ensayo de la botella para mosquitos adultos.13 Cada cepa fue evaluada utilizando las dosis diagnóstico, previamente establecida, en la cepa de referencia Rockefeller (Rodríguez et al 2014, datos sin publicar), para clorpirifos (90 ug/botella), cipermetrina (13,5 ug/botella) y deltametrina (6,5 ug/botella). Un total de 20 mosquitos hembras no alimentadas, de cada cepa, se introdujeron en la botella impregnada con la dosis diagnóstico correspondiente para cada insecticida. Cada ensayo consistió en cuatro botellas tratadas y una botella control impregnada con acetona.
Se realizaron al menos tres réplicas de cada experimento por insecticida y por cada cepa. Todas las soluciones de insecticidas fueron preparadas en el momento de utilizarse, con acetona como diluente, a partir de la solución patrón. Se registró el número de mosquitos muertos y vivos cada 5 minutos hasta que todos los mosquitos murieran. Se tomó como criterio de mortalidad aquellos mosquitos que no pudieron levantarse, volar o moverse del fondo de la botella. Se tomó como criterio de aparición o desarrollo de resistencia cuando en la cepa evaluada no se obtuvo 100 % de mortalidad a los 30 minutos.
RESULTADOS
Las larvas de Ae. aegypti de las cepas Buenos Aires y Misiones mostraron susceptibilidad a los organofosforados temefos y fenitrotion, con valores de factor de resistencia (FR50) menores de 5. Los valores similares de pendiente de las rectas probit-log (mortalidad vs dosis) para ambos insecticidas en ambas cepas indicaron que el nivel de susceptibilidad resultó homogéneo para ambos insecticidas en las cepas de estudios (tabla).
Las larvas también resultaron susceptibles a los piretroides deltametrina y cipermetrina. Los valores de CL50 observados para deltametrina en la cepa de Buenos Aires (0,0013) fueron muy similares al observado en la cepa susceptible Rockefeller (0,0016), resultando en un valor de FR 50 de 1,43. Para cipermetrina se observaron valores de FR50 de 1,92 para Buenos Aires y para la cepa Misiones resultó mayor (4,69), pero dentro de los límites de la susceptibilidad.
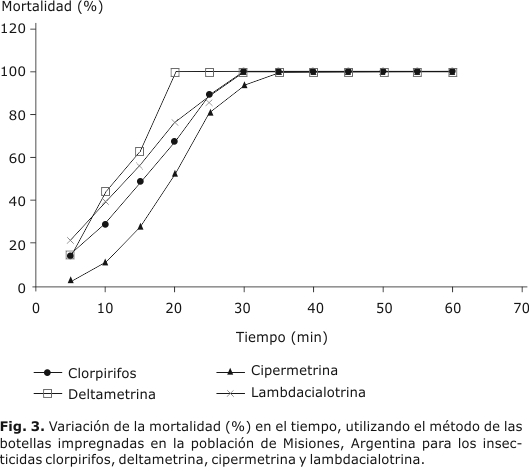
A través de los ensayos de detección de resistencia a insecticidas en mosquitos adultos se demostró que los ejemplares de ambas cepas, Buenos Aires y Misiones resultaron susceptibles a los insecticidas piretroides (deltametrina, lambdacialotrina y cipermetrina) y al organofosforado (clorpirifos), de acuerdo a los criterios de la OMS y CDC. En ambas cepas, se observó que a los 30 minutos de exposición a las botellas impregnadas se obtuvo 100 % de mortalidad para clorpirifos, cipermetrina, deltametrina y lambdacialotrina (fig. 2 y 3), excepto para deltametrina en Misiones, donde se alcanzó 100 porciento de mortalidad a los 20 minutos.
DISCUSIÓN
Las larvas de Misiones y Buenos Aires resultaron susceptibles a temefos de acuerdo al criterio de Mazarry y Georghiou,11 en 1995, ellos recomendaron diagnosticar resistencia para valores de factor de resistencia (FR50) mayores de 5. Sin embargo, se podría hablar de resistencia incipiente en las larvas de Misiones, para un valor de FR50=4, de acuerdo al criterio utilizado en trabajos previos de monitoreo de resistencia a temefos en cepas de Ae. aegypti de Clorinda e Iguazú, Argentina, cuyos autores diagnosticaron resistencia incipiente a temefos, con valores de FR50 mayores de 3.14,15 También en Brasil, para el Ministerio de Salud, un valor de FR50 mayor de 3, es considerado una razón para establecer estrategias de alternar el uso de temefos con otros insecticidas como Bacillus thuringienses var. israelensis o metropreno.16 Las diferentes formas de diagnosticar la resistencia en los diferentes trabajos de investigación, en ocasiones, dificulta la comparación de resultados en la comunidad científica. En este trabajo el nivel de susceptibilidad a temefos y otros insecticidas evaluados en larvas puede ser atribuido a que en Argentina el país hace un gran esfuerzo para aplicar medidas de control integrado de vectores y utilizar la menor cantidad de insecticidas químicos posibles o utilizarlo sólo en casos de epidemias de dengue, de ahí que no se haya detectado resistencia a los productos en uso, en este caso específico a temefos, que sí se ha utilizado como larvicida para el control de Ae. aegypti desde el año 2002, cuando se implementó un programa de control masivo llevado a cabo por la Fundación Mundo Sano.14
En el estado adulto tampoco se detectó resistencia a los insecticidas evaluados. A pesar de que el piretroide cipermetrina fue uno de los más utilizado como adulticida desde el año 2002, para el control de Ae. aegypti,14 aún persisten áreas donde esta especie manifiesta susceptibilidad a los insecticidas más utilizados para su control, como son las áreas de estudio.
Sin embargo, investigaciones previas han dado a conocer hallazgos relacionados con la resistencia a insecticidas en Ae. aegypti de Argentina y se ha caracterizado tanto la resistencia a temefos como a piretroides, así como los mecanismos de resistencia relacionados con los mismos.15,17,18
El concepto que da la Organización Mundial de la Salud sobre la resistencia a insecticidas expresa que es un fenómeno que aparece en intervalos de tiempo sumamente variables, en especies diferentes y aún en la misma especie sometida a distintas intensidades de aplicación de insecticidas.19 De aquí la necesidad de introducir en los programas de control un constante monitoreo del desarrollo de resistencia. Los resultados de esta investigación demostraron que el control de Ae. aegypti de las localidades estudiadas, de las provincias de Misiones y Buenos Aires puede realizarse de forma efectiva, utilizando los insecticidas en uso para el control vectorial, como son, temefos como larvicida y como adulticidas insecticidas, piretroides y el organofosforado clorpirifos.
REFERENCIAS BIBLIOGRÁFICAS
1. Brathwaite O, San Martín JL, Montoya H, del Diego J, Zamrano B. The History of Dengue Outbreaks in the Americas. Am J Trop Med Hyg. 2012;87:584-93.
2. Jansen CC, Beebe NW. The dengue vector Aedes aegypti: what comes next. Microbes Infect. 2010;12:272-79.
3. OPS [Organización Panamericana de la Salud]. Resurgimiento del dengue en las Américas. Boletín Epidemiológico. 1997;18:1-16.
4. Aviles G, Rangeon G, Vorndam V, Briones A, Baroni P, Enria D, Sabattini M. Dengue reemergence in Argentina. Emerg Infect Dis. 1999;5:1-4.
5. Jansen CC, Beebe NW. The dengue vector Aedes aegypti: what comes next. Microbes Infect. 2010;12:272-279. [PAHO] Pan American Health Organization. 2001. [citado 2008]. Disponible en: www.paho.org/spanish/ad/dpc/cd/paraguay-red-junio-2001-5-den-arg.pdf.
6. Carbajo AE, Schweigmann N, Curto SI, Garin A, Bejaran R. Dengue transmission risk maps of Argentina. Trop Med Int Health. 2001;6:170-83.
7. Seccacini E, Masuh H, Licastro S, Zerba E. Laboratory and scaled up evaluation of cis-permethrin applied as a new ultra low volume formulation against Aedes aegypti (Diptera: Culicidae). Acta Trop. 2006;97:1-4.
8. Organización Mundial de la Salud. Guidelines for dengue surveillance and mosquito control, WHO; 1995. Western Pacific Education in Action Series 8, Geneva, 112 pp.
9. Pérez O. Manual de Indicaciones técnicas para insectarios. Ciudad de la Habana: Editorial Ciencias Médicas; 2004:16-53.
10. Organización Mundial de la Salud. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. Geneva: WHO; 1981:6. WHO/VBC/81-80.
11. Mazarri MB, Georgiou GP. Characterization of resistance to organophosphate, carbamate, and pyretroid insecticides in field populations Aedes aegypti from Venezuela. J Am Mosq Control Assoc. 1995;11:315-322.
13. Brogdon WC, Mc Allister JC. Simplification of adult mosquito bioassay through use of time-mortality determinations in glass bottles. J Am Mosq Control Assoc. 1998;14:159-64.
14. Seccacini E, Lucia A, Zerba E, Licastro S, Masuh H. Aedes aegypti resistance to Temephos in Argentina. J Am Mosq Control Assoc. 2008;24:608-9.
15. Llinás GA, Seccacini E, Gardenal CN, Licastro S. Current resistance status to temephos in Aedes aegypti from different regions of Argentina. Mem Inst Oswaldo Cruz. 2010;105:113-16.
16. Braga IA, Valle D. 2007. Aedes aegypti: surveillance, resistance monitoring and control alternatives in Brazil. Epidemiol Serv Saude Brasilia. 16:295-302.
17. Saavedra-Rodriguez K, Urdaneta-Marquez L, Rajatileka S, Moulton M, Flores AE, Fernandez-Salas I, et al. A mutation in the voltage-gated sodium channel gene associated with pyrethroid resistance in Latin American Aedes aegypti. Insect Mol Biol. 2007;16:785-98.
18. Gómez A, Seccacini E, Zerba E, Licastro S. Comparison of the insecticide susceptibilities of laboratory strains of Aedes aegypti and Aedes albopictus. Mem Inst Oswaldo Cruz. 2011;106:993-96.
19. Organización Mundial de la Salud. Resistance of vector disease to pesticides. Fifth report of the WHO Expect Committee in Vector Control and Biology. WHO. 1980;655:1-82.
Recibido: 7 de mayo de 2014.
Aprobado: 19 de septiembre de 2014.
Dr.C. Juan A. Bisset. Apartado Postal 601. Marianao 13. La Habana. Cuba. Correo electrónico: bisset@ipk.sld.cu