Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana sep.-dic. 2014
ARTÍCULO ORIGINAL
Infecciones por los géneros Klebsiella y Acinetobacter en hospitales pediátricos cubanos y resistencia antibiótica
Infections caused by Klebsiella y Acinetobacter genuses in Cuban pediatric hospitals and antimicrobial resistance
Lic. Yesleisy Santisteban Larrinaga,I Dra. Yenisel Carmona Cartaya,II Dra. Yoima de la C. Pérez Faria,II Lic. Lilian Díaz Novoa,III Lic. Sandra García Giro,IV Dra. Nobumichi Kobayashi,V MSc. Dianelys Quiñones PérezII
I Servicio de Microbiología, Hospital "Enrique Cabrera". La Habana, Cuba.
II Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
III Servicio de Microbiología, Hospital "Juan M. Márquez". Holguín, Cuba.
IV Servicio de Microbiología, Hospital "Vladimir I. Lenin". Holguín, Cuba.
V Departamento de Higiene. Universidad de Sapporo, Japón.
RESUMEN
Introducción: Klebsiella pneumoniae y el complejo Acinetobacter baumannii-calcoaceticus constituyen importantes patógenos nosocomiales a nivel mundial siendo más susceptibles los pacientes ingresados en neonatología y unidades de cuidados intensivos.
Objetivos: caracterizar, desde el punto de vista clínico-microbiológico los aislamientos de los géneros Klebsiella y Acinetobacter causantes de infecciones en hospitales pediátricos cubanos.
Métodos: se realizó un estudio descriptivo-longitudinal durante el período de Junio 2011-Septiembre 2012 que incluyó 152 aislamientos clínicos (102 de Klebsiella spp. y 50 de Acinetobacter spp) causantes de infecciones nosocomiales en niños y que fueron remitidos al Laboratorio Nacional de Referencia de Microbiología del Instituto ‘‘Pedro Kourí". La identificación de esta especie se realizó mediante pruebas bioquímicas. Se determinó la susceptibilidad a 18 antimicrobianos, la producción de β-lactamasas de espectro extendido (BLEE) y la de metalo-β-lactamasas (MBLs) según las normas del Instituto de Estandarización de Laboratorio Clínico (CLSI, por sus siglas en inglés).
Resultados: las muestras más frecuentes de recuperación de Acinetobacter y Klebsiella fueron sangre, secreción endotraqueal y lesiones de piel. Klebsiella pneumoniae (96 %) y el complejo Acinetobacter baumannii-calcoaceticus (90 %) fueron las especies más prevalentes y se aislaron con mayor frecuencia en servicios de terapias, neonatología y quemado. Ambos patógenos mostraron elevada resistencia a las cefalosporinas con 57 % de producción de BLEE para el género Klebsiella spp. La resistencia a carbapenémicos solo se detectó en Acinetobacter spp (61 %) mediada por la producción de metalo-β-lactamasas en un 2 % de los aislamientos. La mayor susceptibilidad de este género se encontró para las tetraciclinas, mientras que el género Klebsiella spp. fue más susceptible a la ciprofloxacina. En ambos se observó resistencia elevada para los aminoglucósidos (66 %-75 %) y el trimetoprim-sulfametoxazol (45 %-60 %).
Conclusiones: Klebsiella pneumoniae y el Complejo Acinetobacter baumannii-calcoaceticus constituyen un peligro potencial en servicios pediátricos con escasas opciones terapéuticas quedando como únicas alternativas los carbapenémicos para las infecciones por Klebsiella spp multidrogorresistentes y la colistina para las infecciones por Acinetobacter spp con extremadrogorresistencia.
Palabras clave: resistencia antimicrobiana, niños, Klebsiella spp., Acinetobacter spp., Cuba.
ABSTRACT
Introduction: Klebsiella pneumoniae and the Acinetobacter baumannii-calcoaceticus complex represent important nosocomial pathogens worldwide. The patients admitted to the neonatology and the intensive care unit services suffer infections very frequently.
Objectives: to characterize clinically and microbiologically Klebsiella and Acinetobacter isolates causing infections in Cuban pediatric hospitals.
Methods: a descriptive longitudinal study of 152 clinical isolates (102 Klebsiella spp and 50 Acinetobacter spp), which caused nosocomial infections in children and were sent to the national reference laboratory of microbiology in "Pedro Kouri" Institute. The study was conducted from June 2011 to September 2012. The species were identified by biochemical tests. The susceptibility to 18 antimicrobials, the production of extended spectrum ?-lactamase (ESBL) and metallo-?-lactamases were determined according to the Clinical and Laboratory Standards Institute.
Results: the most frequent infections in infants and children by Acinetobacter and Klebsiella were found in blood, endotracheal secretion and skin lesions.. Klebsiella pneumoniae (96 %) and Acinetobacter baumannii-calcoaceticus complexes (90%) were the most prevalent species and were frequently isolated in intensive care, neonatology and burned patient wards. Both pathogens showed high resistance to cephalosporins with 57 % of extended-spectrum betalactamase production in Klebsiella spp. Resistance to carbapenems was only detected in Acinetobacter (61 %) with 2 % of metallobetalactamse production. Acinetobacter spp. was more susceptible to tetracyclines and cholistin where Klebsiella spp was more susceptible to ciprofloxacin. In both pathogens, a high resistance to aminoglycosides (66% -75 %) and trimethoprim-sulfamethoxazole (45 %-60 %) was observed.
Conclusions: Klebsiella pneumoniae and Acinetobacter baumannii-calcoaceticus complex represent a potential threat in pediatric services with few therapeutic options. The carbapenems remain the only alternative to severe infections caused by multidrug resistant Klebsiella spp and cholistin is the only choice to treat extreme multidrug resistant Acinetobacter spp infections.
Key words: antimicrobial resistance, Klebsiella spp., Acinetobacter spp., Cuba.
INTRODUCCIÓN
Las infecciones asociadas a la atención sanitaria (IAAS), específicamente las infecciones nosocomiales (IN), son una causa importante de morbimortalidad a nivel mundial siendo más susceptibles los pacientes ingresados en unidades de cuidados intensivos, inmunodeprimidos y en neonatos.1
Según reportes de la Organización Mundial de la Salud (OMS) en el mundo fallecen casi cinco millones de recién nacidos (RN) al año, constituyendo las infecciones una de las principales causas de muerte (32-40 %).2 El comportamiento de las IAAS, específicamente en América, en niños menores de cinco años alcanza cifras alrededor de 400 000 muertes por año y más del 40 % ocurren en el período neonatal.3 Las infecciones producidas por bacterias Gram negativas, en particular, Klebsiella pneumoniae y el complejo Acinetobacter baumannii-calcoaceticus ocupan un papel preponderante como causa de morbimortalidad. Entre las infecciones se citan bacteriemias asociadas a catéter, neumonía asociada con ventilación mecánica, heridas quirúrgicas e infección urinaria asociada a sondaje.4 Uno de los problemas más preocupantes en ambos géneros bacterianos, es su elevada resistencia adquirida a una amplia y variada gama de antibióticos unido a una alta resistencia intrínseca, con notable adaptación a la exposición antibiótica.5 En Cuba, Klebsiella spp. y Acinetobacter spp. constituyen uno de los principales patógenos dentro de los bacilos Gram negativos causantes de IN según notifica la Dirección Nacional de Epidemiología del Ministerio de Salud Pública (MINSAP).6
Teniendo en cuenta lo anteriormente expuesto donde los neonatos y niños mayores constituyen una población muy vulnerable a las IN se hace necesario conocer la importancia clínica de Klebsiella spp. y Acinetobacter spp. en poblaciones pediátricas. Para ello se profundiza en el presente trabajo aspectos microbiológicos tales como especies involucradas, susceptibilidad a diferentes antimicrobianos, así como la capacidad de producir betalactamasas y carbapenemasas que inactivan antibióticos de primera línea que se emplean en el tratamiento de las infecciones por dichos patógenos.
MÉTODOS
Se realizó un estudio descriptivo- longitudinal que incluyó la caracterización de 152 aislamientos clínicos (102 de Klebsiella spp. y 50 de Acinetobacter spp) causantes de infecciones nosocomiales en niños ingresados de diferentes hospitales del país. Estos aislamientos fueron enviados al Laboratorio Nacional de Referencia de Microbiología del Instituto de Medicina Tropical "Pedro Kourí" (LNRM/IPK), durante el período de Junio 2011-Septiembre 2012.
Los aislamientos de los géneros Klebsiella y Acinetobacter se recuperaron de las siguientes muestras clínicas: sangre, secreción endotraqueal, secreción de lesión de piel, secreción de herida quirúrgica, punta de catéter y orina. Además, Klebsiella spp también se aisló de secreción de oído y esputo.
Identificación de especies: se realizó mediante pruebas bioquímica por métodos convencionales.7 Se emplearon los sistemas “API 20 NE” y API 20 E (BioMérieux, Francia) para bacilos Gram negativos no fermentadores y enterobacterias, respectivamente, para confirmar la identificación de especie.
Susceptibilidad antimicrobiana: se aplicó el método de difusión por disco (Bauer-Kirby), en agar Mueller- Hinton, excepto para la colistina y la piperacilina/tazobactam, para las que se utilizó el método de E test.8 La evaluación de la susceptibilidad a los antimicrobianos se realizó acorde a lo establecido por el Instituto de Estandarización de Laboratorio Clínico (CLSI, por sus siglas en inglés) de los EE.UU (2012)8 frente a 18 antimicrobianos: piperacilina/tazobactan (0,016-256 mg), ceftazidima (30 mg), cefotaxima (30 mg), cefuroxima (30 mg), ceftriaxone (30 mg), imipenem (10 mg), meropenem (10 mg), aztreonam (30 mg), gentamicina (10 mg), amikacina (30 mg), ciprofloxacino (5 mg), levoflozacina (5 mg), tetraciclina (30 mg), doxiciclina (30 mg), nitrofurantoína (30 mg), colistina (0,016-256 mg), rifampicina (5 mg) y trimetoprim/sulfametoxazol (30 mg), excepto para la rifampicina que se evaluó según los criterios del comité de antibiograma de la Sociedad Francesa de Microbiología.9
Cepas controles: E. coli ATCC 35218 (para evaluar la potencia de la tira de E-test de piperacilina-tazobactam) y E. coli ATCC 25922 (para evaluar la potencia de los discos de antibióticos).
Definición de multidrogorresistencia y extremadrogorresistencia10
Multidrogorresistencia: se define como el aislamiento resistente, al menos, a tres clases de agentes antimicrobianos.
Extremadrogorresistencia: se define como el aislamiento resistente, al menos a tres clases de antibióticos descritos en el concepto de MDR y además es resistente a los carbapenémicos.
Recolección de la información: se confeccionó un modelo de recolección de datos, clínicos-epidemiológicos de los aislamientos de Klebsiella spp. y Acinetobacter spp, que permitió compilar todos los datos necesarios para alcanzar los objetivos del estudio.
Detección de Betalactamasas de Espectro Extendido (BLEE)
Se determinó el fenotipo productor de BLEE mediante el método de discos combinados: cefotaxima (30 mg) y cefotaxima/ácido clavulánico (30/10 mg) y ceftazidima (30 mg), ceftazidima- ácido clavulánico (30/10 mg) (Oxoid, Ltd.) a todas las cepas del género Klebsiella spp. que mostraron sensibilidad disminuida o resistencia a las cefalosporinas y al aztreonam. Se utilizó K. pneumoniae ATCC 700603 como cepa control positivo productora de BLEE.8
Detección cualitativa de metalo- b- lactamasa (MBLs)
A todos los aislamientos de Acinetobacter spp se les realizó la detección cualitativa de MBLs. Se llevó a cabo por el método de aproximación de disco en placas de agar Mueller- Hinton (Oxoid Ltd.) con discos de imipenem, meropenem y ácido etileno (EDTA) (30 mg) (Oxoid Ltd.).8
Análisis estadístico
Los resultados obtenidos se procesaron mediante los programas Microsoft Excel 2007 y Microsoft Access 2007 y se expresaron en tablas y figuras. Se utilizaron medidas de estadística descriptiva como la frecuencia y el porcentaje para el análisis y la presentación de los resultados.
RESULTADOS
Se identificaron tres especies del género Klebsiella y cuatro del género Acinetobacter causantes de infecciones en niños ingresados. K. pneumoniae (96 %) y A. baumannii-calcoaceticus (90 %) constituyeron las especies más frecuentes. Se identificaron, además, otras especies, aunque en menor cuantía (figura 1 y 2).
En relación con el tipo de muestras, el mayor número de aislamientos se obtuvo de las muestras de sangre, seguido por secreción endotraqueal, lesiones de piel y punta de catéter, tal como aparece reflejado en la tabla 1.
Es importante resaltar que el 70,1 % y 82 % de los aislamientos de muestras de sangre pertenecían a neonatos lo que evidencia la elevada susceptibilidad de los recién nacidos a estas infecciones.
Al analizar los aislamientos de ambos géneros bacterianos en relación con los servicios, se destaca que en Neonatología, el género Klebsiella tuvo la cifra más elevada (33 %), seguido de la Unidad de Cuidados Intensivos Pediátricos (UCIP) ( 20,5 %) y Hematología fue la de menor aislamientos (2 %). Sin embargo, respecto al género Acinetobacter la UCIP mostró mayor porcentaje (32 %), seguido de la Unidad de Quemados (28 %) y la de Cirugía fue la más baja (6 %). (figuras 3 y 4).
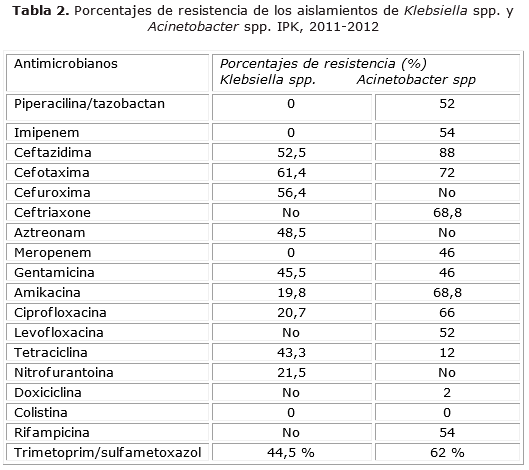
En la tabla 2 se muestran los porcentajes de resistencia de Klebsiella spp. y Acinetobacter spp. a los diferentes antibióticos estudiados. En el género Klebsiella se identificaron altos niveles de resistencia a las cefalosporinas con cifras superiores al 50 % y el género Acinetobacter spp. mostró también el porcentaje más alto (80 %) de resistencia frente a este grupo de antimicrobiano.
En Klebsiella spp. se identificó un 48,5 % de resistencia frente al aztreonam con un elevado porcentaje de cepas productoras de BLEE.
El 100 % de las cepas de Klebsiella spp fue susceptible a los carbapenémicos meropenem e imipenem mientras que el género Acinetobacter spp. presentó resistencia elevada a este grupo de antimicrobianos (46 %-54 %, respectivamente).
En la mayoría de las cepas de Acinetobacter spp. y Klebsiella spp se identificó más de un 45 % de resistencia a los aminoglucósidos (gentamicina y amikacina). En las fluoroquinolonas, particularmente, en la ciprofloxacina, la resistencia se comportó en un 66 % para Acinetobacter spp. y 21 % para Klebsiella spp. En relación con el trimetoprim-sulfametoxazol, también se observó más de un 40 % de resistencia en ambos géneros. Con respecto a las tetraciclinas, Klebsiella spp fue más resistente (43 % de resistencia a la tetraciclina) que Acinetobacter spp (12 %). El 100 % de los aislamientos de Klebsiella spp. y Acinetobacter spp. fueron sensibles a la colistina.
La caracterización de los aislamientos para la detección fenotípica de betalcatamasas demostró un porcentaje elevado de BLEE (57 %) en Klebsiella spp. mientras que en Acinetobacter spp. se obtuvo un 2 % de cepas productoras de MBLs.
Se reveló un 42,2 % y un 70 % de multidrogorresistencia para Klebsiella spp., y para Acinetobacter spp., respectivamente. Además, un 56 % de los aislamientos de este último género mostró extremadrogorresistencia.
DISCUSIÓN
El género Klebsiella y Acinetobacter se consideran un problema frecuente en el ámbito hospitalario por su capacidad para adquirir resistencia frente a la mayoría de los antibióticos y se asocian a una morbimortalidad elevada.11 La distribución de especies encontrada en la presente investigación, es similar a la reportada a nivel mundial, pues las especies K. pneumoniae y A. baumannii son las de mayor prevalencia como causa de IN. Numerosas bibliografías nacionales e internacionales, también las notifican como las de mayor importancia clínica y las más estudiadas en los géneros Klebsiella y Acinetobacter, respectivamente.12,13
La identificación de especies en cada uno de los servicios hospitalarios es de vital importancia para lograr un mejor control terapéutico de estas infecciones. La unidad de cuidados intensivos neonatal, la UCIP, la unidad de cirugía y de quemados aportaron el mayor número de casos. Estos resultados son similares a los informes de otros países, ya que estos constituyen servicios de alto riesgo de dichas infecciones.14,15 Respecto al servicio de quemados, llama la atención el porcentaje elevado de aislamientos identificados de Acinetobacter spp., de lo cual no existían reportes previos en Cuba por lo que este resultado constituye un hallazgo importante del presente estudio y alerta sobre una mayor atención en la vigilancia de este patógeno en dicho servicio.
Los miembros de los géneros Klebsiella y Acinetobacter constituyen una causa importante de infecciones del torrente sanguíneo en el recién nacido.16 Esta observación se corroboró en la presente investigación, donde la mayoría de los aislamientos recuperados de sangre procedían de hemocultivos de niños ingresados en la unidad de cuidados intensivos neonatal, lo que podría estar dado por el esfuerzo creciente de lograr la supervivencia de los recién nacidos de bajo peso, el uso extendido de nutrición parenteral y el empleo de catéter vascular que tiene lugar en esta unidad.17
El análisis de la susceptibilidad antimicrobiana es un reto en la actualidad en los laboratorios de microbiología ante los disímiles mecanismos de resistencia que las bacterias han desarrollado.
La presente investigación muestra la susceptibilidad de las cepas estudiadas frente a diferentes antibióticos donde se encontraron altos niveles de resistencia a las cefalosporinas en ambos géneros bacterianos.
En un estudio puntual desarrollado por Ferrer y colaboradores, en la provincia de Ciego de Ávila, Cuba, se reportan porcentajes de resistencia superior al 35 % frente a las cefalosporinas de primera y tercera generación a partir de aislamientos de Klebsiella.18 Situación similar se observó en la provincia de Villa Clara, Cuba en el año 2011 donde Rodríguez y colaboradores, también notifican cifras elevadas de resistencia frente a las cefalosporinas en cepas del género Klebsiella procedentes de tres unidades de cuidados intensivos de la provincia.19
Los elevados porcentajes de resistencia tanto para el aztreonam como para las cefalosporinas por Klebsiella spp., pudo obedecer a la elevada producción de BLEE en estas cepas descrita anteriormente (57 %) lo que ratifica la problemática internacional de este fenotipo de resistencia diseminado a nivel mundial. Una investigación realizada por Suárez (2011) en el Hospital “Hermanos Ameijeiras”, en Cuba, notifica un 48,2 % de aislamientos de Klebsiella spp. con este fenotipo de resistencia.20
En relación a Acinetobacter spp. se observó una resistencia marcada a los betalactámicos con porcentajes superiores al 80 %. Shete y colaboradores en la India (2009), muestran valores de resistencia a las cefalosporinas de 86 % en una UCIN.21 Otro estudio desarrollado en un hospital pediátrico de Nepal (2010) reporta más del 30 % de resistencia para la cefotaxima.22
La resistencia a los betalactámicos, excepto los carbapenémicos en Acinetobacter spp, puede estar relacionada con la producción de β-lactamasa cromosómica AmpC, que se describe como el mecanismo más frecuente de resistencia en este género. Por otro lado, se describe en la literatura que la actividad intrínseca de inhibidores de betalactamasas (ácido clavulánico, tazobactam y el sulbactam) contra A. baumannii es baja lo que pudiera explicar en parte la baja sensibilidad a la ticarcilina y la piperacilina combinada con los inhibidores en los aislamientos estudiados.23
Los carbapenémicos son otros de los antibióticos de primera línea empleados en el tratamiento de las infecciones por Klebsiella y Acinetobacter; afortunadamente el 100 % de los aislamientos de Klebsiella spp fueron susceptibles a imipenem y meropenem lo que está en correspondencia con los hallazgos de Rodríguez en Villa Clara, Cuba en el 201119 y lo reportado en la vigilancia nacional de este patógeno en el país durante el período (2010-1012).24 En contraste, en el género Acinetobacter se identificó resistencia elevada a los carbapenémicos (46-54 %), similar con los reportes de varios países de Europa.25, 26 En un estudio realizado por Roy en la India en el 2010, se corroboró una resistencia a carbapenémicos superior al 50 % en neonatos en aislamientos de A. baumannii.27
La elevada resistencia a los carbapenémicos por el género Acinetobacter en el presente estudio, pudiera estar dada por la producción de carbapenemasa tipo oxacilinasas (b-lactamasas clase D), mecanismo más frecuente descrito si se tiene en cuenta, que la detección de metalo-b-lactamasas (b-lactamasas clase B) fue baja en los aislamientos caracterizados como se planteó anteriormente. Resultado similar se describe a nivel mundial, donde este tipo de carbapenemasas no son las más frecuentes en Acinetobacter spp.28 Además, es concordante con la prevalencia baja de metalobetalactamasas durante la vigilancia nacional de este patógeno.24
Los elevados porcentajes de resistencia a los aminoglucósidos en ambos géneros bacterianos (Klebsiella spp, 46 % y Acinetobacter spp., 70 %) son concordantes con los reportes de Ravelo y colaboradores (2008), donde identifican porcentajes entre (40- 60 %) de resistencia para los aminoglucósidos en aislamientos de Klebsiella spp, y Acinetobacter spp, en un estudio realizado en el servicio de neonatología del Hospital General de Morón.29 La resistencia encontrada para los aminoglucósidos hace pensar en la codificación plasmídica de los genes que median dicha resistencia que facilitan su amplia diseminación. Los más difundidos son los genes relacionados con enzimas modificadoras de aminoglucósidos, también se han descrito alteraciones en su sitio diana por pérdida de la membrana externa o presencia de bombas de eflujo. Estos mecanismos de resistencia pudieran estar justificando la elevada resistencia en dicho trabajo.30
En relación con el trimetoprin-sulfametoxazol, la resistencia también fue elevada para ambos géneros (Klebsiella spp, 44,5 % y Acinetobacter spp, 60 %), resultados similares a los descrito por Acquah y colaboradores en Ghana (2013).31 Otro estudio realizado en Turquía (2012), encontraron elevados porcentajes de resistencia en Klebsiella spp frente al trimetoprin-sulfametoxazol con valores superiores al 80 %, en niños con sepsis urinaria.32 Este antibiótico se utiliza con frecuencia en las infecciones de tracto urinario y otitis media en niños.10 El uso frecuente de forma racional o irracional favorece la aparición de cepas resistentes, otro factor que se invoca son los determinantes que median la resistencia, localizados en plásmidos y transposones, similar a lo descrito para los aminoglucósidos.33
Otra de los antimicrobianos estudiados en la presente investigación fue la colistina, la que pertenece a la familia de las polimixinas. Esta es una familia de antibióticos que se comercializa desde la década de los cincuenta y sesenta pero cayó en desuso posteriormente, debido a su toxicidad y a la aparición de otros antibióticos activos frente a bacterias Gram negativas.34 Sin embargo, con el incremento de la multirresistencia en bacilos Gram negativos, retoman su importancia terapéutica desde la década del 90.35
Acorde a los resultados del presente trabajo (100 % de sensibilidad de Klebsiella spp. y Acinetobacter spp. a la colistina) unido a los resultados de la vigilancia nacional de Klebsiella y Acinetobacter en el país durante 2010-201224 evidencian a esta droga como una alternativa terapéutica muy útil en tratamiento de las infecciones provocadas por especies de Klebsiella y Acinetobacter multirresistentes. Estos resultados están en concordancia con Giani y colaboradores en Italia (2009)36 y Arnold en Estados Unidos (2012).37
La reciente descripción de nuevos mecanismos de resistencia a distintas familias de antibióticos y la posible adquisición de los mismos, avizora el riesgo de la aparición de cepas de Klebsiella y Acinetobacter resistentes a todas las alternativas terapéuticas. El porcentaje de multirresistencia detectado contrasta a lo reportado por Rodríguez y colaboradores en Villa Clara (Cuba) y Viswanathan en la India en el 2011, donde informan porcentajes superiores al 80 % de cepas Klebsiella spp. multidrogorrestentes19,38 En los aislamientos de Acinetobacter spp. se detectó un 70 % y 56 % de fenotipo MDR y XDR, respectivamente. Estos resultados son semejantes con los reportes Queenan y Shield en Estados Unidos (2012), quienes indentificaron un 54 % y 59 % de cepas con fenotipo MDR y XDR, respectivamente, en aislamientos de Acinetobacter spp.39,40
Klebsiella spp. y Acinetobacter spp. constituyen importantes patógenos causantes de IN en niños ingresados en algunos hospitales del país con la ocurrencia de infecciones invasivas, especialmente en neonatos y niños atendidos en unidades de cuidados intensivos. La resistencia elevada a diversos antimicrobianos estudiados unido a las características anatómicas y limitaciones en la inmunidad propia en los niños, así como fallos en las medidas de prevención y control de las infecciones en los centros hospitalarios son factores a tener en cuenta en la repercusión clínica de estas bacterias cuya tasa de infección puede incrementarse en el tiempo con mayores fallos terapéuticos.
AGRADECIMIENTOS
A todo el personal de los Laboratorios de Microbiología de los hospitales pediátricos y hospitales generales de la red nacional del país y de los Centros provinciales de Higiene y Epidemiología (CPHE) que contribuyen con la vigilancia de Klebsiella y Acintobacter en servicios pediátricos.
REFERENCIAS BIBLIOGRÁFICAS
1. Angel D, Zapata J. Resistencia a los antibióticos en neonatos con infección por Klebsiella pneumoniae en un hospital de tercer nivel de la ciudad de Medellín. Latreia. 2011;14(4):1-4.
2. Coronell W, Rojas J, Escamilla M, Manotas MC, Sánchez MA. Infección Nosocomial en Unidades de Cuidados de Intensivos Neonatales. Mexico: Univesidad de Cartagena; 2010 [cited 2012 15 de Agosto ]; Available from: http://www.scp.com.co/precop/precop_files/modulo_9_vin_3/Precop_9-3-C.pdf.
9. Comité de l’Antibiogramme de la Société Francaise de Microbiologie. Recommandations 2010 [consultado 14 de Octubre 2012.]; Paris, France: Société Franc¸ aise de Microbiologie:[Available from: http://www.sfm-microbiologie.org.
11. Hoyos A, Rivera O, Hoyos C, Mesa C, Alfaro J. Características clínicas, epidemiológicas y de susceptibilidad a los antibióticos en casos de bacteriemia por Klebsiella pneumoniae en neonatos. Rev CES. 2007;21:31-9.
12. Cheguirián ML, Carvajal LR, Ledesma EM, Enrico MC, Reale AL, Culasso C, et al. Prevalencia de microorganismos causantes de bacteriemias y fungemias en pacientes oncológicos pediátricos. Patrones de sensibilidad a los antimicrobianos. Rev argent microbiol. 2008;40(2):111-5.
14. Balboa P, Castillo C. Factores de riesgo de infecciones del tracto sanguíneo asociadas a alimentación parenteral en pacientes pediátricos. Nutr Hosp. 2011;26(6):1-10.
15. Azimi L, Rastegar A, Alaghehbandan R, Alinejad F, Mohammad M, Rahbar M. KPC-Producer Gram negative bacteria among burned infants in motahari hospital, Teheran; first report from Iran. Annals of Burns and Fire Disasters. 2012;XXV(2):1-4.
18. Ferrer M, Dueñas L. Enfermedades Infecciosas y Resistencia Bacteriana en una Unidad de Cuidados Intensivos Pediátricos Ciego de Ávila. Cuba: Hospital General Dr. Antonio Luaces Iraola.; 2005 [cited 2012 15 de Agosto]; Available from: http://www.sld.cu/galerias/pdf/sitios/urgencia/139 Enfermedades infecciosas y resistencia bacteriana en una unidad de cuidados intensivos pediátrios. pdf.
21. Shete VB, Ghadage DP, Muley VA, Bhore AV. Acinetobacter Septicemia in Neonates Admitted to Intensive Care Units. J Lab Physicians. 2009;1(2):73-6.
38. Viswanathan R, Singh A, Basu S, Chatterjee S, Sardar S, Isaacs D. Multi-drug resistant gram negative bacilli causing early neonatal sepsis in India. 2012 [cited 2013 15 de Enero]; Available from: http://fn.bmj.com/content/early/2011/12/07/archdischild-2011-300097.full.html .
40. Shields R, Clancy C, Gillis L, Kwak E, Silveira F, Abdel R, et al. Epidemiology, Clinical Characteristics and Outcomes of Extensively Drug-Resistant Acinetobacter baumannii Infections among Solid Organ Transplant Recipients. Plos One. 2012; 7(12):1-10.
Recibido: 9 de junio de 2014.
Aprobado: 27 de septiembre de 2014.
MSc. Dianelys Quiñones. Instituto de Medicina Tropical "Pedro Kourí". Departamento de Bacteriología-Micología. Autopista “Novia del Mediodía” Km 6 1/2, La Lisa, La Habana, Cuba. Tel. 537- 2553537, Fax: 537–2046051. Correo electrónico: dia@ipk.sld.cu diany.quinones@infomed.sld.cu