Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop vol.69 no.3 Ciudad de la Habana set.-dic. 2017
ARTÍCULO ORIGINAL
Aportes del Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí" durante una década
Contributions of the Research Ethics Committee at Pedro Kouri Tropical Medicine Institute during one decade
Iliana Valdés Hernández, Eric Martínez Torres, Pedro Más Bermejo, Ana Margarita Montalvo Álvarez, Daniel González Rubio, María Caridad Montalvo Villalva, Nereyda Cabrera Cantelar, René Gato Armas, Roberto Fernández Llanes
Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba.
RESUMEN
Introducción: la evaluación ética de los proyectos de investigación en el Instituto de Medicina Tropical "Pedro Kourí" de La Habana, tiene una tradición e historia. En 2008 fue reorganizada esta actividad y creado el Comité de Ética de la Investigación.
Objetivos: realizar una revisión documental del trabajo desarrollado por el Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí" en la última década y evaluar sus aportes a la formación de valores en sus profesionales.
Métodos: se realizó la revisión de los archivos del Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí" (2008-junio 2017). A partir de esta se procedió a clasificar las investigaciones, evaluar la calidad de los documentos, revisar el proceso de seguimiento a los ensayos clínicos e identificar las actividades de capacitación.
Resultados: se evaluaron 407 documentos, pertenecientes a una amplia gama de temáticas. La investigación básica seguida de las asociadas al fortalecimiento de capacidades fueron las más frecuentes. Las principales deficiencias detectadas en el proceso de revisión fueron: la descripción del impacto de la investigación en la comunidad, el procesamiento estadístico, el consentimiento informado, la obtención de avales en estudios multicéntricos, así como la descripción de procederes en animales de laboratorio, entre otras. Estas se discutieron con los autores y se fomentó su cumplimiento a través de los principios de la bioética (autonomía, beneficencia, no maleficencia y justicia). La revisión del seguimiento a los ensayos clínicos reafirmó la colaboración científica del instituto con instituciones cubanas y extranjeras con elevado prestigio. Se identificó una intensa labor capacitadora del comité destacándose la ejecución de talleres de discusión de documentos claves en el análisis ético de las investigaciones.
Conclusiones: la resolución de las principales deficiencias en apego a los principios éticos y el fomento de estos valores entre los investigadores y miembros del Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí" repercutieron de manera positiva en la calidad de las investigaciones.
Palabras clave: Comité de Ética de la Investigación; formación de valores; ensayos clínicos; revisión ética; principios éticos; Declaración de Helsinki.
ABSTRACT
Introduction: ethical evaluation of research projects at Pedro Kouri Tropical Medicine Institute in Havana has both a tradition and a history. In the year 2008 this activity was reorganized and the Research Ethics Committee created.
Objectives: carry out a document review of the work done by the Research Ethics Committee at Pedro Kouri Tropical Medicine Institute during the past decade and evaluate its contributions to the value training of its professionals.
Methods: a review was conducted of the archives of the Research Ethics Committee at Pedro Kouri Tropical Medicine Institute (2008-June 2017). The review served as background to classify the research projects, evaluate the quality of documents, review the follow-up of clinical assays, and identify the training activities.
Results: evaluation was performed of 407 documents about a wide range of topics. The most frequent research type was basic research, followed by studies related to the strengthening of capacities. The main deficiencies detected in the process were the following: description of the impact of the research in the community, statistical processing, informed consent, receipt of endorsements for multicenter studies, and description of procedures related to the use of laboratory animals, among others. These were discussed with the authors and compliance was fostered via bioethical principles (autonomy, beneficence, non-maleficence and justice). Review of the follow-up of clinical assays reaffirmed the scientific cooperation of the institute with renowned Cuban and foreign institutions. It was found that the committee performs intense training work, notably the development of workshops for the discussion of key documents related to the ethical analysis of research.
Conclusions: resolution of the main deficiencies in compliance with ethical principles and fostering of ethical values among researchers and members of the Research Ethics Committee at Pedro Kouri Tropical Medicine Institute positively impacted the quality of research.
Keywords: Research Ethics Committee; value training; clinical assays; ethical review; ethical principles; the Helsinki Declaration.
INTRODUCCIÓN
La evaluación ética de los proyectos de investigación en el Instituto de Medicina Tropical "Pedro Kourí" (IPK) de La Habana, tiene una tradición e historia. En 2008 fue reorganizada esta actividad y creado el Comité de Ética de la Investigación (CEI) mediante Resolución Constitutiva del CEI1,2 a partir de lo establecido en las Resoluciones emitidas por el Ministerio de Salud Pública de Cuba.
La restructuración del CEI-IPK, como órgano consultivo asesor de la institución, demandó la actualización de sus funciones y la renovación de sus miembros y junta directiva, así como la creación de documentos rectores de su actividad fundamental. Posteriormente se impuso la necesidad de normalizar sus procedimientos de trabajo (PNO) y diseñar registros donde quedaran plasmadas las evidencias de su actividad sistemática.
La Resolución Ministerial No. 40 del año 2014, emitida por el Ministro de Salud Pública de Cuba,3 expone las directrices de trabajo de los CEI en aquellas entidades de salud (asistenciales, docentes, investigativas o administrativas) que se caractericen por realizar actividades de investigación que involucren seres humanos, y requieran de la observancia de normas éticas específicas. Haciendo uso de la autonomía concedida en la mencionada Resolución, el CEI-IPK ha cumplido las siguientes funciones: examinar, comentar y enjuiciar el valor y la validez científica y ética de las investigaciones propuestas en el IPK, así como su justificación social; analizar el reclutamiento de los sujetos de investigación y el desarrollo del proceso de obtención del consentimiento informado de los mismos, entre otros. Mención aparte y no menos importante, se encuentra evaluar la calificación y experiencia de los investigadores a cargo de la ejecución del proyecto así como de la idoneidad de los sitios de investigación que acogen las propuestas.3
En el presente artículo nos proponemos realizar una revisión documental del trabajo desarrollado por el CEI-IPK en la última década y evaluar los aportes a la vida científica del IPK y a la formación de valores en los profesionales de la institución, particularmente en el personal en formación (especialistas jóvenes, médicos residentes, maestrantes y doctorantes) a través de las recomendaciones realizadas a cada trabajo evaluado, el seguimiento a los ensayos clínicos en ejecución y mediante las actividades de capacitación.
MÉTODOS
REVISIÓN DOCUMENTAL
Se realizó la revisión de los documentos de archivo: dictámenes, Anexo 1 (Propuesta de modificaciones realizadas por los revisores del CEI-IPK), modelo del criterio de los revisores, actas de las reuniones ordinarias y extraordinarias, así como los registros de las investigaciones recibidas en el CEI-IPK en el periodo comprendido de 2008 a 2017 con el objetivo de contabilizar la actividad de comité. A partir de la misma se procedió a:
- Clasificar las investigaciones. Los protocolos revisados se clasificaron según las siguientes categorías: investigación básica (investigación fundamental de laboratorio llevada a cabo sin fines prácticos inmediatos), investigaciones preclínicas (revisadas de conjunto con el comité para el uso y cuidado de animales de laboratorio, CICUAL), ensayos clínicos, otras investigaciones clínicas, investigaciones que involucran el medio ambiente, investigaciones epidemiológicas e investigaciones para el fortalecimiento de capacidades (desarrollo de recursos humanos e introducción de nuevas tecnologías).
- Evaluar la calidad de los documentos presentados. Se agruparon en tres categorías: aprobado sin modificaciones, aprobado tras modificaciones propuestas por el CEI-IPK y no aprobado. Se registraron las principales deficiencias encontradas durante el proceso de revisión, según lo establecido en el Modelo de evaluación ética empleado por los revisores del CEI-IPK y recogidas en el Anexo 1.
- Revisar el proceso de seguimiento a los ensayos clínicos. Se revisaron los Informes de seguimiento a los ensayos clínicos elaborados por los investigadores principales según la plantilla establecida por el CEI-IPK para estos fines.
- Identificar las actividades de capacitación en las que se involucró el CEI-IPK. Se revisó la ejecución de los planes de capacitación de los miembros del CEI-IPK, así como las evidencias documentales de las actividades capacitadoras ejecutadas por el CEI-IPK para sus miembros y para el resto de los investigadores del IPK.
RESULTADOS
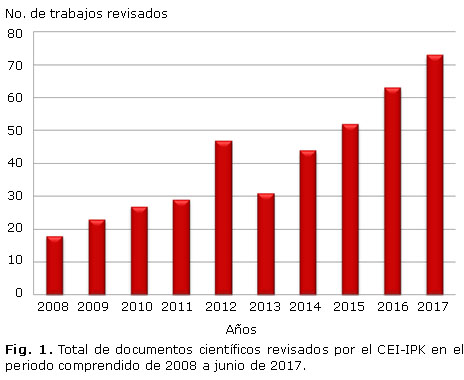
Como se muestra en la figura 1, en el periodo comprendido desde 2008 hasta junio de 2017 se evaluaron, por el CEI-IPK, un total de 407 documentos, entre los que se encontraron proyectos de investigación o innovación, protocolos de tesis para optar por el título de Máster, de Especialista de primer grado en Microbiología o de Doctor en Ciencias. A partir del análisis realizado se evidenció un incremento progresivo de la actividad evaluadora del CEI-IPK, la cual tiene como colofón los datos mostrados en el primer semestre del año 2017, donde se llevó a cabo la revisión de 10 proyectos más que en todo el año precedente.
Es meritorio destacar que los documentos revisados por el CEI-IPK respondían, no solo, a diferentes convocatorias nacionales de proyectos de investigación (Proyectos Nacionales asociados a Programas del Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba, convocatorias institucionales o territoriales), sino también a convocatorias de prestigiosas organizaciones internacionales como la Organización Mundial de la Salud (OMS) y su oficina regional para las Américas (OPS) y la Organización Internacional de Energía Atómica (OIEA). Igualmente se pudo constatar la colaboración científica con diferentes países como Bélgica, Irlanda, Japón, proyectos de la Unión europea y Organizaciones no gubernamentales (ONG) como MediCuba Europa.
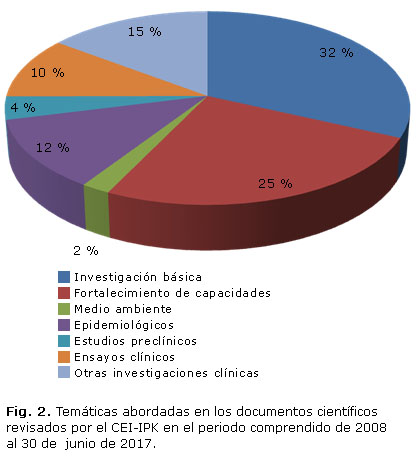
La amplia gama de investigaciones ejecutadas en el IPK se ve reflejada en las temáticas abordadas en los documentos científicos revisados (Fig. 2).
La investigación básica, seguida de aquellos proyectos o protocolos que implicaban, de alguna manera, el fortalecimiento de las capacidades asociadas a los recursos humanos o tecnológicos, fueron las más frecuentes en el periodo analizado. Estas temáticas aportaron, en conjunto, más del 50 % del total de investigaciones revisadas. Es importante hacer énfasis en la actividad del CEI en relación a los ensayos clínicos, la cual demandó el análisis, la formulación de recomendaciones y la aprobación final de más de 30 documentos relacionados con sus diferentes fases de su ejecución.
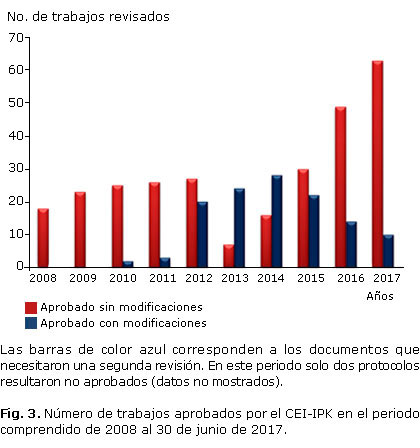
La figura 3 representa una aproximación a la valoración de la calidad de los documentos científicos recibidos y revisados por el CEI-IPK. Como se puede observar, luego de la implementación de los procedimientos normalizados para la revisión de la documentación y la creación del Anexo 1 con los criterios de los revisores en el 2010, se constató un incremento en los protocolos y proyectos que necesitaron modificaciones al documento original. Nótese que a partir de 2015 aumentó progresivamente el número de documentos aprobados sin modificaciones.
Las principales deficiencias encontradas por los miembros del CEI-IPK durante el proceso de evaluación ética de los protocolos y proyectos de investigación, en el periodo 2008 al 30 de junio de 2017, fueron las siguientes:
- Descripción del impacto o beneficio de la investigación en la comunidad.
- Descripción del procedimiento estadístico de los resultados.
- Criterios de inclusión y exclusión.
- Elaboración y proceso de obtención del consentimiento informado.
- Obtención de avales cuando se involucran otras instituciones.
- Descripción de procederes de anestesia, analgesia y eutanasia en el uso de animales de laboratorio.
Para cada una de estas deficiencias y para otras no relacionadas, se llevaron a cabo recomendaciones por el CEI-IPK. Estas se trasladaron a los investigadores principales en el plazo establecido en el Reglamento Interno del Comité de Ética de la Investigación del IPK. Solamente se otorgó el Dictamen de aprobación cuando los autores efectuaron las correspondientes modificaciones en el texto de sus proyectos y entregaron la nueva versión.
La ausencia de conflicto de intereses en la evaluación y toma de decisiones se tuvo en cuenta según lo establecido en el Reglamento Interno del Comité de Ética de la Investigación del IPK para cada documento evaluado. Para esto, en algunos casos, fue necesario excluir de la tarea evaluativa a algunos miembros del comité. La ausencia de conflicto de intereses se refrenda en el Anexo 2 al Dictamen que otorga el CEI. Los miembros del CEI-IPK conocieron y firmaron un documento de confidencialidad por 10 años respecto a los contenidos de cualquier proyecto revisado, los productos o servicios que en el mismo se refieren y toda otra información sensible cuya divulgación pudiera generar afectación de cualquier tipo a la institución y a los investigadores. Ambos aspectos, expuestos anteriormente contribuyen a la calidad de las investigaciones propuestas, la revisión ética y la emisión de resultados
El proceso de seguimiento a los ensayos clínicos se normalizó en el año 2013, de acuerdo con las guías operacionales para comités de ética que evalúan investigación biomédica, de la Organización Mundial de la Salud (OMS).4 Con este fin el CEI-IPK diseñó un Instructivo de Trabajo que sirvió como guía para la elaboración del Informe de Seguimiento. Este último recoge: I) el estado de ejecución del ensayo clínico, II) el apego del mismo al diseño científico original; III) la conducción del estudio; IV) el cuidado y la protección de los participantes en la investigación; V) la confidencialidad de la información; VI) la ejecución del proceso de obtención del consentimiento informado y el reclutamiento de los sujetos participantes y VII) el reporte de resultados parciales o finales de la investigación, adjuntando publicaciones o informes técnicos de los mismos.
El cuadro recoge una muestra de los ensayos clínicos en ejecución en el período 2013 a junio de 2017, a los cuales se les realizó el seguimiento por el CEI-IPK
Adicionalmente, se identificaron las principales actividades de capacitación, en las que se encontraron involucrados los miembros del CEI-IPK. Entre estas se encontraron la participación en dos talleres internacionales de ensayos clínicos, y en dos talleres internacionales relacionados con el funcionamiento de los CEI; en el curso de Introducción a la ética de la investigación en seres humanos perteneciente al Programa de Educación permanente a distancia de la UNESCO y en Reuniones de la Red Cochrane Iberoamericana (Quito 2016 y Medellín 2017) en el tema de los ensayos clínicos. Por su parte, el comité organizó dos talleres dirigidos a sus miembros y a investigadores del IPK: "Taller de Actualización del CEI-IPK" y "Estudio de la Declaración de Helsinki". El primero se centró en el estudio de la Resolución 40 y en la actualización de los documentos rectores del CEI-IPK. El segundo se dedicó a conocer los principios de la Declaración de Helsinki5 relativos a la ética de la investigación y a la aplicación de dichos principios al contexto de las investigaciones en el IPK. Cabe destacar que en esta última actividad se generó un profundo debate sobre los tópicos recogidos en dicha Declaración, entre los que se destacaron: el principio del riesgo mínimo en las investigaciones que involucren seres humanos, la incorporación de grupos vulnerables a las mismas; el uso del placebo y los requisitos científicos de los protocolos de investigación.
Por otra parte, los propios documentos generados por los miembros del CEI-IPK como resultado del proceso de revisión de los protocolos y que se entregan a los investigadores, junto a la atención personalizada a los mismos constituyó, a nuestro modo de ver, una actividad capacitadora cotidiana que repercutió positivamente en la calidad de las investigaciones presentadas, tal y como se muestra en la figura 3.
DISCUSIÓN
Establecer qué es lo correcto y qué no lo es constituye el ámbito de la ética de la investigación con seres humanos. Lo anterior queda materializado en cada proyecto, estudio o protocolo que se confecciona. Acreditar dicho carácter ético es la función de los comités que acometen esta evaluación en las instituciones de salud. Esta acreditación comienza con la evaluación de la calidad del diseño de la investigación, porque nada es menos ético que someter a un grupo de personas voluntarias a un estudio que no cumple con los principios establecidos para un buen diseño. Esto hace perder tiempo y recursos ya que resulta imposible llegar a conclusiones; además del daño que ocasiona al prestigio de autores e instituciones.
En la Medicina, toda actividad que se realiza debe promover la salud, el bienestar y los derechos de los pacientes, lo cual también incluye a los sujetos de investigación. Los conocimientos y la conciencia del personal que labora en este sector deben estar dedicados al cumplimiento de esta premisa. En la actualidad, la bioética va más allá de la vida y la salud humanas, e incluye los experimentos con animales y las demandas ambientales conflictivas.6
El CEI-IPK ha llevado a cabo una ardua labor en la última década. El número de documentos científicos revisados y la gran variedad de temas analizados ha demandado la dedicación de todos sus miembros en pos de garantizar la máxima calidad de las investigaciones que se proponen.
La ética no prescribe una serie de normas o políticas específicas, sino que proporciona una plataforma para evaluar problemas y determinar el curso adecuado de acción. En ética, el proceso por el que se toma una decisión es tan importante como el resultado. Para que una decisión sea éticamente legítima, debe realizarse en un proceso abierto e inclusivo que tome en consideración los puntos de vista de todos los implicados.7,8 El trabajo de revisión ética de los proyectos en el IPK permitió mejorar la calidad del trabajo de la Institución mediante la identificación de problemas de diseño, éticos y de tipo metodológico.
Una aproximación al análisis ético consiste en identificar en las investigaciones, el cumplimiento de los principios básicos de la Bioética recogidos en la Declaración de Helsinki desde 1963 hasta la más reciente de 2013: autonomía (la habilidad de tomar decisiones por uno mismo), beneficencia (la obligación de "hacer el bien" a otros), no maleficencia (la obligación de evitar el causar daño a otros) y justicia (el valor de distribuir equitativamente beneficios y cargas).5
En ese sentido, el trabajo del CEI también ha contribuido a la formación de valores en el personal de la Institución, pues en la evaluación de los proyectos y protocolos de los diversos tipos de investigación, se han tenido en cuenta, los grandes principios aplicables a la actividad científica en general y a la práctica en cualquiera de sus manifestaciones, tanto médica como social.
El respeto a la autonomía del individuo se verificó durante la revisión del proceso de obtención del consentimiento informado. Este fue, precisamente, una de las principales deficiencias detectadas en los protocolos y proyectos que involucraban sujetos de investigación. El comité guió a los investigadores a diseñar documentos que expresaran de forma clara los propósitos de la investigación, así como el detalle de los procederes a los que serían sometidos los sujetos y la competencia del personal encargado de llevarlos a cabo. De igual forma, la voluntariedad del paciente de participar en la investigación constituyó un requisito en la elaboración de este documento. Paralelamente se verificó el proceso de obtención y firma del consentimiento por parte de los voluntarios, garantizando que el mismo fuera llevado a cabo por el personal más calificado. Este proceso fue acompañado, en todos los casos, por el compromiso de confidencialidad con respecto a la información obtenida de los sujetos por parte de los investigadores relacionados con el estudio como por los miembros del CEI-IPK.
La declaración de los beneficios del estudio para los participantes en la investigación, como parte del cumplimiento con el principio ético de Beneficencia, constituyó un punto ampliamente debatido. Este dio lugar a importantes señalamientos realizados y a múltiples sugerencias a los investigadores principales. Un lugar especial lo ocuparon aquellas investigaciones que comprendían la inclusión de grupos vulnerables, las cuales requirieron de una justificación contundente y una relación riesgo/beneficio inclinada totalmente hacia el segundo. La beneficencia es la aspiración mayor de las políticas y prácticas de la salud pública, y cuando se trata de un estudio realizado en la comunidad o de tipo epidemiológico se la debe interpretar en sentido amplio, según las necesidades sociales, y no de manera estrecha en términos de los intereses individuales.
El principio de justicia refiere la igualdad de tratamiento, de oportunidades, de acceso y la equidad respecto a los beneficios de las investigaciones. El CEI-IPK mantiene la exigencia del reconocimiento explícito de la participación de otras instituciones en los estudios del IPK, así como de las distintas instancias representativas de la comunidad (Consejo Popular, líderes formales y no formales) cuando el proyecto lo requiera. En este sentido, la revisión ética de los protocolos ha contribuido en múltiples ocasiones a la equidad y al cumplimiento del principio de justicia.
Se concluye que la identificación de las principales deficiencias en los protocolos revisados, los señalamientos realizados en apego al abordaje y cumplimiento de los principios éticos en las investigaciones científicas y el fomento de estos valores entre los investigadores y miembros del CEI-IPK repercutieron de manera positiva en la calidad de las investigaciones. Este impacto se materializó en un número menor de protocolos que necesitaron una segunda revisión. En nuestra consideración la práctica adoptada por el reestructurado CEI-IPK en su primera década de trabajo, con la introducción de un sistema renovado en sus revisiones sistemáticas constituyeron la principal forma de capacitación para los investigadores de nuestro instituto y contribuyó de manera importante a la formación de valores en los investigadores y demás especialistas.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Resolución No. 7/2008. Resolución Constitutiva del Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí". 2008.
2. Resolución No. 20/2011. Resolución Constitutiva del Comité de Ética de la Investigación del Instituto de Medicina Tropical "Pedro Kourí". 2011.
3. Resolución Ministerial (MINSAP) No. 40/2014. Creación o restructuración de los Comités de Ética de la Investigación. 2014.
4. Organización Mundial de la Salud. Guías Operacionales para Comités de Ética que Evalúan Investigación Biomédica. Ginebra: OMS; 2000.
5. Asociación Médica Mundial (AMM). Declaración de Helsinki de la AMM - Principios éticos para las investigaciones médicas en seres humanos. 64a Asamblea General, Fortaleza, Brasil, octubre 2013.
6. Osorio JG. Principios éticos de la investigación en seres humanos y en animales. Medicina. 2000;60:255-8.
7. OMS. Comités de ética de investigación. Conceptos básicos para el desarrollo de capacidades. Ginebra: Organización Mundial de la Salud; 2009 [citado 8 Jun 2017]. Disponible en: htpp://www.who.int/ethics/publications/
8. Comité de Ética del Instituto de Investigación de Enfermedades Raras. Instituto Carlos III. Ministerio de Ciencia e Innovación. Guías éticas de investigación en biomedicina. I.P.O.: 477-09-017-8. 2009.
Recibido: 1ro. de agosto de 2017.
Aceptado: 19 de octubre de 2017.
Iliana Valdés Hernández. Instituto de Medicina Tropical "Pedro Kourí" (IPK). Autopista Novia del Mediodía km 6½, La Lisa. La Habana, Cuba. La Habana, Cuba. Correo electrónico: iliana@ipk.sld.cu