Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.26 n.2 Ciudad de la Habana Mayo-ago. 2010
ARTÍCULO DE REVISIÓN
Uso del factor VII activado recombinante como agente hemostático en trastornos hemorrágicos
Use of recombinant-activated factor VIIa as a hemostatic agent in hemorrhagic disorders
DrC. Delfina Almagro Vázquez
Instituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
La eficacia del tratamiento con factor VII activado recombinante (FVIIar) durante episodios hemorrágicos en pacientes hemofílicos con inhibidores y el conocimiento de su mecanismo de acción, determinó que en los últimos años se ampliara rápidamente su uso en pacientes con hemorragia de diversas causas no controladas con la terapéutica habitual; entre otras, defectos congénitos de la coagulación, trastornos plaquetarios, hepatopatías, cirugía, hemorragia intracraneal, sangramientos digestivos. Aunque un grupo importante de estas comunicaciones se han realizado en forma de casos reportados y serie de casos, se considera que los resultados obtenidos son importantes y que la administración de FVIIar es una alternativa en pacientes con hemorragia grave no controlada. A pesar de su potente acción procoagulante, el riesgo de complicaciones tromboembólicas es bajo y está relacionado en un grupo importante de pacientes con la presencia de otros factores protrombóticos. En la actualidad se considera que el FVIIar esta indicado en aquellos pacientes con hemorragia masiva que no responden a la terapia con componentes sanguíneos ni a medidas quirúrgicas apropiadas.
Palabras clave: factor VIIa recombinante, trastornos hemorrágicos, eficacia, eventos trombóticos.
ABSTRACT
Effectiveness of the treatment with recombinant activated factor VII (raVII) during the hemorrhagic episodes in hemophilic patients using inhibitions and the knowledge of its action mechanism determined that in pas years its use will be expanded in patients with hemorrhage from non-controlled diverse causes using the usual therapeutics among other, congenital coagulation defects, platelet disorders, liver diseases, surgery, intracranial hemorrhage, digestive bleedings. Although a significant group of these communications have been carried out in reported cases and in cases series, it is considered that the results obtained are important and that the administration of raVII is an alternative in patients presenting with non-controlled severe hemorrhage. Despite its potent pro-coagulant action, thromboembolism complications risk is low and it is related to a significant group of patients with other prothrombotic factors. Nowadays, it is considered that raVII is prescribed in those patients with massive hemorrhage without response either to therapy using blood components or appropriate surgical measures.
Key words: Recombinant aVII, hemorrhagic disorders, effectiveness, thrombotic events.
INTRODUCCIÓN
La demostración de la efectividad del factor VII activado (FVIIa) como agente hemostático fue establecida por Hedner y Kisiel1 en la década de los 80 en pacientes hemofílicos con inhibidores del factor VIII (FVIII). La disponibilidad del FVIIa recombinante (FVIIar; NovoSeven, NovoNordisk, Bagsvaerd, Dinamarca) permitió un uso más generalizado en estos pacientes,2 lo que determinó que en la actualidad se considere el tratamiento de elección durante los episodios hemorrágicos en paciente hemofílicos con inhibidores.
Aunque las indicaciones del FVIIar aprobadas son relativamente limitadas, este producto ha sido utilizado no solo en pacientes hemofílicos con inhibidores y sin estos,3 sino también en múltiples trastornos de la hemostasia congénitos y adquiridos, y en general, en pacientes con sangramientos no controlables con las medidas terapéuticas habituales.4-7
Las consecuencias que resultan del tratamiento convencional de los episodios hemorrágicos graves con cristaloides, coloides y productos de la sangre, en ocasiones provocan un incremento de la coagulopatía y un riesgo potencial de transmisión de agentes infecciosos, lo que ha sugerido la necesidad de un esquema terapéutico que pudiera complementar el tratamiento del sangramiento grave. Para Hoffman,8 el FVIIar pudiera ser de utilidad como sustituto o suplemento de la transfusión de productos de la sangre en pacientes con sangramientos severos.
En esta revisión solo abordaremos el tratamiento del concentrado de FVIIar en pacientes no hemofílicos.
MECANISMO DE ACCIÓN
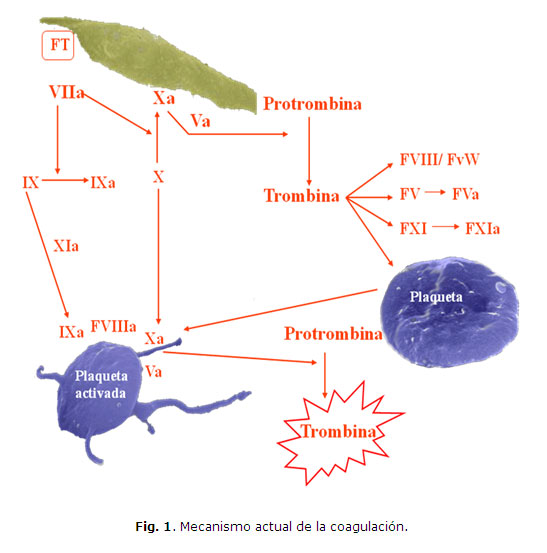
Se conoce que durante el mecanismo hemostático el FVIIa se une con el factor tisular (FT) sobre la superficie celular en el sitio de daño vascular (Fig. 1). El complejo FT/FVIIa activa al factor X (FX) y al factor IX (FIX). El complejo FXa-factor Va (FVa) actúa sobre la protrombina, lo que resulta en la generación de una cantidad de trombina, que aunque pequeña, es suficiente para liberar el FVIII del factor von Willebrand (FvW), activar los factores V y XI y lo más relevante, provocar la activación plaquetaria.
Por otra parte, el inhibidor de la vía del FT (IVFT) no tiene acción sobre el FIX, por lo que este se sitúa sobre la superficie de las plaquetas activadas donde se une con el FVIII para generar FXa, que en presencia del FVa contribuye a la formación del complejo protrombinasa, lo que determina la formación de grandes cantidades de trombina que son las responsables de la conversión del fibrinógeno en fibrina. La trombina, además, tiene una acción protectora del coagulo a través de la activación del inhibidor de la fibrinólisis activado por trombina (TAFI) (Fig. 2).9,10
Se ha demostrado que las altas concentraciones de FVIIa, solo alcanzadas por dosis farmacológicas de FVIIar, pueden convertir directamente el FX a FXa sobre la superficie de las plaquetas activadas sin la presencia del FVIIIa o FIXa, lo que resulta en una generación explosiva de trombina que, aunque menor que la normal, es suficientemente rápida y en cantidades adecuadas para alcanzar un alto grado de eficacia en el tratamiento de pacientes hemofílicos A y B.11 Se considera que el mecanismo de acción más importante del FVIIar es su posibilidad de unirse con las plaquetas activadas y activar directamente al FX en ausencia del FT. Es necesario señalar que el FVIIar no se une con las plaquetas en reposo, por lo que su efecto se localiza en los sitios de daño vascular.12,13 Otra acción del FVIIar recientemente descrita es su influencia sobre la estabilización del coágulo a través de la activación del TAFI.11
FARMACOCINÉTICA
Se ha observado que el aclaramiento del FVIIar en adultos normales es de alrededor de 33 mL/kg/h14 y la vida media de 2,72 horas,15 que ambos son independientes de la dosis utilizada y que existe una amplia variabilidad intrapacientes.16 En estudios realizados en niños se encontró una vida media más corta, de alrededor de 1,32 horas, lo que se corresponde con un aclaramiento más rápido del producto.17 Estas diferencias en los parámetros farmacocinéticos entre niños y adultos sugieren que podrían ser necesarias dosis mayores en la edad pediátrica.
USO DEL FVIIar EN TRASTORNOS HEREDITARIOS DE LA COAGULACIÓN
El FVIIar ha mostrado su eficacia en el tratamiento de episodios hemorrágicos en pacientes con trastornos hereditarios de la coagulación distintos de la hemofilia, como son: el déficit congénito de factor VII, el déficit congénito de factor X, el déficit congénito de factor XI, y la enfermedad de von Willebrand.
En el caso de pacientes con déficit congénito de FVII, se ha demostrado que dosis relativamente bajas, entre 20 y 30 µg/kg cada 2 o 3 horas son suficientes para detener el sangramiento, ya que estos pacientes tienen niveles normales de factores VIII y IX y son capaces de generar una cantidad normal de trombina, una vez que el mecanismo de la coagulación se haya iniciado por la infusión de estas dosis de FVIIar.18-20 También en algunos casos de déficit de FX ha sido efectiva la administración del FVIIar.
Publicaciones anecdóticas han comunicado el uso efectivo del concentrado de FVIIar en pacientes con enfermedad de von Willebrand (EvW) tipo 3 y en casos con anticuerpos al FvW,21 así como pacientes con déficit de FXI con inhibidores y sin estos.22
USO DEL FVIIar EN TRASTORNOS PLAQUETARIOS
Entre los trastornos plaquetarios en que se ha usado el Factor VII activado están, por un lado, las trombocitopatías tales como la enfermedad de Glanzmann, el síndrome de Bernard-Soulier y el síndrome de Hermansky-Pudlak; y por otro lado, las trombocitopenias.
El primer trastorno en que se aprobó el uso de FVIIar después de la hemofilia fue en la tromboastenia de Glanzmann, particularmente en aquellos pacientes con episodios hemorrágicos y anticuerpos a la GPIIb/IIIa y por lo tanto, refractarios a la infusión de plaquetas.23 Esta situación constituye un verdadero reto terapéutico y hasta ahora el tratamiento con concentrado de FVIIar es probablemente la única posibilidad para lograr el control del sangramiento en pacientes con enfermedad de Glanzmann refractarios al uso de plaquetas. En una serie de pacientes fue efectivo en el 48 % de los casos.24
El tratamiento con FVIIar también ha sido recomendado en otras trombocitopatías hereditarias como el síndrome de Bernard-Soulier.25 Se ha sugerido que este producto es capaz de promover la adhesión de las plaquetas al sitio del daño vascular aún en el caso que presenten algún defecto funcional, debido a un aumento local de la generación de trombina.26 Del Pozo y otros,27 utilizaron exitosamente el FVIIar asociado con concentrado de plaquetas en un paciente con síndrome de Hermansky-Pudlak que fue sometido a una tiroidectomía. Una de las indicaciones del FVIIar más controvertidas es quizás su uso en pacientes con trombocitopenia, si consideramos el papel central de las plaquetas en su mecanismo de acción. Sin embargo, ha sido utilizado con éxito en pacientes con disminución marcada de plaquetas.28-30 Aunque se desconoce la concentración plaquetaria mínima necesaria para detener el sangramiento, algunos autores han logrado aumentar la eficiencia del FVIIar con la utilización de dosis más altas en pacientes con trombocitopenia hasta de 1 × 109/L. Estos resultados concuerdan con los hallazgos de Kjalke y otros31 en un modelo in vitro basado en células en que demostraron que dosis altas de FVIIar aumentaban la generación de trombina en condiciones de trombocitopenia.
USO DEL FVIIar EN TRASTORNOS HEPÁTICOS
Las manifestaciones hemorrágicas en pacientes con hepatopatías graves son en ocasiones de difícil control con el tratamiento sustitutivo habitual, particularmente los sangramientos profusos por várices esofágicas y durante el trasplante hepático. El tratamiento profiláctico para procederes invasivos, en especial la biopsia hepática, es otra situación en algunos casos no resuelta con la terapéutica sustitutiva con plasma fresco congelado (PFC).
El hallazgo de que la infusión de FVIIar normalizaba el tiempo de protrombina (TP) en pacientes con cirrosis hepática, propició su uso en enfermos con hepatopatías graves y varices esofágicas.32 La dosis utilizada en estos casos ha sido variable (5-120 µg/kg), y aunque la respuesta al tratamiento fue en general efectiva, se han comunicado fracasos sobre todo por sangramientos recurrentes. Es un hecho demostrado que la infusión de FVIIar es más efectiva que el PFC solo y que los mejores resultados se obtienen con el uso de ambos productos.33
Otro de los usos del FVIIar es el tratamiento profiláctico en pacientes con trastornos de la coagulación por hepatopatía crónica que van a ser sometidos a biopsia hepática u otro proceder invasivo en los que ha fracasado la terapéutica sustitutiva clásica. Se ha observado que al menos el 74 % de los pacientes tratados con FVIIar han alcanzado una hemostasia adecuada para este tipo de proceder.34
El uso del concentrado de FVIIar en el trasplante hepático es aún muy controvertido, ya que los ensayos clínicos han mostrado resultados contradictorios. Según los hallazgos de un grupo de investigadores, la infusión de FVIIar reduce los requerimientos transfusionales en pacientes sometidos a trasplante hepático.35-37 Sin embargo, otros autores no hallaron diferencias significativas entre el FVIIar y el placebo en este tipo de enfermo.38,39
USO DEL FVIIar EN PROCESOS QUIRÚRGICOS
Las intervenciones quirúrgicas son, sin duda, situaciones en las que los eventos hemorrágicos graves son frecuentes. La administración del FVIIar ha sido ensayada con éxito durante complicaciones hemorrágicas en múltiples procesos quirúrgicos, en particular en cirugía cardíaca.40-42 Diprose y otros,43 con el uso de una sola dosis de 90 µg/kg de FVIIar después de la terminación de la derivación bypass cardiopulmonar y la administración de sulfato de protamina para revertir la acción de la heparina, hallaron una disminución significativa de los requerimientos transfusionales. Sin embargo, Ekert y otros,4 con varias dosis de 40 µg/kg no lograron disminuir la pérdida de sangre y las transfusiones en pacientes sometidos a este mismo proceder. Es por ello que a pesar del número importante de comunicaciones que sugieren la eficacia del FVIIar, algunos autores consideran que no es efectivo en todos los casos.45
El FVIIar se ha utilizado en complicaciones hemorrágicas durante otros procederes quirúrgicos. En un ensayo a doble ciegas en pacientes sometidos a prostatectomía retropúbica, se demostró que con dosis de 40 µg/kg no fue necesario el uso de transfusión de eritrocitos.46
De manera anecdótica se ha señalado la efectividad de la infusión de FVIIar en una variedad de procederes quirúrgicos, entre ellos, la cirugía reconstructiva,47 el trasplante renal48 y la cirugía pélvica,49 no obstante, no siempre se ha obtenido una respuesta efectiva. Raobaikady y otros,50 no encontraron diferencias significativas en relación con la pérdida de sangre y requerimientos transfusionales en pacientes sometidos a reparación acetábulo pelviana tratados con 90 µg/kg de FVIIar y aquellos en que se utilizó placebo.
USO DEL FVIIar EN TRASTORNOS HEMORRÁGICOS
Este factor se ha utilizado en diferentes condiciones hemorrágicas:
• Sangramiento intracraneal.
• Sangramiento por traumatismos.
• Sangramiento secundario a anticoagulantes.
• Sangramiento gastrointestinal.
• Hemorragia post partum.
• Trasplante de médula ósea.
• Coagulación intravascular diseminada.
• Dengue hemorrágico.
• Hemorragia alveolar difusa.
• Quemaduras extensas.
• Anomalías vasculares.
• Insuficiencia renal.
Hemorragia intracraneal
Los resultados del uso del FVIIar en la hemorragia intracraneal han sido contradictorios, probablemente por el escaso número de ensayos clínicos aleatorios y de pacientes estudiados.
Algunos autores no han obtenido una respuesta eficaz en ensayos con un reducido número de casos.51,52 Sin embargo, en ensayos controlados con una cantidad mayor de pacientes, se muestran evidencias que el tratamiento con FVIIar dentro de las 4 horas después del comienzo del sangramiento, limita el crecimiento del hematoma, lo que influye de manera relevante en la evolución clínica de estos enfermos, ya que se ha demostrado que el crecimiento del hematoma está relacionado con un pronóstico más grave y aumento de la mortalidad.53-55
Por traumatismos:
Dos causas esenciales provocan el sangramiento profuso secundario a trauma: la hemorragia en el sitio de la herida y los trastornos de la coagulación que se producen después del trauma y que están presentes entre el 25 y el 36 % de los pacientes a su llegada al hospital.56 Se considera que esta hemorragia postraumática secundaria a la coagulopatía, es la causa principal de mortalidad en pacientes con traumatismo severo y su naturaleza es multifactorial, donde tienen un papel importante la hemodilución, consecuencia de la infusión de grandes volúmenes de cristaloides, coloides y productos de la sangre, y que no solo está influida por el volumen transfundido, sino también por el tipo de fluido utilizado, y que se expresa por la presencia de trombocitopenia y disminución de factores e inhibidores de la coagulación,57 la hipotermia que provoca disfunción plaquetaria, trastornos de la coagulación e hiperfibrinólisis,58 y la acidosis resultante de una disminución de la perfusión y la acumulación de ácido láctico. Se ha demostrado que un pequeño descenso en el pH lesiona la función de las plaquetas y de las enzimas de la coagulación, particularmente en presencia de hipotermia.59
Kenet y colaboradores60 publicaron el primer caso con traumatismo severo por herida de arma de fuego en el abdomen tratado exitosamente con FVIIar. A partir de ese momento, se han realizado múltiples ensayos clínicos con el uso de este producto en pacientes con trauma grave. Martinowitz y colaboradores61 lograron el control del sangramiento en pacientes que sufrieron trauma severo con la administración de 1 a 3 dosis de FVIIar en el 79 % de los casos. Otros autores han obtenido resultados similares.62
Pacientes con tratamiento anticoagulante
La posibilidad de controlar el sangramiento con FVIIar en pacientes tratados con antagonistas de la vitamina K, está avalada por los resultados de estudios que demuestran que el FVIIar es capaz de normalizar el TP y el INR en voluntarios sanos con disminución de factores dependientes de la vitamina K por la administración de acenocumarol,63 y que las dosis entre 15-90 µg/kg de FVIIar provocan un marcado acortamiento del TP en pacientes con intoxicación warfarínica.64
Con la asociación de FVIIar a dosis entre 30 y 135 µg/kg, vitamina K y PFC se logró una rápida corrección del INR en pacientes con hemorragia intracraneal asociada con warfarina.65
Se ha señalado que la infusión de FVIIar podría ser de utilidad en el control de episodios hemorrágicos no solo en pacientes anticoagulados con antivitaminas K, sino también con heparina no fraccionada y de bajo peso molecular,66 Sin embargo, Wolzt y otros,67 no lograron incrementar la generación de trombina en voluntarios sanos tratados con melagatran, probablemente debido a que este medicamento es un inhibidor directo de la trombina.
Otras complicaciones hemorrágicas
En los últimos años se han acumulado un número importante de comunicaciones, muchas de ellas con carácter anecdótico, sobre el uso del FVIIar en el control de sangramientos masivos en una variedad de condiciones clínicas, particularmente cuando otras medidas han fracasado.
Se ha señalado que en pacientes con sangramiento gastrointestinal la administración de FVIIar es efectiva si se asocia con la terapéutica sustitutiva tradicional.68
La hemorragia posparto constituye una de las causas principales de muerte materna. Varios autores han sugerido que el tratamiento con FVIIar pudiera ser efectivo en estas pacientes.69,70
Los resultados del uso del FVIIar en las complicaciones hemorrágicas después del trasplante de médula ósea o de células progenitoras hematopoyéticas ha sido muy variable. Karimi y otros71 obtuvieron una respuesta excelente en 2 pacientes con cistitis hemorrágica intratable por ciclofosfamida después del trasplante alogénico de médula ósea. Sin embargo, Pihusch y otros 72 no encontraron diferencia significativa en relación con el sangramiento y los requerimientos transfusionales en 100 pacientes después del trasplante de células progenitoras hematopoyéticas con varias dosis del producto.
La indicación del FVIIar en pacientes con coagulación intravascular diseminada (CID) y sangramientos profusos ha sido muy discutida. Algunos autores consideran que no debe utilizarse en estos pacientes, ya que la CID está asociada con la exposición del FT mediada por citoquinas,73 por lo que podría teóricamente provocar un desarrollo ulterior de trombosis intravascular. Sin embargo, como ya hemos señalado anteriormente, el FVIIar puede contribuir a la generación de trombina por un mecanismo independiente del FT y activar el FX directamente sobre la superficie de las plaquetas en el sitio del daño vascular, por lo que es poco probable la activación sistémica de la coagulación. Por otra parte, no se han observado eventos adversos en pacientes con CID en los que se ha logrado detener el sangramiento con la administración de FVIIar.74
Chuansumrit y otros,75 observaron que la infusión de FVIIar en un grupo de niños con dengue hemorrágico logró mejorar la hemostasia en comparación con los pacientes a los que se les administró un placebo. Sin embargo, las transfusiones de eritrocitos y plasma no disminuyeron.
El FVIIar ha sido utilizado durante episodios hemorrágicos en una gran variedad de trastornos, tales como hemorragia alveolar difusa,76 quemaduras extensas,77 tratamiento de anomalías vasculares78 y sangramientos en la insuficiencia renal.79
CONTROL DE LABORATORIO
En la actualidad, el mejor indicador de la eficiencia del tratamiento con FVIIar es la detención del sangramiento.6 El acortamiento del TP y del tiempo parcial de tromboplastina activado (TPTA) no es una expresión fidedigna de la eficacia del tratamiento. Otros métodos están en proceso de evaluación para determinar el efecto del FVIIar, entre ellos la tromboelastografia rotacional y la generación de trombina.80
REACCIONES ADVERSAS
El FVIIar es un agente con potente actividad procoagulante, por lo que teóricamente podría tener un riesgo potencial de desencadenar eventos tromboembólicos. Sin embargo, los datos acumulados en más de 1 000 pacientes no hemofílicos, obtenidos de varios estudios, demuestran que no existe diferencia significativa en cuanto al desarrollo de trombosis entre pacientes tratados con FVIIar y aquellos en que se administró un placebo.6
Los resultados obtenidos en una serie de pacientes mostraron una incidencia de eventos trombóticos entre el 1 y el 2 % de los pacientes tratados con el producto. Es importante señalar que en la mayoría de los casos estaban presentes otros factores de riesgo que podrían tener alguna influencia en el desarrollo de complicaciones trombóticas.81 Estos resultados apoyan el criterio de que pacientes con alteraciones de la hemostasia, sin otro factor de riesgo trombótico asociado, tienen una menor tendencia a los eventos tromboembólicos con la administración de FVIIar que aquellos que presentan otros trastornos que propicien estas complicaciones, tales como diabetes mellitus, obesidad y enfermedad cardiovascular.82 Se ha demostrado que el desarrollo de trombosis no está relacionado con la dosis utilizada.34
Por otra parte, la presencia de inhibidores del FVII solo ha sido observada en pacientes con déficit congénito de FVII.68
Los efectos adversos leves como dolor en el sitio de la infusión, cefalea, vómitos, fiebre y reacciones cutáneas por hipersensibilidad al producto, son extremadamente raros.
A modo de conclusión, puede considerarse que el concentrado de FVIIar no es un tratamiento de primera línea en casos con manifestaciones hemorrágicas graves y que solo debe ser utilizado en pacientes rescatables con hemorragia masiva, cuando la terapéutica inicial con remplazo de productos de la sangre y medidas quirúrgicas apropiadas han fracasado en controlar el sangramiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Hedner V, Kisiel W. Use of human factor VIIa in the treatment of two hemophilia A patients with high-titer inhibitors. J Clin Invest 1983;71:1836-41.
2. Hedner V, Glazer S, Pingel K, Alberts KA, Blomback M, et al. Succesful use of recombinant factor VIIa in a patient with severe hemophilia A during synovectomy. Lancet 1988;2:1193.
3. Lusher JM, Roberts HR, Davignon G, Joist JH, Smith H, et al. A randomized, double-blind comparison of two storage levels of recombinant factor VIIa in the treatment of joint, muscle and mucocutaneous haemorrhages in persons with haemophilia A and B with and without inhibitors. rFVIIa study group. Haemophilia 1998;4:790-8.
4. Weiskopf RB. Recombinant-activated coagulation factor VIIa (Novo Seven®): Current development. Vox Sang 2007;92:281-8.
5. Vlot JA, Ton E, Machaag AJC, Kramer MHH, Gaillard CAJ. Treatment of a severely bleeding patient without preexisting coagulopathy with activated recombinant factor VII. Am J Med 2000;108:421-2.
6. Marhnowitz V, Michaelson M. The Israeli multidisciplinary rFIIa task forcé. Guidelines for the use of recombinant activated factor VII (r FVIIa) in uncontrolled bleeding: A report by the Israeli multidisciplinary rFVIIa task force. J Thromb Haemost 2005;3:640-8.
7. Hedner V. Recombinant factor VIIa: Its background, development and clinical use. Curr Opin Hematol 2007;9:225-9.
8. Hoffman M. The potential role of factor VIIa in transfusion medicine. TAJM 2003;5 (Supp 5):20-2.
9. Roberts HR, Monroe DM, Escobar MA. Current concepts of hemostasis implication for therapy. Anesthesiology 2004;100:722-30.
10. Hoffman M. A cell-based model of coagulation and the role of factor VIIa. Blood Rev 2003;17(Supp 1):51-5.
11. Lisman T, De Groot PG. Mechanism of action of recombinant factor VIIa. Thromb Haemost 2003;1:1138-9.
12. Levi M, Peters M, Buller HR. Efficacy and safety of recombinant factor VIIa for treatment of severe bleeding: A systematic review. Crit Care Med 2005;33:883-90.
13. Gabriel DA, Li X, Monroe DM, Roberts HR. Recombinant human factor VIIa (rFVIIa) with activated factor IX on activated platelets. J Thromb Haemost 2004;2:1816-22.
14. Fridberg MJ, Hedner V, Roberts HR, Erhardtsen E. A stuy of the pharmacokinetics and safety of recombinant activated factor VII in healthy Caucasian and Japanese subjects. Blood Coagul Fibrinolysis 2005;16:259-66.
15. Lindley CM, Sawyer WT, Masik BG, Lusher J, Harrison JF, et al. Pharmacokinetics and pharmacodynamics of recombinant factor VIIa. Clin Pharmacol Ther 1994;55:638-48.
16. Abshire T, Kent G. Recombinant factor VIIa: Review of efficacy dosing regimens and safety in patients with congenital and acquired factor VIII or IX inhibitors. J Thromb Haemost 2004;2:899-909.
17. Hedner V, Kristesen HL, Berntrop E. Pharmacokinetis of FVIIa in children. Haemophilia 1998;4:224a.
18. Poon MC. Use of recombinat factor VIIa in hereditary bleeding disorders. Curr Opin Hematol 2001;8:312-8.
19. Mariani G, Testa MG, Paolantonio T. Use of recombinant activated factor VII in the treatment of congenital factor VII deficiencies. Vox Sang 1999;77:131-6.
20. Canatan D, Eren E, Ozguner IF, Duman H, Eren C, et al. Activated factor VII in the circumcision operation in the case to a congenital FVII deficiency. Blood Coagul Fibrinolysis 2007;18:375-6.
21. Ciavarella N, Schkroni M, Valenzano E, Mangini F, Inchigolo F. Use of recombinant factor VIIa (Novoseven) in the treatment of two patients with type III von Willebrand's disease and an inhibitor against von Willebrand factor. Haemostasis 1996;26(suppl1):150-4.
22. Roberts HR, Monroe DM, White GC. The use of recombinant factor VIIa in the treatment of bleeding disorders. Blood 2004;104:3858-64.
23. Poon MC, D'Diron R, von Depka M. Prophylactic and therapeutic recombinant factor VIIa administration to patient with Glanzmann's thrombasthenia: Results of an international survey. J Thromb Haemost 2004;2:1096-103.
24. Almeida AM, Khair K, Hann I, Liesner R. The use of recombiant factor VIIa in children with inherited platelet function disorders. Br J Haematol 2003;121:477-81.
25. Peters M, Heijboer H. Treatment of a patient with Bernard-Soulier síndrome and recurrent nose bleeds with recombinant factor VIIa. Thromb Haemost 1998;80:352.
26. Lisman T, Moschatsis S, Adelmeijer J, Nieuwenhuis HK, De Groot PG. Recombinant factor VIIa enhances deposition of platelets with congenital or acquired alpha IIb beta 3 deficiency to endotelial cell matrix and collagen under conditions of flow via tissue factor-independent thrombin generation. Blood 2002;101:1864-70.
27. Del Pozo AL, Jiménez-Yuste V, Villar A, Quintana M, Hernández-Navarro F. Succesful thyroidectomy in a patient with Hermansky-Pudlack síndrome treated with recombinant activated factor VII and platelet concentrates. Blood Coagul Fibrinolysis 2002;13:551-3.
28. Gerotziagas GT, Zervas, C, Garriehdis G, Tokmaktsis A, Hatjiharissi E, et al. Effective hemostasis with rFVIIa treatment in two patients with severe thrombocytopenia and life-threatening hemorrhage. Am J Haemat 2002;69:219-22.
29. Culligan DJ, Salamar A, Tait J, Wostland G, Watson HG. Use of recombinant factor VIIa in life-threatening bleeding following autologous peripheral blood stem cell transplantation complicated by platelet refractoriness. Bone Marrow Transp 2003;1:1183-4.
30. Savani BN, Dunbar CE, Rick ME. Combination therapy with rFVIIa and platelets for hemorrhage in patients with severe thrombocytopenia and alloimmunization. Am J Hematol 2006;81:218-9.
31. Kjalke M, Ezban M, Monroe DM, Hoffman M, Roberts HR, et al. High-dose factor VIIa increase initial thrombin generation and mediates faster platelet activation in thrombocytopenia-like conditions in a cell-based model system. Br J Haematol 2001;114:114-20.
32. Ejlersen E, Melsen T, Ingerslev J, Andersen RB, Vitstrup H. Recombinant activated factor VII (rFVIIa) acutely normalizes prothrombin time in patients with cirrosis during bleeding from oesophageal varices. Scand J Gastroenterol 2001;36:1081-5.
33. Caldwell SH, Chang C, Macik BG. Recombinant activated factor VII (rFVIIa) as a hemostatic agent in liver disease: A break from convention in need of controled trials. Hepatology 2004;39:592-8.
34. Roberts HR, Monroe DM, White GC. The use of recombinant factor VIIa in the treatment of bleeding disorders. Blood 2004;104:3858-64.
35. Hendriks HG, Meijer K, de Wolf JJ, Klompmaker IJ, Porter RJ, et al. Reduced transfusion requirements by recombinant factor VIIa in orthotopic liver transplantation: A pilot study. Transplatation 2001;71:402-5.
36. Porte RJ, Cadwell SH. The role of recombinant factor VIIa in liver transplantation Liver Transpl 2005;11:872-4.
37. Niemann CV, Behrends M, Quan D, Eilers H, Gropper MA, et al. Recombinant factor VIIa reduces transfusion requirements in liver transplant patients with high MELD scores. Transf Med 2006;16:93-100.
38. Planisic RM, van der Meer J, Testa G, Grande L, Candela A, et al. Safety and efficacy of a single bolus administration of recombinant factor VIIa in liver transplantation due to chronic liver disease. Liver Transpl 2005;11:895-900.
39. Lodge JP, Jonas S, Jones RM, Olausson M, Mir-Pallardo J, et al. Efficacy and safety of repeated perioperative doses of recombinant factor VIIa in liver transplantation. Liver Transpl 2005;11:973-9.
40. Tobias JD, Berkenbosch JW, Russo P. Recombinant factor VIIa to treat bleeding after cardiac surgery in an infant. Pedriatr Crit Care Med 2003;4:49-51.
41. Bishop CV, Renwick WE, Hogan C, Haeusler M, Tuckfield A, et al. Recombinant activated factor VII: Treating post-operative hemorrhage in cardiac surgery. Ann Thorac Surg 2006;81:875-9.
42. Romagnoli S, Bevilaque S, Gelsomino S, Pradella S, Ghill C, et al. Small-dose recombinant activated factor VII (Novoseven) in cardiac surgery. Anesth Analg 2006;102:1320-6.
43. Diprose P, Herbertson MJ, O'Shaughnessy D, Gill RS. Activated factor VII after cardiopulmonary bypass reduces allogeneic transfusión in complex non-coronary cardiac surgery: Randomized double-blind placebo-controlled pilot study. Br J Anesth 2005;95:596-602.
44. Ekert H, Brizard C, Eyers R, Cochrane A, Henning R. Elective administration in infants of low-dose recombinant activated factor VII (rFVIIa) in cardiopulmonary bypass surgery for congenital heart disease does not shorten time to chest closure or reduce blood loss and need for transfusions: A randomized, double-blind, parallel group, placebo-controlled study of rFVIIa and standard haemostatic replacement therapy versus standard haemostatic replacement therapy. Blood Coagul Fibrinol 2006;17:389-95.
45. Dietrich W, Spannagl M. Caveat against the use of activated recombinant factor VII for intractable bleeding in cardiac surgery. Anesth Analg 2002;94:1369-70.
46. Friederich PN, Henny CP, Messlink EJ, Grerdink MG, Keller T, et al. Effect of recombinant activated factor VII on perioperative blood loss in patients undergoing retropubic prostatectomy: A double-blind placebo controlled randomized trial. Lancet 2003;361:201-5.
47. Waner M. Novel hemostatic alternatives in reconstructive surgery. Semin Hematol 2004;41:163-7.
48. Gielen-Wijffels SE, van Mook WN, van der Geest S, Ramsay G. Successful treatment of severe bleeding with recombinant factor VIIa after kidney transplantation. Intensive Care Med 2004;30:1232-4.
49. Danilos J, Goral A, Paluszkiewicz P, Przesmyck K, Kotarski J. Successful treatment with recombinant factor VIIa for intractable bleeding at pelvic surgery. Obstet Gynecol 2003;101:1172-3.
50. Raobaikady R, Redman J, Ball JA, Maloney G, Grounds RM. Use of activated recombinant coagulation factor VII in patients undergoing reconstruction surgery for traumatic fracture of pelvis or pelvis and acetabulum: A double-blind, randomized, placebo controlled trial. Br J Anaesth 2005;94:586-91.
51. Mayer SA, Brun NC, Broderick J, Davis S, Diringer MN, et al. Safety and feasibility of recombinant factor VIIa for acute intracerebral hemorrhage. Stroke 2005;36:74-9.
52. Mayer SA, Brun NC, Broderick J, Davis S, Diringer MN, et al. Recombinant activated intracerebral hemorrhage vs phase IIA trial. Neurocrit Care 2006;4:206-14.
53. Pérez-Álvarez F, Serra C, Macía J, Mayol C. FVII for pediatric acute intracraneal hemorrhage stroke 2007;38:63-4.
54. Davis SM, Begtrup K, Broderick J, Davis S, Steiner T. Recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med 2005;3526:777-85.
55. Steiner T, Diringer MN, Schneider D, Mayer S, Bergtrup K, et al. Dynamics of intraventricular hemorrhage in patients with spontaneous intracerebral hemorrhage: Risk factors, clinical impact and effect of hemostatic therapy with recombinant activated factor VII. Neurosurgery 2006;59:767-74.
56. Brohi K. Acute traumatic coagulopathy. J Trauma 2003;541:1127-30.
57. Wilder DM, Reid TJ, Bakaltcheva IB. Hypertonic resuscitation and blood coagulation: In vitro comparison of several hypertonic solutions for their action on platelets and plasma coagulation. Thromb Res 2002;107:255-61.
58. Watts DD, Trask A, Soeken K, Perdue P, Pols S, et al. Hypothermic coagulopathy in trauma: Effect of varying levels of hypothermia on enzyme speed, platelet function and fibrinolytic activity. J Trauma 1998;44:846-54.
59. Meng ZH, Wolberg AS, Monroe DM, Hoffman M. The effect of temperature and pH on the activity of factor VIIa: Implications for the efficacy of high-dose factor VIIa in hypothermic and acidotic patients. J Trauma 2003;5:886-91.
60. Kenet G, Walden R, Eldad A, Martinowitz V. Treatment of traumatic bleeding with recombinant factor VIIa. Lancet 1999;354:1879.
61. Martinowitz V, Kenet G, Lubetski A, Luboshitz J, Segal E. Possible role of recombinant activated factor VII (rFVIIa) in the control of hemorrhage associated with massive trauma. Can J Anaesth 2002;49:515-20.
62. Dutton RP, Scalea TM. Recombinant factor VIIa for the control of hemorrhage: Early experience in critically ill trauma patients. Can J Anaesth 2003;5:184-8.
63. Erhardtsen E, Nony P, Dechavanne M, Fjrench P, Boissel J,et al. The effect of recombinant factor VIIa (Novoseven) in healthy volunteers receiving acenocoumarol to an international normalized ratio above 20. Blood Coagul Fibrinolysis 1998;9:741-8.
64. DeVeras RA, Kessier CM. Reversal of warfarin-induced excessive anticoagulation with recombinant human factor VIIa concentrate. Ann Intern Med 2002;137:884-8.
65. Goonough J. Utilization of recombinant factor VIIa (rFVIIa) in non-approved settings. En: Education Program Book, Hematology 2004. Am Soc Hematol. San Diego, California; 2004. pp. 466-70.
66. Ingerslev J, Vanek T, Culic S. Use of recombinant factor VIIa for emergency reversal of anticoagulation. J Postgrad Med 2007;53:17-22.
67. Wolzt M, Levi M, Savich TC, Bostrom SJ, Eriksson UG, et al. Effect of recombinant factor VIIa on melagatran-induced inhibition of thrombin generation and platelet activation in healthy volunteers. Thromb Haemost 2004;91:1090-6.
68. Parameswaran R, Shapiro AD. The use of recombinant factor VIIa in gastrointestinal bleeding. TATM 2003;5:23-30.
69. Segal S, Schemesh IY, Blumenthal R, Yoffe B, Laufer N, et al. Treatment of obstetric hemorrhage with recombinant activated factor VIIa (rFVIIa). Arch Gynecol Obstet 2003;268:266-7.
70. Bouwmeester FW, Jonlahoff AR, Verheijen RH, van Beijn HP. Successful treatment of life-threatening post-partum hemorrhage with recombinant activated factor VII. Obstet Gynecol 2003;101:1174-6.
71. Karimi M, Zakerina M, Khojasteh HN, Ramzi M, Ahmad E. Successful treatment of cyclophosphamide induced intractable hemorrhagic cystitis with recombinant factor VIIa after allogenic bone marrow transplantation. J Thromb Haemost 2004;2:1853-5.
72. Pihusch M, Baccigalupo A, Szer J, von Depica S, Pronzinski R, et al. F7 BMT-1360 trial investigators. Recombinant activated factor VII in treatment of bleeding complications following hematopoietic stem cell transplantation. J Thromb Haemost 2005;3:1935-44.
73. Osterud B, Bjorklid E. The tissue factor pathway in disseminated intravascular coagulation. Semin Thromb Hemost 2001;27:605-17.
74. Chuansumrit A, Chantarojanasirit T, Isarangkura P, Teeratkul S, Hongeng S, et al. Recombinant activated factor VII in children with acute bleeding resulting from liver failure and disseminated intravascular coagulation. Blood Coagul Fibrinolysis 2000;11(Suppl 1):5101-5.
75. Chuansumrit A, Wangruangsaid S, Lektrakul Y, Chua MN, Capeding MR, et al. Control of bleeding in children with dengue hemorrhagic fever using recombinant activated factor VII: A randomized, double-blind, placebo-controlled study. Blood Coagul Fibrinolysis 2005;16:549-55.
76. Henke D, Falk RJ, Gabriel PA. Successful treatment of diffuse alveolar hemorrhage with activated factor VII. Ann Intern Med 2004;140:493-4.
77. Bianchi A, Jackson D, Maitz P, Thanakrishnan G. Treatment of bleeding with recombinant factor VIIa in a patient with extensive burns. Thromb Haemost 2004;91:203-4.
78. Buckmiller LM, Richter GT, Waner M, Suen JY. Use of recombinant factor VIIa during excision of vascular anomalies. Laryngoscope 2007;117:604-9.
79. Moisescu E, Ardelean L, Simon I, Moresan A, Liupan R. Recombinant factor VIIa treatment of bleeding associated with acute renal failure. Blood Coagul Fibrinolysis 2000;11:575-7.
80. Gabriel DA, Carr M, Roberts HR. Monitoring coagulation and the clinical effects of recombinant factor VIIa. Semin Hematol 2004;41:20-4.
81. Levi M. Safety of recombinant factor VIIa. TATM 2003;5:11-4.
82. Hedner V. Mechanism of action, development and clinical experience of recombinant FVIIa. J Biotechnol 2006;124:747-57.
Recibido: 28 de enero de 2010.
Aprobado: 2 de febrero de 2010.
DraC. Delfina Almagro Vázquez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. Ciudad de La Habana, Cuba. Tel (537) 643 8695, 643 8268, Fax (537) 644 2334. e-mail: ihidir@hemato.sld.cu Website: http://www.sld.cu/sitios/ihi