Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión On-line ISSN 1818-1686
Fitosanidad v.14 n.1 Ciudad de la Habana ene.-mar. 2010
Control biológico
Glomus intraradices para el control de Meloidogyne incognita (Kofoid & White) Chitwood en condiciones protegidas
Glomus intraradices for the Control of Meloidogyne incognita (Kofoid & White) Chitwood under Protected Conditions
Jairo Cristóbal Alejo,¹ Elizabeth Herrera-Parra,² Vicente Reyes Oregel,¹ Esaú Ruiz Sánchez,¹ José María Tun Suárez¹ y Teresita Celis Rodríguez¹
¹Instituto Tecnológico de Conkal. Km 16.3, Antigua Carretera Mérida-Motul, Conkal, Yucatán, México, C. P. 97345, jairoca54@hotmail.com
²Inifap Campo Experimental Mocochá. Km 25, Antigua Carretera Mérida-Motul, Mocochá, Yucatán, México, C. P. 97454
RESUMEN
Se evaluó el efecto de la aplicación del hongo micorrízico arbuscular Glomus intraradices en plantas de tomate (Lycopersicon esculentum Mill.) cv. Maya. Las variables de reproducción del nematodo estimadas fueron número de agallas por planta_1 (NA), número de hembras por g_1de raíz teñida (NHE) y número de huevos por g_1 de raíz licuada (NHU). Para las plantas, las variables agronómicas de vigor consideradas correspondieron a altura de planta (AP), peso de fruto (PF), peso de raíz (PR), volumen radical (VR) y peso seco de planta (PS). Los análisis de varianza realizados con las variables NA, NHE, AP, PF, PR, VR y PS no mostraron diferencias significativas entre tratamientos. Solo se detectó diferencias entre tratamientos con la variable NHU; sin embargo, el NA fue mayor en el tratamiento testigo sin la inoculación de la micorriza arbuscular Glomus intraradices, con un promedio de 467 agallas por planta. Se observó que conforme se incrementaron las dosis de inóculo del hongo micorrízico, disminuyó la formación de agallas en las plantas. Se obtuvo una diferencia de al menos el 39% menos de formación de agallas en los tratamientos inoculados con el hongo micorrízico.
Palabras claves: agallador, tomate, micorriza, hongos
ABSTRACT
The effects of the inoculation with arbuscular micorrhizal fungus Glomus intraradices on tomato (Lycopersicon esculentum Mill.) cv. Maya were evaluated. Variables related to nematode reproduction such as number of galls per plant_1 (NA), number of females per g-1 of stained root (NF) and number of eggs per g_1 of blended root (NE) were estimated. Plant agronomic variables such as plant height (AH), fruit weight (FW), root weight (RW), root volume (RV) and plant dry weight (DW) were also evaluated. The variance analysis for the variables NA, NF, AH, FW, RW, RV and DW did not show significant differences among treatments. Significant difference was only observed on the variable NE. The variable NA was higher on the control plants with no inoculation of arbuscular micorrhizal Glomus intraradices with an average of 467 root-knots per plant; it was also observed that the plants treated with higher concentration of the inoculum showed lower number of root-knots per plant. In general, it was observed at least 39% lower knot-root formation on plants inoculated with the micorrhizal fungus.
Key words: root-knot, tomato, micorrizha, fungus
INTRODUCCIÓN
El género Meloidogyne integra varias especies importantes para la agricultura. Algunas de sus especies son cosmopolitas, y por sus hábitos polífagos prácticamente parasitan cualquier tipo de cultivo, entre los que se encuentran gramíneas, hortalizas, ornamentales, frutales y forestales, en las que ocasionan considerables pérdidas de producción. Estos fitoparásitos, además de causar daños directos, predisponen a las plantas a la infección por otros fitopatógenos como bacterias, hongos y virus [Agrios, 1998].
La implementación de prácticas agronómicas, como la rotación de cultivos y la aplicación de nematicidas sintéticos, son las principales medidas de control de estos patógenos. En el caso particular de los nematicidas, contaminan el manto freático, y si no se aplican de manera adecuada pueden ocasionar fitotoxicidad en las plantas y seleccionar poblaciones resistentes del nematodo. Estos agroquímicos sintéticos tienen como base compuestos organofosforados o carbamatos que, además de poseer fuerte acción insecticida, algunos actúan de forma sistémica y dan lugar a mayor residualidad en los productos hortícolas.
Con el propósito de tener un control de estos organismos y disminuir efectos posteriores, es necesario disponer de otras alternativas de manejo más compatibles con el ambiente. Una de ellas es la utilización de hongos nativos, los cuales producen metabolitos secundarios con actividad nematostática [Verdejo et al., 2002].
También el uso de hongos micorrízicos arbusculares como Glomus aggregatum, G. mosseae y G. intraradices, que colonizan raíces de diferentes especies vegetales, ocupan sitios de entrada y de alimentación de nematodos, favorecen la disponibilidad de nutrimentos y mejoran el desarrollo de los cultivos donde se utilizan [Habte et al., 1999; Masadeh et al., 2004].
En la presente investigación se estudió el efecto de la aplicación de la micorriza arbuscular G. intraradices contra juveniles del segundo estadio de Meloidogyne incognita, con el propósito de controlar a estos organismos y disminuir los problemas de contaminación y de resistencia inducidos por el uso de nematicidas sintéticos.
MATERIALES Y MÉTODOS
Con el propósito de estimar la capacidad inhibitoria de M. incognita en el cultivo de tomate (Lycopersicon esculentum Mill.) se realizó un experimento en condiciones de invernadero, el cual consistió en la inoculación de plántulas de tomate cv. Maya del tipo Saladette de dos semanas de emergencia, con el hongo micorrízico G. intraradices, en dosis de 0,0; 0,5; 1,0; 1,5 y 2,0 g de inóculo previamente preparado. Cada gramo de inóculo con el hongo consistió de 100 esporas.
El objetivo de la inoculación previa de las plántulas con el hongo micorrízico, antes de su trasplante definitivo, fue para favorecer su invasión al tejido cortical y se favoreciera una colonización definitiva sobre la corteza radical de las plántulas, y tener una protección antes de la invasión de los nematodos.
Para la obtención de M. incognita se realizaron colectas de suelo, obtenidas de cultivos en crecimiento de tomate de la región, los cuales manifestaron síntomas por M. incognita, el suelo se homogenizó y se depositaron dos kilogramos en bolsas negras tipo vivero. Con el fin de asegurar que el nematodo agallador correspondiera a M. incognita, se realizaron cortes perineales de las hembras y se hizo un análisis morfotaxonómico de la población del nematodo para la identificación de la especie[Jepson, 1987].
Posteriormente se procedió a depositar una plántula de tomate micorrizada de un mes de edad, se aplicaron riegos cada segundo día para evitar estrés hídrico. Cada tratamiento tuvo cinco repeticiones, y cada repetición estuvo conformada por diez plantas, distribuidas en un diseño experimental completamente al azar. El experimento concluyó 75 días posteriores al trasplante.
Para estimar la efectividad del hongo micorrízico sobre la supresión de M. incognita se consideraron como variables respuesta el número de agallas por planta, las que se contalibilizaron visualmente, el número de huevos por gramo de raíz licuada y el número de hembras por gramo de raíz teñida, para lo cual se hizo una fragmentación total de la raíz en cada planta; luego se homogenizó y se tomaron 2 g de raíz, uno sirvió para licuarlo durante 11 s con hipoclorito de sodio al 2%. Los huevos se contabilizaron en microscopio compuesto (4X) con ayuda de una cámara cuentanematodos, mientras que el otro gramo se utilizó para teñirlo con fuccina ácida a punto de ebullición durante 10 min. Las raíces teñidas se depositaron en frascos con glicerina al 78% para su posterior disección en microscopio estereoscópico y conteo de hembras adultas [Ayoub, 1977]. Estos parámetros se consideraron indicadores de intensidad de enfermedad e índice de reproducción del nematodo. Paralelamente se estimaron como variables de vigor agronómico, el peso de fruto por planta, su altura, así como el volumen radical, el peso fresco de raíz y la ganancia total de biomasas seca por planta. Con los datos obtenidos se realizaron análisis de varianza. La separación de medias se hizo por el método de Tukey (p = 0,05).
RESULTADOS Y DISCUSIÓN
Los análisis de varianza realizados con las variables peso de fruto, altura de planta, volumen radical, biomasa total seca, número de agallas (NA) y número de hembras (NHE) no mostraron diferencias significativas(p . 0,05) entre tratamientos. Solo se detectó diferencias entre tratamientos con la variable número de huevos por gramo de raíz licuada (NHU), por lo que la comparación múltiple de medias (Tukey p = 0,05) no separó estadísticamente a ningún tratamiento para las variables indicadas, excepto con la NHU.
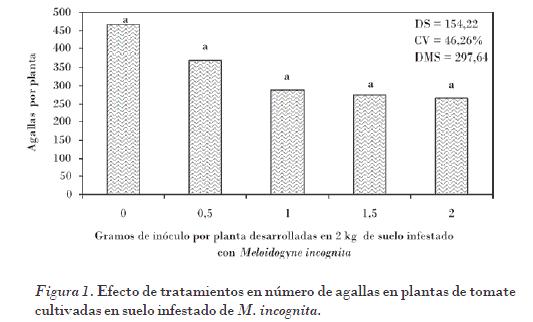
A pesar de no encontrar diferencia significativa entre tratamientos para la mayoría de las variables respuesta estimadas, es importante señalar que el NA fue mayor en el tratamiento testigo sin la inoculación de la micorriza arbuscular G. intraradices, con un promedio de 467 agallas por raíz. También se observó que, conforme se incrementaron las dosis de inóculo del hongo micorrízico, se disminuyó la formación de agallas en las plantas y se obtuvo una diferencia de al menos el 39% menos de formación de agallas en los tratamientos inoculados con el hongo micorrízico (Fig. 1), lo cual demostró su capacidad de colonización y de protección radical del hongo micorrízico en el hospedante y su efecto en la disminución del daño inducido por M. incognita. Esta disminución en la formación de agallas se ha evidenciado por otros reportes relacionados con el uso de hongos micorrízicos [Habte et al., 1999; Zhang et al., 2008], lo cual demuestra en parte la bondad de usar estos organismos como agentes supresivos contra fitonematodos.
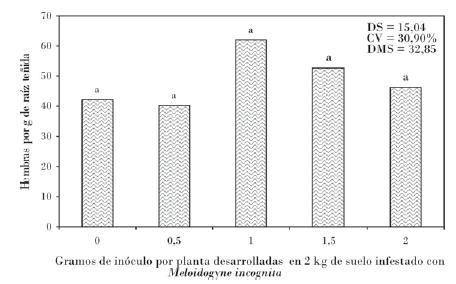
Para el caso de número de hembras obtenidas por gramo de raíz teñida no existió una relación directa entre estas variables de reproducción del nematodo. En este sentido el testigo sin inoculación del hongo micorrízico se encontró en un promedio 42 hembras por gramo de raíz teñida, mientras que con el resto de los tratamientos se estimaron mayor número de hembras en relación con el testigo. Este comportamiento hace suponer que existe mayor funcionalidad de las raíces micorrizadas, por lo que al momento de tomar las muestras para su evaluación mayor, es la cantidad de hembras que se detectan, fenómeno reportado con M. javanica en banano [Pinochet et al., 1997] (Fig. 2).
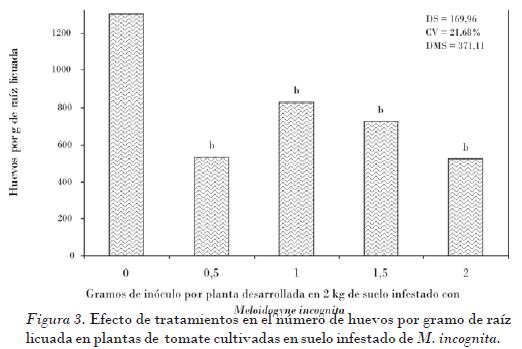
El resultado más significativo y que se consideró la mejor variable para estimar el efecto de tratamientos en el control del nematodo y en el desarrollo de la planta correspondió al número de huevos por gramo de raíz licuada, lo cual coincide con lo obtenido por Masadeh et al. (2004) y Zhang et al. (2008), considerado en este estudio también como estimador de reproducción del nematodo. El testigo sin incorporación de micorrizas permitió hasta 1303 huevos por gramo de raíz licuada, mientras que en el tratamiento con 2 g de micorriza fue de 525 huevos por gramo de raíz licuada, lo cual significó hasta el 40% menos de capacidad reproductiva con tratamientos micorrizados (Fig. 3). El efecto supresor en la producción de huevos se favorece cuando G. intraradices tiene interacción con otros agentes biocontroladores, que en conjunto activan mecanismos de tolerancia del hospedante [Elsen et al., 2001] a las infecciones inducidas por estos fitoparásitos.
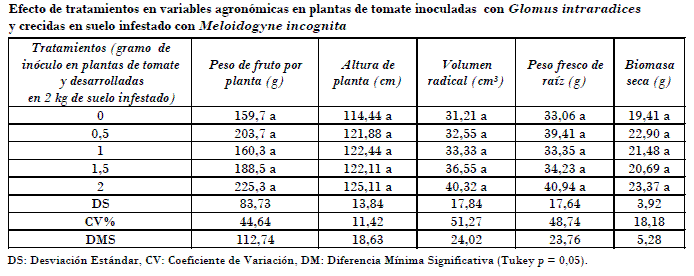
En relación con las variables de vigor o agronómicas, en general no se tuvo diferencia estadística en la comparación de medias (Tukey, p = 0,05), tal y como lo evidenció el análisis de varianza indicado; sin embargo, para algunas variables se observó mejoría en su estimación. Se obtuvo, por ejemplo, para el testigo 159 g de peso de fruto por planta en promedio, mientras que con 2 g de hongo micorrízico 225 g por planta, lo cual representó en este sistema un incremento de al menos el 40% en plantas tratadas previamente con micorrizas.
El mismo comportamiento se observó en la altura de plantas, volumen radical y peso de raíz, en las que, a pesar de no tener separación estadística, se observó la bondad de usar micorrizas como táctica de protección radical fitosanitaria y complemento nutrimental en las plantas inoculadas, mejorando en general el crecimiento radical y aéreo de la planta [Castillo et al., 2006]. El mismo comportamiento se registró con la biomasa seca total de las plantas, en las que las micorrizas aumentaron esta variable respecto al testigo sin inocular (Tabla).
CONCLUSIONES
• Se disminuyó la formación de agallas en plantas inoculadas con Glomus intraradices hasta el 39% en relación con el testigo sin el hongo micorrízico.
• El tratamiento correspondiente a 2 g de inóculo de Glomus intraradices disminuyó hasta el 40% la formación de huevos respecto al testigo sin inoculación de la micorriza, lo cual fue significativo en la reproducción del nematodo.
REFERENCIAS
Agrios, G. N.: Fitopatología, Ed. Limusa, 2.a. ed., México, 1998, pp. 734-741.
Ayoub, M. S.: Plant Nematology an Agricultural Training Aid, Department of Food and Agriculture Division of Plant Industry Laboratory Services Nematology, California, EE. UU., 1977.
Castillo, P.; A. C. Azcón; R. del Rincón; C. Calvet; R. M. Jiménez: «Protection of Olive Planting Stocks Against Parasitism of Root-Knot Nematodes by Arbuscular Mycorrhizal Fungi», Plant Pathology 5:705- 713, EE. UU., 2006.
Elsen, A.; S. Declerck; D. De Waele: «Effects of Glomus intraradices on the Reproduction of the Burrowing Nematode (Radopholus similis) in Dixenic Culture», Mycorrhiza 11:49-51, 2001.
Habte, M.; C. Zhang; D. P. Schimtt: «Effectiveness of Glomus Species in Protecting White Clover Against Nematode Damage», Abstract, Can. Journal Botanic, Canadá, 1999.
Jepson, S. B.: Identification of Root-Knot Nematodes ( Meloidogyne Species), Commonwelth Agricultural Bureau International, Cambrian, News Ltd., Aberystwyth, Inglaterra, 1987.
Masadeh, B.; H. von Alten; S. G. Grunewaldt; R. A. Sikora: «Biocontrol of Root-Knot Nematodes Using the Arbuscular Mycorrizal Fungus Glomus intraradices and the Antagonist Trichoderma viride in Two Tomato Cultivars Differing in Their Suitability as Hosts for the Nematodes», Journal of Plant Diseases and Protection 111 (4):322- 333, Alemania, 2004.
Pinochet, J.; C. Fernández; M. Jaizme; P. Tenoury: «Micropropageted Banana Infected with Meloidogyne javanica Responds to Glomus intraradices and Phosphorus», HortScience 32:101-103, EE. UU., 1997.
Verdejo, L. S.; C. Ornat; F. J. Sorbías; A. Stchiegel: «Species of Root- Knot Nematodes and Fungal Eggs Parasites Recovered from Vegetables in Almería and Barcelona, Spain», Journal of Nematology 2:1-2, EE. UU., 2002.
Zhang, L.; J. Zhang; P. Christie; X. Li: «Pre-inoculation with Arbscular Mycorrhizal Fungi Supresses Root Knot Nematode ( Meloidogyne incognita) on Cucumber (Cucumis sativus)», Biol. Fertil Soils 45:205-211, Alemania, 2008.