Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.3 Ciudad de la Habana jul.-sep. 2010
ARTÍCULOS ORIGINALES
Evaluación de desempeño del método de ensayo de disolución para tabletas de zidovudina 300 mg producidas en Cuba
Performance assessment of dissolution assay method of 300 mg of Zidovudine tablets produced in Cuba
Caridad Margarita García PeñaI; Rafael León RodríguezII; Mirna Fernández CerveraIII; Sergio Ibáñez CalvoIV: Vivian Martínez EspinosaV
IMáster en Tecnología y Control de Medicamentos. Investigadora Agregada. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IILicenciado en Química. Investigador Auxiliar. CIDEM. La Habana, Cuba.
IIIDoctora en Ciencias. Instituto de Farmacia y Alimentos (IFAL). La Habana, Cuba.
IVMáster en Tecnología y Control de Medicamentos. Laboratorios NOVATEC. La Habana, Cuba.
VTécnico Medio en Química. CIDEM. La Habana, Cuba.
RESUMEN
Se validó un método por cromatografía líquida de alta resolución para evaluar la disolución de las tabletas de zidovudina 300 mg producidas en Cuba, con detección ultravioleta a 265 nm. Se evaluaron los parámetros de especificidad, linealidad, precisión e influencia de la filtración. En el estudio de la influencia de la filtración se demostró que a través del filtro de línea, no se absorbe el principio activo, ni se aportan interferencias al filtrado, por lo que se recomienda su empleo. Se demostró la especificidad del método al no observarse interferencias de los excipientes de la formulación, en la determinación del principio activo. La curva de linealidad se realizó en el intervalo de concentraciones estudiadas con un coeficiente de correlación igual a 0,999. El método resultó preciso ya que los valores se encontraron dentro de los límites establecidos. Se realizó además la comparación estadística de los perfiles de disolución de las tabletas producidas en Cuba contra el Retrovir® (medicamento líder), lo cual demostró que existe similitud entre el perfil de liberación de las formulaciones.
Palabras clave: Zidovudina, validación, ensayo de disolución.
ABSTRACT
A high-performance liquid chromatography method was validated to assess the dissolution of 300 mg Zidovudine tablets manufactured in Cuba with 265 nm ultraviolet (UV) detection. Filtration specificity, linearity, accuracy parameters were assessed. In influence filtration study it was shown that through the line-filter the active principle it isn't absorbed and without filtrate interferences thus it is recommended its use. It was possible to demonstrate the method specificity due to no interferences of the formula excipients in active principle assessment. Linearity curve was drawed in the interval of study concentrations with a correlation coefficient similar to 0.999. The method was precise since the values were within the established limits. Also, we made a statistical comparison of dissolution profiles of tablets manufactured in Cuba versus Retrovir® (leading drug) demonstrating that there is a similarity between the formulas release profile.
Key words: Zidovudine, validation, dissolution trial.
INTRODUCCIÓN
La zidovudina es un agente antiviral (antirretroviral), análogo de nucleósidos, de acción virostática selectiva y altamente activo in vivo contra retrovirus, entre los que se incluye el virus de la Inmunodeficiencia Humana (VIH).1,2
El ensayo de disolución constituye uno de los estudios más importantes en el desarrollo de una forma farmacéutica sólida oral. Permite evaluar los procesos de fabricación, la calidad intra e inter-lotes, además de predecir en algunos casos la bioequivalencia y biodisponibilidad de productos sólidos orales y la estabilidad del preparado farmacéutico.3
La USP 30, 2007,4 plantea para el ensayo de disolución (categoría III) el estudio de la precisión, mientras que los restantes parámetros se determinan en dependencia de la naturaleza específica del ensayo. Sin embargo, en otros reportes o fuentes se incluyen aspectos tan importantes como: la especificidad con respecto al placebo, la linealidad, la precisión y la influencia de la filtración.5,6
El presente trabajo tuvo como objetivo la evaluación del desempeño del método reportado en la USP 30, para el ensayo de disolución de las tabletas de zidovudina 300 mg producidas en Cuba, mediante la evaluación de los parámetros de especificidad, linealidad, precisión e influencia de la filtración. Además de estudiar si existía similitud entre los perfiles de disolución del producto fabricado en Cuba y el medicamento líder.
MÉTODOS
Las tabletas de zidovudina fueron elaboradas en el Laboratorio de Formas Terminadas, perteneciente al Centro de Investigación y Desarrollo de Medicamentos (CIDEM, La Habana, Cuba), e identificadas con el número de lote 7001.
La sustancia de referencia química de clorhidrato de zidovudina utilizada fue suministrada por el Departamento de Patrones del Laboratorio de Aseguramiento de la Calidad del CIDEM. Todos los reactivos respondían a la calidad analítica requerida para el estudio, según USP 30.
Las condiciones del ensayo de disolución utilizadas fueron las reportadas en la USP 30:4
Aparato: paleta, 50 rev/min-1.
Medio: agua destilada; 900 mL.
Tiempo: 30 min.
El equipo utilizado en el estudio fue un disolutor Erweka DT 6 RE de 6 plazas (Alemania).
Para el análisis se disolvió en agua destilada, una cantidad exacta de la sustancia de referencia química de zidovudina, de modo que se obtuviera una concentración final de 30 µg/mL.
Para el análisis de las tabletas una vez que se alcanzó una temperatura de 37 °C se adicionó una tableta en cada uno de los vasos del disolutor. Trascurridos los 30 min de duración del ensayo se tomó y filtró una alícuota de 10 mL. Posteriormente, se realizaron las diluciones necesarias con el objetivo de obtener una concentración similar a la sustancia de referencia química.
La validación del ensayo de disolución de las tabletas de zidovudina 300 mg, se realizó teniendo en cuenta el método reportado en la USP 30. Los parámetros evaluados fueron los siguientes: influencia del filtrado, especificidad, linealidad, precisión.
Influencia de la filtración
Para evaluar la influencia de la filtración, se analizaron 6 unidades del lote 7001, comparándose entre sí los resultados de las muestras filtradas por filtro de línea (PALL, 0,2 µm nailon acrodise, Estados Unidos), con las muestras centrifugadas a 3 000 rev/min -1, en una centrífuga Jouan MR18-22 (Francia), durante 10 min. Debió cumplirse que el valor de t calculada fuera menor que el valor de t tabulado, al compararse estadísticamente los resultados con uno de los medios filtrantes.7
Especificidad
El estudio se realizó con el empleo de 6 unidades del placebo, según el procedimiento descrito para el ensayo de disolución, con el objetivo de determinar las posibles interferencias de los excipientes empleados en la formulación en la determinación del principio activo. Debió cumplirse que no existiera interferencia de los excipientes de la formulación en la determinación del principio activo.7
Linealidad
Para el estudio de la linealidad de la respuesta del detector se preparó una curva de calibración con 5 soluciones patrón de zidovudina en un intervalo de 60, 80, 100, 120 y 140 %, de la cantidad declarada en la formulación. Debió cumplirse que el coeficiente de correlación (r) fuera mayor o igual que 0,9990; el coeficiente de variación de los factores de respuesta (CVf))£ 5 %; en la prueba de significación del intercepto, mediante la prueba t de Student, la t calculada (t cal) debió ser menor que la t tabulada (t tab).7
Precisión
La precisión del ensayo de disolución se estudió mediante seis ensayos de disolución en los que se evaluaron las tabletas en 2 días diferentes. Debió cumplirse para un método lineal que el valor de t calculada fuera menor que el valor de t tabulada, para g.l.: 5; p< 0,05.8
Todos los análisis estadísticos fueron procesados mediante el Programa STATGRAPHICS Plus versión 5.1, abril 2002.
Comparación de los perfiles de disolución
Este estudio se realizó para comparar el perfil de disolución de las tabletas de 300 mg de zidovudina fabricadas en Cuba con el perfil de disolución del Retrovir® (fabricante: Glaxo, lote G7003, fecha de fabricación julio de 2010), producto innovador, con el fin de demostrar su similitud. Los tiempos de comparación fueron 5, 10, 20, 30, 45 min.
RESULTADOS
Influencia de la filtración
Los resultados medios de la influencia de la filtración aparecen reportados en la tabla 1, tanto de las muestras centrifugadas como de las muestras filtradas con filtro de línea, así como los valores de la prueba t de Student calculados para cada muestra.
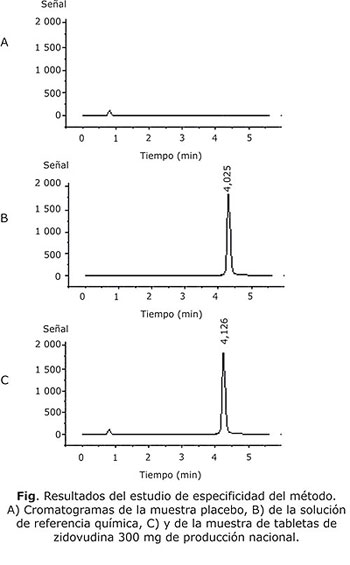
Especificidad
La figura muestra los resultados del estudio de especificidad del método cromatográfico. Como se observa en el cromatograma correspondiente a la muestra placebo (A) no se obtuvo ninguna señal en la zona de interés, al ser comparado con la señal obtenida para la solución estándar de referencia (B) y de la muestra de zidovudina tabletas (C).
Linealidad
Al aplicar el método de los mínimos cuadrados a los resultados, se obtuvo la ecuación de la recta que se expresó según: Y= 40,55 x + 72,15, siendo x la concentración del principio activo; y el área. El coeficiente de correlación lineal fue de 0,9991. Al aplicar la prueba de linealidad, utilizando el coeficiente de variación de los factores de respuesta, se obtuvo un CVf= 2,89 %. Al realizar la prueba de significación de la pendiente, el valor de t calculada (tcal= 1,56) resultó menor que la t tabulada (ttab= 2,14).
Precisión
En la tabla 1 se muestran los resultados del estudio al realizar diferentes ensayos de disolución con el objetivo de analizar la disolución de las tabletas recubiertas de zidovudina, en 2 días diferentes. Se reportan los valores de las medias obtenidas en los ensayos de disolución realizados en los días diferentes, además el valor de la prueba t de Student calculado fue menor que el valor de t tabulado para n= 5 y un 95 % de confianza.
Comparación de los perfiles de disolución
Los resultados de la comparación del perfil de disolución se presentan en las tablas, donde se recogen los valores individuales del porcentaje de principio activo disuelto en cada tiempo para 12 tabletas, así como el valor medio, la varianza y el coeficiente de variación del producto líder y el fabricado en Cuba (tabla 2). El valor del factor de diferenciación (3,17) y de similitud de la comparación del Retrovir® fue 76,01, con el ensayo de producción nacional. Los valores de t calculadas para cada tiempo resultaron menores que los valores de t tabuladas.
DISCUSIÓN
Los resultados del estudio de la influencia de la filtración demostraron que no existieron diferencias significativas entre los resultados, con muestras filtradas y muestras centrifugadas, ya que el valor de t calculada resultó ser menor que la t tabulada. Los resultados se encuentran dentro de los límites establecidos para el estudio de este parámetro en la validación de un ensayo de disolución.6-9 Esto permitió asegurar que como resultado de la filtración el principio activo no fue adsorbido por el sistema de filtración, ni se detectaron interferencias en el filtrado, por lo que es posible su empleo, para la cuantificación de zidovudina en tabletas de liberación inmediata, proponiéndose la filtración por filtro de línea (PALL, 0,2 µm nailon acrodise) como medio de filtración.
Los resultados en el estudio de especificidad, permitieron afirmar que el método es específico en relación con los excipientes que componen la tableta por la respuesta obtenida en el placebo, con respecto a la muestra. Los resultados se encuentran dentro de los límites establecidos para el estudio de especificidad.5
La curva de calibración del estudio de linealidad del sistema, a 265 nm, se comportó de forma lineal en el intervalo de concentraciones estudiadas, con un adecuado valor del coeficiente de correlación (r³ 0,9990). El valor del coeficiente de variación de los factores de respuesta se encontró dentro de los límites establecidos para la evaluación de este parámetro en la validación (CVf£ 5 %), demostrándose una adecuada linealidad5.
Los resultados del estudio de la precisión mostraron que el método es preciso ya que en todos los casos no existieron diferencias significativas, siendo los valores de t calculadas menores que la t tabulada, para cada una de las muestras analizadas. Los resultados, para cada uno de los valores medios obtenidos, se encuentran dentro de los límites establecidos para el estudio de precisión5. Además los valores obtenidos en las muestras evaluadas satisfacieron el límite establecido para el ensayo de disolución de las tabletas de zidovudina (Q³ 70 %).4
El valor del factor de diferenciación (f1) fue menor que 15 (3,17) y el factor de similitud (f2) fue de 76,01, el cual está comprendido dentro del intervalo de aceptación (50-100) por las regulaciones existentes para la comparación de perfiles de disolución. Por ello se puede concluir que no existen diferencias entre los perfiles de liberación del ensayo de prueba y el perfil de liberación del ensayo de referencia. Tampoco se observaron diferencias significativas entre los valores de zidovudina disuelto para cada tiempo evaluado, ya que los valores de t calculadas resultaron menores que el tabulado.
En conclusión, se demuestra el desempeño de las condiciones del ensayo de disolución descrito en la Farmacopea de los Estados Unidos 30 para las tabletas de zidovudina 300 mg producidas en Cuba. Se validó el método de disolución de las tabletas de zidovudina de liberación inmediata, con resultados ajustados a la linealidad, precisión y especificidad.
Existe similitud entre el perfil de liberación de las formulaciones de prueba de las tabletas producidas en Cuba y el producto de referencia Retrovir®.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra. ed. La Habana: Editorial Científico Técnica; 1994. p. 485-7.
2. PDR. Physician´s Desk Reference. 57 ed. New York: Inc at Montuale; 2003. p. 3321.
3. Dressman JB, Lennernas H. Oral drug absorption: prediction and assessment. New York: Marcel Dekker; 2000. p. 197-8.
4. United States Pharmacopoeial Convention. USP 30. United States Pharmacopoeia 30 and National Formulary No 25. Rockville: Mack Printing; 2007.
5. Fortunado D. Dissolution Technologies: Dissolution Method Development for Inmediate Release Solid Oral Dosage Forms. London: Dissolution Technologies Magazine; 2005. p. 12-4.
6. Hanson WA. Handbook of Dissolution Testing. 2nd ed. Oregon: Aster Publishing Corporation; 2002. p. 27-43, 91-113.
7. Skoug JW. Estrategia para el desarrollo y validación de pruebas de disolución para formas sólidas orales. New York: Pharmaceutical Technology Magazine; 1996. p. 8-15.
8. Dressman J. Oral Drugs Absorption. Drugs Pharm Sci. 2002;106;12-425.
9. Cox DC. Guidelines for Dissolution Testing. J Technol. 2001;2:41-58.
Recibido: 8 de abril de 2010.
Aprobado: 17 de mayo de 2010.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1 605 entre Boyeros y Puentes Grandes. CP 10 600. Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu