INTRODUCCIÓN
Entre los múltiples retos que enfrenta el desarrollo acuícola se encuentra la prevención y el control de enfermedades (Ramírez-Jiménez et al., 2015). La producción de camarones peneido ya sea de forma silvestre o cultivado es afectada en gran medida por la presencia de patógenos, presentes en el medio ambiente de forma natural o conviviendo con el cultivo de manera oportunista, que invaden al crustáceo en momentos de lesiones y estrés (Rodríguez-Álvarez et al., 2020).
El sistema inmune de los invertebrados a diferencia de los vertebrados se caracteriza por la ausencia de moléculas del tipo inmunoglobulinas y de células linfoides. En el caso de los crustáceos se basa en efectores humorales y celulares los cuales se conjugan para eliminar microorganismos potencialmente infecciosos (Moreno, Salas y Gutiérrez, 2016). La respuesta inmune innata en camarones es basada en patrones moleculares asociados a patógenos genéricos( PAMP) que pueden ser reconocidos por los receptores de reconocimiento de patrones (PRR) (Andino Lozano y Romero Ramírez, 2014). Los componentes humorales son considerado por (Fonseca, 2016) como las proteínas anticoagulantes, aglutininas, enzima fenoloxidasa, péptidos antimicrobianos y radicales libres.
Estudios recientes demuestran que el conocimiento de los procesos inmunológicos asociados a la bioquímica fisiológica permite determinar el estado de salud de los camarones. La variación de la capacidad osmótica y la concentración de metabolitos plasmáticos han sido utilizados para determinar el estado fisiológico en relación con la talla, la fase de muda, el oxígeno disuelto y la calidad de los reproductores (Peres-Jar et al., 2011). La temperatura es el factor ambiental más importante en el cultivo de camarones peneidos, los ajustes bioquímicos o fisiológicos que ocurran en cualquier adaptación, dependerán de reacciones metabólicas que involucren enzimas dependientes totalmente de este factor para su desarrollo (Pérez y Balam, 2012).
El efecto de la temperatura en las enzimas provoca que la tasa metabólica de un animal incremente exponencialmente con la temperatura corporal (Díaz-Iglesias et al., 2004). La tolerancia y resistencia térmica son estrategias adaptativas que han desarrollado las especies a diferente régimen térmico. En Peneidos la temperatura del agua afecta el rendimiento, incluida las tazas metabólicas de crecimiento e ingestión; fertilidad, comportamiento y también supervivencia (Godínez et al, 2003).
Estudios como los realizados por(Loc et al., 2013; Junprung, Supungul y Tassanakajon, 2019) muestran que exponer a los organismos acuáticos a temperatura no letales estimula el sistema inmune y protege a los mismos contra estresores bióticos y abióticos.
Los estudios que anteceden la exposición de camarones a un estrés térmicos no letal de temperatura (NLHS) no tienen en cuenta el tiempo que demora el sistema inmune en estimularse con la activación de la enzima fenoloxidasa. Siendo este aspecto de gran interés para prevenir frente a retos rutinarios en condiciones de cultivo como: salinidad, temperatura y presencia de bacterias patógenas. Por lo anterior expuesto el objetivo que nos propusimos en este trabajo fue evaluar la estimulación de la enzima fenoloxidasa posterior a un NLHS en camarones adultos P. vannamei.
MATERIALES Y MÉTODOS
Colectas de camarones P. vannamei
Camarones P. vannamei entre (18-20g) fueron extraídos del Centro de Desarrollo de larvas Yagüacam situado en Cumanayagüa, Cienfuegos, Cuba en una densidad de 20 camarones por tanques. La temperatura y salinidad durante el experimento fueron 28 ± 1 °C and 34± 1 g L-1. El agua de mar utilizada, mantuvo un (PH 8,5 ± 0.5) y fue esterilizada y filtrada por 1 μm de radiación ultravioleta, fue usada contante iluminación y aeración durante el experimento. Los recambios de agua se realizaron diariamente, la alimentación fue basada en Artemia franciscana (Aquatic Eco-Systems Inc., Apopka, FL, USA) a razón de 8-10 nauplios de Artemia por camarón cada dos horas y pienso industrial.
Determinación de la NLHS temperatura en camarones P. vannamei
Para determinar la apropiada NLHS temperatura de camarones P. vannamei fueron conformados cinco grupos de 20 camarones cada uno aclimatados a 28⁰ C, cuatro de los grupos fueron expuestos de forma abrupta a un estrés agudo NLHS de temperatura de 34, 36, 37 y 38⁰ C por 30 minutos y luego transferidos inmediatamente a temperatura ambiente para su recuperación y la supervivencia fue evaluada a las 6 h. El grupo de camarones no calentados y mantenido a la temperatura de 28⁰C fue considerado como grupo control. Se colectaron muestras en varios puntos de tiempo (0, 30minutos, 3, 6 y 12h) para evaluar el contenido total de proteínas y la actividad enzimática específica de fenoloxidasa. El experimento fue conformado con tres replicas.
Cinética en la actividad enzimática de la fenoloxidasa
Una vez concluido el estrés agudo de temperatura fueron colectadas muestras en varios puntos de tiempo (0, 30minutos, 3, 6, 12h). Las cuales fueron maceradas y suspendidas en 1mL de Buffer tampón fosfato (PBS). Luego fue evaluado el contenido de proteína y la actividad enzimática específica de la fenoloxidasa en cada punto del tiempo.
NLHS crónico en camarones P. vannamei
Camarones P. vannamei (18-20g de peso corporal) aclimatados a 28 ± 1⁰ C, fueron sometidos de forma abrupta a un estrés térmico crónico de temperatura de 37 ± 0,2 C por 5minutos durante 7 días. Las condiciones de aeración fueron controladas por mantenimiento del oxígeno disuelto (DO) y una salinidad de 10ppm. posterior a completado el calentamiento, ellos fueron transferidos inmediatamente a su temperatura ambiente (28°C), para su recuperación. Las muestras fueron recogidas en dos puntos de tiempo (0 y 7d) en ambos grupos (control y tratados), para evaluar parámetros inmunológicos. Los camarones no calentados (28⁰C) fueron considerados como grupo control.
Concentración de proteína
Se determinó la concentración de proteínas totales en el sobrenadante de las muestras, por el método de (BRADFOR, 1976). El experimento se realizó por triplicado y la concentración de proteína fue calculada a través de una curva patrón, para la cual se empleó una solución de albúmina sérica bovina (ASB) (Sigma- Aldrich USA) en H2Odd. La concentración de proteínas totales se dividió por el número de camarones presentes en cada muestra. Los resultados se expresaron en µg de proteínas por animal.
Para determinar la concentración de proteínas del precipitado de las muestras, al precipitado se le añadió 100 µL de H2Odd, luego se tomaron 10 µL de cada muestra y se solubilizaron en 190 µl de NaOH 1 mol L-1 a 80 °C durante 60 minutos. La concentración de proteínas se determinó a través de una curva patrón para la cual se empleó una solución de ASB en NaOH 1M.
Actividad enzimática específica de Fenoloxidasa (FO)
Se determinó la actividad enzimática de fenoloxidasa mediante la detección espectrofotométrica de la formación de un cromógeno a partir de la L-dihidroxifenilalanina (L-DOPA) (Sigma-Aldrich, USA) (Hernández-López, Gollas-Galván y Vargas-Albores, 1996). Se definió como una unidad de actividad FO a la variación de 0,001 unidades de absorbancia (Abs) por minutos.
Calidad de los camarones P. vannamei (estrés osmótico)
Finalizado el experimento se seleccionaron 50 individuos de los 60 en experimentación por cada grupo para evaluar la calidad de los mismos a partir de la resistencia de estos a un estrés osmótico mediante un cambio de salinidad de 30ppm a 0ppm durante una hora. Transcurrido este tiempo fue restituida la salinidad a 30pmm y se evaluó la supervivencia por conteo de animales vivos.
Análisis estadístico
El tratamiento estadístico de los datos experimentales se realizó con la ayuda de GraphPad Prism versión 8.0 (2016, GraphPad Software, EE. UU). A Los datos obtenidos se le realizó un análisis de normalidad por las pruebas de Kolmogórov-Smirnov. Se comprobó además la homocedasticidad por Prueba de Bartlett).
Para evaluar el efecto de la temperatura sobre la supervivencia y la cinética de la actividad enzimática de la fenoloxidasa, se utilizaron técnicas de comparación de medias como el análisis de varianza simple y doble con interacción; además de HSD Tukey para las comparaciones múltiples, así como, t de Student para muestras independientes al evaluar la supervivencia frente a un estrés osmótico, mientras que en el caso de la determinación de la concentración de proteínas se realizó un análisis de Regresión lineal simple.
RESULTADOS Y DISCUSIÓN
Temperatura no letal en juveniles P. vannamei
Los resultados del ANOVA simple con interacción en la determinación de una apropiada NLHS (Fig.1), muestra una alta supervivencia entre los grupos control (28), 35,36 y 37°C sin diferencias significativas entre los mismos (P˃0,05), donde el 100% de los camarones pueden vivir a un máximo de temperatura no letal de 37⁰ C. Sin embargo. diferencias significativas (P˂0,05) fueron observadas en el grupo calentado a 38°C al ser comparado con el resto de los grupos de NLHS y el control, disminuyendo el índice de supervivencia hasta un 50%. La temperatura máxima no letal 37⁰C fue usada en los siguientes experimentos.
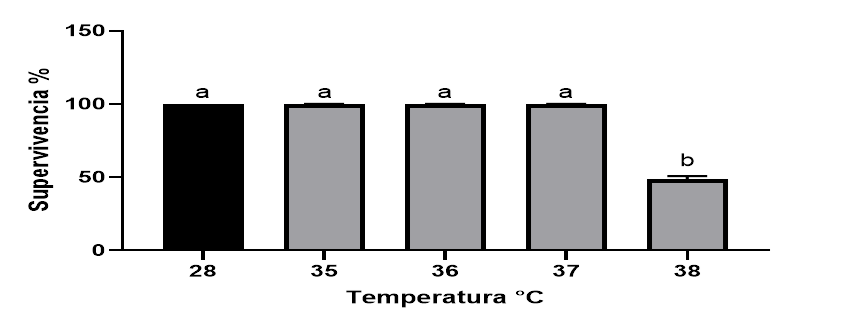
Figura 1 Determinación de una NLHS temperatura en camarones P. vannamei. La barra T corresponde al valor del ES, letras diferentes denotan diferencias significativas (p<0,05) entre los grupos según HSD Tukey).
Una de las principales amenazas en el cultivo del camarón marino es la aparición de enfermedades de origen infeccioso principalmente las causadas por virus y bacterias (Lightner y Redman, 1998). El factor fundamental para que la infección se convierta en enfermedad a nivel del hospedero es el estrés (Overstreet, Cooper y Katz, 1978) . Este es considerado como el conjunto de respuestas fisiológicas de un organismo en reacción a un disturbio ambiental o metabólico para mantener la homeostasis (Schreck, 2000) y puede clasificarse temporalmente de acuerdo a su duración en : Estrés agudo cuando ocurre ante un evento súbito ( minutos, horas, pocos días); y el estrés crónico producido ante eventos ambientales de duración prolongada o recurrente( semanas) (Zacarías-Soto, 1997).
Las respuestas de los animales a la temperatura sirven para inferir los limites térmicos de tolerancia y resistencia (Fried, 1991) . Dentro de estos límites se encuentra la temperatura preferida o referéndum térmico, las temperaturas de evitación, las letales incipientes y las críticas (Brett, 1946). En organismos acuáticos la temperatura preferida se puede diferenciar entre el preferendum agudo de temperatura y el preferendum final. Mientras que la temperatura aguda está influenciada por la temperatura de aclimatación ,el preferendum final no se ve afectado (Dı́az et al., 2002). Cuanto más se somete a una célula a un estrés térmico, mayor tolerancia al mismo presenta, en un fenómeno conocido como termotolerancia, la respuesta al estrés se desata cuando se produce un ascenso de 10-15⁰ C por encima de la temperatura óptima de los organismos siendo el margen de tan solo 5⁰ C (Marchena López, 2020).
Los resultados obtenidos de NLHS a 37°C en nuestro experimento para los adultos de P. vannamei posterior a un estrés agudo es considerada un buen indicador de los requerimientos térmicos ambientales para la especie; dentro de este periodo los parámetros fisiológicos de los organismos se encuentran estables. (Nichelmann, 1983) refiere que, en estos intervalos, el organismo está expuesto a un estrés mínimo y que sus funciones fisiológicas se encuentran optimizadas, lo que se ve reflejado en condiciones reproductivas adecuadas. Un disturbio fisiológico pudiera estar presente en la temperatura de 38° C. donde solo el 50% de los camarones logró sobrevivir. Los choques térmicos son esenciales para la supervivencia. El valor de temperatura obtenido concuerdan con los obtenidos por ( Paschke et al., 2013; Junprung, Supungul y Tassanakajon, 2017; Ulaje et al., 2020).
Cinética de la enzima fenoloxidasa frente a un estrés agudo de temperatura
Los resultados de un ANOVA doble con interacción en nuestro experimento muestran un incremento en la actividad enzimática específica de la fenoloxidasa (Fig.2). altos valores fueron observados a las 3, 6 y 12h posterior al desafío (0,04215; 0,04593; 0,05268 x 10-1 mg respectivamente) en el grupo NLHS; mientras que en el grupo control los resultados fueron muy similares con valores próximos a 0 en todos los tiempos.
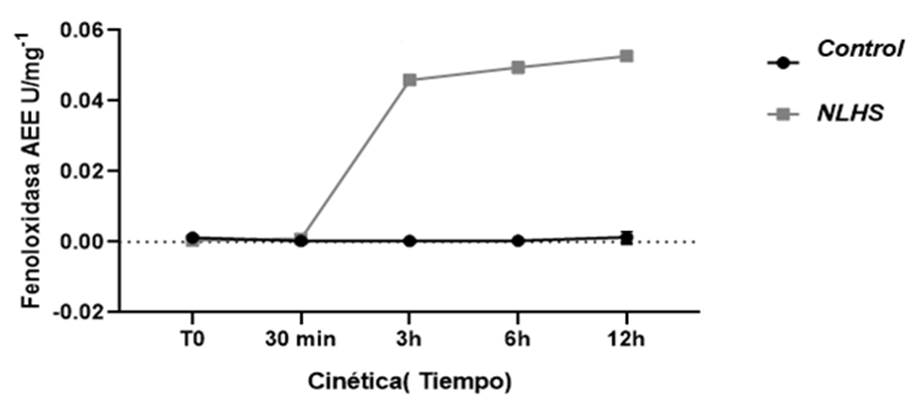
Figura 2 Cinética de la actividad enzimática de fenoloxidasa en camarones adultos P. vannamei, posterior a un NLHS agudo de 37⁰ C.
Dentro de los mecanismos de defensa de los camarones, encontramos el sistema profenoloxidasa (proFO), que al ser activado, tiene como resultado la manifestación de una serie de reacciones enzimáticas y se encuentra en el interior de los gránulos de los hemocitos granulosos y semigranulosos y puede ser liberado por estimulación de antígenos (Martínez y Saa, 2007). Una vez liberado el contenido granular por desgranulación, el proFO es activado a fenoloxidasa (FO). La enzima activadora es una serina-proteasa de tipo tripsina, llamada Profenoloxidasa Activating Proteins (ppA). La FO es la enzima responsable de la melanización observada en crustáceos e insectos, ya que producen la oxidación de fenoles en quinonas, los que se polimerizan a melanina (López-Elías et al., 2016).
La actividad de fenoloxidasa en nuestro experimento fue detectada tres horas posterior al estrés no letal de temperatura donde se evidencia que el sistema de defensa en peneidos es activado en pocas horas posterior al reto. poniendo en alerta al sistema inmune de la presencia de un elemento ajeno que puede comprometer la homeostasis. La FO se activa, controla y regula para minimizar los daños ocasionados por el estrés.
Nuestros resultados están en correspondencia con los resultados obtenidos en un estudio sobre la activación de la expresión de proFO en M. rosengergii, en el cual se observó la mayor actividad de esta enzima entre las 6 y 12 horas post-estimulación (Pascual, Rodríguez y Rosas, 2006). Estos mismos investigadores señalaron que el incremento de esta actividad se produjo después de 3 horas post- infección con Vibrio harbeyi .Otros estudios relacionados con la exposición a temperatura no letales en este caso en Artemias demostró un incremento de la respuesta inmune de la fenoloxidasa al ser comparada con el grupo control (Pestana et al., 2016).
Concentración de proteína
La concentración de proteína muestra un notable incremento del contenido proteico en los animales expuesto al estrés no letal de temperatura; los mayores valores fueron observados a las 6 y 12h (0,83 y 0,89 µg animal-1) al ser comparados con los tiempos T0 y 30min (0,028 y 0,036 µg animal-1) en el grupo NLHS. Mientras que en el grupo control se observaron valores aún más bajos.
Este resultado lo asociamos a que la proteína es utilizada como el principal recurso de energía e indispensables para el mantenimiento de las funciones vitales y en respuesta al estrés. El incremento de proteína mostró una tendencia lineal con un valor de R2= 0,9944.
En P. vannamei, la concentración de proteína es un indicador de desarrollo, buena condición de salud y buena nutrición , esencial este último para evaluar inmunológicos (Martín et al., 2012). Autores como (Bindels et al., 2015; Kumar y Pansari, 2016; Pestana et al., 2016; Srisapoome y Areechon, 2017; Di et al., 2019),han observado incremento de la concentración de proteína en P. vannamei retados con diferentes cepas de Bacillus
NLHS crónico en camarones adultos P. vannamei
Uno de los principales mecanismos con que cuenta el sistema inmunológico de los crustáceos es el sistema pro fenoloxidasa proPO. Los hemocitos inducidos por la presencia de elementos foráneos liberan la enzima en forma de zimógeno inactivo (proPO). Luego se activa por una cascada proteolítica convirtiéndose así en PO activa (Laria et al., 2005).
En nuestro experimento con el grupo NLHS crónico en camarones adultos P. vannamei (Fig.3), aclimatados a 28⁰ C que fueron expuesto abruptamente a temperatura de 37⁰ C por 5 minutos durante 7 días y luego del calentamiento transferidos a su temperatura ambiente; los resultados obtenidos muestran que posterior a un estrés crónico de temperatura la actividad enzimática de fenoloxidasa puede estimularse alcanzando valores de (4,233 ±10-1mg) con diferencias significativas (P<0,05) cuando fueron comparados con el grupo control (1,392 ±10-1 mg).
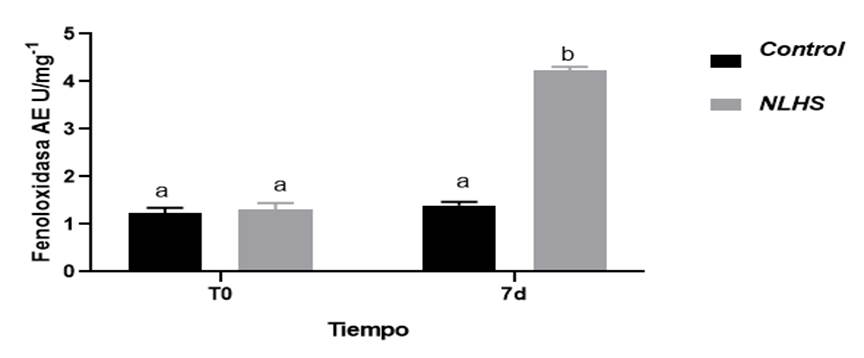
Figura 3 Actividad enzimática específica de Fenoloxidasa en camarones P. vannamei expuesto a un NLHS crónico. Los datos representan las medias y el ES (barras T); letras diferentes representan diferencias significativas entre los grupos (P<0,05) según t de Student.
Previos reportes indican que el tratamiento de NLHS puede incrementar la tolerancia a infecciones patógenas en organismos acuáticos tales como Artemia y el Mejillón verde asiático (Baruah et al., 2017) . Lo que demuestra un incremento en los parámetros inmunológicos protegen a estos organismos contra estresores bióticos y abióticos. El resultado del tratamiento de NLHS crónico a temperatura de 37⁰ C en nuestro experimento demuestra que el sistema inmune se estimula con la activación de la enzima fenoloxidasa posterior al estrés no letal de temperatura por aumento de los hemocitos circulantes y la acción proteolítica de algunas proteínas de choque térmico como HSP70 y HSP90, descritas posterior a un NLHS por ( Loc et al., 2013 ;Junprung et al., 2017)
Algunos trabajos reportan disminución en la actividad de la fenoloxidasa relacionados a cambios de salinidad , fluctuaciones de temperatura , entre otros factores externos (Cabrera Machado, Jaime Ceballos y Galindo López, 2010). Por lo que se hace necesario optimizar estos parámetros en el cultivo de camarones
Estrés osmótico posterior al NLHS crónico en camarones adultos P. vannamei
La determinación de la calidad de los camarones adultos P. vannamei sometidos a un NLHS de temperatura por 5 minutos a temperatura de 37⁰ C durante 7d y luego transferidos a temperatura ambiente (28 ⁰C) fue evaluada por la resistencia de los mismos frente a un stress osmótico a 0 ppm (Fig.4). En nuestro experimento los camarones calentados muestran un alto valor de supervivencia superior al 80% con diferencias significativas (P<0,05) al ser comparados con el del grupo control (20%).
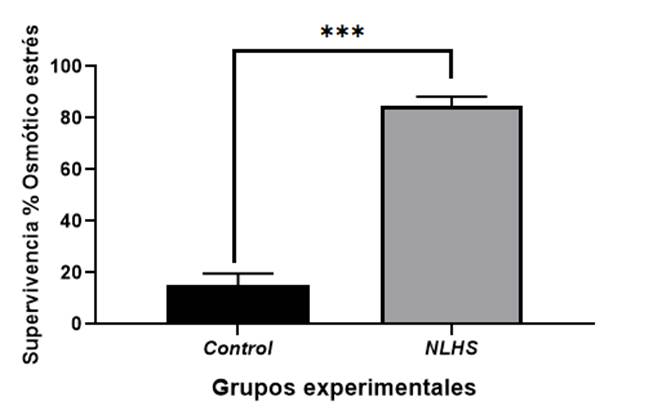
Figura 4 Estrés osmótico a una salinidad de 0 ppm en camarones adultos P. vannamei posterior a un NLHS crónico. La barra T corresponde al valor del ES. Letras diferentes representan diferencias significativas entre los grupos (P < 0,05) según t de Student.
Los camarones del género Peneidos toleran un amplio intervalo de salinidades, desde agua dulce hasta agua de mar a un 150 % (≈ 52 g/L1). Ellos son excelentes hipo e hiper-reguladores y generalmente en una gráfica de osmorregulación presentan un patrón en forma de una amplia meseta en la parte central de todo su intervalo en el cual la concentración de la hemolinfa es muy constante. Leves variaciones en los niveles de regulación y posición de dicha meseta se correlacionan con su hábitat normal de distribución en la naturaleza ((Cabrera Machado et al., 2010 ). respectivamente, resulta muy contradictorio ya que como señalan (Le Moullac y Haffner, 2000), el costo energético de la regulación es más bajo cuando existe un gradiente osmótico bajo entre la hemolinfa y el medio.
De igual forma, es mínimo cuando la osmolaridad del medio es similar a la osmolaridad de la hemolinfa o bien, cuando ésta es isosmótica con el medio externo. Partiendo de esta hipótesis los camarones del grupo experimental mantuvieron un costo de regulación bajo, condicionado por la estimulación del sistema inmune posterior a un NLHS crónico de temperatura, mostrando una alta capacidad defensiva frente al estrés y una mejor capacidad osmorreguladora que los camarones del grupo control no calentado que registraron un mayor grado de severidad de regulación osmótica debido a las diferencias entre la hemolinfa y el medio lo que condujo a una alta mortalidad en este grupo. Similares resultados a los obtenidos en este estudio fueron descritos en la exposición de P. vannamei a combinaciones de salinidades y temperatura. Donde se obtuvo altos índices de supervivencia (Piña-Valdez et al., 2015; Albines Nizama, 2019).














