Introducción
Las infecciones posteriores a procederes quirúrgicos, se mantienen como un problema frecuente en las instituciones de salud, lo que se debe a la aparición de gérmenes multirresistentes y a las características de los pacientes quirúrgicos.1
El neonato que se interviene quirúrgicamente está expuesto al desarrollo de complicaciones durante el posoperatorio, donde las infecciosas son las más frecuentes; ya que por sus condiciones fisiológicas resulta más vulnerable a esta complicación.2
En ocasiones puede ser muy difícil la distinción entre sepsis y otras condiciones inflamatorias como las desencadenadas durante el posoperatorio inmediato, por lo que los procesos infecciosos son un desafío diagnóstico.3,4
Existen biomarcadores de infección y los más utilizados en la práctica médica son el recuento diferencial leucocitario y la concentración de proteína C reactiva. Otras sustancias que se encuentran elevadas durante la infección son: factor de necrosis tumoral alfa, interleucinas 1, 6,8; interferón gamma, que no se utilizan como marcadores de infección por no estar disponibles en la práctica asistencial en la mayoría de las instituciones de salud.5
El lactato sérico (LS), en las guías de la campaña sobreviviendo a la sepsis, ha sido recomendado como criterio diagnóstico de sepsis y de hipoperfusión inducida por sepsis.6,7
En la sepsis y como respuesta al estrés quirúrgico ocurre un estado de hipermetabolismo con un aumento en el transporte de glucosa dentro de la célula y aumento de la glicolisis, gluoconeogénesis y glucogenolisis. Si la glicolisis ocurre a un mayor nivel que el necesario para el metabolismo oxidativo y el piruvato obtenido no se metaboliza totalmente en el ciclo de Krebs, a partir del excedente comienza a producirse LS por rutas metabólicas alternativas como la de la enzima lactato deshidrogenasa. La acumulación de LS por este mecanismo sería independiente de la presencia de hipoxia o isquemia tisular. En la sepsis la concentración de LS elevado puede estar influenciado por catecolaminas endógenas o exógenas que estimulan al metabolismo celular y pueden ser una fuente común de acidosis láctica.8
Determinar la magnitud de asociación del valor del LS con la sepsis en el neonato intervenido quirúrgicamente fue el objetivo del presente estudio.
Métodos
Se realizó un estudio explicativo (variable respuesta: LS posoperatorio), retrospectivo, en el Servicio de Neonatología del Hospital Pediátrico Universitario “William Soler”, del 1 de enero de 2013 a 31 de diciembre de 2016. Se incluyeron 307 recién nacidos intervenidos quirúrgicamente. La información se obtuvo del libro de ingresos localizado en el servicio, de las historias clínicas ubicadas en el Departamento de Registros Médicos del hospital. Las variables estudiadas se agruparon en clínicas (edad gestacional, peso al nacer, causa de la intervención quirúrgica, localización de la infección y paraclínicas (microorganismo causal, LS). La muestra se distribuyó en dos grupos: infectados y no infectados. Los directivos de la institución fueron informados y se obtuvo su consentimiento.
La medición del LS se realizó en el día de la cirugía y en las primeras 24 horas del posoperatorio, se utilizó tecnología de espectrofotometría. Se utilizó Ji- cuadrada de independencia con corrección de Yates para demostrar asociación entre la causa de la cirugía y la infección; se aplicó la prueba de correlación lineal de Pearson parcial (coeficiente: r) con control de la variable infección (si y no) para identificar correlación lineal entre los valores de LS en el preoperatorio (variable independiente) y los valores del LS en el posoperatorio (variable dependiente). El modelo de regresión lineal simple se asumió cuando la infección tomó valor 1 (casos infectados) y se obtuvo el coeficiente de regresión ((: que expresa la velocidad de cambio) y de determinación (R2 que expresa los cambios debido a la regresión). Luego se categorizó la variable LS preoperatoria y posoperatoria (elevada y normal) y se controló la variable infección (si/no) por lo que se estimó el odds ratio (OR) de Mantel-Haenszel; donde OR>1 se tomó como factor predictivo de infección. En todas las pruebas de hipótesis se consideró significativo cuando p<0,05. Se utilizó el programa Epidat 3.0.
Resultados
En el periodo 2013-2016 ingresaron en la unidad de cuidados intensivos neonatales del hospital “William Soler”, 1728 recién nacidos, de ellos, 307 requirieron intervención quirúrgica por lo que la tasa fue 17,87 por 100 ingresos; de los que 63 se encontraba bajo peso (<2 500 gramos) (20,52 %) y 55 nacieron antes del término gestacional (<37 semanas) (17,92 %). De los recién nacidos con requerimiento quirúrgico, se infectaron 62 por lo que la tasa fue 20,2 por 100 operados; de los cuales 16 (25,81 %) eran bajo peso y 17 (27,42 %) pretérminos. En los recién nacidos infectados, 20,83 % fueron operados por afecciones digestivas (n= 35) del total de causas digestivas (n= 168; 54,72 %) y 14,29 % fueron por causas bajas (n= 24) de todos los recién nacidos con causas digestivas bajas (n= 109; 64,88 %) (tabla 1).
Tabla 1 Neonatos intervenidos quirúrgicamente según causa de intervención en infectados y no infectados
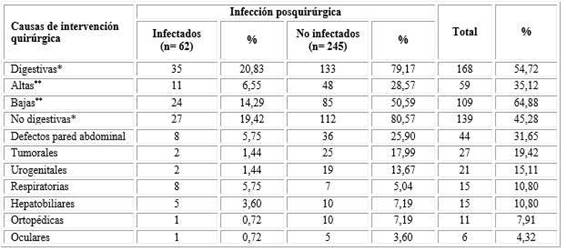
% calculado del total de causas digestivas y no digestivas, respectivamente. Prueba Ji- cuadrada de independencia con corrección de Yates: *(( 2 = 0,026; p= 0,8703); **(( 2 = 0,0993; p= 0,8858).
Se infectaron 11 recién nacidos intervenidos quirúrgicamente (6,55 %) por causas digestivas altas en relación con el total de los que tuvieron afecciones altas (n= 59; 35,12 %) (Tabla 1).
De los 27 recién nacidos infectados que fueron operados por causas no digestivas (19,42 %), en 5,75 % (n= 8) fue debido a defectos de la pared abdominal y por afecciones respiratorias, respectivamente (Tabla 1).
Se comprobó que la infección posquirúrgica fue independiente de la ubicación anatómica de la malformación congénita o defecto (digestiva y no digestiva), p= 0,8703; como también de la localización de la cirugía digestiva (alta o baja), p= 0,8858.
En los recién nacidos con afecciones digestivas bajas infectados, 29,17 % fueron operados de aganglionosis (n= 7); mientras que por afecciones digestivas altas, 54,54 % (n= 6) fueron intervenidos quirúrgicamente por atresia esofágica (Tabla 2).
Tabla 2 Neonatos intervenidos quirúrgicamente infectados segúncausas digestivas
| Causas digestivas | n | % |
|---|---|---|
| Altas (n= 11) | ||
| Atresia esofágica | 6 | 54,54 |
| Atresia duodenal | 2 | 18,18 |
| Estenosis hipertrófica del píloro | 2 | 18,18 |
| Estenosis duodenal | 1 | 9,09 |
| Bajas (n= 24) | ||
| Aganglionosis | 7 | 29,17 |
| Perforación intestinal | 3 | 12,50 |
| Atresia intestinal | 4 | 16,67 |
| Malformación ano rectal | 3 | 12,50 |
| Malrotación | 4 | 16,67 |
| Íleo meconial | 1 | 4,17 |
| Biopsia rectal | 1 | 4,17 |
| Bridas | 1 | 4,17 |
En las tablas 3 y 4 se observa que las infecciones sistémicas alcanzaron 67,74 % (n= 42), presentes en los operados por causas digestivas bajas (n= 6; 25,81 %), digestivas altas (n= 7; 11,29 %) y no digestivas (n= 19; 30,65 %). Las infecciones sistémicas fueron ocasionadas en 45,24 % por Cándida sp n= 19).
Otro lugar de infección (tablas 3 y 4) correspondió al sitio quirúrgico (n= 16; 25,80 %), donde se identificó en 37,50 % Staphylococcus aureus (n= 6); en tanto las infecciones respiratorias (n= 9; 14,52 %) fueron causadas por Staphylococcus coagulasa negativa (n= 3), Cándida sp (n= 2), Staphylococcus aureus (n= 2), Escherichia coli (n= 1) y Enterobacter sp (n= 1) al igual que las infecciones digestivas: Escherichia coli (n= 3), Cándida sp (n= 2), Staphylococcus coagulasa negativa (n= 1) y Enterobacter sp (n= 1).
Tabla 3 Neonatos intervenidos quirúrgicamente infectados según sitio en afecciones digestivas y no digestivas
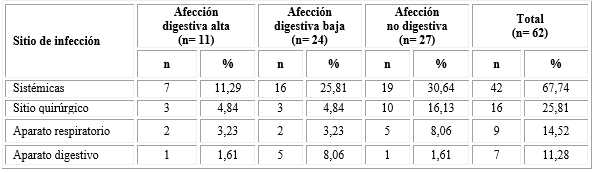
El sitio de infección es no excluyente; % calculado del total por fila.
Tabla 4 Neonatos intervenidos quirúrgicamente según microorganismos y sitio de infección
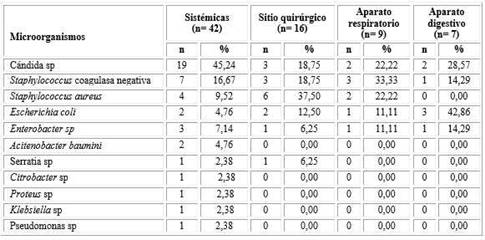
Los microorganismos y sitio de infección son no excluyentes; * infección sobreañadida: en un paciente por Staphylococcus aureus, Proteus sp, Klebsiella sp, Citrobacter sp y por Cándida sp en dos pacientes.
Fuente: Libro de registro del. Dpto. de Microbiología. Hospital “William Soler”.
En la tabla 5 se muestra que la media del LS en el preoperatorio de los infectados fue 2,86 mmol/L variable en 1,10) y en el posoperatorio ascendió a 3,83 mmol/L (variabilidad de 1,31).
Se demostró que cuando hay infección en recién nacidos intervenidos quirúrgicamente, los valores del LS en el posoperatorio dependen de los valores del LS en el preoperatorio (p= 0,000), donde la fortaleza de esta asociación fue aceptable (r= 0,4322) y positiva (cuanto mayor fue el LS en el preoperatorio, más elevado resultó en el posoperatorio). La velocidad de cambio en los infectados (p= 0,001) significó que por cada unidad en mmol/L que ascendió el LS preoperatorio, en el posoperatorio se incrementó 0,489 mmol/L y estos cambios fueron debidos en 16,9 % a los valores del LS preoperatorio.
Tabla 5 Lactato sérico en neonatos intervenidos quirúrgicamente infectados y no infectados
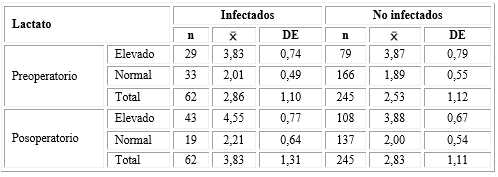
Correlación lineal de Pearson: r= 0,4322; p= 0,000; Regresión lineal simple: (=0,489 (no estandarizado);
p= 0,001; R 2 = 0,169; OR =3,710 [IC95 %: 2,230-6,173]; p= 0,000
Se confirmó que fue 3 710 veces más probable el LS elevado en el posoperatorio en infectados que en los no infectados, entre 2 230 y 6 173 con 95 % de confianza, cuando el LS en el preoperatorio se incrementó.
Discusión
Las características epidemiológicas de las infecciones posquirúrgicas han sido muy estudiadas en adultos, pero las publicaciones en pacientes pediátricos son reducidas, y más aún en neonatos.
Los resultados de esta investigación corrobora en acuerdo con los reportes de otros autores que los recién nacidos tienen mayor susceptibilidad a infecciones por la inmadurez del sistema inmune y las características de la pared intestinal.9,10,11
Se cita en la literatura que aproximadamente 0,9 % de todos los neonatos presenta una anomalía en el conducto digestivo. La prevalencia de las malformaciones congénitas del tracto gastrointestinal es 1,3 por cada mil nacidos vivos.12,13
Publicaciones de autores cubanos relacionados con neonatos a los cuales se les diagnosticó enfermedad con demanda quirúrgica, en la provincia de Pinar del Río, mostraron que las afecciones más frecuentes fueron las de intestino delgado.14 En el oriente en un trabajo realizado en el servicio de neonatología en el Hospital Pediátrico Universitario de Holguín se encontró que las malformaciones congénitas que afectaban el tubo digestivo fueron una de las primeras causas de ingreso en este servicio.15
En estudios realizados en Chile, India y en Egipto registran que la afectación del sistema gastrointestinal está entre las primeras causas de órganos más afectados por defectos congénitos en neonatos.16,17,18
Dentro las malformaciones del sistema digestivo más observadas son las malformaciones anorectales y la atresia esofágica, lo que también se registra en Cuba y en otros países.14,15,19,20
La infección posoperatoria es más frecuente en las cirugías digestivas.11) En particular, dentro de las afecciones digestivas bajas los neonatos intervenidos quirúrgicamente por aganglionosis se infectaron más. La aganglionosis se asocia a infección (enterocolitis) ya que a medida que el intestino se dilata, aumenta la presión intraluminar que hace disminuir la perfusión sanguínea de la pared alterándose la mucosa y sus mecanismos de barrera y transporte, este estancamiento permite la proliferación bacteriana.21) En tanto dentro de las afecciones altas la cirugía de atresia esofágica fue la más representativa en los infectados; y el sitio de localización más observado en estos pacientes fue el aparato respiratorio; algunos autores sugieren que la presencia de epitelio escamoso no ciliar en la tráquea podría empeorar seriamente el mecanismo de barrido ciliar, siendo este un importante mecanismo de defensa del tracto respiratorio que predispone a la aparición de atelectasias y neumonías, también existe una asociación clara entre la severidad del reflujo gastroesofágico y la infección respiratoria.2,22
Las localizaciones más frecuente de infección posquirúrgica en este estudio fueron en primer lugar las sistémicas, en segundo, del sitio quirúrgico y tercero, respiratorias, lo que coincide con otros estudios realizados en Cuba14,15,19) y en Estados Unidos.23) Sin embargo, la infección del sitio quirúrgico constituye la primera causa de infección asociada con la atención sanitaria en pacientes quirúrgicos, representa 40 % y es potencialmente prevenible.24,25,26
Desde las últimas décadas va teniendo importancia creciente las infecciones por Cándida relacionada con la atención en salud, la prematuridad, el bajo peso y la cirugía abdominal son factores de riesgo asociados a su aparición.27,28
La cirugía intestinal también puede generar infección por Cándida al ser una región donde normalmente se encuentra flora micótica que no produce daño pero con la intervención quirúrgica se puede diseminar (por traslocación bacteriana) a vía hematógena y desarrollar candidemia.28
El LS circulante no solo es una molécula de desecho, deletérea para los tejidos, no existe una relación lineal causa-efecto entre el LS y la falla de órganos, e incluso el LS circulante está disponible en tejidos que lo usan como sustrato energético. El LS es un marcador importante de los procesos metabólicos celulares, y en sepsis se le ha interpretado como un biomarcador que indica la deficiencia de aporte de oxígeno a los tejidos.29
En esta investigación la determinación del LS demostró diferencia entre los valores del LS preoperatorio y posoperatorio, este último pudiera ser respuesta al hipermetabolismo generado por la cirugía, pero resultó notable esta modificación entre los que posteriormente desarrollaron infección. Por lo que la autora realiza dos consideraciones, la primera es que el daño de perfusión tisular demostrado por el aumento del LS preoperatorio es un factor contribuyente a la aparición de infección postoperatoria. La segunda es que la variación del LS postoperatorio, no debe ser desestimada sino una alerta para realizar seguimiento a los neonatos intervenidos quirúrgicamente por posibilidad de infección.
Contar con pruebas diagnósticas que ayuden a predecir infección en neonatos intervenidos quirúrgicamente, tiene gran impacto en los cuidados neonatales y el lactato sérico es una herramienta diagnóstica disponible en las unidades cubanas de cirugía neonatal.
La principal limitación de este estudio consiste en que el grupo evaluado no incluye neonatos operados de cardiopatías congénitas ni de malformaciones neurológicas, debido a que en esta institución no se realizan esas cirugías. La posibilidad de realizar en el futuro estudios multicentros, proporcionaría mayor información acerca del impacto del lactato como biomarcador en otras cirugías neonatales.
Se concluye que el lactato sérico está asociado a la infección en los neonatos intervenidos quirúrgicamente y es un biomarcador de sepsis útil en los cuidados intensivos neonatales.














