Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.31 no.1 Santiago de Cuba ene.-abr. 2011
ARTÍCULO ORIGINAL
EVALUACIÓN DE INHIBIDORES DE LA CORROSIÓN OBTENIDOS A PARTIR DE LA VINAZA RESIDUAL DE LAS DESTILERÍAS DE ALCOHOL ETÍLICO CON ADITIVOS
EVALUATION OF CORROSION INHIBITORS OBTAINED FROM THE RESIDUAL VINAZA OF THE ETHYL ALCOHOL DISTILLERIES WITH ADDITIVES
MSc. Elaine Ojeda-Armaignac, MSc. Romelia Hing-Cortón
Facultad de Ingeniería Química, Universidad de Oriente, Santiago de Cuba. eoa@fiq.uo.edu.cu
RESUMEN
En el presente trabajo se hace un estudio de los sólidos extraídos de la vinaza residual proveniente de la fermentación de las mieles finales para obtener alcohol etílico, como inhibidores de la corrosión. La vinaza se somete a un proceso de electrocoagulación, el cual se ha llevado a cabo en diferentes condiciones con el objetivo de aumentar el rendimiento de los sólidos obtenidos, estas condiciones son las siguientes: adicionando NaCl a la vinaza para incrementar su conductividad, adicionando NaOH a la vinaza para incrementar el pH de la misma, sin ningún aditivo y con el pH natural de la vinaza que es ligeramente ácido. Después del proceso de electrocoagulación, se obtienen sólidos en el lodo que precipitan en el fondo del líquido y sólidos que ascienden a la superficie con la espuma. El estudio se realizó con ambos sólidos a 60 º C y se determinó que en las condiciones Nº 1, la adición de NaCl, sólidos L1 y E1 es desfavorable para los 4 materiales metálicos estudiados, a saber: acero al carbono, cinc, aluminio y latón. Los sólidos obtenidos incrementando a 9 el pH de la vinaza antes de ser sometida al proceso de electrocoagulación (L5 y E5), y los sólidos obtenidos con el pH natural de la vinaza (L2 y E2), son comparables en sus propiedades inhibidoras, aunque dependiendo del material metálico, puede uno de ellos ser ligeramente mejor que el otro. Se presentan modelos matemáticos que correlacionan la velocidad de corrosión con el pH, la concentración de inhibidor y la temperatura. Finalmente, no se recomienda adicionarle ningún aditivo a la vinaza.
Palabras claves: inhibidores de la corrosión, electrocoagulación.
ABSTRACT
In this paper a study of solids extracted from the residual vinasse from the fermentation of molasses to obtain ethanol, as corrosion inhibitors. The vinasse is subjected to electrocoagulation process, which was carried out under different conditions in order to increase the performance of the solids obtained, these conditions are: adding NaCl to the residual vinasse to increase its conductivity, adding NaOH to the residual vinasse to increase the pH, without any additives and the natural pH of residual vinasse which is slightly acidic. After electrocoagulation process, you get the sludge solids that precipitate in the bottom of the liquid and solids that rise to the surface with foam. The study was conducted with both solid at 60 ° C and found that conditions Nº 1, the addition of NaCl, solid L1 and E1 is unfavorable for the 4 metallic materials studied, namely: carbon steel, zinc, aluminum and brass. The solids obtained increasing to 9 the pH of vinasse before being subjected to the process of electrocoagulation (L5 and E5), and the solids obtained with the natural pH of vinasse (L2 and E2) are comparable in their inhibitory properties, although depending on the metallic material, one of them can be slightly better than the other. Are presented mathematical models that correlate the corrosion rate with pH, the inhibitor concentration and temperature. Finally, do not recommend adding any additives to the residual vinasse before the electrocoagulation process.
Keywords: corrosion inhibitors, electrocoagulation.
INTRODUCCIÓN
Las soluciones ácidas, neutras y alcalinas son ampliamente utilizadas en la industria, por ejemplo, en las limpiezas ácidas y alcalinas de los centrales azucareros y en otros procesos industriales, por lo que en estos casos se hace necesario utilizar inhibidores de la corrosión para disminuir el daño que esto pueda provocar a los materiales metálicos utilizados. El control de la corrosión por los inhibidores, es uno de los métodos más comunes y eficaz para protegerlos [1].
Se ha determinado que la vinaza residual de las destilerías de alcohol etílico contiene componentes que debido a sus propiedades inhibidoras puede ser utilizado para combatir este problema que afecta a nivel mundial [2].
La contaminación es uno de los problemas ambientales más relevantes que afectan a nuestro mundo y surge cuando se produce un desequilibrio natural que cause efectos adversos en el hombre, en los animales y vegetales. Un ejemplo lo constituye la industria alcoholera cubana, que al verter sus efluentes (vinaza) trae consigo un alto poder contaminante en ríos y mares provocando afectaciones al medio ambiente. Por esta razón, se están realizando estudios para, mediante el método de electrocoagulación de la vinaza, obtener compuestos que puedan ser utilizados como inhibidores de la corrosión, en tal sentido, se hace necesario realizar la obtención, buscando las condiciones que permitan obtener sólidos que presenten altas eficiencias.
La electrocoagulación es la opción distinta, económica y ambiental para reunir los estándares de descarga del tratamiento de desperdicio de agua y requerimientos de conformidad [3, 4, 5, 6]. En el proceso de electrocoagulación la vinaza residual a tratar, puede mantener sus condiciones iniciales o puede ser modificada en algunas de sus propiedad como es el pH y la conductividad mediante la adición de NaCl con el objetivo de mejorar la eficiencia del proceso de electrocoagulación, pero esto puede influir en la calidad de los sólidos inhibidores, por lo que se hace necesario llevar a cabo este trabajo, el cual persigue el siguiente objetivo general:
- Comprobar si la eficiencia de los sólidos inhibidores de la corrosión se ve afectada por la presencia del NaCl adicionado y por la variación del pH en el proceso de electrocoagulación de la vinaza, determinando cuáles son las condiciones que nos permiten obtener sólidos más eficientes para el aluminio y el acero al carbono en diferentes condiciones de agresividad.
FUNDAMENTACION TEORICA [1, 2, 7]
La corrosión se puede definir como la acción química, electromecánica, mecano química o biológica, lenta o acelerada de la naturaleza o el medio ambiente, que degrada y destruye los materiales. Este fenómeno, al que se le da el nombre de corrosión, bastante complejo y afectado por muchas variables, se manifiesta más evidentemente en los cuerpos sólidos como son los metales, las cerámicas, los polímeros artificiales, los agregados y los materiales fibrosos de origen natural.
El fenómeno de la corrosión de la materia sólida consiste básicamente en la pérdida del equilibrio en las fuerzas cohesivas. Las fuerzas que mantienen la cohesión de la materia sólida son de naturaleza eléctrica. Esta cohesión es el resultado del equilibrio de las fuerzas de atracción entre los núcleos atómicos positivos y los electrones con cargas negativas, con las fuerzas de repulsión de los electrones entre si y de los núcleos atómicos entre sí.
Entre los métodos de protección contra la corrosión se encuentran los inhibidores de la corrosión, los cuales son sustancias químicas que protegen al metal contra el ataque electroquímico de soluciones agresivas. Son usados ampliamente por la industria para modificar el comportamiento de las aguas, a efectos de un mejor control de la corrosión.
Entre los inhibidores de corrosión más usados se encuentran los llamados de adsorción. Como su nombre lo indica, son sustancias orgánicas que ejercen su acción al adsorberse física o químicamente sobre la superficie del metal. Para ello estas sustancias deben poseer carácter polar con grupos funcionales que contengan al menos un heteroátomo (S, N, O, P) o que posea en la molécula múltiples enlaces (preferentemente triples) por los cuales se realiza la unión con la superficie metálica.
Electrocoagulación [6]
Es el proceso de desestabilizar contaminantes suspendidos, emulsificados (solubles) o disueltos en un medio acuoso, haciendo pasar una corriente eléctrica a través del mismo usando una variedad de ánodo y cátodo geométrico, incluyendo láminas, bolas, barras y tubos, es una técnica para tratar el agua, extraerle impurezas y eliminar las bacterias patógenas al mismo tiempo que produce un residuo inerte.
La corriente eléctrica proporciona la fuerza electromotriz que provoca las reacciones químicas. Al forzar estas reacciones, los elementos contaminantes en el medio, se aproximan a su estado más estable, generalmente, la estabilidad produce partículas sólidas que son menos coloidales y menos emulsificadas (o solubles).
Cuando esto ocurre, los contaminantes forman componentes hidrofóbicos que se precipitan y se pueden remover fácilmente por algún método de separación secundaria. La electrocoagulación utiliza corriente directa para hacer que los iones de sacrificio de los electrodos eliminen contaminantes indeseados, sea mediante reacción química y precipitación o provocando que los materiales coloidales se aglomeren y sean eliminados por flotación electrolítica.
En el proceso de electrocoagulación, se induce una corriente eléctrica en el medio a través de placas metálicas paralelas de materiales diversos que optimicen el proceso de remoción. Dos de los metales más utilizados son el hierro y el aluminio. De acuerdo con la Ley de Faraday, los iones metálicos se liberan y dispersan en el medio líquido, estos iones metálicos tienden a formar óxidos metálicos que atraen electrostáticamente a los contaminantes que han sido desestabilizados y estas partículas recientemente formadas, precipitan y son eliminadas.
MATERIALES Y METODOS
Durante el proceso de electrocoagulación [6] de la vinaza se obtienen sólidos en la espuma y otros del lodo o fondo del líquido, en varias condiciones de pH, intensidad de corriente y tiempo de exposición. En trabajos desarrollados anteriormente, quedó demostrado que ambos sólidos se comportan de igual forma como inhibidores de la corrosión. Para la obtención de los mismos, el proceso de electrocoagulación se desarrolló en las siguientes condiciones:
1 Se adicionó NaCl para mejorar el proceso de electrocoagulación y con el pH original de la vinaza que tiene un valor de 4.3. A estos sólidos se les denominará S1.
2 Con el pH original de la vinaza (4.3) y sin la adición de otro componente extraño a la misma. A estos sólidos se les denominará S2.
3 Se adicionó Hidróxido de Sodio para llevar el pH de la vinaza a un valor de 9 antes del proceso de electrocoagulación. A estos sólidos se les denominará S3.
El trabajo experimental se desarrolló utilizándose el método gravimétrico (2,10,12) para determinar las velocidades de corrosión de los materiales metálicos utilizados, que son el aluminio y el acero al carbono en las condiciones de 60 ºC.

ANALISIS DE LOS RESULTADOS
En las tablas 1, 2 y 3 se presentan los resultados obtenidos para el aluminio en las diferentes condiciones de trabajo con los tres sólidos a analizar.
Los resultados para el acero al carbono, en las diferentes condiciones de trabajo y con los diferentes sólidos, se reflejan en las tablas 4, 5 y 6.
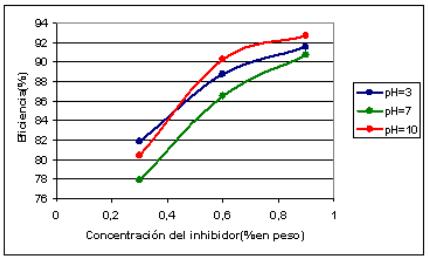
Graficando eficiencia del inhibidor contra la concentración del mismo se obtienen figuras similares a la isoterma de adsorción de Langmuir, lo que indica que estos inhibidores se comportan como inhibidores orgánicos de adsorción [1].
Fig. Comportamiento del acero al carbono con el sólido S3.
ANALISIS ESTADISTICOS DE LOS RESULTADOS
El procesamiento estadístico de los resultados obtenidos se realizó utilizando el programa STATGRAPHICS Plus Versión 5,1 La probabilidad del error fue de un 5 % o lo que es igual, el intervalo de confianza escogido fue de un 95 %, se obtuvieron los modelos matemáticos que correlacionan la velocidad de corrosión DE con la concentración del inhibidor (CI), la temperatura (T) y la interacción de estas variables. Un ejemplo para cada uno de los materiales, se presenta a continuación:

• Haciendo un análisis de los resultados presentados en las tablas anteriores, para el aluminio se evidencia que a un valor de pH igual a 7, disminuye la velocidad de corrosión, ya que en estas condiciones, el aluminio se encuentra en una condición favorable para formar su capa pasiva protectora, pero si se sigue elevando el pH, a valores altos del mismo, la velocidad de corrosión comienza a aumentar, esto se debe a que ya a este valor comienza a evidenciarse el carácter anfótero del aluminio. Sin embargo, para el acero al carbono, la velocidad de corrosión disminuye con el incremento del pH.
• Para los tres valores de pH utilizados con el sólido S1, solamente a la menor concentración de inhibidor en un valor de pH igual a 10, se obtiene un pequeño efecto inhibidor, en el resto de los casos se acelera la velocidad de corrosión, esto se debe a que el contenido de NaCl de los sólidos inhibidores está contrarrestando el efecto inhibidor de los mismos, ya que los iones cloruros tienden a romper la capa pasiva protectora del metal. Sin embargo, para el acero al carbono, a medida que aumenta la concentración del inhibidor aumenta la eficiencia del mismo para todos los valores de pH, pues el acero al carbono no se pasiva en este medio.
• Utilizando el sólido S2, al cual no se le adicionó ningún compuesto extraño, se observa que a medida que aumenta la concentración del inhibidor, aumenta la eficiencia del mismo para los dos materiales metálicos.
• Con el sólido S3 pasa lo mismo que con el sólido S2, pero el primero mostró mejores eficiencias para el aluminio, porque al tener este sólido un carácter más alcalino que el sólido S2, pues se obtuvo con la adición de NaOH a la vinaza antes del proceso de electrocoagulación, promueve la formación de las capas protectoras típicas del aluminio.
CONCLUSIONES
1. Los sólidos obtenidos a partir de la vinaza por electrocoagulación, se comportan como inhibidores orgánicos de adsorción, con excepción del sólido S1 con el aluminio a los tres valores de pH, condiciones en las cuales se acelera la velocidad de corrosión.
2. El sólido S1 es menos eficiente que el sólido S2, y que el sólido S3, por lo que debe evitarse añadir NaCl a la vinaza que va a ser electrocoagulada.
3. No influye de forma significativa el adicionarle NaOH a la vinaza antes de ser sometida al proceso de electrocoagulación.
BIBLIOGRAFIA
1. DOMÍNGUEZ J., D. CASTRO, R. MATOS y R. HING. Introducción a la Corrosión y Protección de Metales. La Habana, Ediciones ENPES, Cuba, 1987.
2. HING R. Obtención de un inhibidor de la corrosióna partir de un mosto de la destilería. Revista Tecnología Química. Vol. 1. No 1. 1980.
3. COLECTIVO DE AUTORES, Características de la vinaza de destilería (mosto). Universidad de Oriente. 2004.
4. CRESPO, H. Proyecto de planta para reciclar el mosto de la destilería. Universidad de Oriente. 2005.
5. CABALLERO L. y PALMERO S. Evaluación de inhibidores de la corrosión ecológicos y naturales de la corrosión. Universidad de Oriente. 2005.
6. MORANTE G. Electrocoagulación de aguas residuales. Revista colombiana de física, Vol. XXXIV, No. 2. 2002.
7. TOMASHOV, N. D. Theory of corrosion and protection of metals. La Habana, 1971.
Recibido: Julio de 2010
Aprobado: Diciembre de 2010
MSc. Elaine Ojeda-Armaignac. Facultad de Ingeniería Química, Universidad de Oriente, Santiago de Cuba. eoa@fiq.uo.edu.cu