Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.1 Ciudad de la Habana ene.-mar. 2001
Centro de Ingeniería Genética y Biotecnología
Centro de Investigaciones Biomédicas
Sistema interferón y estrés oxidativo
Dra. Massiel del Rosario Quijano y Dr. José C. García Piñeiro
Resumen
Los interferones forman parte de una familia de proteínas que ejercen efectos biológicos diversos. En el caso particular del interferón, se encuentra involucrado en el proceso inflamatorio y la producción de especies reactivas del oxígeno. Esta citocina una vez activada, induce la generación de moléculas mediadoras; y estas a su vez, activan un conjunto de células que son reclutadas en el sitio del proceso inflamatorio. Entre los tipos de células activadas cabe mencionar el macrófago; en el nivel de esta célula se producen especies reactivas del oxígeno, por ejemplo el óxido nítrico (NO), por causa del efecto inductor que genera el interferón g en la enzima óxido nítrico sintasa. La velocidad de esta reacción depende del cofactor tetrahidrobiopterina, donde la enzima limitante es codificada por un gen activado por el interferón. Por otra parte, la enzima que modula la producción de óxido nítrico por el suministro de nitrógeno, es regulada también por esta misma citocina.
Descriptores DeCS: INTERFERONES/uso terapéutico; ESPECIES DE OXÍGENO REACTIVO; ÓXIDO NÍTRICO/uso terapéutico; ENDOTELIO VASCULAR; MECANISMOS DE DEFENSA; ESTRÉS OXIDATIVO.
El endotelio ha sido considerado como una simple barrera y a su vez blanco de agentes externos, hoy se le reconoce trascendente participación en los mecanismos de comunicación intercelular y de defensa. En procesos de infección, inflamación o daño local son recluidos los diferentes subtipos leucocitarios y extravasados a través del endotelio localmente modificado; este fenómeno es orquestado y regulado por la producción in situ de citocinas. Interacciones relevantes desde el punto de vista fisiológico ocurren en las vénulas poscapilares, que son muy modificadas anatómica y funcionalmente por citocinas en el sitio de la inflamación. Haller señala funciones fisiológicas de carácter regulatorio del tono vascular vinculadas con las funciones del óxido nítrico (NO) y a su vez, en condiciones no fisiológicas, fundamentalmente con la producción de factores de migración y de diferenciación celular.
El endotelio vascular participa en la producción de selectinas, integrinas y en la superfamilia de inmunoglobulinas. Dentro de las funciones del endotelio vascular se ha enfatizado la regulación del tono vascular por la liberación del NO; mientras que en condiciones patológicas está involucrado en la producción de factores vasoconstrictores. Por ejemplo: endotelin 1 (ET1), favorece la migración de leucocitos y plaquetas; factores de diferenciación y crecimiento celular del músculo liso.
Mecanismo establecido en el reclutamiento y en la interacción del leucocito con la célula endotelial
La cascada de eventos que se producen está vinculada con la migración y adhesión o rodamiento de leucocitos en el sitio de inflamación y daño tisular; este fenómeno está regulado inicialmente por 3 miembros de la familia de las selectinas: L-selectina que es producida constitutiva-mente en la membrana de los linfocitos, granulocitos y monocitos, el papel de esta selectina está relacionado con el establecimiento de linfocitos en ganglios linfáticos y con la adhesión de neutrófilos, monocitos y linfocitos al endotelio activado; P-selectina se encuentra en los gránulos a de las plaquetas y en los cuerpos de Weibel-Palade de la célula endotelial donde se exportan a la superficie celular después de su activación inducida en minutos una vez que se establece el daño tisular por mediadores como la trombina, la histamina, los factores finales de la cascada del complemento y el peróxido de hidrógeno (H2O2). Puede ser inducida además por la acción de endotoxinas, factor de necrosis tumoral (TNF) e infecciones virales. Su función específica está vinculada con el fenómeno de adhesión y rodamiento entre los leucocitos y el endotelio vascular. La selectina E se expresa en la superficie de la célula endotelial tras la activación de citocinas como TNF, interleucina-1 (IL-1) e interferón gamma (IFNg). Este último por sí solo no induce la expresión de esta selectina, pero puede potenciar y prolongar el efecto activador del TNF, que tiene una máxima inducción de 4 a 6 h. Es la responsable de la acumulación de eosinófilos, basófilos, monocitos, neutrófi-los y linfocitos T en el sitio de la inflamación.
Como se puede evidenciar en la tabla 1 cuando ocurre este fenómeno, simultáneamente se expresarán un conjunto de genes que se encuentran involucrados en los cambios o modificaciones que ocurren en el endotelio vascular; esto es regulado por la acción de algunas citocinas, entre ellas la TNF. La variedad de acciones que pueden ejercer este conjunto de genes involucran desde el proceso de angiogénesis que puede ocurrir en la célula endotelial, hasta el efecto de inmunidad y protección que se le confiere a esta barrera fisiológica del organismo.
Tabla 1. Genes que se expresan en la célula endotelial y función específica de cada uno (Tomado de Mantovani A. Immunology Today 1997,18[5].)
|
Genes inducibles por citocinas en células endoteliales | |||
|
Gen | Localización | Citocina | Función |
|
C193 | Núcleo | IL-1; TNF | Desconocida |
|
A20 | Núcleo | TNF | Inhibición NF-kB |
|
B94 | Citoplasma | IL-1; TNF | Angiogénesis |
|
A1 | Intracelular | IL-1; TNF | Homólogo del bcl-2 |
|
B61 | Secretado | IL-1; TNF | Angiogénesis |
|
PTX3 | Secretado | IL-1; TNF | Inmunidad |
Durante este fenómeno de inflamación se liberan además especies reactivas del oxígeno como el NO y el anión superóxido (·O¯2) que responden al efecto inductor del IFNg. Estas especies reactivas son capaces de regular la expresión de biomoléculas relacionadas con la comunicación intercelular a través, entre otros, de los factores transcripcionales como el NFkB, conocido como factor que regula la transcripción nuclear kara B; tal y como queda reflejado en la figura 1, donde se evidencia la interrelación del sistema antioxidante y las especies reactivas del oxígeno (ERO) que dan lugar, una vez roto el equilibrio y creada la situación de estrés oxidativo, a que se expresen los genes codificantes para las biomoléculas relacionadas en la propia figura, y como se conoce, estas tienen relevante participación en los eventos de respuesta celular y muy en particular en las células endoteliales.
Fig. 1. Genes inducibles por el factor NFkB.
Una de las biomoléculas que resulta de particular interés es el interferón (IFN). Los interferones han sido las primeras citocinas clonadas y mejor estudiadas por las herramientas de la biología molecular. Se conoce su estructura, mecanismos de acción y posibles efectos biológicos. Estas moléculas fueron descubiertas por primera vez en 1957 por Isaac y Linderman, los que observaron la presencia de una sustancia que confería resistencia a las células del embrión de pollo a una infección de origen viral;1 de la interferencia observada en estas células proviene el nombre de interferón. En 1965 Wheelock describe otro tipo de interferón el cual se clasifica como tipo II o IFNg tanto por su origen cromosómico diferente así como por su respuesta o liberación ante diferentes variantes biológicas.2
Los IFN son considerados una familia de proteínas o glicoproteínas producidas por células de vertebrados ante diferentes estímulos biológicos. Estas son inducidas por virus, bacterias, micoplasmas, protozoos, ciertas citocinas, mitógenos, ARN de doble cadena tanto naturales como sintéticos y otras sustancias.
Inicialmente los IFN se clasificaron según el tipo de célula donde se producían y sus características génicas: leucocitario o IFNa, fibroblástico o IFNb. Estos 2 tipos de interferones son del tipo I, se caracterizan por ser ácido estables y los genes que los codifican se encuentran localizados en las bandas p21-ter del brazo corto del cromosoma 9; mientras que existe un tercer tipo denominado inmune ó g, clasificado como tipo II y el gen que lo codifica se encuentra ubicado en el brazo largo del cromosoma 12. Este último tipo de IFN tiene un comportamiento ácido lábil, y es inactivo a un pH = 2 en un período de tiempo de muy pocos minutos.3
Hoy día por los avances de la biología molecular esta clasificación está basada en la estructura génica y proteica que agrupa como IFN tipo I a alfa, beta, delta, omega y tau; mientras como tipo II se encuentra solamente el IFNg. En la tabla 2 se puede apreciar de forma general la diferencia existente entre los grandes grupos de interferones que se han podido caracterizar hasta el momento actual.
Tabla 2. Elementos comparativos entre los interferones tipo I y tipo II
|
Variables | IFN tipo I | IFN tipo II |
|
Distribución | Mamíferos, aves, peces y posiblemente anfibios y reptiles | Mamíferos y pollos |
| Genes |
Múltiple, sin intrones | Simple, 3 intrones |
|
Proteínas | Monoméricas | Dimérica |
|
Receptor | Formado por 2 subunidades | Formado por 2 subunidades |
|
Expresión por | Varios tipos celulares | Células T y un rango tipo celular limitado de otras células, incluida la célula trofoblástica de cerdo |
|
Estabilidad | Estable a un pH bajo | Inestable a un pH bajo |
Estos 2 grandes tipos de interferones actúan para ejercer su acción sobre 2 tipos de receptores diferentes. El IFNg como caso particular que se encuentra involucrado en la expresión de las ERO.
La forma biológicamente activa de esta citocina va a estar formada por un homodímero no covalente de 34 kDa que contiene 2 cadenas polipeptídicas idénticas y presenta una estructura glicosilada.4,5 Este tipo específico de interferón tiene la particularidad de ser secretado por células natural killer (NK) ante diferentes estímulos como por ejemplo, citocinas derivadas del macrófago como la IL-12 y TNF a y autoestimulada además por el propio IFNg; es liberado además por otros tipos de células: T (Th1) y CD8+ (fenotipo TC1).6
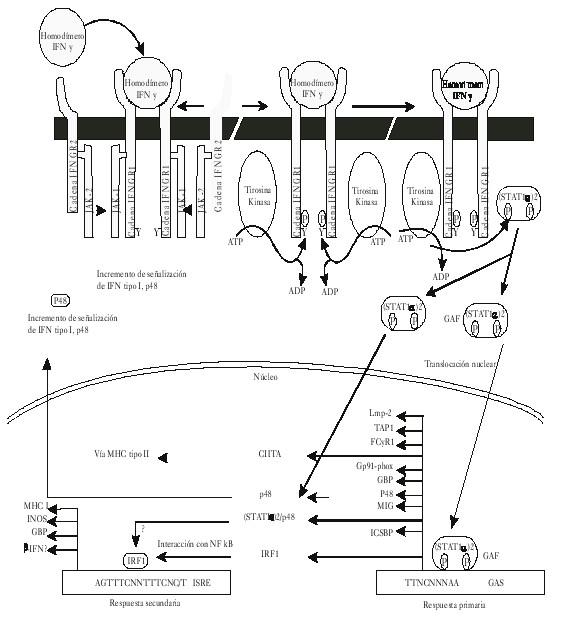
Como puede apreciarse en la figura 2 el receptor para el IFNg desde el punto de vista estructural está formado por 2 cadenas polipeptídicas: IFNGR1 (previamente cadena a o CD119w); esta cadena se encuentra codificada por un gen que se encuentra localizado en el cromosoma 6 humano y tiene una importante función en la mediación de la unión del ligando con el receptor, la incorporación de este a través de la célula y en la transducción de señales. IFNGR2 (previamente cadena b o factor accesorio 1); esta cadena polipeptídica se encuentra codificada por un gen localizado en el cromosoma 21 en humano y la función más relevante que tiene es en el proceso de señalización. Llama poderosamente la atención que en este mismo cromosoma se encuentra localizado el gen que codifica a la enzima Cu-Zn superóxido dismutasa, a la que se le reconoce importante participación como antioxidante en su función de dismutar el O-2. Cada una de estas cadenas polipeptídicas se encuentra constitutivamente asociada con un miembro de las Janus de la familia de las proteínas tirosinas kinasas (JAK). En el caso particular del IFNGR1 se encuentra asociado con las JAK1; mientras que las JAK2 se encuentran asociadas con la cadena IFNGR2 del receptor para el IFN g.
Fig. 2. Esquema del mecanismo de señalización del interferón gamma (IFNg).
La cadena IFNGR1 se expresa constitutivamente de forma moderada. Se sintetiza en el retículo endotelial y sufre el proceso de glicosilación en el aparato de Golgi.7 Esta cadena tiene la particularidad de presentar una mayor afinidad por el ligando y se han identificado secuencias en su dominio extracelular que contribuyen a la especificidad de especie que presenta esta citocina. Hasta el momento se han identificado 3 secuencias importantes: Leu-Ile (270-271). Se plantea que cualquier sustitución o delección por alanina puede generar una deficiencia en la internalización del ligando; mientras que las 2 restantes secuencias Leu-Pro-Lys-Ser (266-269) y Tyr-Asn-Lys-Pro-His (440-444), están involucradas en la inactivación del receptor si sufre cualquier mutación.8,9
La cadena IFNGR2 también se expresa de forma constitutiva, pero a niveles muy bajos, por lo que requiere para su expresión ser regulada por diferentes estímulos externos. La función propia que tiene esta cadena, de menos afinidad por el ligando, es contribuir al proceso de unión ligando-receptor, lo que favorece la estabilización del complejo que se forma. Dentro de las secuencias identificadas importantes en el dominio intracelular se encuentran caracterizadas 2 hasta el momento actual: Pro-Pro-Ser-Ile-Pro (263-267); Ile-Glu-Glu-Tyr-leu (270-274).10 Estas secuencias o dominios se asocian con las JAK2, por lo tanto mutaciones a este nivel afectan esta asociación y por ende la consecuente activación de las proteínas transductoras de señales y activadoras de la transcripción (STAT1).
Mecanismos de señalización (fig. 2)
En este proceso de señalización van a estar involucrados 2 tipos diferentes de proteínas: las STAT1 y las JAKs. En el caso particular de las STAT1 van a formar parte de una gran familia de proteínas consistente en 7 productos génicos que desempeñan un papel importante en la mediación de efectos biológicos en una gran variedad de citocinas y factores de crecimiento.9 Las STAT tienen un peso molecular que se encuentra en el rango de 84 a 113 kD. Esta proteína en ausencia de estímulos se encuentra en forma de monómeros latentes en el citosol y en su estructura presenta dominios SH2 que se han identificado como importantes para establecer su unión con la cadena IFNGR1 del receptor. En el proceso de activación de estas proteínas se relaciona su activación con la fosforilación en un residuo de tirosina que se encuentra ubicado en la posición 701.10 Este fenómeno de fosforilación es llevado a cabo por las JAKS que se encuentran asociadas constitutivamente con ambas subunidades para el receptor del IFNg. Una vez establecida la activación de las STAT, estas forman homodímeros denominados también como factor de activación por el gamma (FAG), que translocan al núcleo y se unen a un sitio promotor denominado sitio activado por el gamma (SAG).11
Las otras proteínas involucradas en el fenómeno de señalización son las denominadas JAKS; en el caso específico del IFNg serían las JAK1 y JAK2. Estas proteínas que se encuentran asociadas constitutivamente con ambas cadenas del receptor para el IFNg cumplen la función biológica de fosforilar a las proteínas STAT después de sufrir una transactivación en respuesta a la interacción ligando receptor. Una vez que se establece esta interacción se genera un conjunto de acciones biológicas de esta molécula que abarca desde efecto antiviral, inmunomodulador así como antiproliferativo.
Dentro de las funciones biológicas de esta citocina una vez establecida su activación; es la de ejercer un efecto inductor en la generación de moléculas mediadoras que son producidas a su vez por la célula endotelial y que tienen como función principal la de activar un conjunto de células que van a ser reclutadas en el sitio del proceso inflamatorio (tabla 3).
Tabla 3. Mediadores producidos por células endoteliales
|
Molécula | Inductor | Blanco |
|
IP-10 (proteína inducible de IFN) | LPS, IFN g | Monocito |
|
MCP-1 (proteína quimiotáctica de monocito) | IL-8, IFN g | Monocito, NK, basófilo |
|
Rantes | TNF, IFN g | Monocito,NK, basófilo, eosinófilo |
LPS: lipopolisacáridos.
Algunos subtipos de estas células una vez activadas y reclutadas en el sitio de la inflamación son capaces de generar la producción de IFNg, y esta citocina a la vez estimula la activación de otros subtipos celulares. Entre los tipos de células que son activadas cabe mencionar el macrófago. Es bueno señalar que en el nivel de esta célula se están produciendo algunas ERO; por ejemplo NO. Esa reacción ocurre por el efecto inductor que genera el IFNg en la activación de la enzima óxido nítrico cintaza.12 La velocidad de esta reacción depende en gran medida de la acción del cofactor tetrahidrobiopterina; esto ocurre por la inducción del gen que codifica para la enzima GTP ciclohidroxilasa I, que es la enzima limitante o sensor en la reacción de síntesis de novo del cofactor antes mencionado. Por otra parte la producción de NO depende en gran medida del suministro de nitrógeno en esta reacción que se debe a la presencia del aminoácido argininosuccínico. La enzima que regula la producción del mismo (argininosuccínico sintetasa), es regulada también por el IFNg. En el caso particular del ·O-2 también la citocromo b 558 (formada por gp91, gp22, gp47, gp67) sufre un proceso de regulación por la acción del IFN; por lo que el gen que codifica la subunidad gp91 se encuentra intensamente regulado por la acción del IFNg. Este fenómeno ha sido ampliamente estudiado en la práctica médica, tal es así que enfermedades que evolucionan con una deficiencia en la expresión del gen gp91 como la granulomatosis crónica tienen una buena respuesta con el empleo de esta citocina.
Este conjunto de mecanismos evidencia el complejo carácter de la respuesta celular donde se reafirma el papel desempeñado por las ERO como segundos mensajeros, teniendo en cuenta los eventos regulados por el predominio de uno de los componentes del sistema antioxidante-proxidante y su consecuencia reconocida como estrés oxidativo si predominan los factores prooxidantes.
Summary
Interferons are part of a family of proteins that have various biological effects. In particular interferon is involved in the inflammatory process and the production of reactive oxygen species. Once this cytosine is activated, it induces the generation of mediating molecules and these in turn activate a group of cell which are recruited at the site of the inflammatory process. Among the types of activated cell, we may find the macrophage where reactive oxygen species such as nitric oxide (NO) are produced as a result of the inductive effect of interferon on the nitric oxide synthase enzyme. The speed of this reaction depends on the tetrahydrobipterin co-factor where the limiting enzyme is coded by an interferon-activating gene. On the other hand, the enzyme modulating the production of nitric oxide by the nitrogen supply is also regulated by this cytosine.
Subject headings: INTERFERONS/therapeutic use; REACTIVE OXYGEN SPECIES; NITRIC OXIDE/ therapeutic use; ENDOTHELIUM, VASCULAR; DEFENSE MECHANISMS; OXIDATIVE STRESS.
Referencias bibliográficas
- Allen G, Díaz MO. Nomenclature of the human interferon proteins. J Interferon Cytokine Res 1996;16:181-4.
- Wheelock EF. Interferon-like virus-inhibitor induced in human leukocytes by phytohemagglutinin. Science 1965;149:310-1.
- Kontsek P, Kontsekova E. Forty years of interferon. Acta Virologica 1997;41:349-53.
- Gray PW. Expression of human immune interferon cDNA in E. coli and monkey cells. Nature 1982;295:503-8.
- Gray PW. Cloning and expression of murine immune interferon cDNA. Proc Natl Acad Sci 1983;80:5842-6.
- Howard A. Molecular regulation of citokine gene expression: Interferon g as a model system. En: Progress in nucleic acid research and molecular biology. Vol 56.
- Hershey GK, Schreiber RD. Biosynthetic analysis of the human interferon g receptor. Identification of N-linked glycosylation intermediates. J Biol Chem 1989;264(11):981-8.
- Farrar MA, Schreiber RD. The molecular cell biology of interferon g and its receptor. Annu Rev Immunol 1993;11: 571-611.
- Farrar MA, Fernandez-Luna, Schreiber RD. Identification of two regions within the cytoplasmic domain of the human interferon gamma receptor required for function. J Biol Chem 1991;266:19626-35.
- Bach EA, Tanner JW, Marsters SA, Ashkenazi A, Aguet M, Shaw AS et al. Ligand-induced assembly and activation of the gamma interferon receptor in intact cells. Mol Cell Biol 1996;16:3214-21.
- Darnell JE Jr, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signalling proteins. Science 1994;264:1415-21.
- Wilks AF, Harpur AG, Kurban RR, Ralph SJ, Zurcher G, Ziemiecki A. Two novel protein tyrosine kinases, each with a second phosphotransferase-related catalytic domain, define a new class of protein kinase. Mol Cell Biol 1991;11: 2057-65.
Recibido: 10 de febrero del 2000. Aprobado: 18 de mayo del 2000.
Centro de Ingeniería Genética y Biotecnología. Apartado Postal 6162, Avenida 31 e/ 158 y 190, Cubanacán, La Habana, Cuba.