Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.21 n.2 Ciudad de la Habana abr.-jun. 2002
Instituto Superior de Ciencias Médicas de Villaclara
El citoesqueleto de actina: una perspectiva desde la biología molecular del cáncer
Dra. Otmara Guirado Blanco, Dra. Montserrat Solanas García, Dra. Irmgard Costa Traschel y Dr. Eduard Escrich Escriche
Resumen
Se realizó una síntesis de los temas que emergen en la actualidad sobre la estructura y organización del citoesqueleto de actina y las vías de señalización que participan en su regulación. La información bibliográfica consultada se ha tratado de ofrecer con un enfoque funcional, sin obviar los mecanismos moleculares involucrados. Se incluye, además, un pequeño apartado sobre la participación de las proteínas Rho en el proceso de transformación maligna, a partir del hecho conocido de que en el fenotipo transformado tumorigénico se pueden apreciar cambios morfológicos que involucran al citoesqueleto de actina.
DeCS: CITOESQUELETO; BIOLOGIA MOLECULAR; PROTEINAS DE MICROFILAMENTOS; PROTEINAS DE NEOPLASMAS.
El citoesqueleto de actina es una red dinámica de polímeros de actina y gran variedad de proteínas asociadas. Sus principales funciones fisiológicas están relacionadas con la motilidad celular y los cambios de forma de la célula durante el ciclo celular. También, participa en la organización del citoplasma para generar fuerzas mecánicas dentro de la célula en respuesta a diversas señales extracelulares, es esencial para algunas actividades contráctiles y controla las interacciones celulares, la adhesión molecular, y el transporte intracelular.1-3
Las relaciones y funciones de la actina del citoesqueleto son moduladas por vías de señalización que responden a estímulos que inciden sobre la membrana plasmática. En este sentido, el estudio de las moléculas que son componentes de las vías de señalización celular como la superfamilia de proteínas Ras, dentro de las cuales se incluye la familia de proteínas Rho, resulta de particular interés. Las GTPasas-Rho participan en la regulación de la organización del citoesqueleto de actina, están envueltas en vías de señalización que activan cascadas de quinasas que regulan la expresión génica y controlan la progresión del ciclo celular y la proliferación celular.1,2,4 Algunas de las proteínas de esta superfamilia o de sus reguladores resultan ser oncogénicas, y de hecho, las mutaciones o la sobreexpresión de estas se hallan implicadas en diferentes tipos de cáncer.4
Este artículo resume una buena parte de la información publicada sobre las bases moleculares y los mecanismos que intervienen en la organización del citoesqueleto de actina. El objetivo fundamental es ofrecer esta información con un enfoque funcional, hacer énfasis en la percepción actual sobre la transducción de señales al citoesqueleto, así como, en las implicaciones de la familia Rho de proteínas en la transformación maligna inducida por Ras.
Actinas citoplasmáticas: estructura y expresión de los genes g y b
La actina es codificada por una familia multigénica que ha evolucionado a partir de un gen precursor común. En los mamíferos y las aves existen 6 isoformas de actinas estructuralmente relacionadas, clasificadas según su patrón de expresión en 4 actinas musculares (a-esquelética, a-cardíaca, a-vascular y g-entérica), y 2 actinas no musculares o actinas citoplasmáticas (b-actina y g-actina).5,6 La b actina es la principal isoforma de las actinas citoplasmáticas y está expresada en la mayoría de las células eucarióticas no musculares, así como en mioblastos indiferenciados.7 Las actinas musculares son tejido específicas y están funcionalmente envueltas en la contracción muscular. En cambio, las actinas citoplasmáticas están expresadas en todos los tipos celulares y participan en una gran variedad de funciones.8 La distinción entre actinas musculares y no musculares aparece en animales superiores, aunque es observada en vertebrados e insectos. En los vertebrados de sangre caliente la isoforma b es regulada negativamente y sustituida por las isoformas musculares específicas durante el proceso de miogénesis.9 Las isoformas de actina no solo se expresan diferencialmente en los distintos tipos celulares, también pueden coexistir dentro de la misma célula y segregarse a diferentes regiones.10,11
El gen funcional humano de la b-actina (ACTB) ha sido mapeado en el cromosoma 7p22.12 Está formado por 5 intrones y 6 exones, 4 de los intrones se hallan interrumpiendo la región codificante entre los codones: 41/42, 121/122, 267 y 327/328. En la región no transcrita 3’ no aparecen intrones en el humano; sin embargo, la región no transcrita 5’ presenta un largo intrón (intrón I), 6 nucleótidos hacia delante del codón de iniciación. Las posiciones relativas de las secuencias correspondientes a las cajas TATA y CCAAT se corresponden con secuencias similares de otros genes.7,10,13
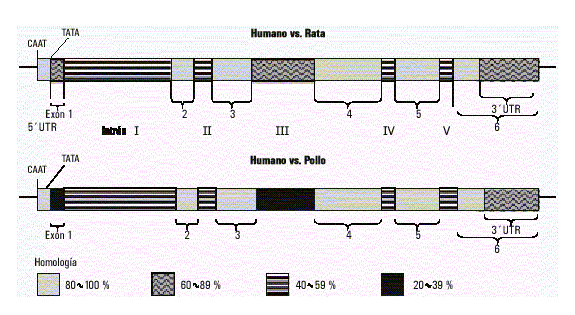
El gen de la g-actina (ACTG1) se halla localizado en el cromosoma 17q2512 y presenta una elevada homología estructural con el de la otra actina citoplasmática. Está formado por igual número de intrones y exones, también el intrón I es el más largo y se encuentra ubicado en la misma posición. Los restantes intrones se hallan interrumpiendo la región codificante en idénticos codones, pero su longitud es menor que los de su contraparte en el gen de b-actina. Asimismo, existe considerable homología en la región flanqueante 5’ y en la secuencia de bases del intrón III. Tal similitud estructural indica que ambos genes se originaron por duplicación génica de un gen ancestral común; probablemente, esta duplicación involucrara, además, a los elementos reguladores de estos, lo que explicaría la persistencia de la coexpresión de ambos genes.14 También existe una considerable homología interespecie entre estos genes, por ejemplo, entre el gen humano de la b-actina y el de rata existe 90 % de homología y más de 85 % de homología con el de pollo. La región límite exón//intrón en las regiones codificantes son idénticas en los 3 genes; sin embargo, el tamaño de los intrones es diferente (fig. 1).7,10,15
Fig. 1. Homología interespecies del gen de b-activa.
En estudios de la expresión de los genes de g y b-actina realizados en diferentes especies de mamíferos, se ha encontrado que ambos mensajeros poseen una longitud de »2 100 pb, correspondiendo »1 100 a las regiones codificantes. Asimismo, existe una elevada conservación interespecie de la longitud de las regiones no codificantes, que no excluye la posibilidad de secuencias divergentes.5,16 En el humano, el ARNm de la b-actina tiene una longitud en la región codificante de 1 761 pb, 41 pb en la región 5’ UTR y 595 pb en la región 3’ UTR. Esta última está flanqueada por una cola poli A de 50 pb aproximadamente.15 En el ratón se ha descrito un transcrito de b-actina de » 2,1 Kb que incluye 1 128 nt correspondientes a la región codificante, 670 nt de la región 3’ UTR y una larga cola poli A. Esta región 3’ no codificante es la menos conservada del gen entre los dos tipos de actina y se considera isotipo específica.17-20
Los ARNm de ambas actinas citoplasmáticas se hallan segregados dentro de la misma célula y, aunque existe coexpresión, está sujeta a regulación diferencial e independiente para cada isoforma en los diferentes tipos celulares.14,21,22 Se ha demostrado que el ARNm de la b-actina se localiza en las regiones periféricas móviles y la región perinuclear, mientras, el ARNm de la g actina solo se asocia con la región perinuclear, lo que implicaría una señal de localización que es única para la isoforma b y podría reflejar procesos relacionados con la motilidad celular.21,22
La molécula de actina tiene un peso molecular de 41 736 kD y es un único polipéptido de 375 aminoácidos asociado muy íntimamente con una molécula de ATP. Las isoactinas musculares difieren entre sí en 4 a 6 aminoácidos y en 25 aminoácidos de las no musculares. En cambio, las actinas citoplasmáticas se diferencian en 4 aminoácidos en el extremo amino-terminal.6,7
Transmisión de señales al citoesqueleto
El citoesqueleto está compuesto de 3 tipos principales de proteínas filamentosas: microtúbulos, filamentos intermedios y microfilamentos. Los microfilamentos son polímeros de actina que junto con un gran número de proteínas asociadas y proteínas de unión a la actina constituyen el citoesqueleto de actina.
El ensamblaje de la actina del citoesqueleto está regulado a múltiples niveles, incluida la organización monomérica de la actina dentro del polímero y la superorganización de los polímeros de actina en una red de filamentos. Un gran número de proteínas de unión a la actina regula el ensamblaje y controla la formación de los filamentos y el entrecruzamiento de la red de actina. Las funciones de estas proteínas son moduladas por moléculas señalizadoras como el calcio o los fosfoinosítidos fosforilados.1,7,23-25
Se han acumulado muchas evidencias de que tanto en células de mamíferos como en levaduras, las GTPasas de la familia Rho son los reguladores de las vías de señalización que unen los estímulos extracelulares o intracelulares al ensamblaje y organización de la actina del citoesqueleto.2,7,23 Las proteínas Rho pertenecen a la superfamilia de proteínas Ras, y comparten cerca de 50 a 60 % de identidad entre ellas y 30 % de identidad con Ras. Atendiendo a las diferencias funcionales y en secuencia, la familia de GTPasas Rho en células de mamíferos puede ser dividida en 5 grupos:
- RhoA, Rho B y RhoC.
- Rac1, Rac2, y RhoG.
- Cdc42 y TC10.
- RhoD.
- RhoE y TTF.
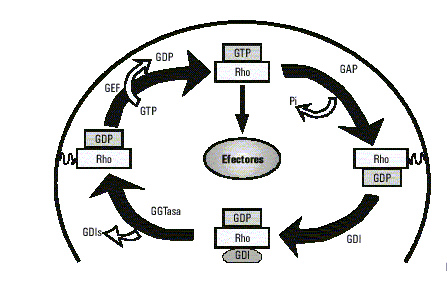
De forma similar a otros miembros de la familia Ras, las proteínas Rho funcionan como interruptores binarios, activos en su forma unida a GTP e inactivos en la forma unida a GDP. El ciclo entre el estado activo y el inactivo es regulado por factores intercambiadores de GTP/GDP (GEFs), proteínas estimuladoras de la actividad GTPasa (GAPs) e inhibidores de la disociación de los nucleótidos de guanina (GDIs).26 La familia de Rho-GEFs actualmente cuenta con más de 20 miembros y la mayoría de estos han sido identificados como oncogenes.27,28 Todos los Rho-GEFs comparten un dominio DH (homología Dbl) de cerca de 200 aminoácidos, que es necesario para la actividad intercambiadora de Rho. También poseen un dominio PH (homología Pleckstrin) adyacente al anterior, que media las interacciones proteína-proteína y proteína-fosfolípidos. Las mutaciones o delecciones del dominio PH en algunos GEFs traen como consecuencia una pérdida de su capacidad transformante.28-30 En cambio, las GAPs unidas a Rho-GTP aceleran su baja actividad GTPasa intrínseca, transformándola en su forma inactiva unida a GDP. Han sido identificadas más de 15 proteínas que contienen un dominio GAP, estas incluyen en mamíferos: p50rhoGAP, BCR, ABR, p190, 3BP-1 y la subunidad regulatoria p85 de PI3K. Asimismo, BCR y ABR son reguladores multifuncionales y pueden servir tanto de RhoGEF como de RhoGAP.4,31,32 Los GDIs fueron primeramente identificados como proteínas capaces de inhibir la disociación del GDP de Rho, sugiriendo una función inhibidora de GEFs; sin embargo, también pueden actuar como inhibidores de GAPs. En las células en reposo, las proteínas Rho están asociadas con GDIs en el citoplasma, pero durante la activación son liberadas del GDI y traslocadas a la membrana4,33 (fig. 2).
Fig. 2. Ciclo de las GTPasas.
Proteínas Rho y transducción de señales al citoesqueleto
En las células de mamíferos las proteínas Rho (RhoA, Cdc42 y Rac) están activadas por señales extracelulares específicas y dirigen la organización de la actina del citoesqueleto para inducir cambios morfológicos característicos. Se ha observado en líneas celulares derivadas de fibroblastos que las RhoGTPasas parecen actuar en una cascada, en la cual Cdc42 activa a Rac y esta a su vez activa a Rho.1,4 La microinyección de la proteína Rac en células en cultivo provoca incremento en la formación de lamellipodios y replegamientos (rufflings). En cambio, mutantes negativos de Rac inhiben la formación de lamellipodios inducidos normalmente por diversos factores de crecimiento como PDGF, EGF, o insulina; esto indica que la respuesta a estos factores es dependiente de Rac. Por otro lado, la inyección de Ras activado también induce replegamientos o rizos de la membrana en una vía dependiente de Rac, sugiriendo que Ras actúa hacia arriba de Rac. En cambio, la microinyección de la proteína Rho o la activación de Rho por LPA (ácido lisofosfatídico) produce la aparición de grandes haces de filamentos de actina, conocidos como fibras de estrés, y el incremento de contactos focales; mientras la activación de Cdc42 por bradicinina provoca la formación de microespículas periféricas de actina incluida la filopodia.1,4,34 Estas obser-vaciones sugieren que la familia de proteínas Rho, además de regular diversos procesos celulares, es un componente crítico de una vía de señalización independiente de Raf-1 (efector clave de Ras), importante para la actividad transformante de Ras.1,4,35-37
La familia de proteínas Rho media sus acciones a través de múltiples dianas efectoras, estas pueden clasificarse atendiendo a sus uniones específicas en 2 grupos: 1. las que se unen a Rac, Cdc42 o ambas, pero no a Rho y 2. las que se unen a Rho.4,38,39 Entre los principales efectores de Rac, Cdc42 o ambas, se encuentran las 3 isoformas de las quinasas serina/treoninas (PAKs), la tirosina quinasa (ACK) y la proteína del síndrome de Wiscott-Aldrich (WASP).1,4 Contienen motivos de unión a Rho las 2 quinasas serina/treonina relacionadas con la proteína quinasa C (PKN/PRK1 y PRK2), 2 proteínas carentes de dominios quinasas (Rhotekina y Rhofilina) y las proteínas citrón.40,41 Otras dianas identificadas de Rho incluyen las quinasas ROKa/Rho, Rhob y p160 ROCK; no obstante, las funciones y moléculas efectoras de estas proteínas son mayormente desconocidas.4,40
Proteínas de la familia Rho y cáncer
Las GTPasas Rho desempeñan un papel importante en el control del crecimiento y la proliferación celular, es conocido que estas proteínas estimulan la progresión de la fase G-1 del ciclo celular y la síntesis de ADN, así como vías de señalización que activan gran variedad de factores de transcripción nuclear.42,43 Además, se ha demostrado que las proteínas Rho poseen un potencial transformante en algunas líneas celulares y muchos GEFs para Rho, Rac y Cdc42 son oncogénicos.4,27,28 Asimismo, Rho y Rac constitutivamente activados incrementan el crecimiento celular e inducen crecimiento independiente y formación de tumores.35-37 Rac pero no Rho provoca transformación maligna en fibroblastos de roedores y Cdc42 activado induce la formación de tumores en ratones desnudos. Por otro lado, Rac, Rho y Cdc42 son esenciales para la transformación maligna inducida por Ras, existen datos experimentales que demuestran que la coexpresión de Rac1 y RhoA con Raf-1 provoca una actividad transformante cooperativa. De forma similar, la coexpresión de Rac1 y RhoA activados con Ras oncogénico causa un gran incremento de la transformación morfológica.4,29,35 En cambio, la coexpresión de mutantes dominantes negativos de Rac1, RhoA y Cdc42 reduce la actividad transformante de Ras en fibroblastos de roedores. Tales observaciones indicarían que las proteínas Rho probablemente contribuyen a las acciones transformantes de Ras; sin embargo, los cambios morfológicos observados en las células transformadas podrían ser causados, en parte, por desregulación de la función de las proteínas Rho, porque en las células transformadas por Ras no se han descrito niveles constitutivamente elevados de alguna proteína específica de la familia Rho.4,35
Finalmente, existe un conjunto de evidencias obtenidas de modelos experimentales de cáncer en animales que demuestran una relación inversa entre los niveles de expresión de b actina y el grado de diferenciación celular. El aumento de expresión de este gen en el proceso de carcinogénesis puede considerarse partiendo del hecho de la participación de los filamentos de actina en los fenómenos biológicos de división celular, interacciones celulares, adhesión y migración celular. De este modo, la desorganización de estos filamentos, observada en fibroblastos transformados, podría estar asociada con un aumento en la motilidad de las células tumorales en cultivo y con un incremento del potencial metastásico in vivo.44
Consideraciones finales
La identificación de que las proteínas Rho actúan como interruptores moleculares en un complejo circuito de señalización que regula la organización del citoesqueleto de actina, así como las implicaciones de estas proteínas en la actividad transformante de Ras oncogénico, son temas emergentes en el campo de la biología molecular del cáncer; sin embargo, aunque existen muchas evidencias de la importante función que desempeñan las proteínas Rho en la proliferación, el reordenamiento de la actina y la transformación celular, las interrelaciones entre estas funciones aún no son suficientemente comprendidas.
Summary
A synthesis of the topics that nowadays deal with the structure and organization of the actin cytoskeleton and with the ways of signaling taking part in its regulation is made. The reviewed bibliographic information has been provided through a functional approach, without excluding the molecular mechanisms that are involved. It is also included a brief section on the participation of Rho proteins in the process of malignant transformation, starting from the known fact that the morphological changes involving the actin cytoskeleton may be appreciated in the transformed tumorigenic phenotype.
Subject headings: CYTOSKELETON; MOLECULAR BIOLOGY; MICROFILAMENT PROTEINS; NEOPLASM PROTEINS.
Referencias bibliográficas
- Schmit A, Hall MN. Signalin to the actin cytoskeleton. Annu Rev Cell Dev Biol 1998;14:305-38.
- Small JV, Rother K, Kaverina I. Funtional design in the cytoskeleton. Curr Opin Cell Biol 1999;11:54-60.
- Moustakas A, Theodoropoullos PA, Gravanis A, Haussinger D, Stournaras C. The cytoskeleton in cell volume regulation. Contrib. Nephrol. Basel Karger 1998;123:121-34.
- Khorravi-Far R, Campbell S, Rossman KL, Der CJ. Increasing complexity of Ras Signal Transduction: Involvement of Rho Family Proteins. Adv Cancer Res 1998;72:55-105.
- Dodemont HJ, Soriano P, Quax WJ, Ramaekers F, Leutra JA, Groenen MAM et al. The genes coding for the cytoskeletal proteins actin and vimentin in warm – blooded vertebrates. EMBO J 1982;1(2):167-71.
- Lodish H, Baltimore AB, Zipursky SL, Matsudaira P, Darnell J. Microfilaments cell motility and control of cell shape. En: Molecular Cell Biology. 3ª ed. New York: Ed. Scientific American Books Inc. 1995, p.991-1050.
- Nudel U, Zakut R, Shani M, Neuman S, Levy Z, Yaffe D. The nucleotide sequence of the rat cytoplasmic b actin gene. Nucleic Acid Res 1983;11(6):1759-71.
- Small JV, Gimona M. The cytoskqleton on the vertebrate smooth mucle cell. Acta Physiol Scand 1998;164:341-8.
- Hayward LJ, Schwartz RJ. Sequential expression of chicken actin genes during myogenesis. J Cell Biol 1986;102:1485-93.
- Nakajima Ijima S, Hamada H, Reddy, Kakunaga T. Molecular structure of the human cytoplasmic b gene. Interspecies homology of sequence in the introns. Proc Natl Acad Sci USA 1985;82:6133-7.
- Mounier N, Perriard JC, Gabbiani G, Chaponnier C. Transfected muscle and non muscle actins are differentially sorted by cultured smooth muscle and non muscle cells. J Cell Sci 1997;110:839-45.
- Nayama H, Inaza J, Nishino H, Ohkubo I, Miwwa T. FISH localization of human cytoplasmic actin gene ACTB to 7p22 and ACTG1 to 17q25 and characterization of related pseudogene. Cytogenet Cell Genet 1996;74(3):221-4.
- Quitschke WW, Lin ZY, DePonti-Zilli L, Paterson BM. The b actin promoter. High levels of transcription depend upon ACCAAT binding factor. J Biol Chem 1998;264(16):9539-45.
- Erba HP, Eddy R, Show ST, Kedes L, Gunning P. Structure, chromosome location and expression of the human g actin gene: Differential evolution, location and expression of the cytoskeletal b and g actin genes. Mol Cell Biol 1988;8(4):1775-89.
- Ponte P, Ng SY, Engel J, Gunning P, Kedes L. Evolutionary conservation in the untraslated regions of actin mRNAs: DNA sequence of a human beta actin cDNA. Nucleid Acids Res 1984;12(3):1687-96.
- Harris DE, Warhaw DM, Periasamy M. Nucleotide sequences of the rabbit alpha-smooth muscle and non muscle actin mRNAs. Gene 1992;112(2):265-6.
- Erba HP, Gunning P, Kedes L. Nucleotide sequence of the human g cytoskeletal actin mRNA: anormalous evolution of vertebrate non-muscle actin genes. Nucleid Acid Res 1986;14(13):5275-94.
- Hanokoglu I, Tanese N, Funchs E. Complementary DNA sequence of a human cytoplasmic actin interspecies divergence of 3’ non-coding regions. J Mol Biol 1983; 163(4):673-8.
- Cleaveland DW, Lopata MA, MacDonald RI, Cowan NJ, Rutter WJ, Kischner MV. Number and evolutionary conservation of a y b tubulin and cytoplasmic b and g actin genes using specific cloned cDNA probes. Cell 1980;20:95-105.
- Alonso S, Minty A, Bourlet Y, Buckinghan M. Comparison of three actin-coding sequence in the mouse, evolutionary relationships between the actin genes of warm-blooded vertebrates. J Mol Evol 1986;23:11-22.
- Hill MA, Gunning P. Beta and gamma actin mRNAs are differentially located within myoblast. J Cell Biol 1993;122(4):825-32.
- Hoock TC, Newcomb PM, Herman IM. b actin and its mRNA are located at the plasma membrane and the regions of moving cytoplasm during the cellular response to injury. J Cell Biol 1991;112(4):653-64.
- Janmey PA. Phosphoinositides and Calcium as regulators of cellular actin assembly and disassembly. Annu Rev Physiol 1994;56:169-91.
- Martin TFJ. Phosphoinositide lipids as signaling molecules; common themes for signal transduction, cytoskeletal regulation and membrane trafficking. Annu Rev Cell Dev Biol 1998;14:231-64.
- Kinnen PKJ, Jukka AK, Lehtonen JYA, Rytomaa AA, Mustonen P. Lipid dynamics and peripheral interactions of proteins with membrane surfase. Chem Phys Lipids 1994; 73:181-207.
- Ridley AJ. Rho: Theme and variations. Curr Biol 1996;6(10):1256-64.
- Cerione RA, Zheng Y. The Dbl family of oncogenes. Curr Opin Cell Biol 1996;8(2): 216-22.
- Lin R, Cerione RA, Manor D. Specific contributions of the small GTPases Rho, Rac and Cdc 42 to Dbl transformation. J Biol Chem 1999;274(33): 23633-41.
- Whitehead IP, Campbell S, Rossman KI. Der CI. Dbl family protein. Biochim Biophys Acta 1997;1332(1):F1-23.
- Zheng Y, Zangrilli D, Cerione RA, Eva A. The plekcstrin homology domain mediates transformation by oncogenic Dbl through specific intracelular targeting. J Biol Chem 1996;271(32):19917-20.
- Erickson JW, Cerione RA, Hart MJ. Identification of an actin cytoskeletal complex that includes IQGAP and the Cdc GTPases. J Biol Chem 1994;272(39):24443-7.
- Brills S, Li S, Lyman CW, Church DM, Wasmuth JJ, Bernards A, et al. The Ras GTPase-activating protein-related human protein IQGAP2 harbors a potential actin binding domain and interacts with calmodulin and Rho family GTPases. Mol Cell Biol 1996;16(9):4869-78.
- Hoffman GR, Nassar N, Cerione RA. Structure of the Rho family GTP-binding protein Cdc42 in complex with the multifuntional regulators Rho GDI. Cell 2000;100(3):345-56.
- Nobes CD, Hall A. Rho, Rac and Cdc42 GTPases regulate the assembly of multimolecular whit actin stress fiber, lamellipodia and filopodia. Cell 1995;81(1)53-62.
- Prendergast GC, Khrosravi-Far R, Solski PA, Lebowittz PF, Der CI. Critical role of Rho in cell transformation by oncogenic Ras. Oncogene 1995;10(12):2289-96.
- Quiu RG, Chen J, McCormick F, Symons M. A role for Rho in Ras transformation. Proc Natl Acad Sci USA 1995;92(25):11781-5.
- Quiu RG, Chen J, Kirn D, McCornik F, Symons M. An essential role for Rac in Ras trasformation. Nature 1995;374(6521):457-9.
- Madaule P, Furuyashiki T, Reid T, Ishizaki T, Watanabe G, Morii N, et al. A novel partner for the GTP-bound forms of Rho and Rac. FEBS Lett 1995;377(2): 243-8.
- Fujisawa K, Madaule P, Ishizaki T, Watanabe G, Bito H, Saito Y, et al. Different regions of the rho determine Rho-selective binding of different classes of Rho target molecules. J Biol Chem 1998;273(30):18943-9.
- Watanabe G, Saito Y, Madaule P, Ishizaki T, Fujisawa K, Morii H, et al. Protein Kinase (PKN) and PKN-related protein rhophilin as target of small GTPases Rho. Science 1996;271(5249):645-8.
- Reid T, Furuyashiki T, Ishizaki T, Watanabe G, Watanabe N, Fujisawa K, et al. Rhotekin, a new putative target for Rho bearing homology toa serine/threonine kinase, PKN and Rhophilin in the Rho-binding domain. J Biol Chem 1996;721(23):13556-60.
- Blanchard JM. Small GTPases, adhesion, cell cycle control and proliferation. Pathol Biol 2000;48(3):318-27.
- Joyce D, Bouzahzah B, Fu M, Albanese C, D’ Amico M, Steer J, et al. Integration of Rac –dependent regulation of cyclin D1 transcription through a nuclear factor kappa B dependent pathway. J Biol Chem 1999;274(36):25245-9.
- Evers EE, Zondag GC, Malliri A, Price LS, Ten Klooster JP, Vander Kammen RA, et al. Rho family proteins in cell adhesion and cell migration. Eur J Cancer 2000;36(10):1269-74.
Recibido: 8 de marzo de 2001. Aprobado: 27 de abril de 2001.
Dra. Otmara Guirado Blanco. Instituto Superior de Ciencias Médicas de Villa Clara. Carretera de Acueducto y Circunvalación. Apartado 860, Santa Clara, Villa Clara, Cuba. Correo electrónico: otmara@capiro.vcl.sld.cu