Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.23 n.2 Ciudad de la Habana abr.-jun. 2004
Trabajos originales
Sociedad Odontológica de La Plata, Argentina
Membranas de colágeno polimerizado: consideraciones sobre su uso en técnicas de regeneración tisular y ósea guiadas
Dr. Diego M. Bernales, Dr. Facundo Caride, Dr. Adrián Lewis y Dr. Lagens Martin
Resumen
Se desarrolló MEMBRACEL-Uso Odontológico-(MO), membrana de colágeno reabsorbible de extrema pureza, teniendo en cuenta como antecedente MEMBRACEL-Apósito de colágeno, uso médico, diseñada como cubierta cutánea transitoria. Se presentaron, además, los informes preliminares de una secuencia de trabajos en los que se demuestra como primera etapa la biocompatibilidad de MO realizando cultivos de queratinocitos sobre el biomaterial. Posteriormente se trabajó con animales de laboratorio recogiéndose datos que alentaron experiencias clínicas. Los resultados obtenidos son avalados por microscopia, cortes histológicos, transiluminación y fotografía.
Palabras clave: Colágeno, membrana reabsorbible, regeneración ósea guiada, regeneración tisular guiada.
Colágeno
El colágeno ha sido uno de los materiales más utilizados en medicina para reparar daños o traumas químico-mecánicos, ya sea en piel o mucosas, debido a su biocompatibilidad y su capacidad para promover la cicatrización de heridas. Esta proteína estructural representa, en los mamíferos, 30 % de las proteínas totales del organismo. Su función es mecánica y de soporte, siendo un componente importante de la matriz extracelular. Cuando el procolágeno intracelular se secreta al medio extracelular, las moléculas liberadas bajo la forma de un precursor tropocolágeno se reúnen en fibras responsables de la integridad funcional y estructural de tejidos como hueso, cartílago, mucosas, dermis, dentina, etcétera.
En los tejidos humanos se conocen alrededor de 16 tipos de colágeno diferentes, siendo los más abundantes y por lo tanto los más estudiados los de tipo I, presente en hueso, los de tipo II, presente en cartílago hialino y los de tipo III, presente en piel. La naturaleza común de todos estos tipos de colágenos es la configuración espacial de triple hélice de su estructura molecular, cada una formada por el enrollamiento de 3 cadenas unidas entre sí. Estas cadenas presentan uniones intramoleculares y extramoleculares, las cuales mantienen el entrecruzamiento molecular, requisito necesario para que las fibras de colágeno puedan resistir el impacto al que son sometidas. Cabe mencionar que estas fibras dejan lugar a sustancias cemento, como los proteoglucanos y glucosaminoglucanos, que estabilizan la estructura helicoidal a temperaturas de entre 36 y 48 °C, además de las glucoproteínas, que hacen a las propiedades biomecánicas y a la función de cada tejido. Asimismo, las fibras se disponen espacialmente de diferentes maneras, de acuerdo con la función que habrá de cumplir cada tejido: en paralelo (tendones), como placas en distintas direcciones (piel), en forma de fibras continuas (dientes), dependiendo de las diferentes direcciones de las fuerzas que deban soportar.1
Regeneración tisular y ósea guiadas
La periodoncia fue una de las ramas pionera de la odontología en la búsqueda de recuperar aquellos tejidos perdidos por procesos patológicos. La terapia periodontal reconstructiva tuvo como objetivo, desde sus orígenes, reparar en forma predecible el aparato de inserción de aquellas piezas dentarias que mostraban pérdida de tejido conectivo de soporte y hueso alveolar, a causa del padecimiento de periodontitis en alguna de sus manifestaciones agresivas.2
Desde principios de la década de los años 80, se han investigado diversos biomateriales que han ampliado el espectro de posibilidades a la hora de tratar una lesión periodontal. El estudio de estos materiales aplicados a la cicatrización de las heridas ha derivado en la modalidad de tratamiento denominada regeneración tisular guiada (RTG).3 Esta técnica no se conforma con mejorar las condiciones biológicas y restablecer la salud mediante la reinserción o la nueva inserción de fibras sobre la superficie radicular tratada, sino que avanza hacia la recuperación de los tejidos perdidos.
La RTG consiste en la colocación de barreras sobre el coágulo que se forma en la lesión periodontal, luego del tratamiento quirúrgico del aparato de inserción de las piezas dentarias y la remoción del material patológico. A su vez, dichas barreras deben ser posicionadas por debajo de los colgajos mucoperiósticos, favoreciendo de esta manera la generación de un espacio que deriva en la proliferación tisular. Cabe aclarar que otro de los principios fundamentales de la RTG es la exclusión de las células provenientes del epitelio gingival y el tejido conectivo en el proceso de cicatrización. Este tratamiento selectivo determina qué tipo de células puebla el espacio generado, induciendo de este modo la formación por parte del organismo de nuevo hueso alveolar, nuevo cemento y nuevas fibras de inserción dentoalveolares a expensas de células pluripotenciales existentes en el ligamento periodontal.4
El material más utilizado para la confección de barreras no reabsorbibles ha sido el politetrafluoroetileno expandido. Los resultados satisfactorios han sido una característica común e incuestionable de la innumerable cantidad de trabajos de experimentación y casos clínicos publicados al respecto.5,6 No obstante esto, algunos autores sugieren la utilización de membranas reabsorbibles, argumentando la obtención de resultados igualmente predecibles sin requerir segundas cirugías de remoción.7
Materiales sintéticos como el ácido poliláctico, entre otros, son utilizados para la confección de membranas reabsorbibles.8 Sin embargo, son los distintos tipos de membranas de colágeno los que en la actualidad cuentan con la mayor casuística exitosa reportada.9
Los defectos periodontales no son los únicos casos clínicos en los que la escasez de tejidos condiciona el éxito del tratamiento.
En la actualidad los implantes endoóseos se han convertido en una alternativa predecible para tratar el edentulismo, siendo la disposición de hueso el mayor condicionante de esta técnica.10
La regeneración ósea guiada (ROG) es el nombre con el cual se denomina a aquellas cirugías que se efectúan con la intención de recuperar hueso alveolar atrofiado o mantener el ya existente en brechas edéntulas, mediante la utilización de barreras.
Para realizar ROG es necesario contar con materiales que cumplan con los mismos requisitos de los que se exigen a los utilizados para RTG. A saber: 1. biocompatibilidad; 2. oclusividad celular; 3. generación de espacio; 4. integración a los tejidos y 5. fácil manipulación. Además, es necesario que permanezcan el tiempo suficiente como para permitir la proliferación de los tejidos buscados.11
Trabajos de laboratorio en los que se efectuaron defectos críticos en mandíbula de conejos, han demostrado que las membranas de colágeno son efectivas para evitar la invasión de tejido fibroso cuando se pretende ROG.12 Sin embargo, ante determinadas situaciones clínicas, estas membranas no resisten la presión que le ejercen los tejidos durante la cicatrización. Esto induce al colapso de la herida y por lo tanto al fracaso de la técnica. Es por esta razón que se aconseja su utilización en combinación con distintos tipos de injertos, con la intención de mantener dicho espacio.13,14 Además, estos injertos pueden ser osteogénicos, osteoinductores u osteoconductores.15
La mayoría de las membranas de colágeno actualmente disponibles para RTG y ROG se obtienen del tejido cadavérico humano o animal.16-18 MO (Membracel Uso Odontológico) se ha desarrollado a partir de M, membrana de colágeno utilizada en medicina como cubierta temporaria para el tratamiento de quemaduras, escaras y úlceras varicosas (Strusi EP, Mohadeb C. Quemaduras tratadas con membranas de colágeno. Informe Preliminar. Inédito). La bibliografía al respecto de este nuevo biomaterial no es abundante (Pérez M, Rodríguez Calzadilla O. Seguridad y eficacia de la membrana de colágeno Membracel con Apafil G. IX Congreso de la Sociedad Cubana de Cirugía Maxilofacial. 2003).19
Según datos aportados por el laboratorio, MO sería el producto de una alta purificación de tejido conectivo de animales jóvenes reconstituida en láminas, y estaría compuesta por colágeno tipo I y vestigios de ácido láctico y glicerol. Las características macroscópicas del material son su transparencia y su textura uniforme. Luego de ser humedecida por unos segundos en solución acuosa adquiere mayor resistencia y aumenta su manuabilidad.
A continuación se mostrarán informes de trabajos de investigación in vitro, in vivo y experiencias clínicas preliminares con este material.
Métodos
Cultivo de queratinocitos humanos sobre membranas de colágeno Membracel
Cultivo de queratinocitos humanos
Se obtienen prepucios humanos por circuncisión quirúrgica y se mantienen a 4 ºC en medio MCDB 153 (Sigma) con antibiótico y antimicótico hasta su procesamiento.
Se realizan varios lavados con PBS (solución salina balanceada) sin calcio ni magnesio con antibiótico y antimicótico y se cortan los prepucios en fragmentos de 1 cm2 de superficie.
Se incuban los fragmentos toda la noche a 4 ºC con dispasa (Sigma P- 3417), 250 mg de dispasa en 100 mL de PBS.
Con ayuda de pinzas, se separa cuidadosamente la epidermis de la dermis.
Los fragmentos de epidermis se lavan en PBS con antibióticos y se cortan en piezas de 1 mm, las que se colocan en una placa de petri con tripsina 0,05 % + 0,2 % de EDTA, durante 12 a 15 min a 37 ºC. Se utiliza una pipeta Pasteur para dispersar las células de la epidermis por aspiración repetida. La suspensión obtenida se pasa a un tubo de centrífuga y se agrega igual volumen de factor antitripsina de poroto de soja (Gibco 17075-011). Se centrifuga a 1 500 rpm durante 5 min y el pellet se dispersa en medio MCDB 153 + 100 mg/mL de extracto de pituitaria bovina (Sigma E-0760 ) con antibiótico y antimicótico, se siembra sobre placa o frasco de poliestireno a una densidad de 105 células/cm2.
El subcultivo debe realizarse cuando las células han alcanzado 60 % de confluencia.
Subcultivo y siembra sobre MO
1. Preparación de las membranas: fragmentos de membrana Membracel son colocados en forma aséptica en el fondo de placas de petri para cultivos celulares y lavadas durante 24 h con 3 cambios de medio MCDB 153 + fibronectina humana (Gibco 33010-018 ) 2 mg/cm2.
2. Subcultivo de los queratinocitos: los queratinocitos son lavados con tripsina–EDTA e incubados durante aproximadamente 5 min a 37 ºC y observados al microscopio hasta que las células se desprendan en 90 %. Se agrega factor antitripsina de poroto de soja y se centrifuga a 1 500 rpm durante 5 min. El pellet se dispersa en medio MCDB 153+ extracto de pituitaria bovina + antibiótico y antimicótico. Se cuenta en cámara de Neubauer y se siembra sobre las membranas a una densidad de 105 células/cm2.20,21
Las muestras fueron tratadas por el método Giemsa de coloración y observadas por microscopia de fases.
Regeneración ósea en defecto crítico generado en calota de ratas de laboratorio
Modelos
Se utilizaron 60 ratas macho Wistar de entre 400 y 450 g.
Los animales fueron separados de a 10 al azar, quedando 6 lotes, que a su vez fueron divididos en 2 grupos, A-B y C (grupos control) y D-E y F (grupos de experimentación).
Los sacrificios se establecieron de la forma siguiente: 1. grupos A y D a los 20 d; 2. grupos B y E a los 40 d; y 3. C y F a los 60 d.
Los animales fueron anestesiados por vía intraperitoneal utilizando ketamina 100 mg/kg de peso y cilacina 40 mg/kg.
Las zonas correspondientes a las calotas de las ratas fueron anestesiadas en forma infiltrativa con xylocaína 2 % y 1:100 000 de epinefrina. Dichas áreas fueron rasuradas y desinfectadas con solución de yodopovidona.
Se efectuó una incisión de 3 cm con hoja de bisturí Nº 11 hasta el plano óseo desde el frontal hasta el occipital. Una vez legrados piel y tejidos subyacentes fueron expuestas las calotas craneanas.
Se realizó una lesión circular de 8 mm de diámetro con fresa trefina en las calotas dejando expuesta la duramadre de los 60 animales.
A los grupos D-E y F se les colocaron trozos de MO entre la duramadre y la calota. Los defectos fueron cubiertos con trozos de MO ubicados en forma subperióstica y los colgajos fijados en su lugar por la sutura. El material utilizado a tal efecto fue seda 4-0.
A los grupos A-B y C se les cubrió el defecto solo con la reposición de los colgajos.
Las biopsias fueron descalcificadas y fijadas en parafina. Se realizaron cortes con micrótomo de 6 μm de espesor. Los cortes fueron teñidos con hematoxilina y eosina y observados en un microscopio de luz (Caride F, Caride E, Laguens M. Estudio histomorfológico del comportamiento de un relleno óseo. Reunión anual de la Sociedad Argentina de Periodoncia. 2002).
Las calotas fueron observadas macroscópicamente por el método de transiluminación.
Resultados
Cultivo de queratinocitos humanos sobre membranas de colágeno Membracel
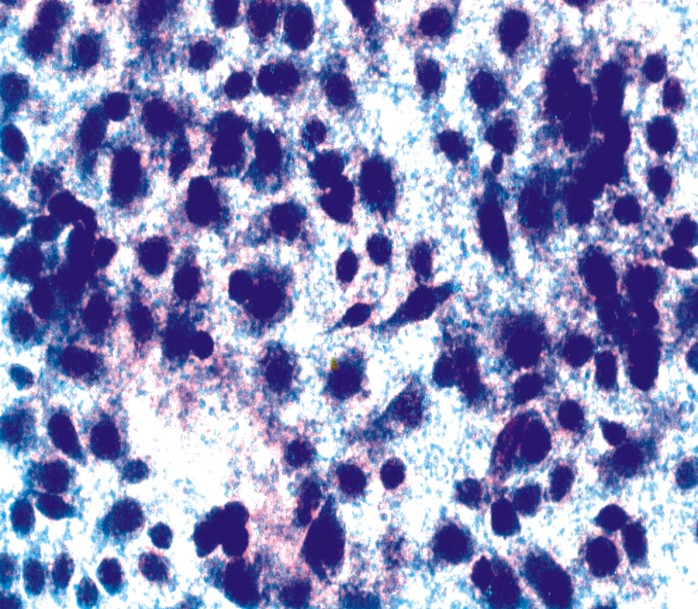
Por microscopia de fases se observó el desarrollo de las células sobre las membranas; no se recogieron datos negativos que pudieran generar dudas respecto de la biocompatibilidad del material (fig.1).
Fig.1. Queratinositos humanos sobre la membrana.
Regeneración ósea en defecto crítico generado en calota de ratas de laboratorio
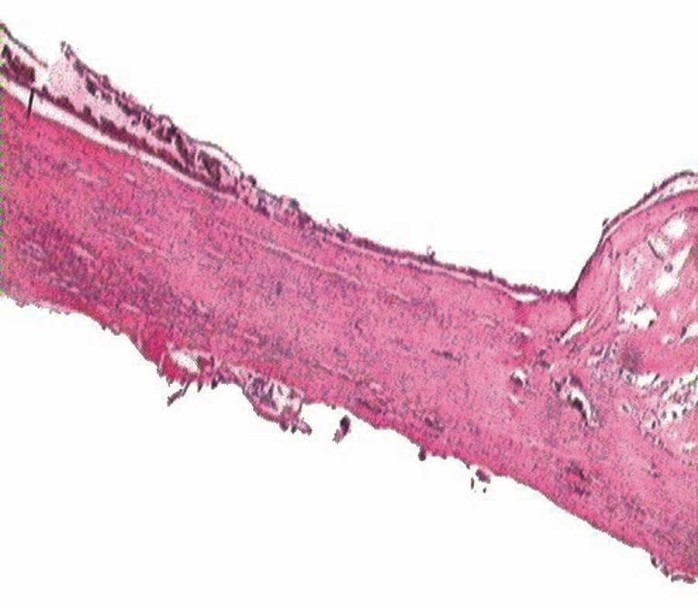
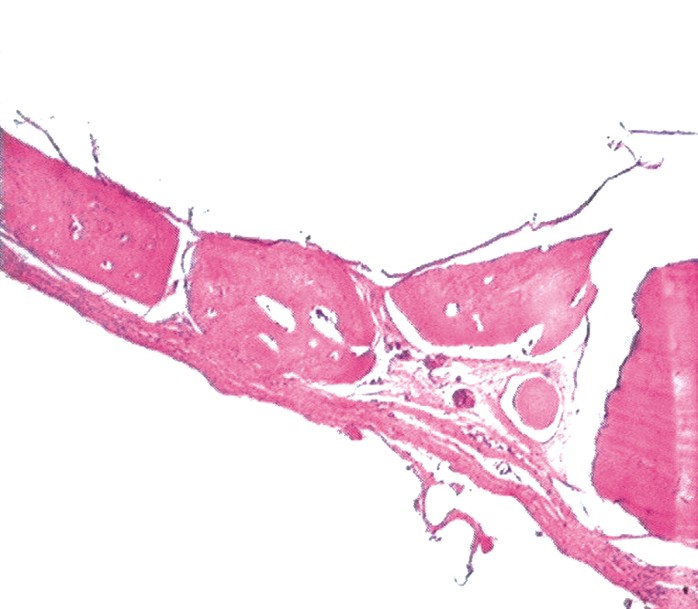
Histología: se realizaron cortes a los 20, 40 y 60 d. Se exponen imágenes correspondientes al grupo control (sin MO) y al experimental (con MO), a los 60 d de efectuadas las cirugías. Mientras que las imágenes correspondientes al grupo control corresponderían a un tejido poco diferenciado, las imágenes del grupo experimental muestran una estructura tisular más organizada y rica en células (figs. 2 y 3).
Fig. 2. Cicatrización de defecto critico sin membrana. Corte histológico a los 60 d de efectuada la cirugía. Nótese el tejido óseo inmaduro con abundante cantidad de células en los márgenes de la lesión y el tejido indiferenciado cubriendo el resto del defecto.
Fig. 3. Cicatrización de defecto crítico con membrana. Corte histológico a los 60 d de efectuada la cirugía. Nótese los centros de tejido diferenciado con abundante cantidad de células cubriendo el defecto.
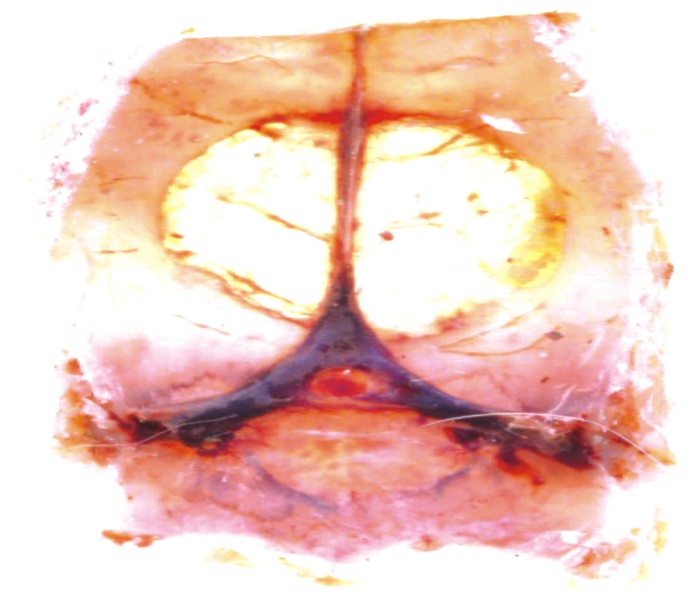
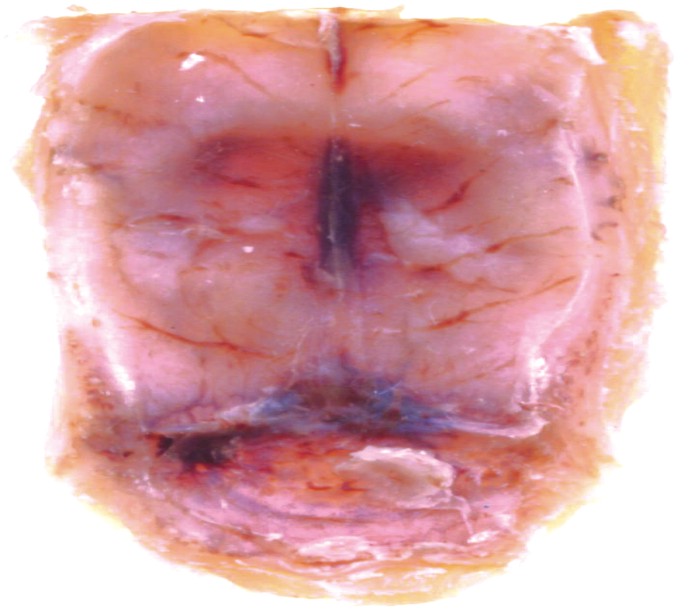
Transiluminación: se observaron diferencias significativas por este método entre las calotas del grupo control (sin MO) y el experimental (con MO) a los 60 d. Mostró mayor grado de calcificación el grupo experimental (figs. 4 y 5).
Fig. 4. Defecto crítico sin membrana. Imagen macroscópica obtenida por transiluminación a los 60 d de efectuada la cirugía. Nótese el defecto óseo cubierto por un tejido de cicatrización poco denso.
Fig. 5. Defecto crítico con membrana. Imagen macroscópica obtenida por transiluminación a los 60 d de efectuada la cirugía. Nótese la dificultad para notar el límite entre el hueso maduro y el tejido calcificado que cubre la lesión en su totalidad.
Ensayos preliminares en humanos
Colocación de MO en alveolos posextracción
Los casos clínicos seleccionados fueron exodoncias de piezas en cuyos lugares se colocarían implantes endoóseos en forma diferida.
Los alveolos posextracción se llenaron de fosfato tricálcico (FTC) con la finalidad de evitar el colapso de las membranas. Las membranas se dejaron expuestas al medio oral.
Los pacientes fueron informados y autorizaron en forma escrita la utilización de MO.
Caso clínico I
Paciente, femenino de 34 años, historia clínica no contributoria, poseedora de prótesis fija en maxilar superior y distintos tipos de restauraciones plásticas. La pieza 16 presentaba destrucción total por caries.
Plan de tratamiento: exodoncia del primer molar superior derecho y técnica de alveoloplastia para facilitar en el futuro la colocación de implantes óseos integrados en la zona.22-24
Preoperatorio: se medicó a la paciente con amoxicilina 500 mg y se indicaron buches con digluconato de clorhexidina 0,12 % cada 8 h. Comenzando 48 h antes del acto quirúrgico.
Fase quirúrgica: se realizó la exodoncia efectuando incisiones verticales y legrado de colgajos bucal y palatino para obtener acceso visual y exponer el reborde alveolar.
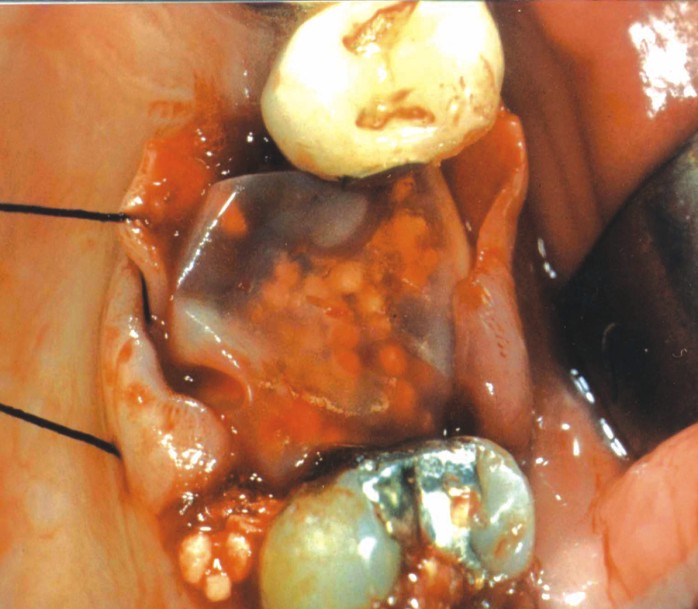
Se llenaron los alveolos posextracción con FTC. Se ubicó la MO entre el reborde alveolar y los colgajos (fig. 6).
Fig. 6. Membrana posicionada por debajo de los colgajos.
Se suturó con seda 0000 sobre la membrana para sujetarla contra el injerto, quedando expuesta por debajo de los colgajos.
Posoperatorio: se continuó la administración de amoxicilina 500 mg y digluconato de clorhexidina 0,12 % en forma tópica cada 8 h durante 5 d. Se procedió a la remoción de la sutura al séptimo día.
Se observó una buena cicatrización de la herida a los 30 d de efectuada la exodoncia. Después de 4 meses se realizó una nueva cirugía en la zona para la colocación de un implante. Se procedió a la exposición del reborde alveolar. Se utilizó una fijación de 5 mm de base. Se suturó en forma interrumpida con seda 0000.
Caso clínico II
Paciente, femenino de 26 años, historia clínica no contributoria, poseedora de distintos tipos de restauraciones plásticas. La pieza 36 presentaba una fractura longitudinal en sentido mesiodistal que abarcaba sus raíces.
Plan de tratamiento: exodoncia del primer molar inferior izquierdo y técnica de alveoloplastia para facilitar en el futuro la colocación de implantes óseos integrados en la zona.
Preoperatorio: se medicó a la paciente con amoxicilina 500 mg y se indicaron buches con digluconato de clorhexidina 0,12 % cada 8 h, comenzando 48 h antes del acto quirúrgico.
Fase quirúrgica: se realizó la exodoncia efectuando incisiones verticales y legrado de colgajos bucal y lingual para obtener acceso visual y exponer el reborde alveolar. Se llenaron los alveolos posextracción con FTC. Se ubicó la MO entre el reborde alveolar y los colgajos. Se suturó con seda 0000 sobre la membrana para sujetarla contra el injerto quedando expuesta por debajo de los colgajos.
Posoperatorio: se continuó la administración de amoxicilina 500 mg y digluconato de clorhexidina 0,12 % en forma tópica cada 8 h durante 5 d. Se procedió a la remoción de la sutura al séptimo día.
Se observó una buena cicatrización de la herida a los 30 d de efectuada la exodoncia.
Después de 4 meses se realizó una nueva cirugía en la zona para la colocación de un implante. Se procedió a la exposición del reborde alveolar mediante maniobras de legrado en las que se desprendieron gránulos de FTC no consolidados, que generó un defecto.
Se utilizó una fijación de 5 mm de base que se ubicó en forma coincidente con el defecto del reborde. Se suturó con seda 0000.
Discusión
El cultivo de queratinocitos humanos in vitro sobre la membrana demostró la biocompatibilidad del material.
La reparación de defectos críticos generados en calota de ratas tratados con MO, confirman la eficacia de este material como barrera celular.
Los casos clínicos que acompañan esta publicación, son solo experiencias preliminares; estas aportan datos que permiten presumir ventajas en la reepitelización de heridas tratadas con MO.
Investigaciones in vivo actualmente en curso, pretenden aportar más información, como por ejemplo su capacidad oclusiva, los tiempos estimados de reabsorción, su posible potencial osteogénico, permeabilidad selectiva, capacidad para mantener espacios, etcétera.
Summary
MEMBRACEL- dentistry use (MO)- high purity reabsorbable collagen membrane - was developed taking into account as an antecedent MEMBRACEL – collagen dressing, for medical use, designed as temporary cutaneous dressing. Additionally, preliminary reports of a series of works that showed the biocompatibility of MO in the first stage supported on cellular culture of keratinocytes were presented. Lab animal tests were performed, which provided data that encouraged clinical experience. The results were backed up by microscopy, histological slides, transilumination and photographs.
Key words: Collagen, reabsorbable membrane, guided bone regeneration, guided tissue regeneration.
Referencias bibliográficas
- Nimni ME. Collagen. Biochemistry.Vol.1.CRC Press, Florida, USA, 1998.
- Stahl SS. Repair potencial of soft tissue-root interface. J Periodontol 1977;48:545-52.
- Scantlebury TV. 1982-1992: a decade of technology development for guided tissue regeneration. J Periodontol 1993;64:1129-37.
- Caffesse RG, Nasjleti CE. Regeneración tisular guiada: fundamentos biológicos, técnicas quirúrgicas y resultados clínicos. Rev SOLP 1995;17:7-11.
- Becker W, Becker BE, Caffesse R. Root isolation for new attachment procedures. J Periodontol 1987;58:819-26.
- Becker W, Becker BE, Caffesse R. New attachment after treatment with Root Isolation procedures. Int J Periodont Restorat Dent 1988;8:8-23.
- Gottlow J. Guided tissue regeneration using bioresorbable and non-resorbable devices: initial healing and long-term results. J Periodontol 1993;64:1157-65.
- Magnussont I, Batich C, Collins BR. New attachment formation following controlled tissue regeneration using biodegradable membranes. J Periodontol 1988; 59:1-5.
- Bunyaratavej P, Wang H-L. Collagen membranes: a review. J Periodontol 2001;72: 215-29.
- Adell R, Lekholm U, Rockeler B. A year of osseointegrated implants in the treatment of edentolous jaw. J Oral Surg 1981;10:387.
- Hardwik R, Hayes BK, Flynn C. Devices for dentoalveolar regeneration: an up-to-date literature review. J Periodontol 1995;66:495-505.
- Mundell RD, Mooney MP. Osseous guided tissue regeneration using a collagen barrier membrane. J Oral Surg 1993;51:1004-12.
- Blumenthal N, Steinberg J. The use of collagen membrane barriers in conjunction with combined demineralized bone-collagen gel implants in human infrabony defects. J Periodontol 1990;61:319-27.
- Chen Ch, Wang H. Evaluation of a collagen membrane with and without bone grafts in treating periodontal intrabony defects. J Periodontol 1995;66:838-47.
- Anitua Aldecoa E. Un nuevo enfoque en la regeneración ósea. 2000; Cap. II y III.
- Encyclopedic Handbook of Biomaterials and Bioenginiering. 1995;Vol I-II.
- Quteish D, Dolby AE. The use of irradiated-crosslinked human collagen membrane in guided tissue regeneration. J Clin Periodontol 1992;19:476-84.
- Leghissa G, Assenza B. Implantes inmediatos posextracción protegidos con liodura humana. Il Dentista Moderno 1992;5:29-36.
- Caride F, Bernales D. Estudio de biocompatibilidad y reabsorción de una membrana de colágeno en ratas de experimentación. Pilares 2002;12:9-11.
- Jud DA, Battista PJ, Behm DD. Culture of human keratinocytes in defined serum-free medium. Focus 1997;19;1:2-5.
- Horch RE, Debus M. Cultured human keratinocytes on type 1 collagen membranes to reconstitute the epidermis.Tissue Engineering. 2000; 6;1: 53-64.
- Jovanic SA, Buser D. Guided bone regeneration in dehiscence defects and delayed extraction sockets. Quintessence. 1994;31.
- Buser D, Dahlin C, Shenk RK. Guided bone regeneration in implant dentistry. Quintessence 1994;31.
- Salagaray Lamberti V. Membranas de colágeno en técnicas de bloqueo celular y protección de injertos. Rev Circ Arg Odont 1994;23:4-10.
Recibido: 16 de enero de 2004. Aprobado: 22 de marzo de 2004.
Dr. Diego M. Bernales. Calle 16 Nº 591. La Plata. Buenos Aires. Argentina. CP: 1900.
Tel-fax: 054-221-4212095. Correo electrónico: bervenodonto@hotmail.com