Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.24 n.2 Ciudad de la Habana abr.-jun. 2005
Centro Nacional de Sanidad Agropecuaria
Caracterización bioquímica y antigénica de diferentes aislamientos de Gardnerella vaginalis
Lic. Ivette Espinosa, Lic. Mayté Lorenzo, Lic. Arsenio Betancourt, Lic.Yamilka Riverón, Lic. Mariselsa Romero y Dra. Elba Álvarez
Resumen
Se realizó la identificación por primera vez en Cuba de diferentes aislamientos de Gardnerella vaginalis con diferencias en el patrón bioquímico, los cuales estaban asociados o no a la presencia de síntomas de vaginosis bacteriana. Se han descrito variaciones fenotípicas de Gardnerella vaginalis relacionadas con pruebas bioquímicas que han permitido clasificar esta especie en diferentes biotipos, los cuales en algunos casos están asociados a vaginosis bacteriana o no. El biotipo 1 resultó el más común, para el cual la hidrólisis del hipurato, la actividad b galactosidasa y lipasa fueron positivas. Se obtuvieron antisueros en conejo a 2 cepas de Gardnerella vaginalis correspondientes a los biotipos 1 y 4, los cuales mostraron un comportamiento diferente por immunoblotting frente a aislamientos correspondientes a diferentes biotipos; esto sugiere la posibilidad de una diferenciación serológica entre aislamientos de Gardnerella vaginalis.
Palabras clave: Gardnerella vaginalis, biotipo, immunoblotting, proteínas.
La vaginosis bacteriana (VB) es una de las infecciones más frecuentes durante el período fértil de la mujer, se caracteriza por una secreción gris y fétida. Los riesgos de la infección son mayores en mujeres sometidas a operaciones ginecológicas o en embarazadas en las cuales puede tener lugar la infección del líquido amniótico y provocar parto prematuro o bajo peso al nacer.1,2 La VB constituye una alteración de la flora vaginal, donde los Lactobacillus spp predominantes son reemplazados por varios microorganismos incluida Gardnerella vaginalis y bacterias anaerobias, producto de alteraciones hormonales y los cambios sucesivos de parejas.1,3,4
A pesar de la etiología múltiple de la VB, G. vaginalis se ha considerado el principal agente, porque presenta los factores de patogenicidad siguientes: una hemolisina que actúa sobre las células del amnio.5 En la superficie celular presenta una glicoproteína que posee una elevada afinidad por la lactoferrina humana presente en la mucosa vaginal.6,7 Existen diferentes biotipos de G. vaginalis, los cuales en algunos casos están asociados o no a vaginosis bacteriana.8,9
Los estudios de proteínas fundamentalmente de membrana han contribuido a una mejor comprensión de la patogenicidad de muchas bacterias. En G. vaginalis, poco se conoce sobre la identidad de sus proteínas de superficie y su relación con los diferentes perfiles bioquímicos observados. Las proteínas de superficie son blancos para los anticuerpos y no han sido caracterizadas en aislamientos de esta bacteria. El objetivo de este trabajo es realizar la caracterización bioquímica e inmunológica de diferentes aislamientos de G. vaginalis y establecer las principales proteínas antigénicas de superficie de esta bacteria.
Métodos
Aislamiento e identificación de Gardnerella vaginalis: se analizó un total de 402 exudados vaginales procedentes de mujeres con síntomas de infecciones vaginales o sin estos, que asistieron a las consultas ginecológicas de los hospitales ¨Ramón González Coro, Luis de la Puente Useda, en Ciudad de La Habana y Piti Fajardo de Güines, en La Habana, en el período de agosto de 1999 a enero de 2003. Las muestras se tomaron de las paredes de fondo de saco con hisopos estériles. Para cada paciente se realizó el diagnóstico de vaginosis bacteriana mediante los criterios propuestos por Amsel y otros,10 la muestra se consideró positiva cuando reunió los 4 o al menos 3 de estos criterios.
Las muestras de secreción vaginal se cultivaron en placas de agar Columbia con el suplemento SR 119 (Oxoid) y sangre humana 5 %, las placas se incubaron con 10 % de CO2 utilizando sobres Anaerogen (Oxoid) durante 48 h a 37 °C. Para la identificación de G. vaginalis se utilizaron los criterios propuestos por Catlin y otros.11 Los cultivos puros de G. vaginalis con 2 pases sucesivos se identificaron por pruebas bioquímicas utilizando el sistema Api 20 Strep (Biomerieux) y la prueba lipasa según el esquema de identificación propuesto por Piot y otros.9
Análisis estadístico: la distribución de los diferentes biotipos según la presencia o ausencia de VB se realizó mediante una prueba de comparación de proporciones para una p< 0,05.
Obtención de los inmunosueros: se obtuvieron antisueros en conejos por inmunización con células completas de G. vaginalis cultivadas en caldo Casman e inactivadas con formalina 0,3 % como se describe en Espinosa y otros12 y utilizando el esquema descrito por Senterfit y otros.13 Se utilizaron las cepas de G. vaginalis siguientes: cepa 14018 procedente del American Collection Culture ATCC (Biotipo 1) y el aislamiento clínico (AC) 18 (Biotipo 4).
Para la caracterización de los antisueros anti-14018 y anti-18 se utilizaron antígenos de las cepas 14018 y de diferentes aislamientos clínicos caracterizados por su perfil bioquímico: aislamiento 256 (biotipo 1), aislamientos 18 y el 260 (biotipo 4), y aislamientos 13, L y 274 (biotipo 5). Los cultivos de estas cepas se obtuvieron en el medio Caldo Casman y se procesaron para electroforesis PAGE-SDS con gel concentrador 5 % y gel separador 12,5 %.14 Los polipéptidos separados por PAGE-SDS se transfirieron a membrana de nitrocelulosa de 0,2 μ (Sigma) durante 30 min con corriente constante de 1 A mediante transferencia semiseca.15 Se incubó toda la noche con el suero hiperinmune obtenido en conejo diluido 1/100 en una solución de leche descremada 5 % en PBS pH 7,2, posteriormente se lavó con PBS-Tween 20 a 0,05 % y se incubó con un conjugado anti-IgG de conejo marcado con peroxidasa diluido 1/10 000 (Sigma). Se lavó nuevamente con PBS-Tween 20 a 0,05 % y se añadió el sustrato. Se utilizó un marcador de peso molecular preteñido procedente de Sigma. A continuación se procesaron las tiras de nitrocelulosa mediante un equipo AcerScan Prisa 620P y se utilizó el programa Kodak digital science ID, mediante el cual se determinó el peso molecular de cada banda por un análisis de regresión incluido en este sistema.
Resultados
Aislamiento e identificación de G. vaginalis: de las 402 muestras evaluadas se identificó la presencia de G .vaginalis en 188 pacientes (46,8 %) según el cultivo microbiológico, mientras los criterios de Amsel para vaginosis bacteriana se detectaron en 113 mujeres (28,2 %). La identificación mediante pruebas bioquímicas fue posible en 40 aislamientos identificados como G. vaginalis, 22 (55 %) correspondieron a mujeres con vaginosis bacteriana y 18 (45 %) a mujeres sin vaginosis bacteriana según los criterios propuestos por Amsel y otros, 1984.10
Se detectaron 3 biotipos diferentes que se muestran en la tabla. Para el biotipo 1 la actividad b-galactosidasa, la hidrólisis del hipurato y la actividad lipasa resultaron positivas; este biotipo fue el más frecuente como muestra la figura 1 en casos con vaginosis bacteriana. Todos los biotipos detectados estaban presentes en casos con vaginosis bacteriana y sin esta. Sin embargo, la comparación de proporciones para una p< 0,05 mostró que existen diferencias significativas entre las frecuencias de casos con VB y sin VB para los biotipos 1 y 4, no así para el biotipo 5 donde no se observan diferencias significativas entre los 2 grupos (fig.1).
Tabla. Resultados de la pruebas bioquímicas para los biotipos más frecuentes de Gardnerella vaginalis
Fig. 1. Distribución de los porcentajes de frecuencia de los biotipos 1, 4 y 5 en los casos con VB (CVB) y sin VB (SVB) según el análisis de proporciones para una p< 0,05.
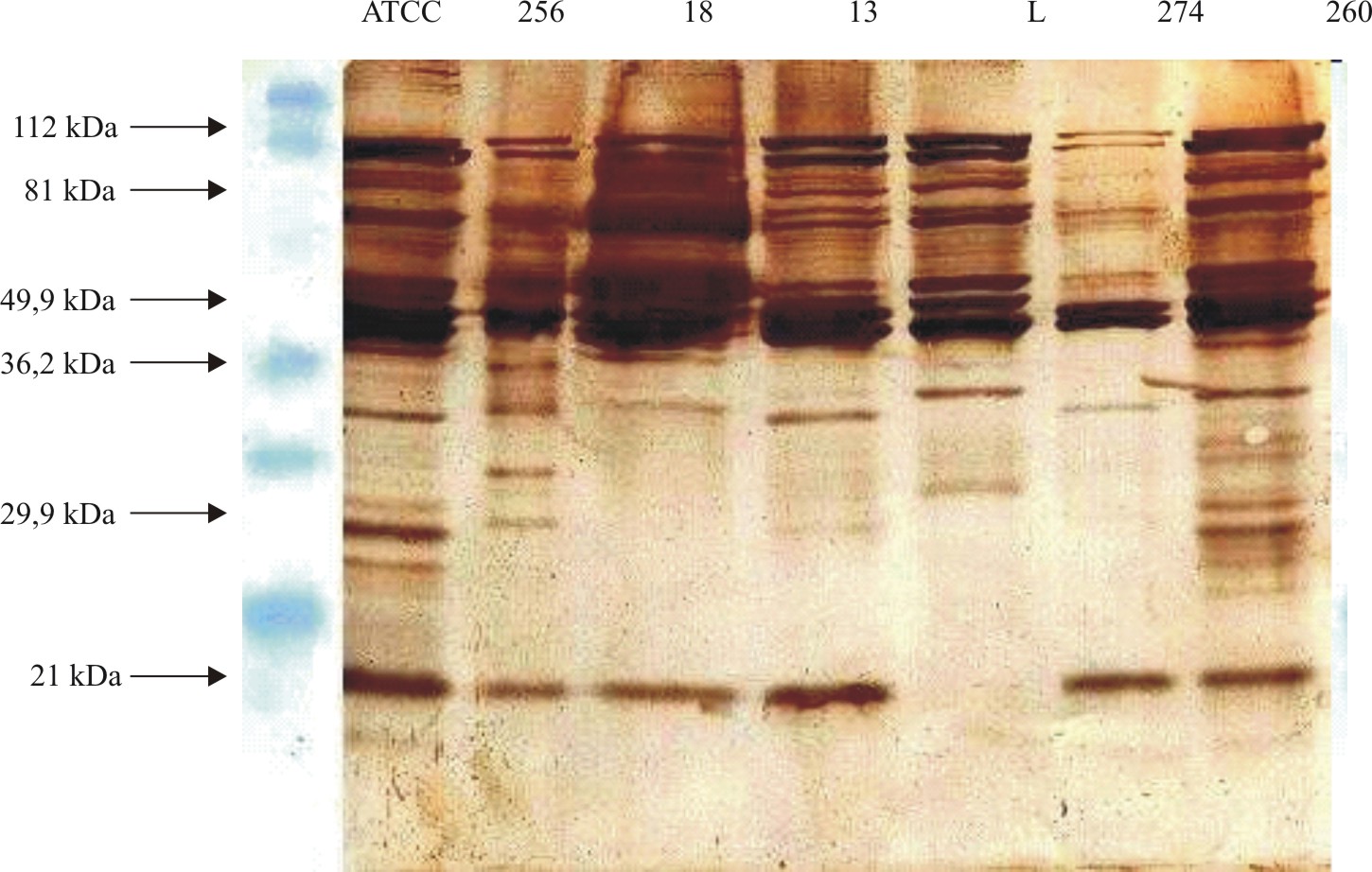
El patrón de proteínas revelado por immunoblotting (fig. 2) utilizando el antisuero anti- 14018 detectó las siguientes proteínas comunes en todos los biotipos considerados en el estudio (18, 38, 42, 46, 65, 76, 90 kDa), la proteína de 26 kDa solo se detectó en la cepa 14018 ATCC y los aislamientos 256 y 260. Por immunoblotting el antisuero anti-cepa -18 mostró una fuerte señal con las bandas 42,46, 65 y 76 kDa con el antígeno homólogo mientras con otros aislamientos la señal de reconocimiento fue débil (fig. 3).
Fig. 2. Inmunoblot de diferentes aislamientos de Gardnerella vaginalis con el antisuero obtenido a partir del biotipo 1 (de izquierda a derecha patrón de peso molecular, cepa ATCC 14018, AC256, AC18, AC 13, ACL, AC274, AC260).
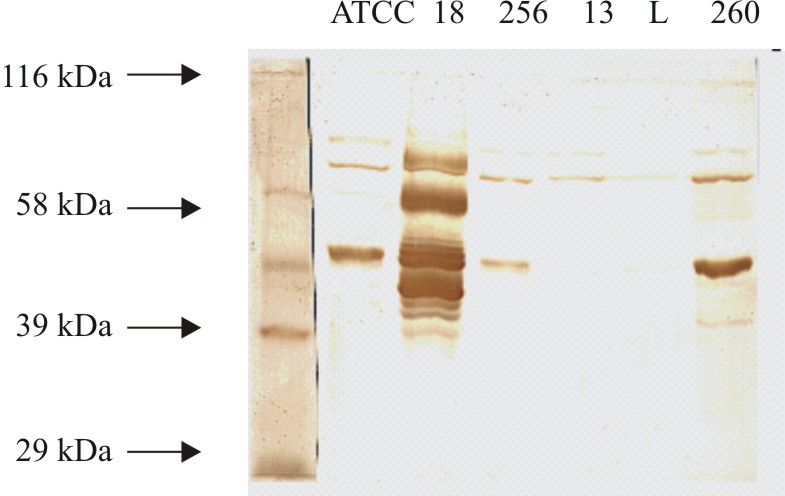
Fig. 3. Inmunoblot de diferentes aislamientos de Gardnerella vaginalis con el antisuero obtenido a partir del biotipo 4 (de izquierda a derecha patrón de peso molecular, cepa ATCC 14018, AC18, AC256, AC13, ACL, AC260).
Discusión
En la población estudiada la frecuencia de aislamiento de G. vaginalis fue de 30,4 %. Ortiz y otros16 reportan una frecuencia de 19,7 % para VB y Gallardo y otros17 de 35,2 %. G. vaginalis es aislada con frecuencia del fluido vaginal de mujeres sin síntomas de VB, la diferencia con respecto a las mujeres que presentan evidencias clínicas se atribuye fundamentalmente a la concentración del microorganismo.18
Algunos biotipos de G. vaginalis producen un proceso asintomático, probablemente por la carencia de factores de virulencia o por una respuesta inmunitaria en el hospedero, por lo cual en ocasiones aunque la paciente presenta leucorrea con fetidez y pH alterado, las células guías no se aprecian. Esto se debe probablemente a que algunos presentan un proceso crónico y por consecuencia hay producción de inmunoglobulina local, la cual bloquea la adhesión de las bacterias a la célula a través de la interacción con proteínas de superficie.19,20 Sin embargo, existen otros biotipos que pueden provocar un cuadro clínico evidente en los cuales es posible registrar elevada actividad sialidasa y prolidasa que provocan una disminución en la respuesta inmunitaria del hospedero.21
Piot y otros9 detectaron 8 biotipos diferentes, de los cuales el 1, 2 y 5 fueron predominantes en 80 % de los aislamientos. Barberis y otros8 detectaron 11 biotipos diferentes al usar el esquema modificado por Benito y otros.22 Cuando se relacionaron los resultados de este trabajo con los obtenidos por Barberis y otros,8 el biotipo 5B muestra el mismo patrón que el biotipo 5 detectado específicamente en el presente estudio. Por otra parte Aroutcheva y otros23 detectaron los biotipos 7 y 8 como los más frecuentes y asociaron el biotipo 5 con un ecosistema vaginal saludable.
Barberis y otros8 en estudios de biotipificación de pacientes que acudieron en ocasiones diferentes a la consulta, encontraron distintos biotipos para cada una, lo que indica que no se trata de una recidiva del microorganismo, sino de una reinfección. Estos datos resaltan la importancia de los estudios de biotipificación en la epidemiología de la VB, proponiendo un sistema de marcación simple y estable que permita detectar reinfección o recidiva, por lo que sería de gran utilidad disponer de una batería de antisueros que permita el reconocimiento de los posibles serotipos de G. vaginalis. En este trabajo se ha observado por immunoblotting el comportamiento disímil de los inmunosueros obtenidos a partir de 2 biotipos diferentes, lo cual sugiere la posibilidad de un sistema de serotipificación que reconoce la existencia de diferentes serotipos para G. vaginalis.
En este estudio el biotipo 1 está relacionado con una frecuencia superior de casos con VB, mientras el biotipo 4 está presente en un número superior de pacientes sin VB. Si se considera que en la inmunización de los animales se utilizaron células completas, es posible que la respuesta inmune esté dirigida sobre todo a antígenos de superficie, probablemente de naturaleza polisacarídica, los cuales podrían determinar la habilidad de las bacterias para colonizar las células y permitir su crecimiento. Entonces, es probable que en el aislamiento que corresponde al biotipo 4 estos determinantes de superficie se encuentren expuestos en un número más pequeño, y por consiguiente, la respuesta inmune es más débil, así como el proceso de la colonización.
La caracterización bioquímica de diferentes aislamientos de G. vaginalis permitió detectar la presencia de 3 biotipos en la población estudiada. Es la primera vez que en Cuba se señala la presencia de estas variaciones fenotípicas en G. vaginalis. La caracterización por immunoblot de los antisueros obtenidos a partir de 2 biotipos diferentes (1 y 4) evidenció que además de las variaciones bioquímicas en G. vaginalis existe heterogeneidad antigénica entre diferentes cepas.
Biochemical and antigenic characterization of different Gardnerella vaginalis isolations
Summary
Diverse isolations of Gardnerella vaginalis with differences in the biochemical pattern, which were associated or not with the presence of symptoms of bacterial vaginosis, were identified for the first time n Cuba. There have been described phenotypical variations of Gardnerella vaginalis related to biochemical tests that have allowed to classify this species in different biotypes that in some cases are connected or not with bacterial vaginosis. The biotype 1 was the commonest, for which the hypurate hydrolisis, the b galactosidase and lipase activity were positive. Antisera were obtained in rabbits from 2 strains of Gardnerella vaginalis corresponding to biotypes 1 and 4, which showed a different behavior by immunoblotting against isolations corresponding to different biotypes. This suggests the possibility of a serological differentiation between isolations of Gardnerella vaginalis.
Key words: Gardnerella vaginalis, biotype, immunoblotting, proteins
Referencias bibliográficas
1. Donders GG, Bosmans E, Dekeermaecker A, Vereecker A, Van Bulk B, Spite B. Pathogenesis of abnormal vaginal bacterial flora. Am Obstet Gynecol 2000;18:872-8.
2. Leitich H, Bodner A, Brunbaver M, Kaider A, Egarter C, Huslein P. Bacterial vaginosisi as a risk factor preterm delivery a meta analysis. Am J Obstet Gynecol 2003;189(1):139-47.
3. Donders GG, Vereecker A, Bosmans E, Dekeermaecker A, Salembier G, Spite B. Definition of a type of abnormal vaginal flora that is distint from bacterial vaginosis aerobic vaginitis. BJOG 2000;109(1):34-43.
4. Marrazzo JM, Koutsky LA, Eschenbach DA, Agnew K, Stine K, Hillier SL. Characterization of vaginal flora and bacterial vaginosis in women who have sex with women. J Infect Dis 2002;185(9):1307-13.
5. Rottini G, Dobrina A, Forgiarini O, Nardon E, Amirante GA, Patriarca P. Identification and parcial characterization of a cytolitic toxin produced by Gardnerella vaginalis. Infect Immun 1990;58(11):3751-8.
6. Jarosik.PG, Land CB, Duhon P, Mercer T. Acquisition of iron by Gardnerella vaginalis. Infect Immun 1998;66(10):5041-7.
7. Jarosik PG, Land CB. Identification of a human lactoferrin-binding protein in Gardnerella vaginalis. Infect Immun 2000;68(6):3443-7.
8. Barberis IL, Pájaro MC, Danielle ML, Godino S, Pascual L. A biotype study of Gardnerella vaginalis isolated from parients whit and whitout symptoms of Bacterial vaginosis. Enfer Infecc Microbiol Clin 1999;17(10):506-8.
9. Piott P, Van.Dyck E, Peeters M, Hale J, Totten P, Holmes KK. Biotypes of Gardnerella vaginalis. J Clin Microbiol 1984;20(4):677-9.
10. Amsel R, Totten PA, Spiegel CA. Nonspecific vaginitis:diagnostic criteria an microbial and epidemiological associations. Am J Med 1984;74:14-22.
11. Catlin BW. Gardnerella vaginalis: characteristics, clinical consideration and controversies. Clin Microbiol Rev 1992;5(3):213-37.
12. Espinosa I, Álvarez E, Amaral C, Alonso M, Lorenzo M. Evaluación de diferentes medios líquidos para el cultivo de Gardnerella vaginalis y caracterización del perfil de proteína por electroforesis PAGE-SDS. Rev Cubana Med Trop 2003;55(2):69-75.
13. Senterfit LB. Preparation of antigenss and antisera en: Methods in mycoplasmology. Razin S, Tully JG ed. Vol 1. Academic Press; 1983. p.403.
14. Laemli UK. Cleavage of structural protein during the assembly of the head bacteriofago T4. Nature 1970;227:680-5.
15. Sachse K, Grojetzki C, Pfutzer H, Hass R. Comparison of Mycoplasma bovis strains based on SDS-PAGE and Immunoblot patterns. J Vet Med 1992; 39:246-52.
16. Ortiz C, Ny ML, Llorente C, Almanza C. Vaginosis bacteriana en mujeres con leucorrea. Rev Cubana Obstet Ginecol 2000;26(2):74-81.
17. Gallardo J, Valdés S, Díaz ME, Romay C. Comportamiento de las enfermedades de transmisión sexual con sepsis ginecológica. Rev Cubana Obstet Ginecol 2000;26(1):10-4.
18. Schmitdt H, Hansen JG. Diagnosis of bacterial vaginosis by wet mount identification of bacterial morphotypes in vaginal fluid. Int J STD AIDS 2000; 11(3):150-5.
19. Cauci S. IgA response against Gardnerella vaginalis hemolysin and sialidasa activity in Bacterial vaginosis. Am J Obstet Gynecol 1998;178(3):511-5.
20. Cauci S, Guaschino S, Isola M, Quadrifoglio F. Correlation of local interleukin-1 beta levels with specific IgA response against Gardnerella vaginalis in women with bacterial vaginosis. Am J Reprod Immunol 2002;47(5):257-64.
21. Cauci S, Guaschino S, Driussi S, De Santo D, Lanzafame P, Quadrifoglio F. Correlation of local interleukin-8 with immunoglobulin A against Gardnerella vaginalis hemolysin and with prolidase and sialidase levels in women with bacterial vaginosis. J Infect Dis 2002;185(11):1614-20.
23. Benito.R, Vásquez JA, Berrón S, Fenoll A, Nilo S. A modified scheme for biotyping Gardnerella vaginalis . J Med Microbiol 1996;21:357-9.
24. Aroutcheva AA, Simoes JA, Behbakht K, Faro S. Gardnerella vaginalis isolated from patients with bacterial vaginosis and from patients with healthy vaginal ecosystems. Clin Infect Dis 2001;33(7):1022-7.
Recibido: 2 de marzo de 2005. Aprobado: 5 de mayo de 2005.
Lic. Ivette Espinosa. Centro Nacional de Sanidad Agropecuaria. Carretera Tapaste y Autopista Nacional. Apdo. 10 San José de las Lajas, La Habana, Cuba. Teléf: 06463014. Correo electrónico: espinosa@censa.edu.cu