Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.25 n.3 Ciudad de la Habana jul.-sep. 2006
Instituto Superior de Ciencias Médicas de Camagüey
Centro de Inmunología y Productos Biológicos
Cambios en la actividad biológica de un antígeno debido a la temperatura generada durante la electroforesis de poliacrilamida
Dr. Oscar Hernández Betancourt, Ing. Yadira Falcón Almeida, Lic. Blanca R. Santana Guerra, Dr. Andrés Pedrosa y Téc. Leyanis Rodríguez Cardoso
Resumen
Se evaluó el efecto que origina la temperatura sobre la actividad biológica de un antígeno durante la electroforesis en geles no reductores de poliacrilamida, porque en ocasiones la técnica precede a la electroelusión, método empleado en la purificación de determinadas proteínas. Se utilizó el antígeno específico prostático para el ensayo, este se purificó a partir del semen de pacientes voluntarios, precipitado con sulfato de amonio 70 %. Las corridas (3 para cada temperatura), se llevaron a cabo a 4 y 25 °C, y se realizaron a 20 mA. Para cada temperatura ensayada, los fragmentos provenientes de los geles cortados a la talla esperada para el antígeno específico prostático (33 kDa), se electroeluyeron a 4 °C. Mediante la comparación de las concentraciones de proteínas empleando la técnica de Lowry y el método radioinmunoenzimático, se cuantificó la cantidad de proteína biológicamente activa posterior a la electroforesis. Se utilizó un antígeno específico prostático comercial como control. Los resultados indican que el antígeno a 4 °C, conserva 80 % de su actividad biológica, lo que no sucede a 25 °C donde más de 50 % de la proteína es biológicamente inactiva.
Palabras clave: ASP, temperatura, electroforesis.
Los geles de poliacrilamida son comúnmente utilizados en los laboratorios con diversos fines, entre los que se encuentran la separación de biomoléculas como proteínas y ADN, fundamentada en el peso molecular de estas, así como en su carga iónica.1 Es una técnica que presenta un poder resolutivo superior a otros soportes usados como la celulosa, acetato de celulosa, almidón y la azarosa,2 lo cual permite su uso como método de purificación cuando es seguida de la electroelusión del fragmento cortado a la talla deseada. Generalmente se lleva a cabo a la temperatura de laboratorio (25 °C) y en ocasiones se obvia por parte del investigador el efecto que este factor físico originado por el campo eléctrico generado, puede tener sobre la actividad biológica de la molécula de interés. La migración a lo largo del gel con una temperatura incrementada, genera un gradiente que influye sobre la desnaturalización de las proteínas, la cual puede llegar a ser irreversible en algunos casos.3 Es importante que el antígeno purificado, conserve la actividad biológica para ser utilizado en los bioensayos (diagnósticos, terapéuticos u otros) con la finalidad de lograr buenos resultados. Para los estudios se empleó el antígeno especifico prostático (AEP) proteína de 33 kDa, considerada un antígeno asociado a tumores (AAT) y sobre expresada en pacientes con cáncer de próstata a niveles superiores a los 4 ng/mL.4 Se presentan en esta molécula varios enlaces disulfuros, que la hacen de estructura complicada, la cual puede verse afectada por la temperatura. La sensibilidad a este factor esta relacionada con la forma en que se encuentra en la sangre; la molécula es más termosensible cuando se presenta en su estado libre,5 no formando complejo con la a–1antiquimiotripsina y la b–macroglobulina.
El presente trabajo tiene como objetivo mostrar el efecto del factor temperatura sobre la actividad biológica del ASP durante el proceso de electroforesis, sugiriendo cambios conformacionales que afectan la actividad biológica de la molécula.
Métodos
Fuente de antígeno
El antígeno fue obtenido a partir del semen de pacientes voluntarios y se purificó según el método descrito por Wang y otros.6
Electroforesis de poliacrilamida no reducida (PAGE discontinuo) y western-blot
La preparación de la muestra así como la electroforesis se realizaron según el método descrito por Sambrook y otros.7 Se empleó una cámara vertical de 16 x 18 cm para los ensayos. Las corridas (3 para cada temperatura) se efectuaron a 20 mA y se realizaron a 4 y 25 °C. Una vez terminada la electroforesis, se cortó el gel en la región correspondiente a la talla esperada para el ASP (33 kDa), haciendo uso de un marcador de peso molecular conocido. Para la técnica de western-blot7 se empleó el líquido ascítico de ratones Balb/c que contenía el anticuerpo monoclonal CMC-H9 diluido 1/20. Se empleó al conjugado anti-ratón peroxidasa gentilmente donado por los compañeros del Centro de Ingeniería Genética y Biotecnología de Sancti Spíritus en una dilución 1/200.
Electroelusión
Se siguió el procedimiento descrito.7 Se realizaron 3 electroelusiones para cada temperatura ensayada en la corrida electroforética (4 y 25 °C). Todas (6 en total) se efectuaron a 30 mA y 4 °C de temperatura. Concluida esta, se procedió a dializar la muestra en PBS 1X durante 24 h. Posteriormente la muestra final de cada electroelusión se concentró hasta el volumen deseado (1-1,5mL) para su posterior cuantificación.
Cuantificación del ASP y determinación de la actividad biológica
Las muestras provenientes de las electroelusiones (6 en total) fueron cuantificadas utilizando el método de proteínas totales de Lowry.7 Para cuantificar la actividad biológica específica basada en el reconocimiento antígeno anticuerpo, se empleó un radioinmunoensayo (RIA) comercializado por el CENTIS (CIS-BIO), empleado en el seguimiento de los pacientes con cáncer de próstata. Se utilizó un antígeno comercial como control.
Estudios estadísticos
Se presentan los resultados con las medias y las desviaciones estándar para cada ensayo realizado (n= 3)
Resultados
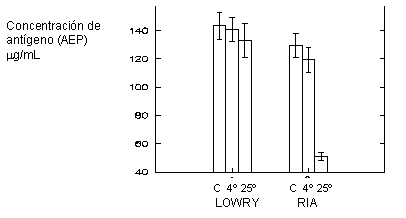
En la figura 1 se muestra el efecto de la temperatura sobre el reconocimiento de la molécula de AEP por parte de los anticuerpos monoclonales utilizados en el ensayo de cuantificación específico para este antígeno (RIA-CISBIO). El empleo de 2 métodos de cuantificación de proteínas, uno inespecífico (Lowry) y otro específico para el AEP (RIA), permitieron evidenciar daños en la molécula de AEP que afectan el reconocimiento de esta por los anticuerpos monoclonales.
Fig. 1. Diagrama de barra que compara la concentración de proteínas (AEP) obtenidas con un método de cuantificación inespecífico (Lowry) y un método específico para este antígeno (RIA-CISBIO) a diferentes temperaturas (4 y 25 °C) se compara empleando un antígeno comercial de la firma CISBIO. Se muestran los valores medios para n=3 con sus desviaciones estándar.
Se evidencia el efecto negativo que tiene la temperatura cuando el ensayo (electroforesis) se realizó a 25 °C, donde más de 50 % de la molécula muestra una pérdida de la actividad biológica. Este se comparó con los resultados obtenidos a 4 °C, donde además se utilizó un antígeno comercial de la firma CISBIO. Sin embargo cuando la corrida de proteínas se llevó a cabo a 4°C, se detectó actividad en casi 80 % del antígeno purificado.
Con el objetivo de detectar cambios moleculares en el antígeno específico prostático (AEP) se procedió a realizar un western-blot en condiciones no reductoras a la muestra proveniente del experimento de 25 °C posterior al proceso de electroelusión. En la figura 2 se observan poblaciones moleculares del antígeno que no son reconocidas por el anticuerpo monoclonal específico CMC-H9.
Fig. 2. Electroforesis de proteína realizada a la muestra del experimento de 25 °C posterior a la electroelusión, empleando geles de poliacrilamida no reducidos (carril 1) y western-blot (carril 2) utilizando un anticuerpo monoclonal específico para el AEP (H9). Se empleó un conjugado anti-ratón peroxidasa 1/200. La flecha en el carril 2 indica el peso molecular del AEP (33 kDa). Las flechas en el carril 1 indican las poblaciones moleculares no reconocidas por el AcM.
Discusión
Las técnicas empleadas en el inmunodiagnóstico in vitro de múltiples enfermedades, requieren de moléculas que conserven su estructura o conformación nativa, lo cual permite preservar su actividad biológica y asegurar por consiguiente la eficiencia del ensayo en términos de especificidad, sensibilidad y precisión entre otros.
El cáncer de próstata constituye una enfermedad estudiada en muchos laboratorios del mundo. En Cuba algunos laboratorios dedican su atención a tan penosa enfermedad, dirigiendo sus estudios bien al tratamiento o al diagnóstico precoz de esta.
En el presente trabajo la proteína de interés estudiada se encuentra relacionada con este tipo de cáncer porque circulan a muy bajas concentraciones (inferiores a 4 ng/mL) en los fluidos corporales (sangre y semen) de personas sanas del sexo masculino,1 pero se exacerba en presencia de una lesión de la próstata. Se conoce que esta molécula se encuentra en forma libre o asociada a otras proteínas formando complejos8 y que su forma libre es termosensible5 en contradicción con otros autores que en ensayos de estabilidad de sueros de pacientes a altas temperaturas, plantean que el complejo es más sensible a este factor que su forma libre.9 Es esta forma libre de 33 kDa la que frecuentemente es manipulada en el laboratorio para establecer los sistemas de detección como patrones positivos en curvas controles.
Dada la demanda de la molécula como patrón en los sistemas de detección (ELISA, RIA) y el interés de su obtención mediante el empleo de un método sencillo, poco costoso y con un alto poder resolutivo como es la electroelusión de proteínas, se decidió realizar un estudio que evidenciara cambios moleculares de esta. Estos resultados serían de gran utilidad para otros investigadores que emplean la electroelusión como una alternativa conveniente de purificación por las ventajas antes mencionadas y donde se puede incurrir en errores al realizar comúnmente las electroforesis a temperaturas del laboratorio (25 °C).
El trabajo aquí mostrado evidenció la pérdida de la actividad biológica del AEP debido a un cambio conformacional que impidió el reconocimiento por los anticuerpos utilizados en el RIA (fig.1) y en el western-blot (fig. 2), y se mostró que este cambio en la actividad ocurrió de forma marcada a 25 °C donde solo pudo detectarse 40 % de la molécula, no siendo así cuando el ensayo se efectuó a 4 °C donde se cuantificó 80 % del AEP empleando el mismo juego diagnóstico mencionado antes. Este resultado coincide con datos publicados anteriormente, donde los autores plantean que la mayor estabilidad de la molécula de AEP reside a 4 °C.10,11 Este es un factor importante, si se tiene en cuenta que la utilidad clínica del ensayo puede verse comprometida por la pérdida de la actividad del antígeno, comprometiendo variables claves del método diagnóstico.
Con el objetivo de evidenciar los cambios moleculares que ocurrieron a 25 °C durante la electroforesis de proteína, se procedió a realizar el western-blot, donde se empleó un AcM (CMC-H9) obtenido contra esta molécula de AEP en nuestro laboratorio. Se observaron cambios de conformación que coincidieron con los cambios moleculares descritos por Thatcher y otros.3 Esos autores mostraron además que estos cambios pueden llegar a ser irreversibles, citando como ejemplos las enzimas alcohol deshidrogenasa y la ácido láctico deshidrogenasa de Drosophila melanogaster, debido a las temperaturas generadas durante el ensayo, en cambio mostraron que proteínas como la b-lactamasa recuperaron su actividad biológica posterior a la corrida y observaron diferentes estados de transición entre la forma nativa y la desnaturalizada, coincidiendo la presencia de estos estados de transición con nuestros resultados. Varios trabajos informan sobre el efecto del factor temperatura en los procesos biológicos, como cambios en estructuras moleculares al nivel de células,12-14 así como de mecanismos celulares como la transcripción.15 Este trabajo confirma la importancia que tiene para el investigador, comprobar la estabilidad térmica de la proteína de interés, y ajustar las condiciones óptimas de sus experimentos que en ocasiones se realizan de forma rutinaria según los protocolos generales descritos.
Changes in the biological activity of an antigen due to the temperature generated during the polyacrylamide electrophoresis
Summary
The effect of temperature on the biological activity of an antigen during the electrophoresis in non-reducing polyacrylamide gels was evaluated because on occasions the technique precedes electroelution, a method used in the purification of certain proteins. The prostate specific antigen was utilized for the assay. It was purified starting from the semen of voluntary patients. It was precipitated with ammonium sulfate 70 %. The repetitions (3 for each temperature) were made at 4 and 25 °C and at 20 mA. For every tested temperature, the fragments from the gels cut at the expected size for the specific prostatic antigen (33 kDa) were electroeluted at 4 °C. By comparing the protein concentrations using Lowrys technique and the radioimmunoenzymatic method, it was quantified the amount of biologically active protein after the electrophoresis. A commercial prostate specific antigen was used as control. The results indicate that at 4 °C the antigen keeps 80 % of its biological activity, which does not occur at 25 °C, where more than 50 % of the protein is biologically inactive.
Key words: PSA, temperature, electrophoresis.
Referencias bibliográficas
1. Experimental Biosciences. Sample preparation for electrophoresis of proteins (on line) 3 de febrero 2004. URL disponible en: http://www.ruf.rice.edu/~bioslabs/studies/sds-page/denature.html
2. García HM. Electroforesis en geles de poliacrilamida: fundamentos, actualidad e importancia. Univ Diag 2000;1(2):31-41.
3. Thatcher DR, Hodson B. Denaturation of proteins and nucleic acids by thermal gradient electrophoresis. Biochem J 1981;197(1):105-9.
4. Yu H, Giai M, Diamandis E, Katsaros D,Southerlands D, Levasque M. Prostate specific antigen is a new favorable prognostic indicator for woman with breast cancer. Cancer Res 1995;55:2104-10.
5. Chen KC, Peng CH, Wang HE, Peng CC, Peng RY. Modeling of the pH and the temperature dependent variations of the free to total PSA (prostate specific antigen) ratios for clinical predictability of prostate cancer and benign prostate hyperplasia. Bull Math Biol 2004; 66(3):423-45.
6. Wang MC, Valenzuela LA, Murphy GP,
7. Sambrook KJ, Fritsh EF, Maniatis T. Molecular cloning: a laboratory manual. 2da ed. New York:Cold Spring Harbor Lab; 1989.
8. Jung K, Lein M, Brux B, Sinha P, Schnorr D, Loening SA. Different stability of free and complexed prostate specific antigen in serum in relation to specimen handling and storage conditions. Clin Chem Lab Med 2000;38(12):1271-5.
9. Yoshida K, Honda M, Sumi S, Arai K, Suzukis, Kitahara S. Levels of free prostate specific antigen (PSA) can be selectively measured by heat treatment of serum: free/total PSA ratios improve detection of prostate carcinoma. Clin Chem Acta 1999;280(1-2):195-203.
10. Tessmer U, Quack T, Donn F, Leuner A, Dernick R. Biological activity of prostate specific antigen isolated by sodium dodecyl sulfate-polyacrylamide gel electrophoresis and electroelution. Electrophoresis 1995;16(5):793-9.
11. Sokoll LJ, Bruzek DJ, Dua R, Dunn W, Mohr P, Wallerson G. Short term stability of the molecular forms of prostate specific antigen and effect on percent complexed prostate specific antigen and percent free prostate specific antigen. Urology 2002;60(4):24-30.
12. Karcher D, Bock R. Temperature sensitivity of RNA editing and intron splicing reactions in the plastid ndhB transcript. Curr Genet 2002;41(1):48-52.
13. Katayama S, Matsushita O, Tamai E, Miyata S, Okabe A. Phased A-tracts bind to the alpha subunit of RNA polymerase with increased affinity at low temperature. FEBS Lett 2001;509(2):235-8.
14. Verdone L, Cesari F, Denis CL, Di Mauro E, Caserta M. Factors affecting Sacharomyces serevisiae ADH2 chromatin remodeling and transcription. J Biol Chem 1997;272(49):30828-34.
15. Hernández O. Effect of temperature on the posttranscriptional processing of VP1 intron from SV40 used in expression vectors transfected in fish cells. Biotecnología Aplicada 2004;,21(4): 196-200.
Recibido: 10 de mayo de 2006. Aprobado: 20 de junio de 2006.
Dr. Oscar Hernández Betancourt. Centro de Inmunología y Productos Biológicos (CENIPBI). AP 150. Camagüey CP 70100. Cuba. Teléf: 293321. Correo electrónico: oscar@finlay.cmw.sld.cu